एकांक 9 समन्वय यौगिक (अभ्यास प्रश्न)
अभ्यास प्रश्न
9.1 समन्वय यौगिकों में बंधन को वर्नर के प्रतिपादनों के आधार पर समझाइए।
उत्तर दिखाएं
उत्तर
वर्नर के प्रतिपादन समन्वय यौगिकों में बंधन को निम्नलिखित तरीके से समझाते हैं:
(i) एक धातु दो प्रकार के मोलरता दर्शाती है, अर्थात् प्राथमिक और द्वितीयक मोलरता। प्राथमिक मोलरता नकारात्मक आयनों द्वारा संतुलित होती है, जबकि द्वितीयक मोलरता नकारात्मक और उदासीन आयनों द्वारा संतुलित होती है।
आधुनिक भाषा में, प्राथमिक मोलरता धातु आयन के ऑक्सीकरण अंक के समान होती है, जबकि द्वितीयक मोलरता धातु आयन के समन्वय संख्या के समान होती है।
(ii) एक धातु आयन के केंद्रीय परमाणु के चारों ओर एक निश्चित संख्या में द्वितीयक मोलरता होती है। इसके अतिरिक्त, ये मोलरता समन्वय यौगिक के निश्चित ज्यामिति के अनुसार अंतरिक अंतर के दिशा में व्यापक होती है।
(iii) प्राथमिक मोलरता आमतौर पर आयनित होती है, जबकि द्वितीयक मोलरता आयनित नहीं होती है।
9.2 $\mathrm{FeSO_4}$ विलयन को $\left(\mathrm{NH_4}\right)_{2} \mathrm{SO_4}$ विलयन के 1:1 मोलर अनुपात में मिश्रित करने पर $\mathrm{Fe}^{2+}$ आयन के परीक्षण के परिणाम आते हैं, लेकिन $\mathrm{CuSO_4}$ विलयन को जलीय अमोनिया के 1:4 मोलर अनुपात में मिश्रित करने पर $\mathrm{Cu}^{2+}$ आयन के परीक्षण के परिणाम नहीं आते हैं। क्यों?
उत्तर दिखाएं
उत्तर
$\mathrm{(NH_4)_2} \mathrm{SO_4}+\mathrm{FeSO_4}+6 \mathrm{H_2} \mathrm{O} \longrightarrow \underset{\text{मोहर के लवण}}{\mathrm{FeSO_4} \cdot\mathrm{(NH_4)_2} \mathrm{SO_4} \cdot 6 \mathrm{H_2} \mathrm{O}}$
$\mathrm{CuSO_4}+4 \mathrm{NH_3}+5 \mathrm{H_2} \mathrm{O} \longrightarrow \underset{\text{तेत्रामिनोकॉपर(II) सल्फेट}}{\left[\mathrm{Cu}\left(\mathrm{NH_3}\right)_{4}\right] \mathrm{SO_4} \cdot 5 \mathrm{H_2} \mathrm{O}}$
दोनों यौगिक, अर्थात् $\mathrm{FeSO_4} \cdot \mathrm{(NH_4)_2} \mathrm{SO_4} \cdot 6 \mathrm{H_2} \mathrm{O}$ और $[\mathrm{Cu}\mathrm{(NH_3)_4}] \mathrm{SO_4} \cdot 5 \mathrm{H_2} \mathrm{O}$, एक संयोजन यौगिक के श्रेणी में आते हैं जिनमें केवल एक मुख्य अंतर है, अर्थात् पहला एक द्विसल लवण का उदाहरण है, जबकि दूसरा एक समन्वय यौगिक है।
एक डबल लवण एक योगात्मक यौगिक होता है जो ठोस अवस्था में स्थायी होता है लेकिन घोल के रूप में अपने संघटक आयनों में विखंडित हो जाता है। इन यौगिकों में अपने संघटकों के व्यक्तिगत गुण प्रकट होते हैं। उदाहरण के लिए, $\mathrm{FeSO_4} \cdot\left(\mathrm{NH_4}\right)_{2} \mathrm{SO_4} \cdot 6 \mathrm{H_2} \mathrm{O}$ अपने संघटक आयनों $\mathrm{Fe}^{2+}, \mathrm{NH}^{4+}$, और $\mathrm{SO_4}{ }^{-2}$ में विखंडित हो जाता है। इसलिए, यह $\mathrm{Fe}^{2+}$ आयनों के लिए धनात्मक परीक्षण देता है।
एक सह-संयोजन यौगिक एक योगात्मक यौगिक होता है जो ठोस अवस्था में तथा घोल के रूप में अपनी पहचान को बरकरार रखता है। हालांकि, संघटकों के व्यक्तिगत गुण खो देते हैं। यह इसलिए होता है कि $\left[\mathrm{Cu}\left(\mathrm{NH_3}\right)_{4}\right] \mathrm{SO_4} \cdot 5 \mathrm{H_2} \mathrm{O}$ $\mathrm{Cu}^{2+}$ के लिए परीक्षण नहीं दिखाता है। $\left[\mathrm{Cu}\mathrm{(NH_3)_4}\right] \mathrm{SO_4} \cdot 5 \mathrm{H_2} \mathrm{O}$ के घोल में उपस्थित आयन $\left[\mathrm{Cu}\mathrm{(NH_3)_4}\right]^{2+}$ और $\mathrm{SO_4}{ }^{2-}$ होते हैं।
9.3 निम्नलिखित के दो उदाहरणों के साथ समझाइए: सह-संयोजन एंटिटी, लिगेंड, सह-संयोजन संख्या, सह-संयोजन बहुफलक, होमोलेप्टिक और हेटेरोलेप्टिक।
उत्तर दिखाएं
Answer
(i) सह-संयोजन एंटिटी:
एक सह-संयोजन एंटिटी एक विद्युत चार्जित रेडिकल या वस्तु होती है जो धनात्मक या नकारात्मक चार्ज को ले रही होती है। सह-संयोजन एंटिटी में, केंद्रीय परमाणु या आयन के चारों ओर एक संख्या में उदासीन अणुओं या नकारात्मक आयनों (जिन्हें लिगेंड कहा जाता है) के द्वारा घेरा होता है। उदाहरण के लिए:
$$ \begin{aligned} & {\left[\mathrm{Ni}\mathrm{(NH_3)_6}\right]^{2+},\left[\mathrm{Fe}\mathrm{(CN)_6}\right]^{4+}=\text { धनात्मक यौगिक }} \\ & {\left[\mathrm{PtCl_4}\right]^{2-}, \quad\left[\mathrm{Ag}\mathrm{(CN)_2}\right]^{-}=\text { नकारात्मक यौगिक }} \\ & {\left[\mathrm{Ni}\mathrm{(CO)_4}\right], \quad\left[\mathrm{Co}\mathrm{(NH_3)_4} \mathrm{Cl_2}\right] {=\text { उदासीन यौगिक }}} \end{aligned} $$
(ii) लिगेंड
एक सह-संयोजन एंटिटी या सह-संयोजन यौगिक में धनात्मक अणुओं या नकारात्मक आयनों जो धातु आयन के चारों ओर घेरे होते हैं।
लिगेंड के रूप में जाने जाते हैं। उदाहरण के लिए, $\stackrel{\large{\cdot \cdot} }{\mathrm{N}}\mathrm{H_3}, \mathrm{H_2} \stackrel{\large{\cdot \cdot}}{\mathrm{O}}, \mathrm{Cl^-} , \mathrm{OH}^{-}$. लिगेंड आमतौर पर ध्रुवीय प्रकृति के होते हैं और कम से कम एक असंयोजी इलेक्ट्रॉन युग्म के साथ होते हैं।
(iii) समन्वय संख्या:
समन्वय क्षेत्र में केंद्रीय धातु परमाणु के आवेशित अणुओं या नकारात्मक आयनों की कुल संख्या को केंद्रीय धातु परमाणु की समन्वय संख्या कहते हैं। इसे इसकी लिगेंसी के रूप में भी संदर्भित किया जाता है।
उदाहरण के लिए:
(a) समन्वय यौगिक, $\mathrm{K_2}\left[\mathrm{PtCl_6}\right]$ में, छह क्लोराइड आयन $\mathrm{Pt}$ के समन्वय क्षेत्र में जुड़े हुए हैं। अतः $\mathrm{Pt}$ की समन्वय संख्या 6 है।
(b) इसी तरह, समन्वय यौगिक $\left[\mathrm{Ni}\left(\mathrm{NH_3}\right)_{4}\right] \mathrm{Cl_2}$ में, केंद्रीय परमाणु (Ni) की समन्वय संख्या 4 है।
(vi) समन्वय बहुफलक:
केंद्रीय परमाणु के समन्वय क्षेत्र में जुड़े लिगेंड के अंतर्गत अंतर्विन्यास को केंद्रीय परमाणु के समन्वय बहुफलक के रूप में परिभाषित किया जाता है। उदाहरण के लिए:
(a)
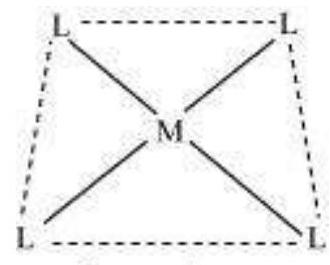
चौकोर तलीय
(b) चतुष्फलकीय
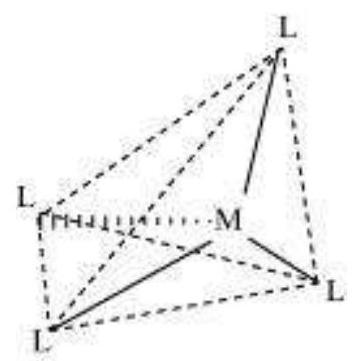
चतुष्फलकीय
(v) समान लिगेंड यौगिक:
ये वे यौगिक हैं जिनमें धातु आयन केवल एक प्रकार के डोनर समूह से जुड़े होते हैं।
उदाहरण: $\left[\mathrm{Co}\mathrm{(NH_3)_6}\right]^{3+},\left[\mathrm{PtCl_4}\right]^{2-}$ आदि।
(vi) विषम लिगेंड यौगिक:
हेटरोलेप्टिक कम्प्लेक्स वे कम्प्लेक्स होते हैं जिनमें केंद्रीय धातु आयन एक से अधिक प्रकार के डोनर समूह से बंधे होते हैं।
उदाहरण के लिए: $\left[\mathrm{Co}\mathrm{(NH_3)_4} \mathrm{Cl_2}\right]^{+},\left[\mathrm{Co}\mathrm{(NH_3)_5} \mathrm{Cl}\right]^{2+}$
9.4 एकल-दंडी, द्विदंडी और अम्बिडेंटेट लिगेंड के अर्थ क्या हैं? प्रत्येक के दो उदाहरण दीजिए।
उत्तर दिखाएं
उत्तर
एक लिगेंड में एक या अधिक अनुमानित इलेक्ट्रॉन युग्म हो सकते हैं जो लिगेंड के डोनर साइट कहलाते हैं। अब, इन डोनर साइट की संख्या के आधार पर लिगेंड को निम्नलिखित वर्गीकृत किया जा सकता है:
(a) एकल-दंडी लिगेंड: वे लिगेंड जिनमें केवल एक डोनर साइट होती है एकल-दंडी लिगेंड कहलाते हैं। उदाहरण के लिए: $\stackrel{\large{\cdot \cdot} }{\mathrm{N}}\mathrm{H_3}, \mathrm{Cl}^{-}$ आदि।
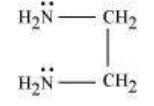
(b) द्विदंडी लिगेंड: वे लिगेंड जिनमें दो डोनर साइट होती है द्विदंडी लिगेंड कहलाते हैं। उदाहरण के लिए:
(a) एथेन-1,2-डाइएमीन
(b) ऑक्सलेट आयन
$\left(\mathrm{C_2} \mathrm{O_4}^{2-}\right)$ या $\begin{array}{l} \mathrm{COO}^{-} \\ | \\ \mathrm{COO}^{-} \end{array}$
(c) अम्बिडेंटेट लिगेंड:
वे लिगेंड जो केंद्रीय धातु आयन के साथ दो अलग-अलग परमाणुओं के माध्यम से जुड़ सकते हैं (लेकिन एक बार में केवल एक परमाणु) अम्बिडेंटेट लिगेंड कहलाते हैं। उदाहरण के लिए:
(a)
(डोनर परमाणु $\mathrm{N}$ है)
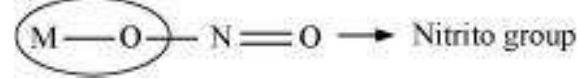
(The donor atom is oxygen)
(b)
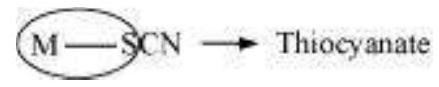
(The donor atom is $\mathrm{S}$ )

(The donor atom is $\mathrm{N}$ )
9.5 निम्नलिखित संकर एंटिटी में धातुओं के ऑक्सीकरण संख्या निर्धारित कीजिए:
(i) $\left[\mathrm{Co}\left(\mathrm{H_2} \mathrm{O}\right)(\mathrm{CN})(\mathrm{en})_2\right]^{2+}$
(ii) $\left[\mathrm{CoBr_2}(\mathrm{en})_2\right]^{+}$
(iii) $\left[\mathrm{PtCl_4}\right]^{2-}$
(iv) $\mathrm{K_3}\left[\mathrm{Fe}(\mathrm{CN})_6\right]$
(v) $\left[\mathrm{Cr}\left(\mathrm{NH_3}\right)_3 \mathrm{Cl_3}\right]$
उत्तर दिखाएं
Answer
(i) $\left[\mathrm{Co}\left(\mathrm{H_2} \mathrm{O}\right)(\mathrm{CN})(\mathrm{en})_{2}\right]^{2+}$
मान लीजिए $\mathrm{Co}$ का ऑक्सीकरण संख्या $x$ है।
कम्प्लेक्स का आवेश +2 है।
$\begin{array}{cccccccr} [\mathrm{Co} & & \left(\mathrm{H_2} \mathrm{O}\right) & &(\mathrm{CN}) && \left.(\mathrm{en})_{2}\right]^{2+} &\\ \downarrow & &\downarrow && \downarrow & &\downarrow & \\ x &+ & 0 &+ & (-1)& + &2(0)& =+2 \\ &&& x & -1 & = & +2 & \\ &&&& x & = & +3& \end{array}$
(ii) $\left[\mathrm{CoBr_2}(\mathrm{en})_2\right]^{+}$
$\begin{array}{cccccc} [\mathrm{Co} & & \mathrm{(Br)_2} & & \left.\mathrm{(en)_2}\right]^{+} &\\ \downarrow & &\downarrow && \downarrow & \\ x &+ & 2(-1) &+ & 2(0)& = &+1 \\ x&-&2 & = & +1& \\ x & = & +3& \end{array}$
(iii) $\left[\mathrm{Pt}(\mathrm{Cl})_{4}\right]^{2-}$
मान लीजिए Pt का ऑक्सीकरण संख्या $x$ है।
चार्ज जटिल पर -2 है ।
$\begin{array}{cccc} [\mathrm{Pt} & & \left(\mathrm{Cl_4}\right) \left. \right]^{2-} &\\ \downarrow & &\downarrow & & \\ x &+ & 4(-1) &= & -2 \\ x & = & +2 \\ \end{array}$
(iv) $\mathrm{K_3}\left[\mathrm{Fe}(\mathrm{CN})_{6}\right]$
$\begin{array}{cccc} [\mathrm{Fe} & & \mathrm{(CN)_6} \left. \right]^{3-} &\\ \downarrow & &\downarrow & & \\ x &+ & 6(-1) &= & -3 \\ x & = & +3 \\ \end{array}$
(v) $\left[\mathrm{Cr}\left(\mathrm{NH_3}\right)_3 \mathrm{Cl_3}\right]$
$\begin{array}{cccccc} [\mathrm{Cr} & & \mathrm{(NH_3)_3} & & \left.\mathrm{(Cl)_3}\right] &\\ \downarrow & &\downarrow && \downarrow & \\ x &+ & 3(0) &+ & 3(-1)& = &0 \\ x & = & +3& \end{array}$
9.6 IUPAC नियमों के अनुसार निम्नलिखित के सूत्र लिखिए:
(i) टेट्राहाइड्रोक्सिडोजिंकेट(II)
(ii) पोटेशियम टेट्राक्लोरिडोपैलेडेट(II)
(iii) डाइएमिनेडीक्लोरिडोप्लैटिनम(II)
(iv) पोटेशियम टेट्रासाइनिडोनिकेलेट(II)
(v) पेंटा एमिनीनिट्रिटो-O-कोबाल्ट(III)
(vi) हेक्सा एमिनिकोबाल्ट(III) सल्फेट
(vii) पोटेशियम ट्राइ(ऑक्सलेटो)क्रोमेट(III)
(viii) हेक्सा एमिनिप्लैटिनम(IV)
(ix) टेट्राब्रोमिडोकूप्रेट(II)
(x) पेंटा एमिनीनिट्रिटो-N-कोबाल्ट(III)
उत्तर दिखाएं
Answer
(i) $\left[\mathrm{Zn}(\mathrm{OH})_{4}\right]^{2-}$
(ii) $\mathrm{K_2}\left[\mathrm{PdCl_4}\right]$
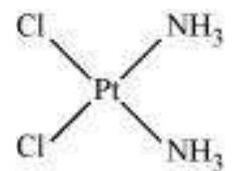
(iii) $\left[\mathrm{Pt}\left(\mathrm{NH_3}\right)_{2} \mathrm{Cl_2}\right]$
(iv) $\mathrm{K_2}\left[\mathrm{Ni}(\mathrm{CN})_{4}\right]$
(v) $\left[\mathrm{Co}(\mathrm{ONO})\left(\mathrm{NH_3}\right)_{5}\right]^{2+}$
(vi) $\left[\mathrm{Co}\mathrm{(NH_3)_6}\right]_2\mathrm{(SO_4)_3}$
(vii) $\mathrm{K_3}\left[\mathrm{Cr}\left(\mathrm{C_2} \mathrm{O_4}\right)_{3}\right]$
(viii) $\left[\mathrm{Pt}\left(\mathrm{NH_3}\right)_{6}\right]^{4+}$
(ix) $\left[\mathrm{Cu}(\mathrm{Br})_{4}\right]^{2-}$
(x) $\left[\mathrm{Co}\left(\mathrm{NO_2}\right)\left(\mathrm{NH_3}\right)_{5}\right]^{2+}$
9.7 IUPAC नियमों के अनुसार निम्नलिखित के प्रणालीय नाम लिखिए:
(i) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{6}\right] \mathrm{Cl_3}$
(ii) $\left[\mathrm{Pt}\left(\mathrm{NH_3}\right)_{2} \mathrm{Cl}\left(\mathrm{NH_2} \mathrm{CH_3}\right)\right] \mathrm{Cl}$
(iii) $\left[\mathrm{Ti}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right]^{3+}$
(iv) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{4} \mathrm{Cl}\left(\mathrm{NO_2}\right)\right] \mathrm{Cl}$
(v) $\left[\mathrm{Mn}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right]^{2+}$
(vi) $\left[\mathrm{NiCl_4}\right]^{2-}$
(vii) $\left[\mathrm{Ni}\left(\mathrm{NH_3}\right)_{6}\right] \mathrm{Cl_2}$
(viii) $\left[\mathrm{Co}(\mathrm{en})_{3}\right]^{3+}$
(ix) $\left[\mathrm{Ni}(\mathrm{CO})_{4}\right]$
उत्तर दिखाएं
Answer
(i) षट्काम्मीनकोबाल्ट(III) क्लोराइड
(ii) द्विअम्मीनक्लोरिडो(मेथिलएमीन) प्लैटिनम(II) क्लोराइड
(iii) षट्क्वाटिटिनियम(III) आयन
(iv) टेट्रा-अम्मीनीक्लोरिडोनिट्रिटो-N-कोबाल्ट(III) क्लोराइड
(v) षट्क्वाटमैंगनीज(II) आयन
(vi) टेट्राक्लोरिडोनिकेलेट(II) आयन
(vii) षट्काम्मीननिकेल(II) क्लोराइड
(viii) ट्रिस(एथेन-1, 2-डाइएमीन) कोबाल्ट(III) आयन
(ix) टेट्राकार्बोनिलनिकेल(0)
9.8 संयोजन यौगिकों के लिए संभावित विभिन्न प्रकार के समावयवी रूप सूचित करें, और प्रत्येक के एक उदाहरण दें।
उत्तर दिखाएं
Answer
(a) ज्यामितीय समावयवी:
इस प्रकार के समावयवी विषमलेपिक संकेंद्रित यौगिकों में सामान्य होते हैं। इसके उत्पन्न होने के कारण लिगेंड के विभिन्न संभावित ज्यामितीय व्यवस्था होती है। उदाहरण के लिए:
समान अभिकर्मक
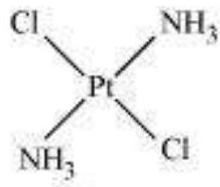
अनुक्रमित समान अभिकर्मक
(b) प्रकाश अभिकर्मकता:
इस प्रकार की अभिकर्मकता चिरल अणुओं में उत्पन्न होती है। अभिकर्मक एक दूसरे के दर्पण छवि होते हैं और एक दूसरे पर ठीक नहीं ठहर सकते हैं।
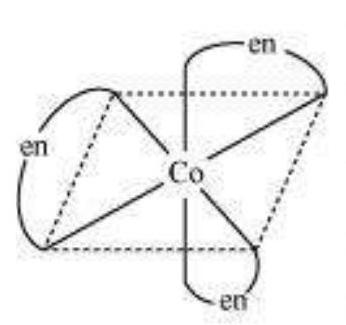
$\left[\mathrm{Co}(\mathrm{en})_{3}\right]^{3+}$ (दक्षिणावर्त)
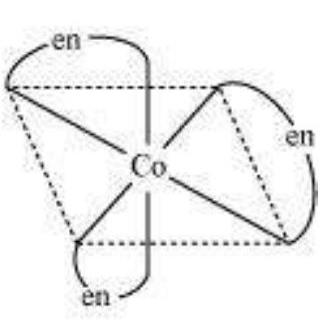
$\left[\mathrm{Co}(\mathrm{en})_{3}\right]^{3+}$(वामावर्त)
(c) आंतरिक अभिकर्मकता: इस प्रकार की अभिकर्मकता ऐम्बिडेंटेट लिगेंड वाले जटिलों में पाई जाती है। उदाहरण के लिए:
$\underset {\text{पीला रूप}} {[\mathrm{Co}\mathrm{(NH_3)_5}\mathrm{(NO_2)}] \mathrm{Cl_2}}$ और $\underset {\text{लाल रूप}} {[\mathrm{Co}\mathrm{(NH_3)_5}(\mathrm{ONO}) \mathrm{Cl_2}]}$
पीला रूप लाल रूप
(d) समन्वय अभिकर्मकता:
इस प्रकार की अभिकर्मकता जब लिगेंड अलग-अलग धातु आयनों के समन्वय विशिष्ट धनात्मक और ऋणात्मक एंटिटी के बीच बदल जाते हैं तो उत्पन्न होती है।
$\left[\mathrm{Co}\mathrm{(NH_3)_6}\right]\left[\mathrm{Cr}\mathrm{(CN)_6}\right]$ और $\left[\mathrm{Cr}\mathrm{(NH_3)_6}\right]\left[\mathrm{Co}\mathrm{(CN)_6}\right]$
(e) आयनन अभिकर्मकता:
इस प्रकार की अभिकर्मकता जब एक विपरीत आयन एक लिगेंड के स्थान पर जाता है तो उत्पन्न होती है। इसलिए, जब एक घोल में पानी में घोले जाने पर विभिन्न आयन देते हैं लेकिन संघटन एक ही हो तो इन्हें आयनन अभिकर्मक कहते हैं। उदाहरण के लिए, $\left(\mathrm{Co}\mathrm{(NH_3)_5} \mathrm{SO_4}\right) \mathrm{Br}$ और $[\mathrm{Co}\mathrm{(NH_3)_5} \mathrm{Br} ]\mathrm{SO_4}$
(f) सॉल्वेट आइसोमरिज़म:
सॉल्वेट आइसोमर विभेदित होते हैं यह तय करते हैं कि सॉल्वेंट अणु धातु आयन के साथ सीधे बंधे हैं या क्रिस्टल लैटिस में मुक्त सॉल्वेंट अणु के रूप में मौजूद हैं।
$\underset{\text{बैंगनी}}{\left[\mathrm{Cr}\mathrm{(H_2O)_6}\right] \mathrm{Cl_3}\cdot \mathrm{H_2O}}$
$\underset{\text{ग्रे-हरा}}{\left[\mathrm{Cr}\mathrm{(H_2O)_5 \mathrm Cl }\right] \mathrm{Cl_2}\cdot \mathrm{H_2O}}$
9.9 निम्नलिखित संयोजन एंटिटिज़ में कितने ज्यामितीय आइसोमर संभव हैं?
(i) $\left[\mathrm{Cr}\left(\mathrm{C_2} \mathrm{O_4}\right)_3\right]^{3-}$
(ii) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_3 \mathrm{Cl_3}\right]$
उत्तर दिखाएं
उत्तर
(i) $\left[\mathrm{Cr}\left(\mathrm{C_2} \mathrm{O_4}\right)_{3}\right]^{3-}$ के लिए कोई ज्यामितीय आइसोमर संभव नहीं है क्योंकि यह एक द्विदंडी लिगेंड है।
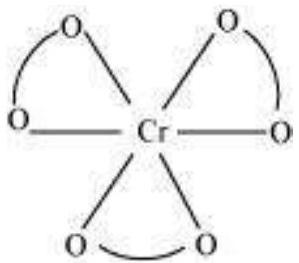
(ii) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{3} \mathrm{Cl_3}\right]$
दो ज्यामितीय आइसोमर संभव हैं।
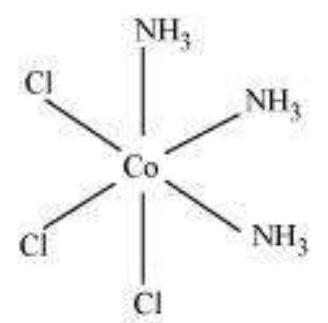
फेसियल
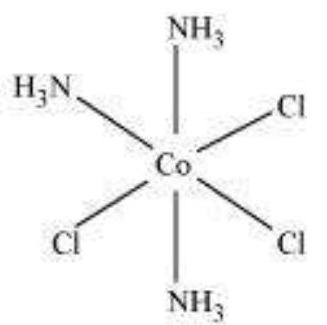
मेरिडियन
9.10 निम्नलिखित विकिरण आइसोमर के संरचनाएं बनाइए:
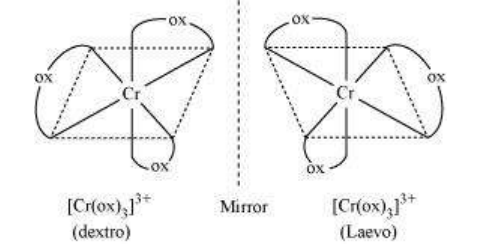
(i) $\left[\mathrm{Cr}\left(\mathrm{C_2} \mathrm{O_4}\right)_3\right]^{3-}$
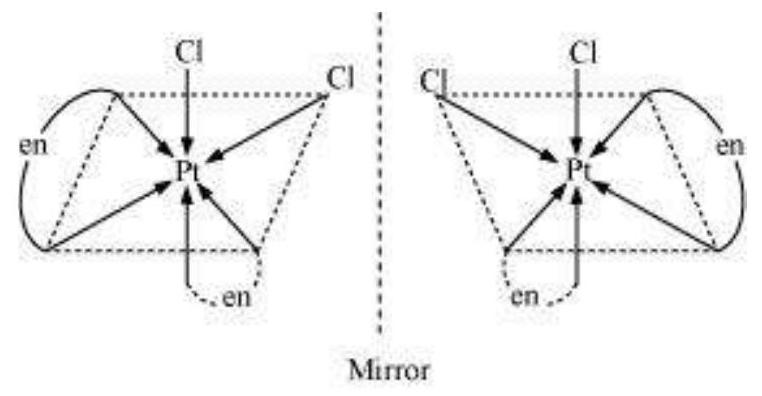
(ii) $\left[\mathrm{PtCl_2}(\mathrm{en})_2\right]^{2+}$
(iii) $\left[\mathrm{Cr}\left(\mathrm{NH_3}\right)_2 \mathrm{Cl_2}(\mathrm{en})\right]^{+}$
उत्तर दिखाएं
Answer
(i) $\left[\mathrm{Cr}\left(\mathrm{C_2} \mathrm{O_4}\right)_{3}\right]^{3-}$
(ii) $\left[\mathrm{PtCl_2}(\mathrm{en})_{2}\right]^{2+}$
(iii) $\left[\mathrm{Cr}\left(\mathrm{NH_3}\right)_{2} \mathrm{Cl_2}(\mathrm{en})\right]^{+}$
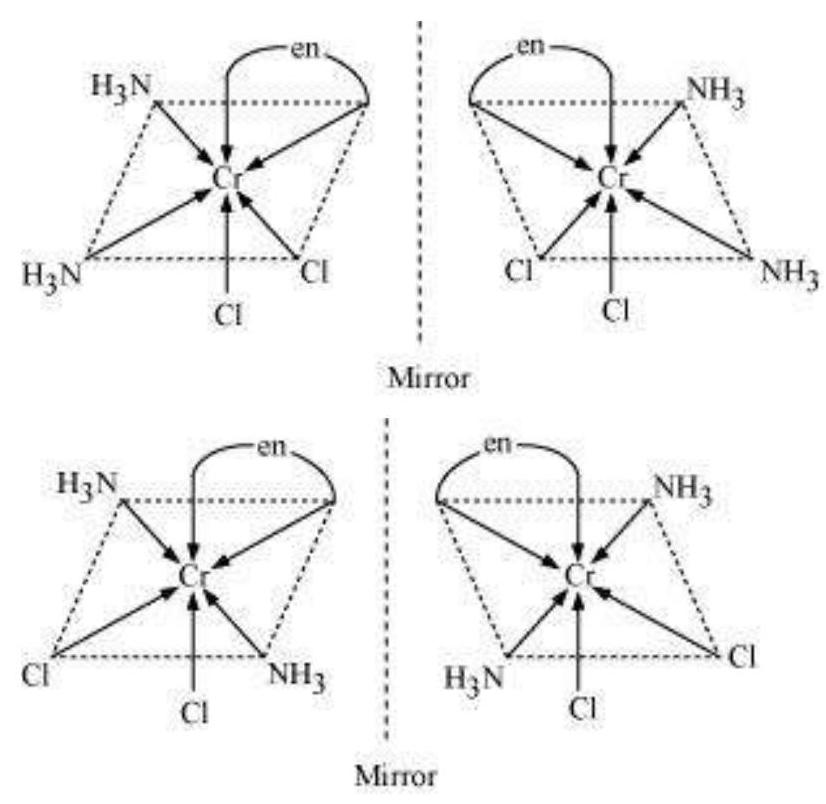
9.11 सभी इसोमर (ज्यामितीय और प्रकाशिक) बनाएं:
(i) $\left[\mathrm{CoCl_2}(\mathrm{en})_2\right]^{+}$
(ii) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right) \mathrm{Cl}(\mathrm{en})_2\right]^{2+}$
(iii) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_2 \mathrm{Cl_2}(\mathrm{en})\right]^{+}$
उत्तर दिखाएं
Answer
(i) $\left[\mathrm{CoCl_2}(\mathrm{en})_{2}\right]^{+}$
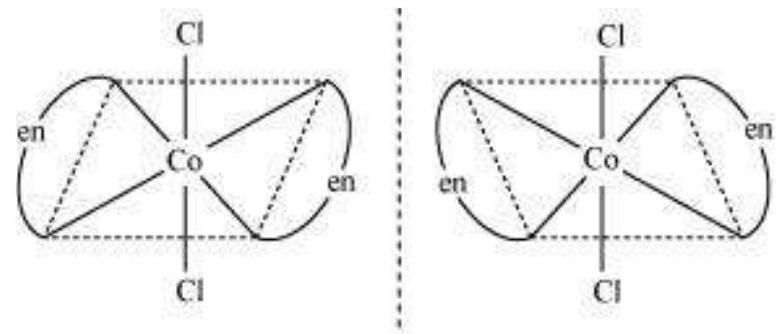
Trans $\left[\mathrm{CoCl_2}(\mathrm{en})_{2}\right]^{+}$ इसोमर-प्रकाशिक अक्रिय
(दर्पण छवि एक दूसरे के उपरिच्छेदी हैं)
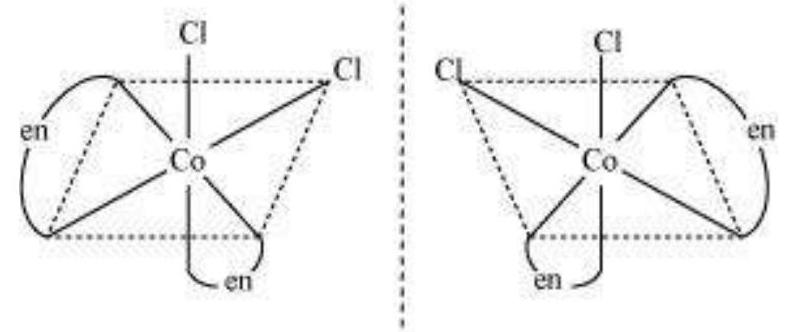
Cis $\left[\mathrm{CoCl_2}(\mathrm{en})_{2}\right]^{+}$ इसोमर-प्रकाशिक रूप से सक्रिय
(असुमेलन दर्पण छवियाँ)
कुल मिलाकर, तीन इसोमर संभव हैं।
(ii) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right) \mathrm{Cl}(\text { en })_{2}\right]^{2+}$
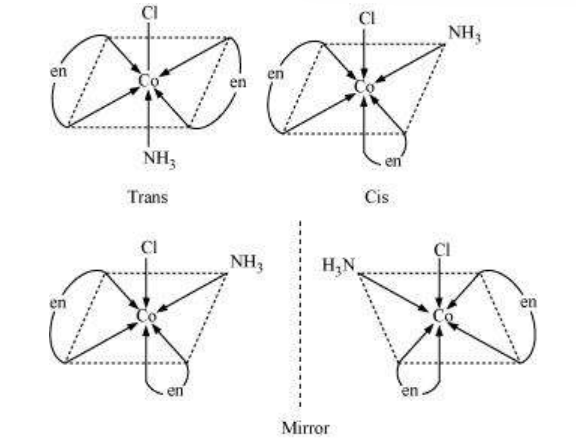
अनुक्रमित इसोमर प्रकाशिक रूप से असक्रिय होते हैं।
संकर इसोमर प्रकाशिक रूप से सक्रिय होते हैं।
कुल मिलाकर, तीन इसोमर संभव हैं।
(iii) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{2} \mathrm{Cl_2}(\mathrm{en})\right]^{+}$

दिए गए यौगिक के लिए कुल मिलाकर, चार इसोमर हो सकते हैं जिनमें संकर रूप प्रकाशिक रूप से सक्रिय होता है और दो अनुक्रमित रूप प्रकाशिक रूप से असक्रिय होते हैं।
9.12 $\left[\mathrm{Pt}\left(\mathrm{NH_3}\right)(\mathrm{Br})(\mathrm{Cl})(\mathrm{py})\right]$ के सभी यांत्रिक इसोमर लिखिए और इनमें से कितने वस्तुओं के प्रकाशिक इसोमर दिखाई देंगे?
उत्तर दिखाएं
Answer
$\left[\mathrm{Pt}\left(\mathrm{NH_3}\right)(\mathrm{Br})(\mathrm{Cl})(\mathrm{py})\right.$

उपरोक्त इसोमर में से कोई भी प्रकाशिक इसोमर नहीं दिखाई देगा। वे सभी वर्गीय तलीय हैं और एक सममिति तल के अंतर्गत आते हैं।
9.13 जलीय कॉपर सल्फेट घोल (नीला रंग) देता है:
(i) जलीय पोटेशियम फ्लुओराइड के साथ हरा अवक्षेप और
(ii) एक चमकदार हरे रंग के घोल में जलीय पोटैशियम क्लोराइड। इन प्रयोग के परिणामों को समझाइए।
उत्तर दिखाएं
उत्तर
जलीय $\mathrm{CuSO_4}$ के रूप में $\left[\mathrm{Cu}\mathrm{(H_2O)_4}\right] \mathrm{SO_4}$ में मौजूद होता है। इसका नीला रंग $\left[\mathrm{Cu}\mathrm{(H_2O)_4}\right]^{2+}$ आयनों की उपस्थिति के कारण होता है।
(i) जब KF डाला जाता है:
$$ \left[\mathrm{Cu}\left(\mathrm{H_2} \mathrm{O}\right)_{4}\right]^{2+}+4 \mathrm{~F}^{-} \longrightarrow \underset{\text { (हरा) }}{[\mathrm{Cu(F)_4 } ]^{2-}} + 4 \mathrm {H_2O} $$
(ii) जब $\mathrm{KCl}$ डाला जाता है:
$$ \left[\mathrm{Cu}\left(\mathrm{H_2} \mathrm{O}\right)_{4}\right]^{2+}+4 \mathrm{Cl}^{-} \longrightarrow \underset{\text{(चमकदार हरा)}}{\left[\mathrm{CuCl_4}\right]^{2-}}+4 \mathrm{H_2} \mathrm{O} $$
दोनों मामलों में, कम बल लगाने वाले लिगेंड पानी को $\mathrm{F}^{-} $ और $\mathrm{Cl}^{-}$ आयनों द्वारा प्रतिस्थापित कर दिया जाता है।
9.14 जब अत्यधिक जलीय $\mathrm{KCN}$ तांबा सल्फेट के जलीय घोल में डाला जाता है तो बनने वाला संयोजन एंटिटी क्या होता है? जब $\mathrm{H_2} \mathrm{~S}(\mathrm{~g})$ इस घोल में पार किया जाता है तो तांबा सल्फाइड के अवक्षेप के लिए कारण क्या है?
उत्तर दिखाएं
उत्तर
$\mathrm{CuSO_4{(a q)}}+4 \mathrm{KCN{(a q)}} \longrightarrow \mathrm{K_2[Cu(CN)_4]} {(aq)} + \mathrm{K_2SO_4 {(aq)}} $
अर्थात, $\left[\mathrm{Cu}\mathrm{(H_2O)_4}\right]^{2+}+4 \mathrm{CN}^{-} \longrightarrow\left[\mathrm{Cu}\mathrm{(CN)_4}\right]^{2-}+4 \mathrm{H_2} \mathrm{O}$
इस प्रक्रिया में बनने वाला संयोजन एंटिटी $\mathrm{K_2[Cu(CN)_4]} . \mathrm{K_2}[\mathrm{Cu}\mathrm{(CN)_4}]$ एक बहुत स्थिर जटिल है, जो पानी में डाले जाने पर $\mathrm{Cu^{2+}}$ आयन देने के लिए विघटित नहीं होता। इसलिए, $\mathrm{Cu}^{2+}$ आयन तब तक अवक्षेपित नहीं होते हैं जब तक $\mathrm{H_2S {(g)}}$ घोल में पार नहीं किया जाता।
9.15 मूल्य बंध तर्क के आधार पर निम्नलिखित संयोजन एंटिटी में बंधन की प्रकृति के बारे में चर्चा कीजिए:
(i) $\left[\mathrm{Fe}(\mathrm{CN})_6\right]^{4-}$
(ii) $\left[\mathrm{FeF_6}\right]^{3-}$
(iii) $\left[\mathrm{Co}\left(\mathrm{C_2} \mathrm{O_4}\right)_{3}\right]^{3-}$
(iv) $\left[\mathrm{CoF_6}\right]^{3-}$
उत्तर दिखाएं
Answer
(i) $\left[\mathrm{Fe}(\mathrm{CN})_{6}\right]^{4-}$
ऊपर के समन्वयन यौगिक में, लौहा $ \mathrm{+II}$ ऑक्सीकरण अवस्था में होता है।
$\mathrm{Fe}^{2+}$ : इलेक्ट्रॉनिक विन्यास $3 d^{6}$ होता है
$\mathrm{Fe}^{2+}$ आयन के ऑर्बिटल:

क्योंकि $\mathrm{CN}^{-}$ एक मजबूत क्षेत्र लिगेंड है, इसके कारण $3 d$ इलेक्ट्रॉन के अनुनयन के लिए अनुनयन नहीं होता है।

केंद्रीय धातु आयन के चारों ओर छह लिगेंड हैं, इसलिए सबसे उपलब्ध हाइब्रिडाइजेशन $d^{2} s p^{3}$ है।
$\mathrm{Fe}^{2+}$ के $d^{2} s p^{3}$ हाइब्रिड ऑर्बिटल:
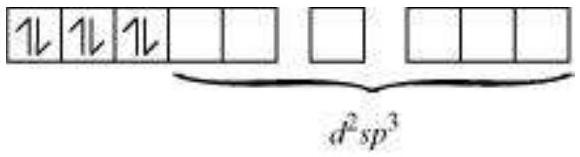
$\mathrm{CN}^{-}$ आयनों से 6 इलेक्ट्रॉन युग्म $d^{2} s p^{3}$ हाइब्रिड ऑर्बिटल में बैठे हैं।
तब,
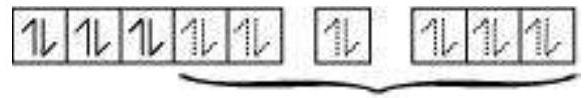
6 इलेक्ट्रॉन युग्म $6\ \mathrm{CN}^{-}$ आयनों से। अतः, यौगिक की ज्यामिति अष्टफलकीय है और यौगिक विषुवतीय (क्योंकि कोई अनुनयन इलेक्ट्रॉन नहीं है) है।
(ii) $\left[\mathrm{FeF_6}\right]^{3}$
इस यौगिक में, $\mathrm{Fe}$ का ऑक्सीकरण अवस्था +3 है।
$\mathrm{Fe}^{+3}$ आयन के ऑर्बिटल:
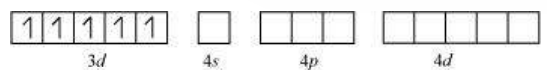
यहाँ 6 $\mathrm{~F}^{-}$ आयन हैं। इसलिए, यह $d^{2} s p^{3}$ या $s p^{3} d^{2}$ हाइब्रिडाइजेशन करेगा। क्योंकि $\mathrm{F}^{-}$ एक कम शक्ति क्षेत्र लिगेंड है, इसलिए यह $3 d$ ऑर्बिटल में इलेक्ट्रॉन के युग्मन का कारण नहीं बनता। इसलिए, सबसे संभावित हाइब्रिडाइजेशन $s p^{3} d^{2}$ है।
$\mathrm{Fe}$ के $s p^{3} d^{2}$ हाइब्रिडाइजेशन ऑर्बिटल:
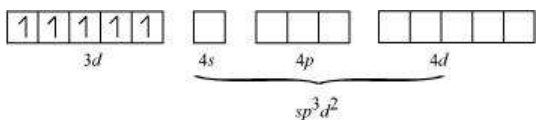
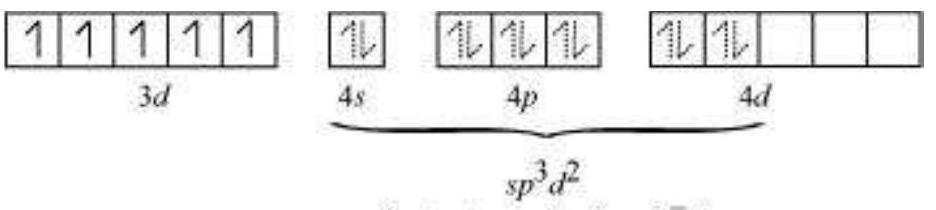
$\mathrm{F}^{-}$ आयन से 6 इलेक्ट्रॉन युग्म। इसलिए, यौगिक की ज्यामिति अष्टफलकीय ज्यामिति है।
(iii) $\left[\mathrm{Co}\left(\mathrm{C_2} \mathrm{O_4}\right)_{3}\right]^{3-}$
दिए गए यौगिक में कोबाल्ट +3 ऑक्सीकरण अवस्था में है।
$\mathrm{Co}^{3+}$ आयन के ऑर्बिटल:
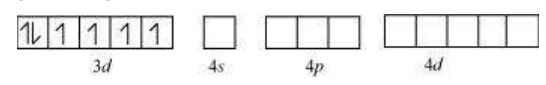
ऑक्सलेट एक कम शक्ति क्षेत्र लिगेंड है। इसलिए, यह $3 d$ ऑर्बिटल में इलेक्ट्रॉन के युग्मन का कारण नहीं बनता। चूंकि 6 लिगेंड हैं, हाइब्रिडाइजेशन $s p^{3} d^{2}$ या $d^{2} s p^{3}$ हो सकती है।
$s p^{3} d^{2}$ हाइब्रिडीकरण $\mathrm{Co}^{3+}$ के

3 ऑक्सलेट आयनों (ऑक्सलेट आयन एक द्विदंतीय लिगेंड है) से 6 इलेक्ट्रॉन युग्म $s p^{3} d^{2}$ ऑर्बिटल में बसे हुए हैं।

इसलिए, यौगिक की ज्यामिति अष्टफलकीय पाया जाता है।
(iv) $\left[\mathrm{CoF_6}\right]^{3-}$
कोबाल्ट +3 ऑक्सीकरण अवस्था में होता है।
$\mathrm{Co}^{3+}$ आयन के ऑर्बिटल:
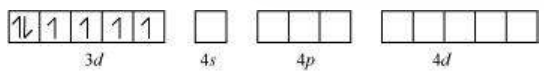
फ्लुओराइड आयन एक कम बल वाला लिगेंड है। यह $3 d$ इलेक्ट्रॉन के युग्मन का कारण नहीं बन सकता। इस कारण, $\mathrm{Co}^{3+}$ आयन $s p^{3} d^{2}$ हाइब्रिडीकरण करेगा।
$\mathrm{Co}^{3+}$ आयन के $s p^{3} d^{2}$ हाइब्रिडीकरण ऑर्बिटल हैं:
9.16 अष्टफलकीय क्रिस्टल क्षेत्र में $d$ ऑर्बिटल के विभाजन को दिखाने के लिए चित्र बनाएं।
उत्तर दिखाएं
उत्तर
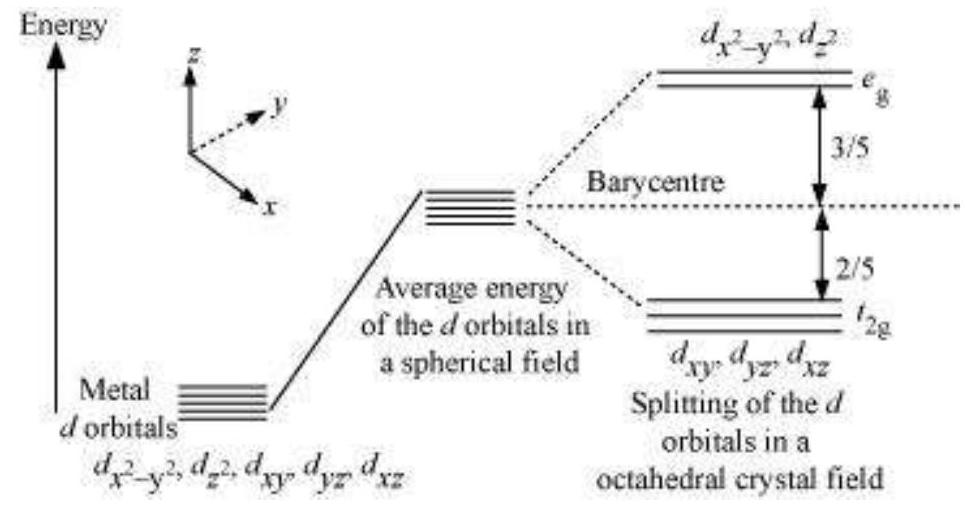
अष्टफलकीय क्षेत्र में $d$ ऑर्बिटल के विभाजन इस तरह होता है कि $d_{x^{2}-y^{2}}, d_{z^{2}}$ ऊर्जा में वृद्धि करते हैं और $e_{g}$ स्तर बनाते हैं, जबकि $d_{x y}, d_{y z}$ और $d_{xz}$ ऊर्जा में गिरते हैं और $t_{2 g}$ स्तर बनाते हैं।
9.17 स्पेक्ट्रोकेमिक श्रेणी क्या है? कम क्षेत्र लिगेंड और तीव्र क्षेत्र लिगेंड में अंतर समझाइए।
उत्तर दिखाएं
उत्तर
एक स्पेक्ट्रोकेमिक श्रेणी विभिन्न लिगेंड के आवेश विभाजन ऊर्जा (CFSE) मान के बढ़ते क्रम में व्यवस्थित करती है। श्रेणी के दाहिने छोर पर तीव्र क्षेत्र लिगेंड होते हैं जबकि बाएँ छोर पर कम क्षेत्र लिगेंड होते हैं। इसके अतिरिक्त, तीव्र क्षेत्र लिगेंड $d$ कक्षकों में अधिक विभाजन करते हैं जबकि कम क्षेत्र लिगें उनमें कम विभाजन करते हैं।
$ \mathrm{I}^{-} < \mathrm{Br}^{-} < \mathrm{S}^{2-}<\mathrm{SCN}^{-}<\mathrm{Cl}^{-}<\mathrm{N_3}<\mathrm{F}^{-}<\mathrm{OH}^{-}<\mathrm{C_2} \mathrm{O_4}{ }^{2-}< \mathrm{H_2} \mathrm{O}<\mathrm{NCS}^{-} < \mathrm{H}^{-}<\mathrm{CN}^{-}<\mathrm{NH_3}<$ en $< \mathrm{SO_3}{ }^{2-}<\mathrm{NO_2}^{-}<$ phen $<\mathrm{CO}$
9.18 क्रिस्टल क्षेत्र विभाजन ऊर्जा क्या है? एक संकर निर्माण एंटिटी में $d$ कक्षकों की वास्तविक व्यवस्था के लिए $\Delta_{\mathrm{o}}$ के मान कैसे निर्धारित करता है?
उत्तर दिखाएं
उत्तर
एक समान विभाजन $d$-कक्षक (एक गोलीय क्षेत्र परिवेश में) लिगेंड की उपस्थिति में दो स्तरों में विभाजित हो जाते हैं अर्थात $e_{g}$ और $t_{2 g}$। लिगेंड की उपस्थिति के कारण विभाजित समान स्तरों के विभाजन को क्रिस्टल-क्षेत्र विभाजन कहते हैं जबकि दो स्तरों $e_{g}$ और $t_{2 \mathrm{~g}}$ के बीच ऊर्जा अंतर को क्रिस्टल-क्षेत्र विभाजन ऊर्जा कहते हैं। इसे $\Delta_{0}$ से नोट किया जाता है।
कक्षकों के विभाजन के बाद, इलेक्ट्रॉनों के भराव का कार्य शुरू हो जाता है। तीन $t_{2 g}$ कक्षकों में प्रत्येक में एक इलेक्ट्रॉन भर जाने के बाद, चौथे इलेक्ट्रॉन के भराव के दो तरीके हो सकते हैं। यह $e_{g}$ कक्षक में प्रवेश कर सकता है (जिससे $t_{2 g}{ }^{3} e_{\mathrm{g}}{ }^{1}$ इलेक्ट्रॉनिक व्यवस्था बनती है) या $t_{2 \mathrm{~g}}$ कक्षक में इलेक्ट्रॉनों के युग्मन कर सकता है (जिससे $t_{2 g}{ }^{4} e_{g}{ }^{0}$ इलेक्ट्रॉनिक व्यवस्था बनती है)। यदि एक लिगेंड के $\Delta_{0}$ मान युग्मन ऊर्जा (P) से कम हो, तो इलेक्ट्रॉन $e_{g}$ कक्षक में प्रवेश करते हैं। दूसरी ओर, यदि एक लिगेंड के $\Delta_{0}$ मान युग्मन ऊर्जा (P) से अधिक हो, तो इलेक्ट्रॉन $t_{2 g}$ कक्षक में प्रवेश करते हैं।
9.19 $\left[\mathrm{Cr}\left(\mathrm{NH_3}\right)_6\right]^{3+}$ प्रामाणिक चुंबकीय है जबकि $\left[\mathrm{Ni}(\mathrm{CN})_4\right]^{2-}$ विपरीत चुंबकीय है। क्यों?
उत्तर दिखाएं
उत्तर
$\mathrm{Cr}$ +3 ऑक्सीकरण अवस्था में है अर्थात $d^{3}$ विन्यास। इसके अतिरिक्त, $\mathrm{NH_3}$ एक कम क्षेत्र लिगेंड है जो $3d$ ऑर्बिटल में इलेक्ट्रॉन के युग्मन को कारण बनता है नहीं।
$\mathrm{Cr}^{3+}$

इसलिए, यह $d^{2} s p^{3}$ हाइब्रिडाइजेशन करता है और $3d$ ऑर्बिटल में इलेक्ट्रॉन अयुग्मित रहते हैं। इसलिए, यह प्रामाणिक चुंबकीय प्रकृति का है।
$\left[\mathrm{Ni}(\mathrm{CN})_{4}\right]^{2-}$ में, Ni +2 ऑक्सीकरण अवस्था में है अर्थात $d^{8}$ विन्यास।
$\mathrm{Ni}^{2+}$
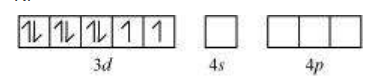
$\mathrm{CN}^{-}$ एक शक्तिशाली क्षेत्र लिगेंड है। यह $3d$ ऑर्बिटल इलेक्ट्रॉन के युग्मन को कारण बनता है। फिर, $\mathrm{Ni}^{2+}$ $d s p^{2}$ हाइब्रिडाइजेशन करता है।
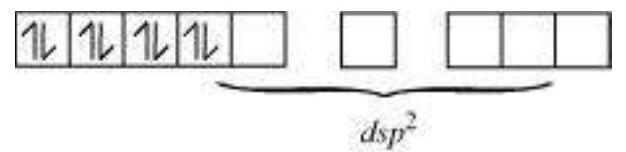
क्योंकि कोई अयुग्मित इलेक्ट्रॉन नहीं है, इसलिए यह विपरीत चुंबकीय है।
9.20 $\left[\mathrm{Ni}\left(\mathrm{H_2} \mathrm{O}\right)_6\right]^{2+}$ के घोल हरा होता है लेकिन $\left[\mathrm{Ni}(\mathrm{CN})_4\right]^{2-}$ के घोल रंगहीन होता है। क्यों?
उत्तर दिखाएं
उत्तर
$[\mathrm{Ni(H_2O)_6}]^{2+}$ में निम्न ऊर्जा स्तर से द-इलेक्ट्रॉन ऊँचे ऊर्जा स्तर में उत्प्रेरित हो सकते हैं अर्थात $d-d$ परिवर्तन की संभावना होती है। इसलिए, $\mathrm{Ni(H_2O)_6}]^{2+}$ रंगीन होता है।
In $\left[\mathrm{Ni}(\mathrm{CN}) _{4}\right]^{2 \cdot}$, इलेक्ट्रॉन सभी युग्मित हो जाते हैं क्योंकि $\mathrm{CN}^{-}$ एक मजबूत क्षेत्र लिगेंड है। अतः, $\left[\mathrm{Ni}(\mathrm{CN}) _{4}\right]^{2-}$ में $d-d$ संक्रमण संभव नहीं है। इसलिए, यह रंगहीन होता है।
9.21 $\left[\mathrm{Fe}(\mathrm{CN})_6\right]^{4-}$ और $\left[\mathrm{Fe}\left(\mathrm{H_2} \mathrm{O}\right)_6\right]^{2+}$ तनु विलयन में अलग-अलग रंगों के होते हैं। क्यों?
उत्तर दिखाएं
Answer
एक निश्चित संकर यौगिक के रंग के निर्धारण में क्रिस्टल-क्षेत्र विभाजन ऊर्जा, $\Delta$ के मान पर निर्भर करता है। इस CFSE के मान लिगेंड की प्रकृति पर निर्भर करता है। $\left[\mathrm{Fe}(\mathrm{CN}) _{6}\right]^{4-}$ और $\left[\mathrm{Fe}\left(\mathrm{H_2} \mathrm{O}\right) _{6}\right]^{2+}$ के मामले में रंग अलग होता है क्योंकि इनमें CFSE में अंतर होता है। अब, $CN^{-}$ एक मजबूत क्षेत्र लिगेंड है जिसका CFSE मान पानी के CFSE मान से अधिक होता है। इसका अर्थ यह है कि अंतर $d-d$ संक्रमण के लिए ऊर्जा अवशोषण में अंतर होता है। इसलिए, प्रसारित रंग में भी अंतर होता है।
9.22 धातु कार्बोनाइल के बंधन की प्रकृति के बारे में चर्चा करें।
उत्तर दिखाएं
Answer
(i) कार्बोनिल के कार्बन के इलेक्ट्रॉन युग्म के दान से धातु परमाणु के खाली ऑर्बिटल में $M \leftarrow C$ सिग्मा बंध का निर्माण होता है। यह दाता अधिरंजन होता है।
(ii) भरे हुए धातु d-ऑर्बिटल से वैकल्पिक बंधन अंतर अणुओं के $\pi^ *$ अंतर बंधन ऑर्बिटल में इलेक्ट्रॉन के दान से $M \rightarrow C \pi$ बंध का निर्माण होता है। यह पीछे का दान या पीछे का बंधन होता है। यह एक सहभागी प्रभाव उत्पन्न करता है और CO और धातु के बीच बंध को मजबूत करता है।
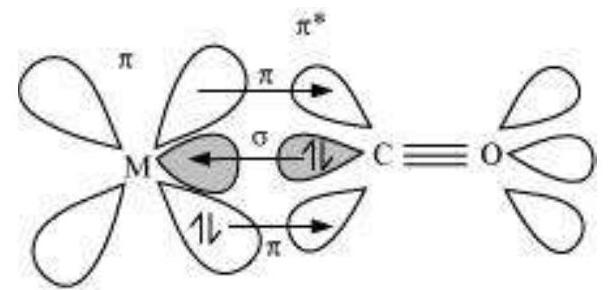
धातु कार्बोनाइल में सहभागी बंधन
9.23 निम्नलिखित यौगिकों में केंद्रीय धातु आयन के ऑक्सीकरण अवस्था, $d$ ऑर्बिटल उपस्थिति और समन्वय संख्या बताइए:
(i) $\mathrm{K_3}\left[\mathrm{Co}\left(\mathrm{C_2} \mathrm{O_4}\right)_3\right]$
(ii) cis- $\left[\mathrm{CrCl_2}(\mathrm{en})_{2}\right] \mathrm{Cl}$
(iii) $\left(\mathrm{NH_4}\right)_{2}\left[\mathrm{CoF_4}\right]$
(iv) $\left[\mathrm{Mn}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right] \mathrm{SO_4}$
उत्तर दिखाएं
उत्तर
(i) $\mathrm{K_3}\left[\mathrm{Co}\left(\mathrm{C_2} \mathrm{O_4}\right)_{3}\right]$
केंद्रीय धातु आयन Co है।
इसकी समन्वय संख्या 6 है।
ऑक्सीकरण अवस्था निम्नलिखित रूप में दी जा सकती है:
$x-6=-3$
$x=+3$
$\mathrm{Co}^{3+}$ के $d$ ऑर्बिटल उपस्थिति $t_{2 g}{ }^{6} e_{g}{ }^{0}$ है।
(ii) cis- $\left[\mathrm{Cr}(\mathrm{en})_{2} \mathrm{Cl_2}\right] \mathrm{Cl}$
केंद्रीय धातु आयन $\mathrm{Cr}$ है।
समन्वय संख्या 6 है।
ऑक्सीकरण अवस्था निम्नलिखित रूप में दी जा सकती है:
$x+2(0)+2(-1)=+1$
$x-2=+1$
$x=+3$
$\mathrm{Cr}^{3+}$ के $d$ ऑर्बिटल उपस्थिति $t_{2 g}{ }^{3}$ है।
(iii) $\left(\mathrm{NH_4}\right)_{2}\left[\mathrm{CoF_4}\right]$
केंद्रीय धातु आयन Co है।
समन्वय संख्या 4 है।
ऑक्सीकरण अवस्था निम्नलिखित रूप में दी जा सकती है:
$x-4=-2$
$x=+2$
$\mathrm{Co}^{2+}$ के $d$ ऑर्बिटल उपस्थिति $\mathrm{e}{ }^{4} t_{2}{ }^{3}$ है।
(iv) $\left[\mathrm{Mn}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right] \mathrm{SO_4}$
केंद्रीय धातु आयन Mn है।
समन्वय संख्या 6 है।
ऑक्सीकरण अवस्था निम्नलिखित रूप में दी जा सकती है:
$x+0=+2$
$x=+2$
$\mathrm{Mn}$ के $d$ ऑर्बिटल उपस्थिति $t_{2g}{ }^{3} e_{g}{ }^{2}$ है।
9.24 निम्नलिखित प्रत्येक यौगिक के IUPAC नाम लिखिए और ऑक्सीकरण अवस्था, इलेक्ट्रॉनिक विन्यास और समन्वय संख्या का संकेत दें। साथ ही, यौगिक की स्थानिक रासायनिक विन्यास और चुंबकीय आघूर्ण भी बताइए:
(i) $\mathrm{K}\left[\mathrm{Cr}\left(\mathrm{H_2} \mathrm{O}\right)_{2}\left(\mathrm{C_2} \mathrm{O_4}\right)_2\right] \cdot 3 \mathrm{H_2} \mathrm{O}$
(ii) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{5} \mathrm{Cl}\right] \mathrm{Cl_2}$
(iii) $\left[\mathrm{CrCl_3}(\mathrm{py})_{3}\right]$
(iv) $\mathrm{Cs}\left[\mathrm{FeCl_4}\right]$
(v) $\mathrm{K_4}\left[\mathrm{Mn}(\mathrm{CN})_{6}\right]$
उत्तर दिखाएं
Answer
(i) पोटेशियम डाइएक्वाडाइऑक्सलेटोक्रोमेट (III) ट्राइहाइड्रेट।
क्रोमियम की ऑक्सीकरण अवस्था $=3$
इलेक्ट्रॉनिक विन्यास: $3 d^{3}: t_{2 g}{ }^{3}$
कोऑर्डिनेशन संख्या $=6$
आकृति: अष्टफलकीय
स्थानिक रासायनिक विन्यास:
चुंबकीय आघूर्ण, $= \sqrt{n(n+2)}$
$=\sqrt{3(3+2)}$
$=\sqrt{15}\ \mathrm{BM}=3.873\ \mathrm{BM}$
(ii) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{5} \mathrm{Cl}\right] \mathrm{Cl_2}$
IUPAC नाम: पेंटा एमीनी क्लोरिडो कोबाल्ट (III) क्लोराइड
कोबाल्ट की ऑक्सीकरण अवस्था $=+3$
कोऑर्डिनेशन संख्या $=6$
आकृति: अष्टफलकीय।
इलेक्ट्रॉनिक विन्यास: $d^{6}: t_{2g}{ }^{6}$.
स्थानिक रासायनिक विन्यास:

दिए गए यौगिक के लिए केवल एक आइसोमर संभव है।
चुंबकीय आघूर्ण $=0\ \mathrm{BM}$
(iii) $[\mathrm{CrCl_3}(\mathrm{py})_{3}]$
IUPAC नाम: ट्राइक्लोरिडो ट्राइपिरिडीन क्रोमियम (III)
क्रोमियम की ऑक्सीकरण अवस्था $=+3$
$ d^{3} $ के लिए इलेक्ट्रॉनिक विन्यास $ t_{2g}{ }^{3} $
कोऑर्डिनेशन संख्या $=6$
आकृति: अष्टफलकीय।
स्थानिक रासायनिक विन्यास:
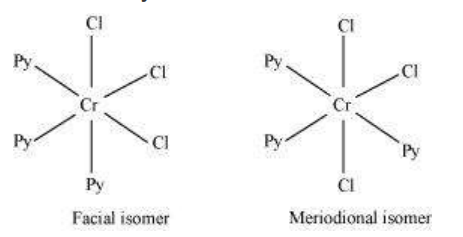
केवल मेरिडियन आइसोमर चुंबकीय अक्रिय है जबकि फेसियल आइसोमर चुंबकीय क्रियशील है इसलिए कुल तीन आइसोमर होंगे।
चुंबकीय आघूर्ण, $=\sqrt{n(n+2)}$
$=\sqrt{3(3+2)}$
$=\sqrt{15}\ \mathrm{BM}=3.873\ \mathrm{BM}$
(iv) $\mathrm{Cs}\left[\mathrm{FeCl_4}\right]$
IUPAC नाम: कैसियम टेट्राक्लोरोफेरेट (III)
$\mathrm{Fe}$ का ऑक्सीकरण अवस्था $=+3$
$ d^{5} $ की इलेक्ट्रॉनिक विन्यास: $ e_{g}{ }^{2} t_{2 g}{ }^{3} $
कोऑर्डिनेशन संख्या $=4$
आकृति: चतुष्फलकीय
स्टीरियोकेमिस्ट्री: प्रकाश के अनुप्रस्थ अक्षित
चुंबकीय आघूर्ण:
$=\sqrt{n(n+2)}$
$=\sqrt{5(5+3)}$
$=\sqrt{35}\ \mathrm{BM}=5.916\ \mathrm{BM}$
(v) $\mathrm{K_4}\left[\mathrm{Mn}(\mathrm{CN})_{6}\right]$
पोटेशियम हेक्सासाइनोमैंगनेट(II)
मैंगनीज का ऑक्सीकरण अवस्था $=+2$
इलेक्ट्रॉनिक विन्यास: $d^{5}: t_{2 g}{ }^{5}$
कोऑर्डिनेशन संख्या $=6$
आकृति: अष्टफलकीय।
स्टीरियोकेमिस्ट्री: प्रकाश के अनुप्रस्थ अक्षित
चुंबकीय आघूर्ण, $=\sqrt{n(n+2)}$
$=\sqrt{1(1+2)}$
$=\sqrt{3}$
$=1.732\ \mathrm{BM}$
9.25 क्रिस्टल क्षेत्र सिद्धांत के आधार पर $\left[\mathrm{Ti}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right]^{3+}$ कम्प्लेक्स के बैंगनी रंग की व्याख्या कीजिए।
उत्तर दिखाएं
कम्प्लेक्स $\left[\mathrm{Ti}\left(\mathrm{H}2 \mathrm{O}\right)6\right]^{3+}$ में, Ti परमाणु की ऑक्सीकरण अवस्था +3 है। इसकी बाहरी इलेक्ट्रॉनिक विन्यास $3 \mathrm{d}^1$ है। इसमें एक असुम्पन इलेक्ट्रॉन होता है। यह असुम्पन इलेक्ट्रॉन $t{2 g}$ स्तर से $\mathrm{e}{\mathrm{g}}$ स्तर में लाल रंग के प्रकाश के अवशोषण के कारण उत्तेजित होता है और इसलिए बैंगनी रंग का दिखाई देता है।

9.26 चेलेट अपघटन के अर्थ क्या है? एक उदाहरण दीजिए।
उत्तर दिखाएं
उत्तर
जब एक लिगेंड धातु आयन के साथ ऐसे तरीके से जुड़ता है जो एक वलय बनाता है, तो धातु-लिगेंड संयोजन अधिक स्थायी पाया जाता है। अन्य शब्दों में, हम कह सकते हैं कि वलय वाले संकुल बिना वलय वाले संकुल की तुलना में अधिक स्थायी होते हैं। इसे चेलेट अपघटन कहते हैं।
उदाहरण के लिए:
$ \begin{aligned} \mathrm{Ni^{2+} {(a q)}}+6 \mathrm{NH _3{(a q)}} \rightleftharpoons & {\left[\mathrm{Ni}\left(\mathrm{NH _3}\right) _{6}\right]^{2+} {(a q)} } \\ `
& \log \beta=7.99 \\ \mathrm{Ni^{2+} {(a q)}}+3 \mathrm{en {(a q)}} \rightleftharpoons & {\left[\mathrm{Ni}(\mathrm{en}) _{3}\right] ^{2+}{(a q)} } \\ & \log \beta=18.1 \\ & \text { (अधिक स्थायी) } \end{aligned} $
9.27 प्रत्येक स्थिति में उदाहरण देकर संयोजन यौगिकों के भूमिका के बारे में ब्रिफ चर्चा करें:
(i) जैविक प्रणालियों में
(ii) चिकित्सा रसायन विज्ञान में
(iii) विश्लेषणात्मक रसायन विज्ञान में
(iv) धातुओं के निष्कर्षण/खनन में
उत्तर दिखाएं
Answer
(i) जैविक प्रणालियों में संयोजन यौगिकों की भूमिका:
हम जानते हैं कि प्रकाश संश्लेषण के लिए क्लोरोफिल रंगक की उपस्थिति के कारण संभव होता है। यह रंगक मैग्नीशियम के एक संयोजन यौगिक है। मनुष्य के जैविक प्रणाली में कई संयोजन यौगिक महत्वपूर्ण भूमिका निभाते हैं। उदाहरण के लिए, रक्त के ऑक्सीजन-वाहक, अर्थात हीमोग्लोबिन, लोहा के एक संयोजन यौगिक है।
(ii) चिकित्सा रसायन विज्ञान में संयोजन यौगिकों की भूमिका:
कुछ प्लैटिन के संयोजन यौगिक (उदाहरण के लिए, सिस-प्लैटिन) का उपयोग कैंसर के विकास को रोकने के लिए किया जाता है।
(iii) विश्लेषणात्मक रसायन विज्ञान में संयोजन यौगिकों की भूमिका:
लवण विश्लेषण के दौरान, कई मूल धनात्मक अपघटकों का पता लगाया जाता है, जो विभिन्न प्रतिरक्षकों के साथ अपने रंग के परिवर्तन के कारण दिखाई देते हैं। ये रंग परिवर्तन विभिन्न लिगेंडों के साथ मूल धनात्मक अपघटकों द्वारा बनाए गए संयोजन यौगिकों या जटिलों के परिणाम होते हैं।
(iv) धातुओं के निष्कर्षण या खनन में संयोजन यौगिकों की भूमिका:
कुछ धातुओं के अपने अयस्क से निष्कर्षण की प्रक्रिया में संयोजन के निर्माण के लिए आवश्यकता होती है। उदाहरण के लिए, जलीय विलयन में, स्वर्ण कायनाइट आयनों के साथ संयोजन बनाता है जो $\left[\mathrm{Au}(\mathrm{CN})_{2}\right]$ होता है। इस विलयन से बाद में जिंक धातु के योग के द्वारा स्वर्ण को निष्कर्षित किया जाता है।
9.28 विलयन में संकुल $\mathrm{Co}\left(\mathrm{NH_3}\right)_6 \mathrm{Cl_2}$ से कितने आयन उत्पन्न होते हैं?
(i) 6
(ii) 4
(iii) 3
(iv) 2
उत्तर दिखाएँ
उत्तर
(iii) दिया गया संकुल $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{6}\right] \mathrm{Cl_2}$ के रूप में लिखा जा सकता है
इसलिए, $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{6}\right]^{+}$ एवं दो $\mathrm{Cl}^{-}$ आयन उत्पन्न होते हैं।
9.29 निम्नलिखित आयनों में से किसके चुंबकीय आघूर्ण मान सर्वाधिक है?
(i) $\left[\mathrm{Cr}\left(\mathrm{H_2} \mathrm{O}\right)_6\right]^{3+}$
(ii) $\left[\mathrm{Fe}\left(\mathrm{H_2} \mathrm{O}\right)_6\right]^{2+}$
(iii) $\left[\mathrm{Zn}\left(\mathrm{H_2} \mathrm{O}\right)_6\right]^{2+}$
उत्तर दिखाएँ
उत्तर
(i) $\left[\mathrm{Cr}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right]^{3+}$ में असुमेलित इलेक्ट्रॉनों की संख्या = 3
तब, $=\sqrt{n(n+2)}$
$=\sqrt{3(3+2)}$
$=\sqrt{15}=3.873\ \mathrm{BM}$
(ii) $\left[\mathrm{Fe}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right]^{2+}$ में असुमेलित इलेक्ट्रॉनों की संख्या = 4
तब, $=\sqrt{4(4+2)}$
$=\sqrt{24}\ \mathrm{BM}=4.899\ \mathrm{BM}$
(iii) $\left[\mathrm{Zn}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right]^{2+}$ में असुमेलित इलेक्ट्रॉनों की संख्या = 0
अतः $\left[\mathrm{Fe}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right]^{2+}$ के चुंबकीय आघूर्ण मान सर्वाधिक है।
9.30 निम्नलिखित में से सबसे स्थायी संकुल है
(i) $\left[\mathrm{Fe}\left(\mathrm{H}_2 \mathrm{O}\right)_6\right]^{3+}$
(ii) $\left[\mathrm{Fe}\left(\mathrm{NH}_3\right)_6\right]^{3+}$
(iii) $\left[\mathrm{Fe}\left(\mathrm{C}_2 \mathrm{O}_4\right)_3\right]^{3-}$
(iv) $\left[\mathrm{FeCl}_6\right]^{3-}$
उत्तर दिखाएँ
उत्तर
हम जानते हैं कि एक संकुल की स्थायित्व चेलेटन द्वारा बढ़ जाती है। अतः सबसे स्थायी संकुल $\left[\mathrm{Fe}\left(\mathrm{C_2} \mathrm{O_4}\right)_{3}\right]^{3 .}$ है।
9.31 निम्नलिखित के लिए दृश्य तरंगदैर्ध्य के अवशोषण के सही क्रम क्या होगा:
$$ \left[\mathrm{Ni}\left(\mathrm{NO_2}\right)_6\right]^{4-},\left[\mathrm{Ni}\left(\mathrm{NH_3}\right)_6\right]^{2+},\left[\mathrm{Ni}\left(\mathrm{H_2} \mathrm{O}\right)_6\right]^{2+} ? $$
उत्तर दिखाएं
उत्तर
सभी तीन यौगिकों में केंद्रीय धातु आयन समान है। अतः दृश्य क्षेत्र में अवशोषण लिगेंड पर निर्भर करता है। लिगेंड के CFSE मान के आवेश श्रेणी में वृद्धि के क्रम में निम्नलिखित है:
$\mathrm{H_2} \mathrm{O}<\mathrm{NH_3}<\mathrm{NO_2}^{-}$
इसलिए, अवलोकन किए गए क्रिस्टल-क्षेत्र विभाजन के मान निम्नलिखित क्रम में होंगे: $\Delta _{\left(\mathrm{H _2} \mathrm{O}\right)}<\Delta _{\left(\mathrm{NH _3}\right)}<\Delta _{\left(\mathrm{NO _2}^{-}\right)}$
अतः दृश्य क्षेत्र में अवशोषण की तरंगदैर्ध्य निम्नलिखित क्रम में होंगी:
$\left[\mathrm{Ni}\left(\mathrm{H _2} \mathrm{O}\right) _{6}\right]^{2+}>\left[\mathrm{Ni}\left(\mathrm{NH_3}\right) _{6}\right]^{2+}>\left[\mathrm{Ni}\left(\mathrm{NO _2}\right) _{6}\right]^{4}$





