अध्याय 8 रेडॉक्स अभिक्रियाएँ
अभ्यास
8.1 निम्नलिखित प्रतियोगियों में अंतर्गत तत्वों के ऑक्सीकरण संख्या का निर्धारण कीजिए:
(a) $\mathrm{NaH_2} \mathrm{PO_4}$
(b) $\mathrm{NaHSO_4}$
(c) $\mathrm{H_4} \mathrm{P_2} \mathrm{O_7}$
(d) $\mathrm{K_2} \mathrm{MnO_4}$
(e) $\mathrm{CaO_2}$
(f) $\mathrm{NaBH_4}$
(g) $\mathrm{H_2} \underline {\mathrm{S}_2} \mathrm{O_7}$
(h) $\mathrm{KAl}\left(\mathrm{SO_4}\right)_{2} \cdot 12 \mathrm{H_2} \mathrm{O}$
उत्तर दिखाएँ
उत्तर
(a) $NaH_2 \underline PO_4$
मान लीजिए $P$ के ऑक्सीकरण संख्या $x$ है।
हम जानते हैं कि,
$Na$ के ऑक्सीकरण संख्या $+1$ है
$H$ के ऑक्सीकरण संख्या $+1$ है
$O$ के ऑक्सीकरण संख्या $-2$ है
$\Rightarrow \stackrel{+1}{Na} \stackrel{+1}{H} \stackrel{x}{P} \stackrel{-2}{O_4}$
तब हमें प्राप्त होता है
$1(+1)+2(+1)+1(x)+4(-2)=0$
$\Rightarrow 1+2+x-8=0$
$\Rightarrow x=+5$
अतः $P$ के ऑक्सीकरण संख्या +5 है।
(b) $NaHSO_4$
$\stackrel{+1}{Na} \stackrel{+1}{H} \stackrel{x}{S} O_4$
तब हमें प्राप्त होता है
$1(+1)+1(+1)+x+4(-2)=0$
$\Rightarrow 1+1+x-8=0$
$\Rightarrow x=+6$
अतः $S$ के ऑक्सीकरण संख्या +6 है।
(c) $H_4 \underline P_2 O_7$ $\stackrel{+1}{H_4} \stackrel{x}{P} \stackrel{-2}O_7$
तब हमें प्राप्त होता है
$4(+1)+2(x)+7(-2)=0$
$\Rightarrow 4+2 x-14=0$
$\Rightarrow 2 x=+10$
$\Rightarrow x=+5$
अतः $P$ के ऑक्सीकरण संख्या +5 है।
(d) $K_2 \underline {MnO_4}$
$ \stackrel{+1}{K_2} \stackrel{x}{Mn} \stackrel{-2}{O_4} $
तब हमें प्राप्त होता है
$2(+1)+x+4(-2)=0$
$\Rightarrow 2+x-8=0$
$\Rightarrow x=+6$
अतः $Mn$ के ऑक्सीकरण संख्या +6 है।
(e) $CaO \underline O_2$
$\stackrel{+2}{Ca} \stackrel{x_O^{2}}{ }$
तब हमें प्राप्त होता है
$(+2)+2(x)=0$
$\Rightarrow 2+2 x=0$
$\Rightarrow x=-1$
अतः $O$ के ऑक्सीकरण संख्या - 1 है।
(f) $NaBH_4$
$\stackrel{+1}{Na} \stackrel{x}B^{-1} H_4$
तब हमें प्राप्त होता है
$1(+1)+1(x)+4(-1)=0$
$\Rightarrow 1+x-4=0$
$\Rightarrow x=+3$
अतः $B$ के ऑक्सीकरण संख्या +3 है।
(g) $H_2 \underline S_2 O_7$
$\stackrel{+1}{H_2} S_2 \stackrel{-2}{O}$
तब, हमें यह प्राप्त होता है
$2(+1)+2(x)+7(-2)=0$
$\Rightarrow 2+2 x-14=0$
$\Rightarrow 2 x=12$
$\Rightarrow x=+6$
इसलिए, $S$ के ऑक्सीकरण संख्या +6 है ।
(ह) $KAl(\underline SO_4)_2 \cdot 12 H_2 O$
$\stackrel{+1}{KAl}(\stackrel{x^{2}-SO_4}{ })_2 .12 \stackrel{+1}{H_2} \stackrel{-2}{O}$
तब, हमें यह प्राप्त होता है
$1(+1)+1(+3)+2(x)+8(-2)+24(+1)+12(-2)=0$
$\Rightarrow 1+3+2 x-16+24-24=0$
$\Rightarrow 2 x=12$
$\Rightarrow x=+6$
या,
हम पानी के अणु को नगण्य मान सकते हैं क्योंकि यह एक उदासीन अणु है। तब, पानी के अणु के सभी परमाणुओं के ऑक्सीकरण संख्या को शून्य मान लिया जा सकता है। इसलिए, पानी के अणु को नगण्य कर देने के बाद हमें यह प्राप्त होता है
$1(+1)+1(+3)+2(x)+8(-2)=0$
$\Rightarrow 1+3+2 x-16=0$
$\Rightarrow 2 x=12$
$\Rightarrow x=+6$
इसलिए, $S$ के ऑक्सीकरण संख्या +6 है ।
8.2 प्रत्येक निम्नलिखित में अंतर्रिक तत्वों के ऑक्सीकरण संख्या क्या है और आप अपने परिणाम को कैसे तर्क देंगे?
(a) $\mathrm{KI_3}$
(b) $\mathrm{H_2} \underline {\mathrm{S}_4} \mathrm{O_6}$
(c) $\mathrm{Fe_3} \mathrm{O_4}$
(d) $\mathrm{CH_3} \mathrm{CH_2} \mathrm{OH}$
(e) $\mathrm{CH_3} \mathrm{COOH}$
उत्तर दिखाएं
उत्तर
(a) $KI_3$
$KI_3$ में $K$ के ऑक्सीकरण संख्या (O.N.) +1 है। इसलिए, $I$ के औसत ऑक्सीकरण संख्या $-\frac{1}{3}$ है। हालांकि, ऑक्सीकरण संख्या भिन्न नहीं हो सकती। इसलिए, हमें $KI_3$ के संरचना को ध्यान में रखते हुए ऑक्सीकरण अवस्था ज्ञात करनी होगी।
एक $KI_3$ अणु में, आयोडीन के एक परमाणु आयोडीन अणु के साथ सहसंयोजक संयोजक आबंध बनाता है।
$ \stackrel{+1}{K^+}[\stackrel{0}{I-}\stackrel{0}{I} \longleftarrow \stackrel{-1}{I} ]^{-} $
इसलिए, $KI_3$ अणु में, $I_2$ अणु बनाने वाले दो I परमाणुओं के ऑक्सीकरण संख्या 0 है, जबकि सहसंयोजक आबंध बनाने वाले I परमाणु के ऑक्सीकरण संख्या -1 है।
(b) $H_2 \underline S_4 O_6$
$ \stackrel{+1}{H_2} \stackrel{\stackrel{x}{S} O_4 \stackrel{-2}{O}}{6} $
अब, $2(+1)+4(x)+6(-2)=0$
$\Rightarrow 2+4 x-12=0$
$\Rightarrow 4 x=10$
$\Rightarrow x=+2 \frac{1}{2}$
हालांकि, O.N. भिन्न भिन्न ऑक्सीकरण अवस्था में उपस्थित हो सकता है। अतः, अणु में S के अलग-अलग ऑक्सीकरण अवस्था में उपस्थित होना आवश्यक है।
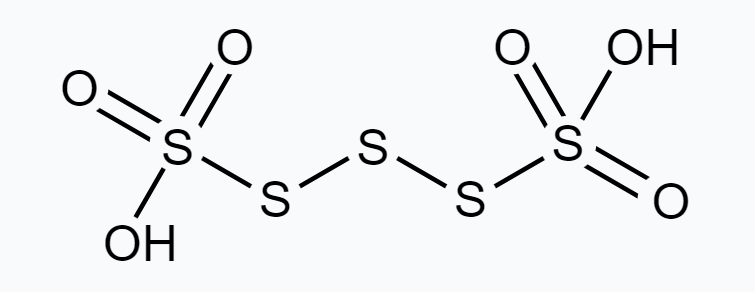
चार $S$ परमाणुओं में से दो के O.N. +5 है और बाकी दो के O.N. 0 है।
(c) $\underline Fe_3 O_4$
ऑक्सीजन के O.N. को -2 मानकर, लोहा के O.N. को ${ }^{+2 \frac{2}{3}}$ पाया जाता है। हालांकि, O.N. भिन्न भिन्न ऑक्सीकरण अवस्था में उपस्थित हो सकता है। यहां, तीन लोहा परमाणुओं में से एक के O.N. +2 है और बाकी दो के O.N. +3 है।
$\stackrel{+2}{FeO}, \stackrel{+3}{F} e_2 O_3$
(d) $CH_3 \underline CH_2 OH$
$2(x)+6(+1)+1(-2)=0$
या, $2 x+4=0$
या, $x=-2$
अतः, C के O.N. -2 है।
(e)
$CH_3 \underline {COOH}$
$2(x)+4(+1)+2(-2)=0$
या, $2 x=0$
या, $x=0$
हालांकि, 0 C के औसत O.N. है। इस अणु में उपस्थित दो कार्बन परमाणु अलग-अलग वातावरण में उपस्थित हैं। अतः, वे एक ही ऑक्सीकरण अवस्था में नहीं हो सकते। अतः, $C$ अणु $CH_3 COOH$ में +2 और -2 ऑक्सीकरण अवस्था में उपस्थित है।
8.3 निम्नलिखित अभिक्रियाओं के लिए बताइए कि ये रेडॉक्स अभिक्रियाएं क्यों हैं:
(a) $\mathrm{CuO}$ (s) $+\mathrm{H_2}$ (g) $\rightarrow \mathrm{Cu}$ (s) $+\mathrm{H_2} \mathrm{O}$ (g)
(b) $\mathrm{Fe_2} \mathrm{O_3}$ (s) $+3 \mathrm{CO}$ (g) $\rightarrow 2 \mathrm{Fe}(\mathrm{s})+3 \mathrm{CO_2}$ (g)
(c) $4 \mathrm{BCl_3}(\mathrm{~g})+3 \mathrm{LiAlH_4}(\mathrm{~s}) \rightarrow 2 \mathrm{~B_2} \mathrm{H_6}(\mathrm{~g})+3 \mathrm{LiCl}(\mathrm{s})+3 \mathrm{AlCl_3}$ (s)
(d) $2 \mathrm{~K}(\mathrm{~s})+\mathrm{F_2}(\mathrm{~g}) \rightarrow 2 \mathrm{~K}^{+} \mathrm{F}^{-}(\mathrm{s})$
(e) $4 \mathrm{NH_3}(\mathrm{~g})+5 \mathrm{O_2}(\mathrm{~g}) \rightarrow 4 \mathrm{NO}(\mathrm{g})+6 \mathrm{H_2} \mathrm{O}(\mathrm{g})$
उत्तर दिखाएं
Answer
(a)
$ CuO _{(s)}+H _{2(g)} \longrightarrow Cu _{(s)}+H_2 O _{(g)} $
हम दिए गए अभिक्रिया में शामिल प्रत्येक तत्व के ऑक्सीकरण संख्या को लिखें:
$\stackrel{+2}{Cu} \stackrel{-2}{O}(s)+\stackrel{0}{H}(g) \longrightarrow \stackrel{0}{C} u _{(s)}+\stackrel{+1}H_2 \stackrel{-2}O _{(g)}$
यहाँ, $Cu$ की ऑक्सीकरण संख्या $CuO$ में +2 से $Cu$ में 0 तक घट जाती है, अर्थात $CuO$ $Cu$ में अपचयित हो जाता है। एक ओर, $H$ की ऑक्सीकरण संख्या $H_2$ में 0 से $H_2 O$ में +1 तक बढ़ जाती है, अर्थात $H_2$ $H_2 O$ में ऑक्सीकृत हो जाता है। अतः यह अभिक्रिया एक रेडॉक्स अभिक्रिया है।
(b)
$ Fe_2 O _{3(s)}+3 CO _{(g)} \longrightarrow 2 Fe _{(s)}+3 CO _{2(g)} $
हम दिए गए अभिक्रिया में शामिल प्रत्येक तत्व के ऑक्सीकरण संख्या को लिखें:
$ \stackrel{+3}{Fe_2} \stackrel{-2}{O_3} + \stackrel{+2 -2}{3CO_{(g)}} \longrightarrow 2\stackrel{0}{Fe_{(s)}} + 3\stackrel{+4-2}{CO_{2(g)}} $
यहाँ, $Fe$ की ऑक्सीकरण संख्या $Fe_2 O_3$ में +3 से $Fe$ में 0 तक घट जाती है, अर्थात $Fe_2 O_3$ $Fe$ में अपचयित हो जाता है। दूसरी ओर, $C$ की ऑक्सीकरण संख्या $CO$ में +2 से $CO_2$ में +4 तक बढ़ जाती है, अर्थात $CO$ $CO_2$ में ऑक्सीकृत हो जाता है। अतः दी गई अभिक्रिया एक रेडॉक्स अभिक्रिया है।
(c)
$ 4 BCl _{3(g)}+3 LiAlH _{4(s)} \longrightarrow 2 B_2 H _{6(g)}+3 LiCl _{(s)}+3 AlCl _{3(s)} $
दी गई अभिक्रिया में शामिल प्रत्येक तत्व की ऑक्सीकरण संख्या को इस प्रकार दर्शाया जा सकता है:
$ 4 \stackrel{+3}{B} \stackrel{-1}{Cl_{3(g)}} + \stackrel{+1+3-1}{\quad 3LiAlH_{4(s)}} \longrightarrow \stackrel{-3 \quad +1}{\quad 2B_2 H_{6(g)}} + \stackrel{+1-1}{3LiCl_{(s)}} + \stackrel{+3 -1}{\quad 3AlCl_{3(s)}} $
इस अभिक्रिया में, $B$ की ऑक्सीकरण संख्या $BCl_3$ में +3 से $B_2 H_6$ में -3 तक घट जाती है, अर्थात $BCl_3$ $B_2 H_6$ में अपचयित हो जाता है। एक ओर, $H$ की ऑक्सीकरण संख्या $LiAlH_4$ में -1 से $B_2 H_6$ में +1 तक बढ़ जाती है, अर्थात $LiAlH_4$ $B_2 H_6$ में ऑक्सीकृत हो जाता है। अतः दी गई अभिक्रिया एक रेडॉक्स अभिक्रिया है।
(d) $2 K _{(s)}+F _{2(g)} \longrightarrow 2 K^{+} F^{-} _{(s)}$
दिए गए अभिक्रिया में प्रत्येक तत्व के ऑक्सीकरण संख्या को निम्नलिखित रूप में प्रस्तुत किया जा सकता है:
$2 \stackrel{0}K _{(s)}+\stackrel{0}F _{2(g)}^{\longrightarrow} 2 \stackrel{+1}K^{+} \stackrel{-1}F _{(s)}^{-}$
इस अभिक्रिया में, $K$ के ऑक्सीकरण संख्या $K$ में 0 से $KF$ में +1 तक बढ़ जाती है, अर्थात $K$ के $KF$ में ऑक्सीकरण हो जाता है। दूसरी ओर, $F$ के ऑक्सीकरण संख्या $F_2$ में 0 से $KF$ में -1 तक घट जाती है, अर्थात $F_2$ के $KF$ में अपचयन हो जाता है।
इसलिए, उपरोक्त अभिक्रिया एक रेडॉक्स अभिक्रिया है।
(e)
$ 4NH_{3(g)} + 5O_{2(g)} \longrightarrow 4NO_{(g)} + 6H_2O_{(g)} $
दिए गए अभिक्रिया में प्रत्येक तत्व के ऑक्सीकरण संख्या को निम्नलिखित रूप में प्रस्तुत किया जा सकता है:
$4 \stackrel{-3}N _{3(g)}+5 \stackrel{0}O _{2(g)}^{\longrightarrow} 4 \stackrel{+2}{N} \stackrel{-2}O _{(g)}+6 \stackrel{+1}H_2 \stackrel{-2}O _{(g)}$
यहाँ, $N$ के ऑक्सीकरण संख्या $NH_3$ में -3 से $NO$ में +2 तक बढ़ जाती है। दूसरी ओर, $O_2$ के ऑक्सीकरण संख्या $O_2$ में 0 से $NO$ और $H_2 O$ में -2 तक घट जाती है, अर्थात $O_2$ के $NO$ और $H_2 O$ में अपचयन हो जाता है। इसलिए, दिए गए अभिक्रिया एक रेडॉक्स अभिक्रिया है।
8.4 फ्लूओरीन बर्फ के साथ अभिक्रिया करता है और निम्नलिखित परिवर्तन होता है:
$\mathrm{H_2} \mathrm{O}(\mathrm{s})+\mathrm{F_2}(\mathrm{~g}) \rightarrow \mathrm{HF}(\mathrm{g})+\mathrm{HOF}(\mathrm{g})$
इस अभिक्रिया को रेडॉक्स अभिक्रिया के रूप में बताइए।
उत्तर दिखाएं
Answer
दिए गए अभिक्रिया में शामिल प्रत्येक परमाणु के ऑक्सीकरण संख्या को उसके प्रतीक के ऊपर लिखा जा सकता है:
$ \stackrel{+1 -2}{H_2O} + \stackrel{0}{F} \longrightarrow \stackrel{+1-1}{HF} + \stackrel{+1-2+1}{HOF} $
यहाँ, हम देखते हैं कि $F$ के ऑक्सीकरण संख्या $F_2$ में 0 से $HOF$ में +1 तक बढ़ जाती है। इसके अलावा, $F$ के ऑक्सीकरण संख्या $F_2$ में 0 से $HF$ में -1 तक घट जाती है। इसलिए, उपरोक्त अभिक्रिया में $F$ एक साथ ऑक्सीकृत और अपचयित होता है। इसलिए, दिए गए अभिक्रिया एक रेडॉक्स अभिक्रिया है।
8.5 $\mathrm{H_2} \mathrm{SO_5}, \mathrm{Cr_2} \mathrm{O_7}^{2-}$ और $\mathrm{NO_3}^{-}$ में सल्फर, क्रोमियम और नाइट्रोजन के ऑक्सीकरण संख्या की गणना कीजिए। इन यौगिकों की संरचना के बारे में सुझाव दीजिए। त्रुटि की गणना कीजिए।
उत्तर दिखाएँ
उत्तर
(i)
$\stackrel{+1}{H_2} \stackrel{x}{S^{-2}} S_5$
$2(+1)+1(x)+5(-2)=0$
$\Rightarrow 2+x-10=0$
$\Rightarrow x=+8$
हालाँकि, $S$ के ऑक्सीकरण अवस्था +8 नहीं हो सकती। $S$ में छह बाह्य इलेक्ट्रॉन होते हैं। इसलिए, $S$ के ऑक्सीकरण अवस्था +6 से अधिक नहीं हो सकती। $H_2 SO_5$ की संरचना निम्नलिखित है:
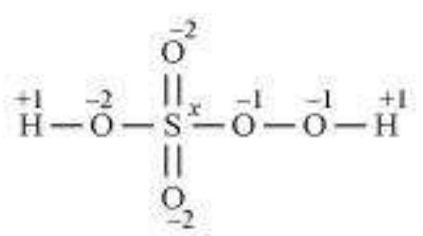
अब, $2(+1)+1(x)+3(-2)+2(-1)=0$
$\Rightarrow 2+x-6-2=0$
$\Rightarrow x=+6$
इसलिए, $S$ के ऑक्सीकरण अवस्था +6 है।
(ii)
${ }^{Cr} r_2 O_7^{2-}$
$2(x)+7(-2)=-2$
$\Rightarrow 2 x-14=-2$
$\Rightarrow x=+6$
यहाँ, $Cr_2 O_7^{2-}$ में $Cr$ के ऑक्सीकरण अवस्था के बारे में कोई त्रुटि नहीं है।
$Cr_2 O_7^{2-}$ की संरचना निम्नलिखित है:
यहाँ, दोनों $Cr$ परमाणुओं के ऑक्सीकरण अवस्था +6 है।
(iii) $\stackrel{x}{N} \stackrel{2-}{O_3^{-}}$
$1(x)+3(-2)=-1$
$\Rightarrow x-6=-1$
$\Rightarrow x=+5$
यहाँ, $NO_3^{-}$ में $N$ के ऑक्सीकरण अवस्था के बारे में कोई त्रुटि नहीं है।
$NO_3^{-}$ की संरचना निम्नलिखित है:
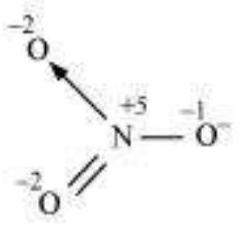
$N$ परमाणु के ऑक्सीकरण अवस्था +5 है।
8.6 निम्नलिखित यौगिकों के सूत्र लिखिए:
(a) रту क्लोराइड (II)
(b) निकल (II) सल्फेट
(c) टिन (IV) ऑक्साइड
(d) थैलियम (I) सल्फेट
(e) लोहा (III) सल्फेट
(f) क्रोमियम (III) ऑक्साइड
उत्तर दिखाएँ
उत्तर
(a) रту (II) क्लोराइड:
$HgCl_2$
(b) निकल (II) सल्फेट:
$NiSO_4$
(c) टिन (IV) ऑक्साइड:
$SnO_2$
(d) थैलियम (I) सल्फेट:
$TI_2 SO_4$
(e) लोहा (III) सल्फेट:
$Fe_2(SO_4)_3$
(f) क्रोमियम (III) ऑक्साइड:
$Cr_2 O_3$
8.7 कार्बन के ऑक्सीकरण अवस्था -4 से +4 तक और नाइट्रोजन के ऑक्सीकरण अवस्था -3 से +5 तक दिखाने वाले यौगिकों की सूची सुझाएँ।
उत्तर दिखाएँ
उत्तर
कार्बन के ऑक्सीकरण अवस्था (-4 से +4) के बीच परिवर्तन कर सकने वाले पदार्थों की सूची निम्नलिखित तालिका में दी गई है।
| पदार्थ | कार्बन की ऑक्सीकरण अवस्था (O.N.) |
|---|---|
| $CH_2 Cl_2$ | 0 |
| $ClC \equiv CCl$ | +1 |
| $HCA \equiv CH$ | $- 1$ |
| $CHCl_3, CO$ | +2 |
| $CH_3 Cl$ | $- 2$ |
| $Cl_3 C - CCl_3$ | +3 |
| $H_3 C - CH_3$ | -3 |
| $CCl_4- CO_2$ | +4 |
| $CH_4$ | -4 |
नाइट्रोजन के ऑक्सीकरण अवस्था (-3 से +5) के बीच परिवर्तन कर सकने वाले पदार्थों की सूची निम्नलिखित तालिका में दी गई है।
| पदार्थ | नाइट्रोजन की ऑक्सीकरण अवस्था (O.N.) |
|---|---|
| $N_2$ | 0 |
| $N_2 O$ | +1 |
| $N_2 H_2$ | $- 1$ |
| $NO$ | +2 |
| $N_2 H_4$ | $-2$ |
| $N_2 O_3$ | +3 |
| $NH_3$ | $- 3$ |
| $NO_2$ | +4 |
| $N_2 O_5$ | +5 |
8.8 सल्फर डाइऑक्साइड और हाइड्रोजन पेरॉक्साइड अपने प्रतिक्रियाओं में ऑक्सीकारक और अपचायक दोनों के रूप में कार्य कर सकते हैं, जबकि ओजोन और नाइट्रिक अम्ल केवल ऑक्सीकारक के रूप में कार्य करते हैं। क्यों?
उत्तर दिखाएं
उत्तर
सल्फर डाइऑक्साइड $(SO_2)$ में, सल्फर $(S)$ की ऑक्सीकरण अवस्था (O.N.) +4 है और सल्फर की ऑक्सीकरण अवस्था की संभावित श्रेणी +6 से -2 है।
इसलिए, $SO_2$ एक ऑक्सीकारक और अपचायक दोनों के रूप में कार्य कर सकता है।
हाइड्रोजन पेरॉक्साइड $(H_2 O_2)$ में, ऑक्सीजन $(O)$ की ऑक्सीकरण अवस्था -1 है और ऑक्सीजन की ऑक्सीकरण अवस्था की संभावित श्रेणी 0 से -2 है। ऑक्सीजन कभी-कभी +1 और +2 के ऑक्सीकरण अवस्था भी प्राप्त कर सकती है। इसलिए, $H_2 O_2$ एक ऑक्सीकारक और अपचायक दोनों के रूप में कार्य कर सकता है।
ओजोन $(O_3)$ में, ऑक्सीजन $(O)$ की ऑक्सीकरण अवस्था शून्य है और ऑक्सीजन की ऑक्सीकरण अवस्था की संभावित श्रेणी $O$ से -2 है। इसलिए, ऑक्सीजन की ऑक्सीकरण अवस्था इस मामले में केवल कम हो सकती है। इसलिए, $O_3$ केवल ऑक्सीकारक के रूप में कार्य करता है।
नाइट्रिक अम्ल $(HNO_3)$ में, नाइट्रोजन $(N)$ की ऑक्सीकरण अवस्था +5 है और नाइट्रोजन की ऑक्सीकरण अवस्था की संभावित श्रेणी +5 से -3 है। इसलिए, नाइट्रोजन की ऑक्सीकरण अवस्था इस मामले में केवल कम हो सकती है। इसलिए, $HNO_3$ केवल ऑक्सीकारक के रूप में कार्य करता है।
8.9 निम्नलिखित प्रतिक्रियाओं को ध्यान में रखें:
(a) $6 \mathrm{CO_2}(\mathrm{~g})+6 \mathrm{H_2} \mathrm{O}(\mathrm{l}) \rightarrow \mathrm{C_6} \mathrm{H_12} \mathrm{O_6}(\mathrm{aq})+6 \mathrm{O_2}(\mathrm{~g})$
(b) $\mathrm{O_3}(\mathrm{~g})+\mathrm{H_2} \mathrm{O_2}(\mathrm{l}) \rightarrow \mathrm{H_2} \mathrm{O}(\mathrm{l})+2 \mathrm{O_2}(\mathrm{~g})$
क्यों इन अभिक्रियाओं को इस तरह लिखना अधिक उपयुक्त है :
(a) $6 \mathrm{CO_2}(\mathrm{~g})+12 \mathrm{H_2} \mathrm{O}(\mathrm{l}) \rightarrow \mathrm{C_6} \mathrm{H_12} \mathrm{O_6}(\mathrm{aq})+6 \mathrm{H_2} \mathrm{O}(\mathrm{l})+6 \mathrm{O_2}(\mathrm{~g})$
(b) $\mathrm{O_3}$ (g) $+\mathrm{H_2} \mathrm{O_2}$ (l) $\rightarrow \mathrm{H_2} \mathrm{O}(\mathrm{l})+\mathrm{O_2}(\mathrm{~g})+\mathrm{O_2}$ (g)
इन (a) और (b) रेडॉक्स अभिक्रियाओं के पथ की जांच करने की एक तकनीक का सुझाव भी दें।
उत्तर दिखाएं
Answer
(a) प्रकाश संश्लेषण की प्रक्रिया में दो चरण होते हैं।
चरण 1:
$H_2 O$ के अपघटन से $H_2$ और $O_2$ प्राप्त होते हैं।
$ 2 H_2 O _{(l)} \longrightarrow 2 H _{2(g)}+O _{2(g)} $
चरण 2:
चरण 1 में उत्पन्न $H_2$ कार्बन डाइऑक्साइड को अपचयित करता है, जिससे ग्लूकोज $(C_6 H _{12} O_6)$ और $H_2 O$ बनते हैं।
$ 6 CO _{2(g)}+12 H _{2(g)} \longrightarrow C_6 H _{12} O _{6(s)}+6 H_2 O _{(l)} $
अब, प्रक्रिया की सामग्री अभिक्रिया निम्नलिखित रूप में दी गई है:
$ \begin{aligned} 2 H_2 O _{(i)} & .\longrightarrow 2 H _{2(g)}+O _{2(g)}] \times 6 \\ 6 CO _{2(g)}+12 H _{2(g)} & \longrightarrow C_6 H _{12} O _{6(g)}+6 H_2 O _{(l)} \\ 6 CO _{2(g)}+12 H_2 O _{(l)} & \longrightarrow C_6 H _{12} O _{6(g)}+6 H_2 O _{(l)}+6 O _{2(g)} \end{aligned} $
इस अभिक्रिया को ऊपर दिए गए रूप में लिखना अधिक उपयुक्त है क्योंकि प्रकाश संश्लेषण की प्रक्रिया में पानी के अणु भी उत्पन्न होते हैं।
इस अभिक्रिया के पथ की जांच करने के लिए $H_2 O^{18}$ के रेडियोधर्मी अणु के स्थान पर $H_2 O$ का उपयोग किया जा सकता है।
(b) $O_3$ और $H_2 O_2$ दोनों अभिकर्मकों से $O_2$ उत्पन्न होता है। इस कारण, $O_2$ दो बार लिखा गया है।
दी गई अभिक्रिया में दो चरण होते हैं। पहले, $O_3$ के अपघटन से $O_2$ और $O$ बनते हैं। दूसरे चरण में, $H_2 O_2$ पहले चरण में उत्पन्न $O$ के साथ अभिक्रिया करता है, जिससे $H_2 O$ और $O_2$ बनते हैं।
$ \begin{aligned} & O _{3(g)} \longrightarrow O _{2(g)}+O _{(g)} \\
& H_2 O _{2(l)}+O _{(g)} \longrightarrow H_2 O _{(l)}+O _{2(g)} \\ & H_2 O _{2(l)}+O _{3(g)} \longrightarrow H_2 O _{(l)}+O _{2(g)}+O _{2(g)} \end{aligned} $
इस अभिक्रिया के पथ का अध्ययन $H_2 O_2{ }^{18}$ या $O_3^{18}$ का उपयोग करके किया जा सकता है।
8.10 यौगिक $\mathrm{AgF_2}$ अनावश्यक यौगिक है। हालांकि, यदि इसका निर्माण होता है, तो यह एक बहुत मजबूत ऑक्सीकारक के रूप में कार्य करता है। क्यों?
उत्तर दिखाएं
Answer
$\mathrm{AgF_2}$ में $Ag$ की ऑक्सीकरण अवस्था +2 है। लेकिन, +2 $Ag$ की अनावश्यक ऑक्सीकरण अवस्था है। अतः, जब $\mathrm{AgF_2}$ का निर्माण होता है, तो सिल्वर तेजी से एक इलेक्ट्रॉन ग्रहण करता है ताकि $Ag^{+}$ का निर्माण हो सके। इससे $Ag$ की ऑक्सीकरण अवस्था +2 से एक अधिक स्थायी अवस्था +1 में घट जाती है। इस कारण $\mathrm{AgF_2}$ एक बहुत मजबूत ऑक्सीकारक के रूप में कार्य करता है।
8.11 जब एक ऑक्सीकारक एवं एक अपचायक एजेंट के बीच अभिक्रिया होती है, तो अपचायक एजेंट अधिक मात्रा में होता है तो एक निम्न ऑक्सीकरण अवस्था वाला यौगिक बनता है और ऑक्सीकारक एजेंट अधिक मात्रा में होता है तो एक उच्च ऑक्सीकरण अवस्था वाला यौगिक बनता है। इस कथन की पुष्टि करें तीन उदाहरणों के माध्यम से।
उत्तर दिखाएं
Answer
जब एक ऑक्सीकारक एवं एक अपचायक एजेंट के बीच अभिक्रिया होती है, तो अपचायक एजेंट अधिक मात्रा में होता है तो एक निम्न ऑक्सीकरण अवस्था वाला यौगिक बनता है और ऑक्सीकारक एजेंट अधिक मात्रा में होता है तो एक उच्च ऑक्सीकरण अवस्था वाला यौगिक बनता है। इस कथन की पुष्टि निम्नलिखित तीन उदाहरणों के माध्यम से की जा सकती है:
(i) $P_4$ एक अपचायक एजेंट है और $F_2$ एक ऑक्सीकारक एजेंट है।
यदि $P_4$ की अधिक मात्रा $F_2$ के साथ अभिक्रिया करती है, तो $PF_3$ बनता है, जहां $P$ की ऑक्सीकरण अवस्था +3 है।
P_4 \text{ (excess) }+F_2 \longrightarrow \stackrel{+3}{P_3}
हालांकि, यदि $P_4$ को अधिक मात्रा में $F_2$ के साथ अभिक्रिया कराई जाती है, तो $PF_5$ बनता है, जहां $P$ की ऑक्सीकरण अवस्था +5 है।
P_4+F_2$ (excess) $\longrightarrow \stackrel{+5}{P_5}
(ii) $K$ एक अपचायक एजेंट है, जबकि $O_2$ एक ऑक्सीकारक एजेंट है।
यदि $K$ की अधिक मात्रा $O_2$ के साथ अभिक्रिया करती है, तो $K_2 O$ बनता है, जहां $O$ की ऑक्सीकरण अवस्था $-2$ है।
$ 4 K \text{ (अतिरिक्त) }+O_2 \longrightarrow 2 K_2{ }^{-2} $
हालांकि, यदि $K$ अतिरिक्त $O_2$ के साथ अभिक्रिया करे, तो $K_2 O_2$ बनेगा, जहां $O$ का ऑक्सीकरण संख्या $\hat{a} E^{\text{" }} 1$ होता है।
$ 2 K+O_2 \text{ (अतिरिक्त) } \longrightarrow K_2{\stackrel{-1}{O_2}}^{-1} $
(iii) C एक अपचायक एजेंट है, जबकि $O_2$ एक ऑक्सीकरण एजेंट के रूप में कार्य करता है।
यदि $C$ को अपर्याप्त मात्रा में $O_2$ की उपस्थिति में जलाया जाए, तो $CO$ उत्पन्न होगा, जहां $C$ का ऑक्सीकरण संख्या +2 होता है।
$ C(\text{ अतिरिक्त })+O_2 \longrightarrow \stackrel{+2}{C} O $
दूसरी ओर, यदि $C$ को अतिरिक्त $O_2$ के साथ जलाया जाए, तो $CO_2$ उत्पन्न होगा, जहां $C$ का ऑक्सीकरण संख्या +4 होता है।
$ C+O_2 \text{ (अतिरिक्त) } \longrightarrow \stackrel{+4}{CO_2} $
8.12 आप निम्नलिखित अवलोकनों के लिए कैसे गणना करेंगे?
(a) अतिरिक्त जिंक अम्लीय पोटैशियम परमैंगनेट और क्षारीय पोटैशियम परमैंगनेट दोनों ऑक्सीकरण एजेंट के रूप में उपयोग किए जाते हैं, लेकिन टॉलूईन से बेंजोइक अम्ल के निर्माण में हम एल्कोहॉलिक पोटैशियम परमैंगनेट का उपयोग करते हैं। क्यों? अभिक्रिया के लिए संतुलित रेडॉक्स समीकरण लिखें।
(b) जब अतिसांद्रित सल्फ्यूरिक अम्ल एक अकार्बनिक मिश्रण में क्लोराइड के साथ मिलाया जाता है, तो हमें रंगहीन, तीखा गंध वाली गैस $\mathrm{HCl}$ प्राप्त होती है, लेकिन यदि मिश्रण में ब्रोमाइड होता है तो हमें लाल वाष्प ब्रोमीन प्राप्त होती है। क्यों?
उत्तर दिखाएं
Answer
(a) टॉलूईन से बेंजोइक अम्ल के निर्माण में एल्कोहॉलिक पोटैशियम परमैंगनेट का उपयोग ऑक्सीकरण एजेंट के रूप में किया जाता है क्योंकि निम्नलिखित कारणों के कारण:
(i) उदासीन माध्यम में, अभिक्रिया के दौरान $OH^{-}$ आयन उत्पन्न होते हैं। इस कारण, अम्ल या क्षार के उत्पादन की लागत को कम कर सकते हैं।
(ii) $KMnO_4$ और एल्कोहॉल एक दूसरे के समान होते हैं क्योंकि दोनों ध्रुवीय होते हैं। टॉलूईन और एल्कोहॉल भी एक दूसरे के समान होते हैं क्योंकि दोनों कार्बनिक यौगिक होते हैं। एक समान माध्यम में अभिक्रियाएं एक विषम माध्यम की तुलना में तेजी से चल सकती हैं। इसलिए, एल्कोहॉल में $KMnO_4$ और टॉलूईन तेजी से अभिक्रिया कर सकते हैं।
उदासीन माध्यम में अभिक्रिया के लिए संतुलित रेडॉक्स समीकरण नीचे दिया गया है:
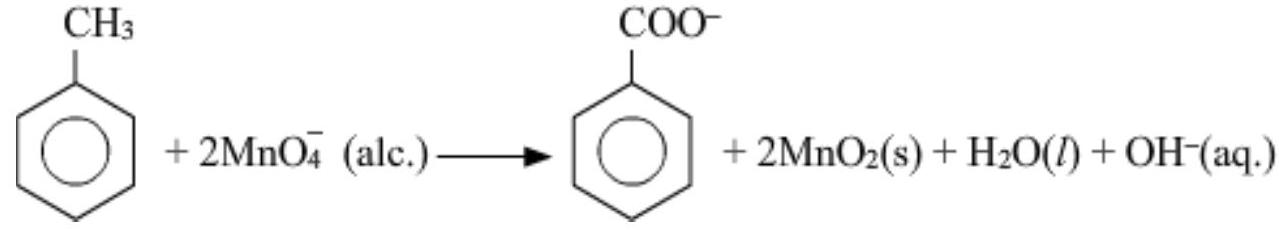
(b) जब सांद्र $H_2 SO_4$ एक अकार्बनिक मिश्रण में ब्रोमाइड के साथ मिलाया जाता है, तो शुरू में $HBr$ उत्पन्न होता है। $HBr$, एक मजबूत अपचायक एजेंट होता है जो $H_2 SO_4$ को $SO_2$ में घटाता है और लाल वाष्प ब्रोमीन के उत्पादन के साथ।
$ \begin{aligned} & 2 NaBr+2 H_2 SO_4 \longrightarrow 2 NaHSO_4+2 HBr \\ & 2 HBr+H_2 SO_4 \longrightarrow Br_2+SO_2+2 H_2 O \\ & \text{ (लाल वाष्प) } \end{aligned} $
लेकिन, जब सांद्र $H_2 SO_4$ एक अकार्बनिक मिश्रण में क्लोराइड के साथ मिलाया जाता है, तो एक तीखी गंध वाली गैस $(HCl)$ उत्पन्न होती है। $HCl$, एक कम अपचायक एजेंट होता है, जो $H_2 SO_4$ को $SO_2$ में घटाने में असमर्थ होता है
$2 NaCl+2 H_2 SO_4 \longrightarrow 2 NaHSO_4+2 HCl$
8.13 निम्नलिखित प्रतिक्रियाओं में प्रत्येक के लिए ऑक्सीकृत वस्तु, अपचायक वस्तु, ऑक्सीकारक एजेंट और अपचायक एजेंट की पहचान करें:
(a) $2 \mathrm{AgBr}$ (s) $+\mathrm{C_6} \mathrm{H_6} \mathrm{O_2}$ (aq) $2 \mathrm{Ag}(\mathrm{s})+2 \mathrm{HBr}$ (aq) $+\mathrm{C_6} \mathrm{H_4} \mathrm{O_2}$ (aq)
(b) $\mathrm{HCHO}(\mathrm{l})+2 \left[\mathrm{Ag} \left(\mathrm{NH_3} \right)_{2} \right]^{+}(\mathrm{aq})+3 \mathrm{OH}^{-}(\mathrm{aq}) + 2 \mathrm{Ag}(\mathrm{s})+\mathrm{HCOO}^{-}(\mathrm{aq})+4 \mathrm{NH_3}(\mathrm{aq})+ 2 \mathrm{H2O}\mathrm{(l)}$
(c) $\mathrm{HCHO} \mathrm{(l)}+2 \mathrm{Cu}^{2+}(\mathrm{aq})+5 \mathrm{OH}^{-}(\mathrm{aq}) \quad \mathrm{Cu} 2 \mathrm{O}(\mathrm{s})+\mathrm{HCOO}^{-}(\mathrm{aq})+3 \mathrm{H_2} \mathrm{O}(\mathrm{l})$
(d) $\mathrm{N_2} \mathrm{H_4}(\mathrm{l})+2 \mathrm{H_2} \mathrm{O_2}(\mathrm{l}) \rightarrow \mathrm{N_2}(\mathrm{~g})+4 \mathrm{H_2} \mathrm{O}(\mathrm{l})$
(e) $\mathrm{Pb}(\mathrm{s})+\mathrm{PbO_2}(\mathrm{~s})+2 \mathrm{H_2} \mathrm{SO_4}(\mathrm{aq}) \rightarrow 2 \mathrm{PbSO_4}(\mathrm{~s})+2 \mathrm{H_2} \mathrm{O}(\mathrm{l})$
उत्तर दिखाएँ
उत्तर
(a) ऑक्सीकृत पदार्थ $ \longrightarrow C_6H_6O_2 $
अपचयित पदार्थ $ \longrightarrow $ AgBr
ऑक्सीकारक $ \longrightarrow A g B r$
अपचायक $ \longrightarrow $ $C_6 H_6 O_2$
(b)ऑक्सीकृत पदार्थ $\longrightarrow $ HCHO
अपचयित पदार्थ $ \longrightarrow ,[Ag(NH_3)_2]^{+}$
ऑक्सीकारक $ \longrightarrow ,[Ag(NH_3)_2]^{+}$
अपचायक $ \longrightarrow $ HCHO
(c) ऑक्सीकृत पदार्थ $ \longrightarrow $ HCHO
अपचयित पदार्थ $ \longrightarrow Cu^{2+}$
ऑक्सीकारक $ \longrightarrow $ $Cu^{2+}$
अपचायक $ \longrightarrow $ $HCHO$
(d) ऑक्सीकृत पदार्थ $ \longrightarrow N_2 H_4$
अपचयित पदार्थ $ \longrightarrow $ $H_2 O_2$
ऑक्सीकारक $ \longrightarrow H_2 O_2$
अपचायक $\longrightarrow N_2H_4 $
(e) ऑक्सीकृत पदार्थ $ \longrightarrow $ Pb
अपचयित पदार्थ $ \longrightarrow PbO_2$
ऑक्सीकारक $ \longrightarrow $ $PbO_2$
अपचायक $\longrightarrow Pb $
8.14 अभिक्रियाएँ विचार करें :
$2 \mathrm{~S_2} \mathrm{O_3}^{2-}(\mathrm{aq})+\mathrm{I_2}(\mathrm{~s}) \rightarrow \mathrm{S_4} \mathrm{O_6}^{2-}(\mathrm{aq})+2 \mathrm{I}^{-}(\mathrm{aq})$
$\mathrm{S_2} \mathrm{O_3}^{2-}(\mathrm{aq})+2 \mathrm{Br_2}(\mathrm{l})+5 \mathrm{H_2} \mathrm{O}(\mathrm{l}) \rightarrow 2 \mathrm{SO_4}^{2-(\mathrm{aq})}+4 \mathrm{Br}^{-}(\mathrm{aq})+10 \mathrm{H}^{+}(\mathrm{aq})$
क्यों एक ही अपचायक, थायोसल्फेट, आयोडीन और ब्रोमीन के साथ अलग-अलग रूप से प्रतिक्रिया करता है?
उत्तर दिखाएँ
उत्तर
$S_2 O_3^{2-}$ में $S$ की औसत ऑक्सीकरण संख्या (O.N.) +2 है। ब्रोमीन ($Br_2$) आयोडीन ($I_2$) की तुलना में एक शक्तिशाली ऑक्सीकारक है, इसलिए यह $S_2 O_3^{2-}$ को $SO_4^{2-}$ में ऑक्सीकृत करता है, जहाँ $S$ की ऑक्सीकरण संख्या +6 है। हालाँकि, आयोडीन एक कमजोर ऑक्सीकारक है। इसलिए, यह $S_2 O_3^{2-}$ को $S_4 O_6^{2-}$ में ऑक्सीकृत करता है, जहाँ $S$ की औसत ऑक्सीकरण संख्या केवल +2.5 है। इस कारण, $S_2 O_3^{2-}$ आयोडीन और ब्रोमीन के साथ अलग-अलग प्रतिक्रिया करता है।
8.15 फ्लूरीन के ऑक्सीकारक और हाइड्रोहैलिक यौगिकों में से हाइड्रोआयोडिक अम्ल के अपचायक के रूप में सबसे अच्छा क्यों है, इसकी व्याख्या करें।
उत्तर दिखाएं
उत्तर
$F_2$ के $Cl^{-}$ को $Cl_2$ में ऑक्सीकृत करने, $Br^{-}$ को $Br_2$ में ऑक्सीकृत करने और $I^{-}$ को $I_2$ में ऑक्सीकृत करने के लिए निम्नलिखित अभिक्रिया होती है:
$ \begin{aligned} & F _{2(a q)}+2 Cl _{(s)}^{-} \longrightarrow 2 F _{(a q)}^{-}+Cl _{(g)} \\ & F _{2(a q)}+2 Br _{(a q)}^{-} \longrightarrow 2 F _{(a q)}^{-}+Br _{2(l)} \\ & F _{2(a q)}+2 I _{(a q)}^{-} \longrightarrow 2 F _{(a q)}^{-}+I _{2(s)} \end{aligned} $
दूसरी ओर, $Cl_2, Br_2$ और $I_2$ $F^{-}$ को $F_2$ में ऑक्सीकृत नहीं कर सकते। हैलोजन के ऑक्सीकारक शक्ति क्रम $I_2<Br_2<Cl_2<F_2$ होती है। इसलिए, फ्लूरीन हैलोजन में सबसे अच्छा ऑक्सीकारक है।
$HI$ और $HBr$ $H_2 SO_4$ को $SO_2$ में अपचायक कर सकते हैं, लेकिन $HCl$ और $HF$ नहीं कर सकते। इसलिए, $HI$ और $HBr$ $HCl$ और $HF$ से अधिक अपचायक होते हैं।
$2 HI+H_2 SO_4 \longrightarrow I_2+SO_2+2 H_2 O$
$2 HBr+H_2 SO_4 \longrightarrow Br_2+SO_2+2 H_2 O$
पुनः, $I^{-}$ $Cu^{2+}$ को $Cu^{+}$ में अपचायक कर सकता है, लेकिन $Br^{-}$ नहीं कर सकता।
$4 I _{(a q)}^{-}+2 Cu _{(a q)}^{2+} \longrightarrow Cu_2 I _{2(s)}+I _{2(a q)}$
इसलिए, हाइड्रोहैलिक यौगिकों में हाइड्रोआयोडिक अम्ल सबसे अच्छा अपचायक है।
इसलिए, हाइड्रोहैलिक अम्लों की अपचायक शक्ति क्रम $HF<HCl<HBr<HI$ होती है।
8.16 निम्नलिखित अभिक्रिया क्यों होती है?
$\mathrm{XeO_6}{ }^{4-}(\mathrm{aq})+2 \mathrm{~F}^{-}(\mathrm{aq})+6 \mathrm{H}^{+}(\mathrm{aq}) \rightarrow \mathrm{XeO_3}(\mathrm{~g})+\mathrm{F_2}(\mathrm{~g})+3 \mathrm{H_2} \mathrm{O}(\mathrm{l})$
इस अभिक्रिया से निष्कर्ष लें कि $\mathrm{Na_4} \mathrm{XeO_6}$ (जिसमें $\mathrm{XeO_6}^{4-}$ एक हिस्सा है) के बारे में क्या कहा जा सकता है।
उत्तर दिखाएं
उत्तर
दी गई अभिक्रिया $XeO_6^{4-}$ द्वारा $F^{-}$ के ऑक्सीकरण और $F^{-}$ द्वारा $XeO_6^{4-}$ के अपचयन के कारण होती है।
$\mathrm{XeO} _{6(\mathrm{aq})}^{4-}+2 \mathrm{~F}^{-1}{ } _{(\mathrm{aq})}+6 \mathrm{H} _{(\mathrm{aq})}^{+} \rightarrow \mathrm{XeO} _{3(\mathrm{~g})}^{+6}+\mathrm{F} _{2(\mathrm{~g})}^0+3 \mathrm{H} _2 \mathrm{O} _{(\mathrm{l})}$
इस अभिक्रिया में, Xe के ऑक्सीकरण संख्या (O.N.) $XeO_6^{4-}$ में +8 से $XeO_3$ में +6 तक घटती है और F के ऑक्सीकरण संख्या $F^{a \hat{e}}$ में -1 से $F_2$ में O में बढ़ जाती है।
इसलिए, हम निष्कर्ष निकाल सकते हैं कि $Na_4 XeO_6$ $F^{a \epsilon}$ से एक शक्तिशाली ऑक्सीकरण एजेंट है।
8.17 निम्नलिखित अभिक्रियाओं को ध्यान से देखें:
(a) $\mathrm{H_3} \mathrm{PO_2}(\mathrm{aq})+4 \mathrm{AgNO_3}(\mathrm{aq})+2 \mathrm{H_2} \mathrm{O}(\mathrm{l}) \rightarrow \mathrm{H_3} \mathrm{PO_4}(\mathrm{aq})+4 \mathrm{Ag}(\mathrm{s})+4 \mathrm{HNO_3}(\mathrm{aq})$
(b) $\mathrm{H_3} \mathrm{PO_2}$ (aq) $+2 \mathrm{CuSO_4}(\mathrm{aq})+2 \mathrm{H_2} \mathrm{O}$ (l) $\rightarrow \mathrm{H_3} \mathrm{PO_4}$ (aq) $+2 \mathrm{Cu}$ (s) $+\mathrm{H_2} \mathrm{SO_4}(\mathrm{aq})$
(c) $\mathrm{C_6} \mathrm{H_5} \mathrm{CHO}(\mathrm{l})+2\left[\mathrm{Ag}\left(\mathrm{NH_3}\right)_{2}\right]^{+}(\mathrm{aq})+3 \mathrm{OH}^{-}(\mathrm{aq}) \rightarrow \mathrm{C_6} \mathrm{H_5} \mathrm{COO}^{-}(\mathrm{aq})+2 \mathrm{Ag}(\mathrm{s})+ 4 \mathrm{NH_3}(\mathrm{aq})+2 \mathrm{H_2} \mathrm{O}(\mathrm{l})$
(d) $\mathrm{C_6} \mathrm{H_5} \mathrm{CHO}(\mathrm{l})+2 \mathrm{Cu}^{2+}(\mathrm{aq})+5 \mathrm{OH}^{-}(\mathrm{aq}) \rightarrow$ कोई परिवर्तन नहीं देखा गया।
इन अभिक्रियाओं से आप $Ag^{+}$ और $Cu^{2+}$ के व्यवहार के बारे में क्या निष्कर्ष निकाल सकते हैं?
उत्तर दिखाएं
उत्तर
$Ag^{+}$ और $Cu^{2+}$ क्रमशः अभिक्रिया (a) और (b) में ऑक्सीकरण एजेंट के रूप में कार्य करते हैं।
अभिक्रिया (c) में, $Ag^{+}$ $C_6 H_5 CHO$ को $C_6 H_5 COO$ में ऑक्सीकृत करता है, लेकिन अभिक्रिया (d) में, $Cu^{2+}$ $C_6 H_5 CHO$ को ऑक्सीकृत नहीं कर सकता।
इसलिए, हम कह सकते हैं कि $Ag^{+}$ $Cu^{2+}$ से एक शक्तिशाली ऑक्सीकरण एजेंट है।
8.18 आयन-इलेक्ट्रॉन विधि के माध्यम से निम्नलिखित रेडॉक्स अभिक्रियाओं को संतुलित करें:
(a) $\mathrm{MnO_4}^{-}$(aq) $+\mathrm{I}^{-}$(aq) $\rightarrow \mathrm{MnO_2}$ (s) $+\mathrm{I_2}$ (s) (क्षारीय माध्यम में)
(b) $\mathrm{MnO_4}^{-}(\mathrm{aq})+\mathrm{SO_2}$ (g) $\rightarrow \mathrm{Mn}^{2+}(\mathrm{aq})+\mathrm{HSO_4}^{-}$(aq) (अम्लीय विलयन में)
(c) $\mathrm{H_2} \mathrm{O_2}(\mathrm{aq})+\mathrm{Fe}^{2+}(\mathrm{aq}) \rightarrow \mathrm{Fe}^{3+}(\mathrm{aq})+\mathrm{H_2} \mathrm{O}$ (l) (अम्लीय विलयन में)
(d) $\mathrm{Cr_2} \mathrm{O_7}^{2-}+\mathrm{SO_2}(\mathrm{~g}) \rightarrow \mathrm{Cr}^{3+}(\mathrm{aq})+\mathrm{SO_4}{ }^{2-}$ (aq) (अम्लीय विलयन में)
उत्तर दिखाएं
उत्तर
(a) कदम 1: दिए गए अभिक्रिया में शामिल दो अर्ध-अभिक्रियाएं निम्नलिखित हैं:
ऑक्सीकरण अर्ध-अभिक्रिया: $\stackrel{-1}{I}(aq) \longrightarrow 0^{0}$
अपचयन अर्ध-अभिक्रिया:
$ \stackrel{+7}{MnO} H _{4(a q)}^{-} \longrightarrow \stackrel{+4}{M} nO _{2(a q)} $
कदम 2:
ऑक्सीकरण अर्ध-अभिक्रिया में I के संतुलन के लिए, हमें निम्नलिखित प्राप्त होता है:
$ 2 I _{(a q)}^{-} \longrightarrow I _{2(s)} $
अब, आवेश के संतुलन के लिए, हम अभिक्रिया के दाएं ओर $2 e^{-}$ जोड़ते हैं।
$ 2 I _{(a q)}^{-} \longrightarrow I _{2(s)}+2 e^{-} $
कदम 3:
अपचयन अर्ध-अभिक्रिया में, $Mn$ के ऑक्सीकरण अवस्था +7 से +4 में घट गई है। इसलिए, अभिक्रिया के बाएं ओर 3 इलेक्ट्रॉन जोड़े जाते हैं।
$ MnO _{4(a q)}^{-}+3 e^{-} \longrightarrow MnO _{2(a q)} $
अब, आवेश के संतुलन के लिए, हम अभिक्रिया के दाएं ओर $4 OH^{-}$ आयन जोड़ते हैं क्योंकि अभिक्रिया एक क्षारीय माध्यम में हो रही है।
$ MnO _{4(a q)}^{-}+3 e^{-} \longrightarrow MnO _{2(a q)}+4 OH^{-} $
कदम 4:
इस समीकरण में, दाएं ओर 6 O अणु और बाएं ओर 4 O अणु हैं। इसलिए, बाएं ओर दो जल अणु जोड़े जाते हैं।
$ MnO _{4(a q)}^{-}+2 H_2 O+3 e^{-} \longrightarrow MnO _{2(a q)}+4 OH^{-} $
कदम 5:
इलेक्ट्रॉन की संख्या के संतुलन के लिए, ऑक्सीकरण अर्ध-अभिक्रिया को 3 से गुणा कर देते हैं और अपचयन अर्ध-अभिक्रिया को 2 से गुणा कर देते हैं, तो हमें निम्नलिखित प्राप्त होता है:
$6 I _{(a q)}^{-} \longrightarrow 3 I _{2(s)}+6 e^{-}$
$2 MnO _{4(a q)}^{-}+4 H_2 O+6 e^{-} \longrightarrow 2 MnO _{2(s)}+8 OH _{(a q)}^{-}$
कदम 6:
दोनों अर्ध-अभिक्रियाओं को जोड़कर, हमें निम्नलिखित संतुलित रेडॉक्स अभिक्रिया प्राप्त होती है:
$ 6 I _{(a q)}^{-}+2 MnO _{4(a q)}^{-}+4 H_2 O _{(l)} \longrightarrow 3 I _{2(s)}+2 MnO _{2(s)}+8 OH _{(a q)}^{-} `
$
(b) भाग (a) में चरण अपनाते हुए, हमें ऑक्सीकरण अर्ध-अभिक्रिया के रूप में निम्नलिखित प्राप्त होती है:
$ SO _{2(g)}+2 H_2 O _{(j)} \longrightarrow HSO _{4(a q)}^{-}+3 H _{(a q)}^{+}+2 e _{(a q)}^{-} $
और अपचयन अर्ध-अभिक्रिया के रूप में:
$ MnO _{4(a q)}^{-}+8 H _{(a q)}^{+}+5 e^{-} \longrightarrow Mn _{(a q)}^{2+}+4 H_2 O _{(l)} $
ऑक्सीकरण अर्ध-अभिक्रिया को 5 से गुणा करके और अपचयन अर्ध-अभिक्रिया को 2 से गुणा करके, फिर उन्हें जोड़कर हमें शुद्ध संतुलित रेडॉक्स अभिक्रिया के रूप में निम्नलिखित प्राप्त होती है:
$ 2 MnO _{4(a q)}^{-}+5 SO _{2(g)}+2 H_2 O _{(i)}+H _{(a q)}^{+} \longrightarrow 2 Mn _{(a q)}^{2+}+5 HSO _{4(a q)}^{-} $
(c) भाग (a) में चरण अपनाते हुए, हमें ऑक्सीकरण अर्ध-अभिक्रिया के रूप में निम्नलिखित प्राप्त होती है:
$ Fe _{(a q)}^{2+} \longrightarrow Fe^{3+} _{(a q)}+e^{-} $
और अपचयन अर्ध-अभिक्रिया के रूप में:
$ H_2 O _{2(a q)}+2 H _{(a q)}^{+}+2 e^{-} \longrightarrow 2 H_2 O _{(l)} $
ऑक्सीकरण अर्ध-अभिक्रिया को 2 से गुणा करके फिर उसे अपचयन अर्ध-अभिक्रिया में जोड़कर हमें शुद्ध संतुलित रेडॉक्स अभिक्रिया के रूप में निम्नलिखित प्राप्त होती है:
$ H_2 O _{2(a q)}+2 Fe^{2+} _{(a q)}+2 H _{(a q)}^{+} \longrightarrow 2 Fe^{3+} _{(a q)}+2 H_2 O _{(l)} $
(d) भाग (a) में चरण अपनाते हुए, हमें ऑक्सीकरण अर्ध-अभिक्रिया के रूप में निम्नलिखित प्राप्त होती है:
$ SO _{2(g)}+2 H_2 O _{(i)} \longrightarrow SO _{4(a q)}^{2-}+4 H _{(a q)}^{+}+2 e^{-} $
और अपचयन अर्ध-अभिक्रिया के रूप में:
$ Cr_2 O _{7(a q)}^{2-}+14 H _{(a q)}^{+}+6 e^{-} \longrightarrow 2 Cr^{3+} _{(a q)}+7 H_2 O _{(l)} $
ऑक्सीकरण अर्ध-अभिक्रिया को 3 से गुणा करके फिर उसे अपचयन अर्ध-अभिक्रिया में जोड़कर हमें शुद्ध संतुलित रेडॉक्स अभिक्रिया के रूप में निम्नलिखित प्राप्त होती है:
$ Cr_2 O _{7(a q)}^{2-}+3 SO _{2(g)}+2 H _{(a q)}^{+} \longrightarrow 2 Cr _{(a q)}^{3+}+3 SO _{4(a q)}^{2-}+H_2 O _{(l)} $
8.19 आयन-इलेक्ट्रॉन विधि और ऑक्सीकरण संख्या विधि के द्वारा निम्नलिखित समीकरणों को क्षारीय माध्यम में संतुलित करें और ऑक्सीकारक एवं अपचायक की पहचान करें।
(a) $\mathrm{P_4}(\mathrm{~s})+\mathrm{OH}^{-}(\mathrm{aq}) \rightarrow \mathrm{PH_3}(\mathrm{~g})+\mathrm{HPO_2}^{-}(\mathrm{aq})$
(b) $\mathrm{N_2} \mathrm{H_4}(\mathrm{l})+\mathrm{ClO_3}^{-}(\mathrm{aq}) \rightarrow \mathrm{NO}(\mathrm{g})+\mathrm{Cl}^{-}(\mathrm{g})$
(c) $\mathrm{Cl_2} \mathrm{O_7}$ (g) $+\mathrm{H_2} \mathrm{O_2}$ (aq) $\rightarrow \mathrm{ClO_2}^{-}$(aq) $+\mathrm{O_2}$ (g) $+\mathrm{H}^{+}$
उत्तर दिखाएं
Answer
(a)
$P$ के O.N. (ऑक्सीकरण संख्या) $P_4$ में 0 से $PH_3$ में -3 तक घटती है और $HPO_2^{-}$ में +2 तक बढ़ जाती है। अतः इस अभिक्रिया में $P_4$ ऑक्सीकरक एजेंट और अपचायक एजेंट दोनों के रूप में कार्य करता है।
आयन-इलेक्ट्रॉन विधि:
ऑक्सीकरण अर्ध-समीकरण है:
$P _{4(s)} \to H_2 PO_2{ }^{-}(aq)$
$P$ परमाणु के संतुलन के लिए:
$\stackrel{0}P _{4(s)} \to 4 H_2 \stackrel{+1}{P} O_2^{-}(aq)$
ऑक्सीकरण संख्या के संतुलन के लिए 4 इलेक्ट्रॉन जोड़े जाते हैं:
$P _{4(s)} \to 4 H_2 PO_2{ }^{-} _{(a q)}+4 e^{-}$
आवेश के संतुलन के लिए $8 OH^{-}$ जोड़े जाते हैं:
$ P_{4(s)} +8OH^-_{(aq)} \to 4 H_2 PO _{2(aq)} + 4e^-$
$O$ और $H$ परमाणु पहले से संतुलित हैं।
अपचायक अर्ध-समीकरण है:
$P _{4(s)} \longrightarrow PH _{3(g)}$
$P$ परमाणु के संतुलन के लिए:
$\stackrel{0}{P _{4(s)}} \longrightarrow 4 \stackrel{-3}{P^{H _{3(g)}}}$
ऑक्सीकरण संख्या के संतुलन के लिए 12 इलेक्ट्रॉन जोड़े जाते हैं:
$ P _{4(s)}+12 e^{-} \longrightarrow 4 PH _{3(g)} $
आवेश के संतुलन के लिए $12 OH^{-}$ जोड़े जाते हैं:
$ P_{4(s)}+12 e^- \longrightarrow 4 PH_{3(g)}+12 OH_{(a q)} $
$O$ और $H$ परमाणु के संतुलन के लिए $12 H_2 O$ जोड़े जाते हैं:
$ P_{4_(s)} + 12H_2O_{(i)} + 12e^- \longrightarrow 4PH_{3_{(g)}}+ 12HO^1_{aq} $
समीकरण (i) को 3 से गुणा करके और समीकरण (ii) को 2 से गुणा करके और फिर उन्हें जोड़कर संतुलित रासायनिक समीकरण प्राप्त किया जा सकता है:
$P _{4(s)}+3 OH^{-} _{(a q)}+3 H_2 O \to PH_3+3 H_2 PO_2{ }^{-} _{(a q)}$
(b)

$N_2 H_4$ में $N$ की ऑक्सीकरण संख्या $-2$ से $NO$ में +2 तक बढ़ जाती है और $Cl$ की ऑक्सीकरण संख्या
+5 $ClO_3^{-}$ में से -1 $Cl^{\hat{\epsilon} \epsilon^{e}}$ में। इसलिए, इस अभिक्रिया में $N_2 H_4$ अपचायक एजेंट और $ClO_3^{-}$ ऑक्सीकारक एजेंट है।
एकल इलेक्ट्रॉन विधि:
ऑक्सीकरण अर्ध-समीकरण है:
$ \stackrel{-2}N_2 H_4(l) \longrightarrow \stackrel{+2}{N} O_{(g)} $
$N$ परमाणु संतुलित किए गए हैं जैसे:
$N_2 H_4(l) \longrightarrow 2 NO_{(g)}$
ऑक्सीकरण संख्या को संतुलित करने के लिए 8 इलेक्ट्रॉन जोड़े गए हैं जैसे:
$N_2 H_4(l) \longrightarrow 2 NO_{(g)}+8 e^{-}$
आवेश को संतुलित करने के लिए $8 OH^{\circledR \epsilon}$ आयन जोड़े गए हैं जैसे:
$N_2 H_4(l)+8 OH_{(aq)}^{-} \longrightarrow 2 NO_{(g)}+8 e^{-}$
$O$ परमाणु को संतुलित करने के लिए $6 H_2 O$ जोड़े गए हैं जैसे:
$ N_2H_4(i) +8OH^{-}_{aq} \longrightarrow 2NO(g) + 6H_2O(i) + 8e^{-} $
अपचायक अर्ध-समीकरण है:
ऑक्सीकरण संख्या को संतुलित करने के लिए 6 इलेक्ट्रॉन जोड़े गए हैं जैसे:
$ClO_{3(aq)}^{-}+6 e^{-} \longrightarrow Cl_{(aq)}^{-}$
आवेश को संतुलित करने के लिए $6 OH^{-}$ आयन जोड़े गए हैं जैसे:
$ ClO_{3(aq)}^{-}+6 e^{-} \longrightarrow Cl_{(aq)}^{-}+6 OH_{(aq)}^{-} $
$O$ परमाणु को संतुलित करने के लिए $3 H_2 O$ जोड़े गए हैं जैसे:
$ ClO^-_3aq + 3H_2O_i + 6e^- \longrightarrow Cl^-_aq + 6OH^-_aq $
संतुलित समीकरण को प्राप्त करने के लिए समीकरण (i) को 3 से गुणा करें और समीकरण (ii) को 4 से गुणा करें फिर उन्हें जोड़ें:
$ 3 N_2 H_4(l)+4 ClO_{3(aq)}^{-} \longrightarrow 6 NO_{(g)}+4 Cl_{(aq)}^{-}+6 H_2 O_{(l)} $
ऑक्सीकरण संख्या विधि:
$N$ के ऑक्सीकरण संख्या में कमी $2 \times 4=8$ है
$Cl$ के ऑक्सीकरण संख्या में वृद्धि $1 \times 6=6$ है
$N_2 H_4$ को 3 से गुणा करें और $ClO_3^{-}$ को 4 से गुणा करें ताकि ऑक्सीकरण संख्या में वृद्धि और कमी को संतुलित कर सकें, तो हमें प्राप्त होता है:
$ 3 N_2 H_4(f)+4 ClO_{3(aq)}^{-} \longrightarrow NO_{(g)}^{-}+Cl_{(aq)}^{-} $
$N$ और $Cl$ परमाणु संतुलित हैं जैसे:
$ 3 N_2 H _{4(l)}+4 ClO _{3(a q)}^{-} \longrightarrow 6 NO _{(g)}+4 Cl _{(a q)}^{-} $
$O$ अणुओं को संतुलित करने के लिए $6 H_2 O$ जोड़ा गया है:
$ 3 N_2 H _{4(l)}+4 ClO _{3(a q)}^{-} \longrightarrow 6 NO _{(g)}+4 Cl _{(a q)}^{-}+6 H_2 O _{(l)} $
यह संतुलित समीकरण है।
(c)
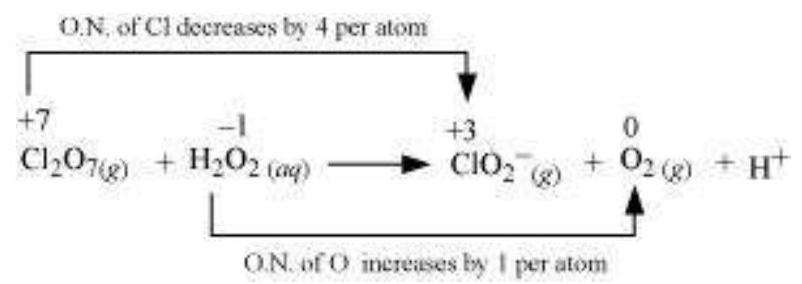
$Cl_2 O_7$ में $Cl$ की ऑक्सीकरण संख्या +7 से $ClO_2^{-}$ में +3 तक घट जाती है और $H_2 O_2$ में $O$ की ऑक्सीकरण संख्या -1 से $O_2$ में शून्य हो जाती है। इसलिए, इस अभिक्रिया में $Cl_2 O_7$ ऑक्सीकरण एजेंट और $H_2 O_2$ अपचायक एजेंट है।
आयन-इलेक्ट्रॉन विधि:
ऑक्सीकरण अर्ध-समीकरण है:
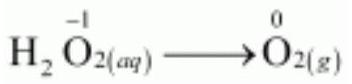
$H_2 O _{2(a q)} \longrightarrow O _{2(g)}+2 e^{-}$
ऑक्सीकरण संख्या को संतुलित करने के लिए 2 इलेक्ट्रॉन जोड़े गए हैं:
$ H_2 O _{2(a q)} \longrightarrow O _{2(g)}+2 e^{-} $
आवेश को संतुलित करने के लिए $2 OH^{a \epsilon}$ आयन जोड़े गए हैं:
$ H_2 O _{2(a q)}+2 OH _{(a q)}^{-} \longrightarrow O _{2(g)}+2 e^{-} $
ऑक्सीजन अणुओं को संतुलित करने के लिए $2 H_2 O$ जोड़े गए हैं:
$$ \begin{equation*} H_2O_{2(a q)}+2 OH_{(a q)}^{-} \longrightarrow O_{2(g)}+2 H_2 O _{(J)}+2 e^{-} \tag{i} \end{equation*} $$
अपचायक अर्ध-समीकरण है:
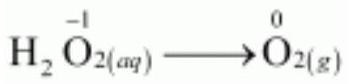
$Cl$ अणुओं को संतुलित करने के लिए:
$ Cl_2 O_{7(g)} \longrightarrow 2 ClO_{2(a q)}^{-} $
ऑक्सीकरण संख्या को संतुलित करने के लिए 8 इलेक्ट्रॉन जोड़े गए हैं:
$ Cl_2O_{7(g)}+8 e^{-} \longrightarrow 2 ClO_{2(a q)}^{-} $
आवेश को संतुलित करने के लिए $6 OH^{-}$ जोड़े गए हैं:
$ Cl_2 O _{7(g)}+8 e^{-} \longrightarrow 2 ClO _{2(a q)}^{-}+6 OH _{(a q)}^{-}
$
ऑक्सीजन परमाणुओं को संतुलित करने के लिए $3 H_2 O$ जोड़ा जाता है जैसे:
$$ \begin{equation*} Cl_2 O _{7(g)}+3 H_2 O _{(l)} 8 e^{-} \longrightarrow 2 ClO _{2(a q)}^{-}+6 OH _{(a q)}^{-} \tag{ii} \end{equation*} $$
संतुलित समीकरण को प्राप्त करने के लिए समीकरण (i) को 4 से गुणा करके और इसमें समीकरण (ii) को जोड़ा जाता है:
जैसे: $Cl_2 O _{7(g)}+4 H_2 O _{2(a q)}+2 OH _{(a q)}^{-} \longrightarrow 2 ClO _{2(a q)}^{-}+4 O _{2(g)}+5 H_2 O _{(l)}$
ऑक्सीकरण संख्या विधि:
$Cl_2 O_7$ में कार्बन की ऑक्सीकरण संख्या में कमी $4 \times 2=8$ है।
$H_2 O_2$ में कार्बन की ऑक्सीकरण संख्या में वृद्धि $2 \times 1=2$ है।
ऑक्सीकरण संख्या में वृद्धि और कमी को संतुलित करने के लिए $H_2 O_2$ और $O_2$ को 4 से गुणा करके हम प्राप्त करते हैं:
$ Cl_2 O _{7(g)}+4 H_2 O _{2(a q)} \longrightarrow ClO _{2(a q)}^{-}+4 O _{2(g)} $
कार्बन परमाणुओं को संतुलित करने के लिए:
$ Cl_2 O _{7(g)}+4 H_2 O _{2(a q)} \longrightarrow 2 ClO _{2(a q)}^{-}+4 O _{2(g)} $
ऑक्सीजन परमाणुओं को संतुलित करने के लिए $3 H_2 O$ जोड़ा जाता है जैसे:
$ Cl_2 O _{7(g)}+4 H_2 O _{2(a q)} \longrightarrow 2 ClO _{2(a q)}^{-}+4 O _{2(g)}+3 H_2 O _{(\delta)} $
हाइड्रोजन परमाणुओं को संतुलित करने के लिए $2 OH^{-}$ और $2 H_2 O$ जोड़े जाते हैं जैसे:
$ Cl_2 O _{7(g)}+4 H_2 O _{2(a q)}+2 OH _{(a q)}^{-} \longrightarrow 2 ClO _{2(a q)}^{-}+4 O _{2(g)}+5 H_2 O _{(l)} $
यह आवश्यक संतुलित समीकरण है।
8.20 निम्नलिखित अभिक्रिया से आप किस प्रकार की जानकारी ले सकते हैं?
$\left(\mathrm{CN_2}(\mathrm{~g})+2 \mathrm{OH}^{-}(\mathrm{aq}) \rightarrow \mathrm{CN}^{-}(\mathrm{aq})+\mathrm{CNO}^{-}(\mathrm{aq})+\mathrm{H_2} \mathrm{O}(\mathrm{l})\right.$
उत्तर दिखाएं
Answer
$(CN)^{2}, CN^{-}$ और $CNO^{\hat{A}}{ }^{-1}$ में कार्बन की ऑक्सीकरण संख्या क्रमशः $+3,+2$ और +4 है। ये नीचे दिए गए तरीके से प्राप्त किए जाते हैं:
मान लीजिए कि $C$ की ऑक्सीकरण संख्या $x$ है।
$(CN)_2$
$2(x$-3 $)=0$
$\therefore x=3$
$CN^{-}$
$x$ - $3= - 1$
$\therefore x=2$
$CNO^{-}$
$x - 2$ = -1
$\therefore x=4$
विभिन्न अणुओं में कार्बन की ऑक्सीकरण संख्या है:
$ (\stackrel{+3}{C} N) _{2(g)}+2 OH _{(a q)}^{-} \longrightarrow \stackrel{+2}{C} N _{(a q)}^{-}+\stackrel{+4}{C} NO _{(a q)}^{-}+H_2 O _{(l)}
$
यह आसानी से देखा जा सकता है कि दी गई समीकरण में एक ही यौगिक एक साथ अपचयित और ऑक्सीकृत हो रहा है। ऐसी अभिक्रियाएँ जिनमें एक ही यौगिक अपचयित और ऑक्सीकृत होता है, अपचयन-ऑक्सीकरण अभिक्रियाएँ कहलाती हैं। इसलिए, कहा जा सकता है कि सांत्वन अपघटन के क्षारीय अपघटन का एक अपचयन-ऑक्सीकरण अभिक्रिया का उदाहरण है।
8.21 $\mathrm{Mn}^{3+}$ आयन विलयन में अनिश्चित होता है और अपचयन-ऑक्सीकरण के माध्यम से $\mathrm{Mn}^{2+}$, $\mathrm{MnO_2}$ और $\mathrm{H}^{+}$ आयन देता है। अभिक्रिया के संतुलित आयनिक समीकरण को लिखिए।
उत्तर दिखाएं
उत्तर
दी गई अभिक्रिया को इस प्रकार दर्शाया जा सकता है:
$ Mn _{(a q)}^{3+} \longrightarrow Mn _{(a q)}^{2+}+MnO _{2(s)}+H _{(a q)}^{+} $
ऑक्सीकरण अर्ध-समीकरण है:

$ \stackrel{+3}{\quad Mn^{3+}} _{(aq)} \longrightarrow \stackrel{+4}{\quad \quad MnO _{2(s)}}$
ऑक्सीकरण संख्या को संतुलित करने के लिए एक इलेक्ट्रॉन जोड़ा जाता है:
$ Mn _{(a q)}^{3+} \longrightarrow MnO _{2(s)}+e^{-} $
आवेश को संतुलित करने के लिए $4 H^{+}$ आयन जोड़े जाते हैं:
$ Mn _{(a q)}^{3+} \longrightarrow MnO _{2(s)}+4 H _{(a q)}^{+}+e^{-} $
$O$ अणु और $H^{+}$ आयन को संतुलित करने के लिए $2 H_2 O$ अणु जोड़े जाते हैं:
$$ \begin{equation*} Mn _{(a q)}^{3+}+2 H_2 O _{(f)} \longrightarrow MnO _{2(s)}+4 H _{(a q)}^{+}+e^{-} \tag{i} \end{equation*} $$
अपचयन अर्ध-समीकरण है:
$ Mn _{(a q)}^{3+} \longrightarrow Mn _{(a q)}^{2+} $
ऑक्सीकरण संख्या को संतुलित करने के लिए एक इलेक्ट्रॉन जोड़ा जाता है:
$$ \begin{equation*} Mn _{(a q)}^{3+}+e^{-} \longrightarrow Mn _{(a q)}^{2+} \tag{ii} \end{equation*} $$
संतुलित रासायनिक समीकरण को समीकरण (i) और (ii) को जोड़कर प्राप्त किया जा सकता है:
$ 2 Mn _{(a q)}^{3+}+2 H_2 O _{(l)} \longrightarrow MnO _{2(s)}+2 Mn _{(a q)}^{2+}+4 H _{(a q)}^{+} $
8.22 निम्नलिखित तत्वों को ध्यान में रखें :
$\mathrm{Cs}, \mathrm{Ne}, \mathrm{I}$ और $\mathrm{F}$
(a) वह तत्व कौन-सा है जो केवल नकारात्मक ऑक्सीकरण अवस्था दर्शाता है।
(b) वह तत्व कौन-सा है जो केवल धनात्मक ऑक्सीकरण अवस्था दर्शाता है।
(c) वह तत्व कौन-सा है जो दोनों धनात्मक और नकारात्मक ऑक्सीकरण अवस्था दर्शाता है।
(d) वह तत्व कौन-सा है जो न तो नकारात्मक न ही धनात्मक ऑक्सीकरण अवस्था दर्शाता है।
उत्तर दिखाएं
उत्तर
(a) F केवल -1 के नकारात्मक ऑक्सीकरण अवस्था दर्शाता है। (b) Cs केवल +1 के धनात्मक ऑक्सीकरण अवस्था दर्शाता है।
(c) I दोनों धनात्मक और नकारात्मक ऑक्सीकरण अवस्था दर्शाता है। यह -1, +1, +3, +5 और +7 ऑक्सीकरण अवस्था दर्शाता है।
(d) Ne की ऑक्सीकरण अवस्था शून्य है। यह न तो नकारात्मक न ही धनात्मक ऑक्सीकरण अवस्था दर्शाता है।
8.23 क्लोरीन पीने के पानी को स्वच्छ करने में प्रयोग किया जाता है। क्लोरीन की अत्यधिक मात्रा हानिकारक हो सकती है। अत्यधिक क्लोरीन को जल में सल्फर डाइऑक्साइड के साथ उपचार करके हटाया जाता है। इस रेडॉक्स परिवर्तन के लिए एक संतुलित समीकरण प्रस्तुत करें जो जल में होता है।
उत्तर दिखाएं
उत्तर
दी गई रेडॉक्स अभिक्रिया को इस प्रकार दर्शाया जा सकता है:
$ Cl _{2(s)}+SO _{2(a q)}+H_2 O _{(l)} \longrightarrow Cl _{(a q)}^{-}+SO _{4(a q)}^{2-} $
ऑक्सीकरण अर्ध-अभिक्रिया है:
$ \stackrel{+4}{S O _{2(a q)}} \longrightarrow \stackrel{+6}{S O^{2-} _{4(a q)} }$
ऑक्सीकरण संख्या को संतुलित करने के लिए दो इलेक्ट्रॉन जोड़े जाते हैं:
$ SO _{2(a q)} \longrightarrow SO_4^{2-}(a q)+2 e^{-} $
आवेश को संतुलित करने के लिए $4 H^{+}$ आयन जोड़े जाते हैं:
$ SO _{2(a q)} \longrightarrow SO _{4(a q)}^{2-}+4 H _{(a q)}^{+}+2 e^{-} $
$O$ अणु और $H^{+}$ आयन को संतुलित करने के लिए $2 H_2 O$ अणु जोड़े जाते हैं:
$$ \begin{equation*} SO _{2(a q)}+2 H_2 O _{(j)} \longrightarrow SO _{4(a q)}^{2-}+4 H _{(a q)}^{+}+2 e^{-} \tag{i} \end{equation*} $$
अपचयन अर्ध-अभिक्रिया है:
$ Cl _{2(s)} \longrightarrow Cl _{(a q)}^{-} $
क्लोरीन अणु को संतुलित करने के लिए:
$ \stackrel{0}C _{2(s)} \longrightarrow \stackrel{-1}C _{(a q)}^{-} $
ऑक्सीकरण संख्या को संतुलित करने के लिए इलेक्ट्रॉन जोड़े जाते हैं
$$ \begin{equation*} Cl _{2(s)}+2 e^{-} \longrightarrow 2 Cl _{(a q)}^{-} \tag{ii} \end{equation*} $$
संतुलित रासायनिक समीकरण को समीकरण (i) और (ii) को जोड़कर प्राप्त किया जा सकता है:
$ Cl _{2(s)}+SO _{2(a q)}+2 H_2 O _{(f)} \longrightarrow 2 Cl _{(a q)}^{-}+SO _{4(a q)}^{2-}+4 H _{(a q)}^{+} $
8.24 अपनी किताब में दिए गए आवर्त सारणी का संदर्भ लें और अब निम्नलिखित प्रश्नों के उत्तर दें:
(a) अपचयन अपचयन अभिक्रिया दिखा सकने वाले संभावित अधातुओं का चयन करें।
(b) तीन धातुओं का चयन करें जो अपचयन अपचयन अभिक्रिया दिखा सकें।
उत्तर दिखाएं
उत्तर
अपचयन अपचयन अभिक्रिया में, एक अभिकारक पदार्थ में हमेशा एक तत्व होता है जो कम से कम तीन ऑक्सीकरण अवस्थाओं में विद्यमान हो सकता है।
(a) $P, Cl$, और $S$ अपचयन अपचयन अभिक्रिया दिखा सकते हैं क्योंकि इन तत्वों को तीन या अधिक ऑक्सीकरण अवस्थाओं में विद्यमान हो सकता है।
(b) $Mn, Cu$, और $Ga$ अपचयन अपचयन अभिक्रिया दिखा सकते हैं क्योंकि इन तत्वों को तीन या अधिक ऑक्सीकरण अवस्थाओं में विद्यमान हो सकता है।
8.25 नाइट्रिक अम्ल के निर्माण में ओस्टवाल्ड प्रक्रम के पहले चरण में अमोनिया गैस के ऑक्सीकरण ऑक्सीजन गैस द्वारा नाइट्रिक ऑक्साइड गैस और भाप देता है। 10.00 ग्राम अमोनिया और 20.00 ग्राम ऑक्सीजन केवल से अधिकतम वजन कितना नाइट्रिक ऑक्साइड प्राप्त किया जा सकता है?
उत्तर दिखाएं
उत्तर
दिए गए अभिक्रिया के लिए संतुलित रासायनिक समीकरण नीचे दिया गया है:
$$ \begin{matrix} 4 NH _{3(g)}+5 O _{2(g)} & 4 NO _{(g)} & +6 H_2 O _{(g)} \\ 4 \times 17 g & 5 \times 32 g & 4 \times 30 g \quad 6 \times 18 g \\ =68 g \quad=160 g & =120 g \quad=108 g \end{matrix} $$
इसलिए, $68 g$ के $NH_3$ $160 g$ के $O_2$ के साथ अभिक्रिया करता है।
इसलिए, $10 g$ के $NH_3$ $ \frac{160 \times 10}{68} g $ के $O_2$ के साथ अभिक्रिया करता है, या $23.53 g$ के $O_2$ के साथ अभिक्रिया करता है।
लेकिन उपलब्ध $O_2$ की मात्रा $20 g$ है।
इसलिए, $O_2$ अभिकारक है (हमने $O_2$ की मात्रा को अभिक्रिया में प्राप्त नाइट्रिक ऑक्साइड के वजन की गणना करने के लिए लिया है)।
अब, $160 g$ के $O_2$ से $120 g$ के $NO$ प्राप्त होते हैं।
इसलिए, $20 g$ के $O_2$ से $\frac{120 \times 20}{160} g$ के $N$ प्राप्त होते हैं, या $15 g$ के $NO$ प्राप्त होते हैं।
इसलिए, नाइट्रिक ऑक्साइड के अधिकतम $15 g$ प्राप्त किए जा सकते हैं।
8.26 सारणी 8.1 में दिए गए मानक इलेक्ट्रोड विभव का उपयोग करते हुए, निम्नलिखित के बीच अभिक्रिया के अभिकल्पन की भविषेद करें:
(a) $\mathrm{Fe}^{3+}(\mathrm{aq})$ और $\mathrm{I}^{-}(\mathrm{aq})$
(b) $\mathrm{Ag}^{+}(\mathrm{aq})$ और $\mathrm{Cu}(\mathrm{s})$
(c) $\mathrm{Fe}^{3+}$ (aq) और $\mathrm{Cu}(\mathrm{s})$
(d) $\mathrm{Ag}(\mathrm{s})$ और $\mathrm{Fe}^{3+}(\mathrm{aq})$
(e) $\mathrm{Br_2}$ (aq) और $\mathrm{Fe}^{2+}(\mathrm{aq})$.
उत्तर दिखाएं
उत्तर
(a) $Fe _{(a q)}^{3+}+I _{(a q)}^{-}$ के बीच संभावित अभिक्रिया निम्नलिखित है,
$2 Fe _{(a q)}^{3+}+2 I _{(a q)}^{-} \longrightarrow 2 Fe _{(a q)}^{2+}+I _{2(s)}$
ऑक्सीकरण अर्ध-समीकरण : $\quad 2 I _{(x q)}^{-} \longrightarrow I _{2(s)}+2 e^{-} ; \quad E^{\circ}=-0.54 V$
अपचयन अर्ध-समीकरण : $[Fe _{(cq)}^{3+}+e^{-} \longrightarrow Fe _{(cq)}^{2+}] \times 2 ; \quad E^{\circ}=+0.77 V$
$ 2 Fe _{(a q)}^{3+}+2 I _{(a q)}^{-} \longrightarrow 2 Fe _{(a q)}^{2+}+I _{2(s)} ; E^{\circ}=+0.23 V $
अभिक्रिया के लिए $E^{\circ}$ धनात्मक है। इसलिए, $Fe _{(a q)}^{3+}$ और $I _{(a q)}^{-}$ के बीच अभिक्रिया संभव है।
(b) $Ag _{(a q)}^{+}+Cu _{(s)}$ के बीच संभावित अभिक्रिया निम्नलिखित है,
$ 2 Ag _{(a q)}^{+}+Cu _{(s)} \longrightarrow 2 Ag _{(s)}+Cu _{(a q)}^{2+} $
ऑक्सीकरण अर्ध-समीकरण : $\quad Cu _{(s)} \longrightarrow Cu _{(\text{aq })}^{2+}+2 e^{-} \quad ; E^{\circ}=-0.34 V$
$ \frac{\text{ अपचयन अर्ध-समीकरण : }[Ag _{(a q)}^{+}+e^{-} \longrightarrow Ag _{(s)}] \times 2 \quad ; E^{\circ}=+0.80 V}{2 Ag _{(a q)}^{+}+Cu _{(s)} \longrightarrow 2 Ag _{(s)}+Cu^{2+} ; E^{\circ}=+0.46 V} $
अभिक्रिया के लिए $E^{\circ}$ धनात्मक है। इसलिए, $Ag _{(a q)}^{+}$ और $Cu _{(s)}$ के बीच अभिक्रिया संभव है।
(c) $Fe _{(a q)}^{3+}$ और $Cu _{(s)}$ के बीच संभावित प्रतिक्रिया निम्नलिखित है,
$ 2 Fe _{(a q)}^{3+}+Cu _{(s)} \longrightarrow 2 Fe _{(x)}^{2+}+Cu _{(a q)}^{2+} $
ऑक्सीकरण अर्ध-समीकरण: $\quad Cu _{(s)} \longrightarrow Cu _{(a q)}^{2+}+2 e^{-} \quad ; E^{\circ}=-0.34 V$
अपचयन अर्ध-समीकरण : $[Fe _{(\alpha q)}^{3+}+e^{-} \longrightarrow Fe _{(s)}^{2+}] \times 2 \quad ; E^{\circ}=+0.77 V$
$ 2 Fe _{(a q)}^{3+}+Cu _{(s)} \longrightarrow 2 Fe _{(s)}^{2+}+Cu _{(a q)}^{2+} ; E^{\circ}=+0.43 V $
सम्पूर्ण प्रतिक्रिया के लिए $E^{\circ}$ धनात्मक है। अतः, $Fe _{(a q)}^{3+}$ और $Cu _{(s)}$ के बीच प्रतिक्रिया संभव है।
(d) $Ag _{(s)}$ और $Fe _{(a q)}^{3+}$ के बीच संभावित प्रतिक्रिया निम्नलिखित है, $Ag _{(s)}+2 Fe _{(a q)}^{3+} \longrightarrow Ag _{(a q)}^{+}+Fe _{(a q)}^{2+}$
ऑक्सीकरण अर्ध-समीकरण: $\quad Ag _{(x)} \longrightarrow Ag _{(a g)}^{+}+e^{-} \quad ; E^{\circ}=-0.80 V$
अपचयन अर्ध-समीकरण : $Fe _{(a q)}^{3+}+e^{-} \longrightarrow Fe _{(a q)}^{2+} \quad ; E^{\circ}=+0.77 V$ $Ag _{(s)}+Fe _{(a q)}^{3+} \longrightarrow Ag _{(a q)}^{+}+Fe _{(a q)}^{2+} ; E^{\circ}=-0.03 V$
यहाँ, सम्पूर्ण प्रतिक्रिया के लिए $E^{\circ}$ नकारात्मक है। अतः, $Ag _{(s)}$ और $Fe _{(a q)}^{3+}$ के बीच प्रतिक्रिया संभव नहीं है।
(e) $Br _{2(a q)}$ और $Fe _{(a q)}^{2+}$ के बीच संभावित प्रतिक्रिया निम्नलिखित है,
$Br _{2(s)}+2 Fe _{(a q)}^{2+} \longrightarrow 2 Br _{(a q)}^{-}+2 Fe _{(a q)}^{3+}$
ऑक्सीकरण अर्ध-समीकरण : $.\quad Fe _{(a q)}^{2+} \longrightarrow Fe _{(a q)}^{3+}+e^{-}] \times 2 \quad ; E^{\circ}=-0.77 V$
अपचयन अर्ध-समीकरण: $Br _{2(a q)}+2 e^{-} \longrightarrow 2 Br _{(a q)}^{-} \quad ; E^{\circ}=+1.09 V$
$ Br _{2(a q)}+2 Fe _{(a q)}^{2+} \longrightarrow 2 Br _{(a q)}^{-}+2 Fe _{(a q)}^{3+} ; E^{\circ}=-0.32 V $
यहाँ, सम्पूर्ण प्रतिक्रिया के लिए $E^{\circ}$ धनात्मक है। अतः, $Br _{2(a q)}$ और $Fe _{(a q)}^{2+}$ के बीच प्रतिक्रिया संभव है।
8.27 प्रत्येक निम्नलिखित में विद्युत अपघटन के उत्पादों की भविषेद करें:
(i) $\mathrm{AgNO_3}$ के जलीय विलयन में सिल्वर इलेक्ट्रोड
(ii) $\mathrm{AgNO_3}$ के जलीय विलयन में प्लेटिनम इलेक्ट्रोड
(iii) $\mathrm{H_2} \mathrm{SO_4}$ के तनु विलयन में प्लेटिनम इलेक्ट्रोड
(iv) $\mathrm{CuCl_2}$ के जलीय विलयन में प्लेटिनम इलेक्ट्रोड।
उत्तर दिखाएं
उत्तर
(i) $AgNO_3$ जलीय विलयन में आयनित होकर $Ag^{+}$ और $NO_3^{-}$ आयन बनाता है।
विद्युत अपघटन के दौरान, कैथोड पर $Ag^{+}$ आयन या $H_2 O$ अणु कम्पन कर सकते हैं। लेकिन $Ag^{+}$ आयन के अपचयन विभव के मूल्य $H_2 O$ के अपचयन विभव के मूल्य से अधिक होता है।
$$ \begin{aligned} & Ag _{(o q)}^{+}+e^{-} \longrightarrow Ag _{(s)} ; E^{\circ}=+0.80 V \\ & 2 H_2 O _{(t)}+2 e^{-} \longrightarrow H _{2(g)}+2 OH _{(a q)}^{-} ; E^{\circ}=-0.83 V \end{aligned} $$
इसलिए, कैथोड पर $Ag^{+}$ आयन अपचयित होते हैं। इसी तरह, कैथोड पर $Ag$ धातु या $H_2 O$ अणु के ऑक्सीकरण हो सकते हैं। लेकिन $Ag$ के ऑक्सीकरण विभव के मूल्य $H_2 O$ अणु के ऑक्सीकरण विभव के मूल्य से अधिक होता है।
$$ \begin{aligned} Ag _{(s)} & \longrightarrow Ag _{(a q)}^{+}+e^{-} \quad ; E^{\circ}=-0.80 V \\ 2 H_2 O _{(l)} & \longrightarrow O _{2(g)}+4 H _{(a q)}^{+}+4 e^{-} ; E^{\circ}=-1.23 V \end{aligned} $$
इसलिए, एनोड पर $Ag$ धातु ऑक्सीकृत होती है।
(ii) प्लेटिनम को आसानी से ऑक्सीकृत नहीं किया जा सकता। इसलिए, एनोड पर पानी के ऑक्सीकरण होता है ताकि $O_2$ गैस मुक्त की जा सके। कैथोड पर $Ag^{+}$ आयन अपचयित होते हैं और उपस्थित होते हैं।
(iii) $H_2 SO_4$ जलीय विलयन में आयनित होकर $H^{+}$ और $SO_4^{2-}$ आयन बनाता है।
$ H_2 SO _{4(a q)} \longrightarrow 2 H _{(a q)}^{+}+SO_4^{2-} _{(a q)} $
विद्युत अपघटन के दौरान, कैथोड पर $H^{+}$ आयन या $H_2 O$ अणु कम्पन कर सकते हैं। लेकिन $H^{+}$ आयन के अपचयन विभव के मूल्य $H_2 O$ अणु के अपचयन विभव के मूल्य से अधिक होता है।
$$ \begin{aligned} & 2 H _{(x q)}^{+}+2 e^{-} \longrightarrow H _{2(g)} ; E^{\circ}=0.0 V \\ & 2 H_2 O _{(a q)}+2 e^{-} \longrightarrow H _{2(g)}+2 OH _{(a q)}^{-} ; E^{\circ}=-0.83 V \end{aligned} $$
इसलिए, कैथोड पर $H^{+}$ आयन अपचयित होते हैं ताकि $H_2$ गैस मुक्त की जा सके।
दूसरी ओर, एनोड पर, $SO_4^{2-}$ आयन या $H_2 O$ अणु के ऑक्सीकरण हो सकते हैं। लेकिन $SO_4^{2-}$ के ऑक्सीकरण में $H_2 O$ अणु के तुलना में अधिक बंध टूटते हैं। इसलिए, $SO_4^{2-}$ आयन की ऑक्सीकरण विभव नीचे होता है। इसलिए, एनोड पर $H_2 O$ के ऑक्सीकरण होता है ताकि $O_2$ अणु मुक्त किए जा सकें।
(iv) जलीय विलयन में, $CuCl_2$ आयनित होकर $Cu^{2+}$ और $Cl^{-}$ आयन देता है जैसे कि:
$ CuCl _{2(a q)} \longrightarrow Cu _{(a q)}^{2+}+2 Cl _{(a q)}^{-} $
इलेक्ट्रोलिसिस के दौरान, कैथोड पर $Cu^{2+}$ आयन या $H_2 O$ अणु के अपचयन हो सकते हैं। लेकिन $Cu^{2+}$ का अपचयन विभव $H_2 O$ अणु के अपचयन विभव से अधिक होता है।
$$ \begin{aligned} & Cu _{(a q)}^{2+}+2 e^{-} \longrightarrow Cu _{(a q)} ; E^{\circ}=+0.34 V \\ & H_2 O _{(l)}+2 e^{-} \longrightarrow H _{2(g)}+2 OH^{-} ; E^{\circ}=-0.83 V \end{aligned} $$
इसलिए, कैथोड पर $Cu^{2+}$ आयन अपचयित होते हैं और उपस्थित होते हैं।
समान रूप से, एनोड पर $Cl^{-}$ या $H_2 O$ के ऑक्सीकरण हो सकते हैं। $H_2 O$ का ऑक्सीकरण विभव $Cl^{-}$ के ऑक्सीकरण विभव से अधिक होता है।
$$ \begin{aligned} & 2 Cl _{(a q)}^{-} \longrightarrow Cl _{2(g)}+2 e^{-} \quad ; E^{\circ}=-1.36 V \\ & 2 H_2 O _{(l)} \longrightarrow O _{2(g)}+4 H _{(a q)}^{+}+4 e^{-} ; E^{\circ}=-1.23 V \end{aligned} $$
लेकिन $H_2 O$ अणु के ऑक्सीकरण के लिए विभव कम होता है क्योंकि विद्युत विभव (गैस को मुक्त करने के लिए अतिरिक्त विभव) के कारण। इसलिए, एनोड पर $Cl^{-}$ आयन ऑक्सीकरण होते हैं ताकि $Cl_2$ गैस मुक्त किए जा सकें।
8.28 निम्नलिखित धातुओं को उनके लवण के विलयन से एक दूसरे को विस्थापित करने के क्रम में व्यवस्थित करें।
$\mathrm{Al}, \mathrm{Cu}, \mathrm{Fe}, \mathrm{Mg}$ और $\mathrm{Zn}$।
उत्तर दिखाएं
उत्तर
एक धातु जो दूसरी धातु की तुलना में अधिक रूपांतरण शक्ति रखती है, अपने लवण के विलयन से दूसरी धातु को विस्थापित कर सकती है।
दिए गए धातुओं की बढ़ती रूपांतरण शक्ति के क्रम $Cu<Fe<Zn<Al<Mg$ है।
इसलिए, हम कह सकते हैं कि $Mg$ $Al$ के अपने लवण के विलयन से विस्थापित कर सकता है, लेकिन $Al$ $Mg$ को विस्थापित नहीं कर सकता।
इसलिए, दिए गए धातुओं के अपने लवण के विलयन से एक दूसरे को विस्थापित करने के क्रम के नीचे दिया गया है:
$Mg>Al>Zn>Fe,>Cu$
8.29 दिए गए मानक इलेक्ट्रोड विभव,
$\mathrm{K}^{+} / \mathrm{K}=-2.93 \mathrm{~V}, \mathrm{Ag}^{+} / \mathrm{Ag}=0.80 \mathrm{~V}$,
$\mathrm{Hg}^{2+} / \mathrm{Hg}=0.79 \mathrm{~V}$
$\mathrm{Mg}^{2+} / \mathrm{Mg}=-2.37 \mathrm{~V} . \mathrm{Cr}^{3+} / \mathrm{Cr}=-0.74 \mathrm{~V}$
दिए गए धातुओं के बढ़ते क्रम में अपचायक शक्ति के अनुसार व्यवस्थित करें।
उत्तर दिखाएं
उत्तर
इलेक्ट्रोड विभव जितना कम होगा, उतना ही अपचायक एजेंट मजबूत होगा। इसलिए, दिए गए धातुओं के बढ़ते क्रम में अपचायक शक्ति के अनुसार व्यवस्थित करें $Ag<Hg<Cr<Mg<K$.
8.30 विद्युत रासायनिक सेल का चित्र बनाएं जिसमें अभिक्रिया $\mathrm{Zn}(\mathrm{s})+2 \mathrm{Ag}^{+}(\mathrm{aq}) \rightarrow \mathrm{Zn}^{2+}(\mathrm{aq})+2 \mathrm{Ag}(\mathrm{s})$ होती है, आगे दिखाएं:
(i) कौन सा इलेक्ट्रोड नकारात्मक चार्जित होता है,
(ii) सेल में विद्युत के वाहक क्या होते हैं, और
(iii) प्रत्येक इलेक्ट्रोड पर अलग-अलग अभिक्रिया।
उत्तर दिखाएं
उत्तर
दिए गए रेडॉक्स अभिक्रिया के संगत विद्युत रासायनिक सेल को नीचे दिए गए रूप में दर्शाया जा सकता है:
$Zn|Zn _{(a q)}^{2+} | Ag _{(a q)}^{+}| Ag$
(i) $Zn$ इलेक्ट्रोड नकारात्मक चार्जित होता है क्योंकि इस इलेक्ट्रोड पर $Zn$ का ऑक्सीकरण $Zn^{2+}$ में होता है और इस इलेक्ट्रोड पर छोड़े गए इलेक्ट्रॉन इकट्ठा हो जाते हैं।
(ii) सेल में विद्युत के वाहक आयन होते हैं।
(iii) $Zn$ इलेक्ट्रोड पर होने वाली अभिक्रिया नीचे दिए गए रूप में दर्शाई जा सकती है:
$ Zn _{(s)} \longrightarrow Zn _{(a q)}^{2+}+2 e^{-} $
और $Ag$ इलेक्ट्रोड पर होने वाली अभिक्रिया नीचे दिए गए रूप में दर्शाई जा सकती है:
$Ag _{(a q)}^{+}+e^{-} \longrightarrow Ag _{(s)}$





