अध्याय 4 रासायनिक आबंधन एवं अणुक संरचना
अभ्यास
4.1 रासायनिक आबंधन के निर्माण की व्याख्या करें।
उत्तर दिखाएं
उत्तर रासायनिक आबंधन एक आकर्षण बल है जो एक रासायनिक वस्तु में घटक (परमाणु, आयन आदि) को एक साथ बांधे रखता है।
रासायनिक आबंधन के निर्माण के लिए विभिन्न सिद्धांतों का प्रस्तावित किया गया है, जैसे इलेक्ट्रॉन सिद्धांत, वैलेंस शेल इलेक्ट्रॉन युग्म प्रतिकर्षण सिद्धांत, वैलेंस आबंध सिद्धांत और अणु ऑर्बिटल सिद्धांत।
रासायनिक आबंधन के निर्माण को एक प्रणाली के स्थायित्व के प्राप्त करने की प्रवृत्ति के कारण समझा जाता है। यह देखा गया कि नोबल गैसों की अक्रियता उनके बाहरी सबसे बाहरी कक्षा के पूर्ण भरे होने के कारण है। इसलिए, यह प्रस्तावित किया गया कि वे तत्व जिनके बाहरी सबसे बाहरी कक्षा अपूर्ण होते हैं, अस्थिर (अभिक्रियाशील) होते हैं। अतः, परमाणु एक दूसरे के साथ संयोजन करते हैं और अपने क्रमानुसार अष्टक या दुपल्ट को पूरा करके सबसे करीबी नोबल गैस के स्थायी संरचना के अनुरूप बन जाते हैं। यह संयोजन एक दूसरे के इलेक्ट्रॉन साझा करके या एक या एक से अधिक इलेक्ट्रॉन के एक परमाणु से दूसरे परमाणु में स्थानांतरित करके हो सकता है। परमाणुओं के बीच इलेक्ट्रॉन साझा करने के परिणामस्वरूप बने रासायनिक आबंध को सहसंयोजक आबंध कहते हैं। एक आयनिक आबंध एक अणु से दूसरे अणु में इलेक्ट्रॉन के स्थानांतरण के परिणामस्वरूज होता है।
4.2 निम्न तत्वों के परमाणुओं के लुईस डॉट संकेत लिखें : Mg, Na, B, O, N, Br.
उत्तर दिखाएं
उत्त र
Mg : Mg परमाणु में दो वैलेंस इलेक्ट्रॉन होते हैं। इसलिए, Mg के लुईस डॉट संकेत इस प्रकार होता है :
$ \hspace{5cm} \boldsymbol{\overset{\bullet \ \bullet}{ \ \ Mg}}$
Na : सोडियम परमाणु में केवल एक वैलेंस इलेक्ट्रॉन होता है। इसलिए, लुईस डॉट संरचना इस प्रकार होती है :
$ \hspace{5cm} \boldsymbol{\overset{\bullet}Na}$
B : बोरॉन परमाणु में तीन वैलेंस इलेक्ट्रॉन होते हैं। इसलिए, लुईस डॉट संरचना इस प्रकार होती है :
$ \hspace{5cm} {}^{\bullet}{\overset{\bullet\bullet}{B}}$
O : ऑक्सीजन परमाणु में छह वैलेंस इलेक्ट्रॉन होते हैं। इसलिए, लुईस डॉट संरचना इस प्रकार होती है :
$ \hspace{5cm} \overset{\bullet\bullet}{{}^\bullet_\bullet{\mathrm{ \ O \ }}^\bullet_\
N : नाइट्रोजन के परमाणु में पांच संयोजक इलेक्ट्रॉन होते हैं। इसलिए, लुईस डॉट संरचना निम्नलिखित होती है:
$ \hspace{5cm} \overset{\bullet\bullet}{{}^\bullet{\mathrm{ \ N \ }}^\bullet_\bullet}$
Br : ब्रोमीन में सात संयोजक इलेक्ट्रॉन होते हैं। इसलिए, लुईस डॉट संरचना निम्नलिखित होती है :
$ \hspace{5cm} \overset{\bullet\bullet}{{}^\bullet_\bullet{\mathrm{ \ Br \ }}^\bullet_\bullet}$
4.3 निम्नलिखित परमाणु और आयनों के लुईस संकेत लिखिए: $\mathrm{S}$ और $\mathrm{S}^{2-} ; \mathrm{Al}$ और $\mathrm{Al}^{3+} ; \mathrm{H}$ और $\mathrm{H}^{-}$
उत्तर दिखाएं
Answer
(i) $S$ और $S^{2}$
सल्फर में संयोजक इलेक्ट्रॉन की संख्या 6 होती है।
सल्फर $(S)$ के लुईस डॉट संकेत है $\hspace{0.5cm}$ $ \overset{\bullet\bullet}{{}^\bullet_\bullet{\mathrm{ \ Br \ }}^\bullet_\bullet}$
द्विऋणात्मक आवेश यह बताता है कि छह संयोजक इलेक्ट्रॉन के अतिरिक्त दो इलेक्ट्रॉन भी होंगे। इसलिए, $S^{2 \cdot}$ के लुईस डॉट संकेत है

(ii) $Al$ और $Al^{3+}$
एल्यूमिनियम में संयोजक इलेक्ट्रॉन की संख्या 3 होती है।
एल्यूमिनियम $(Al)$ के लुईस डॉट संकेत है $ \hspace{0.5cm} {}^{\bullet}{\overset{\bullet\bullet}{Al}}$
एक त्रिधनात्मक आवेश एक वस्तु पर यह बताता है कि इसने अपने तीन इलेक्ट्रॉन दान कर दिए हैं। इसलिए, लुईस डॉट संकेत $[Al]^{3+}$ होता है।
(iii) $H$ और $H$
हाइड्रोजन में संयोजक इलेक्ट्रॉन की संख्या 1 होती है।
हाइड्रोजन $(H)$ के लुईस डॉट संकेत है $ \hspace{0.5cm} \boldsymbol{\overset{\bullet}H}$
एक ऋणात्मक आवेश यह बताता है कि एक संयोजक इलेक्ट्रॉन के अतिरिक्त एक इलेक्ट्रॉन भी होगा। इसलिए, लुईस डॉट संकेत $ \hspace{0.5cm} \big[\boldsymbol{\overset{\bullet \ \bullet}{ \ H}} \ \big]^-$ होता है।
4.4 निम्नलिखित अणु और आयनों के लुईस संरचना बनाइए:
$\mathrm{H}_2 \mathrm{S}, \mathrm{SiCl}_4, \mathrm{BeF}_2, \mathrm{CO}_3^{2-}$, $\mathrm{HCOOH}$
उत्तर दिखाएं
उत्तर
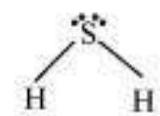
$H_2S$
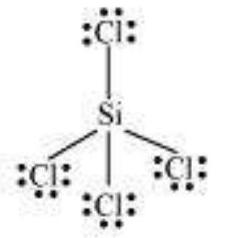
$SiCl_4$
$BeF_2$
$ \overset{ \ \ \bullet \ \bullet}{^\bullet_\bullet\underset{\bullet \ \bullet}{{F}}}{\LARGE{\boldsymbol{-}}}{Be}{\LARGE{\boldsymbol{-}}} \underset{\bullet \ \bullet \ \ \ }{\overset{\bullet \ \bullet \ \ }{F{ \ }^\bullet_\bullet}} $
$CO_3^{2-}$

4.5 आठ-इलेक्ट्रॉन नियम को परिभाषित करें। इसके महत्व और सीमाएं लिखें।
उत्तर दिखाएं
उत्तर
आठ-इलेक्ट्रॉन नियम या रासायनिक बंधन के इलेक्ट्रॉनिक सिद्धांत को कोसल और लुईस द्वारा विकसित किया गया था। इस नियम के अनुसार, परमाणु एक दूसरे के वैलेंस इलेक्ट्रॉन के स्थानांतरण या उनके वैलेंस इलेक्ट्रॉन के साझा करके सबसे करीबी नोबल गैस विन्यास प्राप्त करने के लिए आठ इलेक्ट्रॉन वाले अपने वैलेंस शेल में आ जाते हैं।
आठ-इलेक्ट्रॉन नियम ने तत्व की प्रकृति पर आधारित रासायनिक बंधन के निर्माण को सफलतापूर्वक समझाया है।
आठ-इलेक्ट्रॉन सिद्धांत की सीमाएं:
आठ-इलेक्ट्रॉन नियम की निम्नलिखित सीमाएं हैं:
(a) नियम अणु के आकार और संबंधित स्थायित्व की भविष्यवाणी नहीं कर सकता।
(b) यह स्पष्ट है कि आठ-इलेक्ट्रॉन नियम नोबल गैसों की रासायनिक अक्रियता पर आधारित है। हालांकि, कुछ नोबल गैस (उदाहरण के लिए एक्ज़ेनॉन और क्रिप्टॉन) ऑक्सीजन और फ्लूओरीन के साथ संयोजित होकर जैसे $\mathrm{XeF}_2, \mathrm{KrF}_2, \mathrm{XeOF}_2$ आदि अनेक यौगिक बनाते हैं।
(c) आवर्त सारणी के तीसरे आवर्त और उससे आगे के तत्वों में, अलावा $3 s$ और $3 p$ कक्षकों के बाहर, $3 d$ कक्षक भी बंधन के लिए उपलब्ध होते हैं। इन तत्वों के कई यौगिकों में केंद्रीय परमाणु के आसपास आठ से अधिक आबंधन इलेक्ट्रॉन होते हैं। इसे विस्तारित आठ इलेक्ट्रॉन कहा जाता है। स्पष्ट रूप से ऐसे मामलों में आठ इलेक्ट्रॉन के नियम काम नहीं करता है।
ऐसे यौगिकों के कुछ उदाहरण हैं: $\mathrm{PF}_5, \mathrm{SF}_6, \mathrm{H}_2 \mathrm{SO}_4$ और कई समन्वय यौगिक।

(d) इलेक्ट्रॉन की विषम संख्या वाले अणुओं में, जैसे नाइट्रिक ऑक्साइड, NO और नाइट्रोजन डाइऑक्साइड, $\mathrm{NO}_2$, सभी परमाणुओं में आठ इलेक्ट्रॉन के नियम की पूर्ति नहीं होती है।

(e) कुछ यौगिकों में केंद्रीय परमाणु के आसपास इलेक्ट्रॉन की संख्या आठ से कम होती है। यह विशेष रूप से वह तत्व होते हैं जिनके आठ से कम आबंधन इलेक्ट्रॉन होते हैं। उदाहरण हैं $\mathrm{LiCl}, \mathrm{BeH}_2$ और $\mathrm{BCl}_3$।

Li, Be और B केवल 1, 2 और 3 आबंधन इलेक्ट्रॉन होते हैं। कुछ अन्य ऐसे यौगिक हैं $\mathrm{AlCl}_3$ और $\mathrm{BF}_3$।
4.6 आयनिक आबंधन के निर्माण के अनुकूल कारक लिखिए।
उत्तर दिखाएं
उत्तर
एक आयनिक आबंध एक या अधिक इलेक्ट्रॉन के स्थानांतरण के कारण बनता है। इसलिए, आयनिक आबंध के निर्माण पर उदासीन परमाणुओं के इलेक्ट्रॉन खोने या लेने की आसानी पर निर्भर करता है। आबंध के निर्माण पर बने यौगिक की लेटिस ऊर्जा भी प्रभाव डालती है।
इसलिए, आयनिक आबंध के निर्माण के अनुकूल कारक निम्नलिखित हैं:
(i) धातु परमाणु की कम आयनन एन्थैल्पी।
(ii) अधातु परमाणु की उच्च इलेक्ट्रॉन ग्रहण एन्थैल्पी $(\Delta _{e g} H)$।
(iii) बने हुए यौगिक की उच्च लैटिस ऊर्जा।
4.7 VSEPR मॉडल के आधार पर निम्नलिखित अणुओं के आकार की चर्चा कीजिए :
$\mathrm{BeCl}_2, \mathrm{BCl}_3, \mathrm{SiCl}_4, \mathrm{AsF}_5, \mathrm{H}_2 \mathrm{~S}, \mathrm{PH}_3$
उत्तर दिखाएं
उत्तर
${BeCl_2}$
केंद्रीय परमाणु में कोई अकेला युग्म नहीं है और दो आबंध युग्म हैं। अर्थात, $BeCl_2$ के प्रकार $AB_2$ है। इसलिए, इसका आकार सीधा है।
$Cl: Be: Cl$
$BCl_3$
केंद्रीय परमाणु में कोई अकेला युग्म नहीं है और तीन आबंध युग्म हैं। इसलिए, इसके प्रकार $AB_3$ है। इसलिए, इसका आकार त्रिकोणीय समतलीय है।
${SiCl_4}$
केंद्रीय परमाणु में कोई अकेला युग्म नहीं है और चार आबंध युग्म हैं। इसलिए, $SiCl_4$ का आकार चतुष्कोणीय है जो $AB_4$ प्रकार के अणु होते हैं।
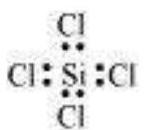
$\mathrm{AsF}_5$
केंद्रीय परमाणु में कोई अकेला युग्म नहीं है और पांच आबंध युग्म हैं। इसलिए, $AsF_5$ के प्रकार $AB_5$ है। इसलिए, इसका आकार त्रिकोणीय बिपिरामिडल है।
$H_2 S$ :
केंद्रीय परमाणु में एक अकेला युग्म है और दो आबंध युग्म हैं। इसलिए, $H_2 S$ के प्रकार $AB_2 E$ है। आकार घुमावदार है।
н: $\ddot{s}: H$
$PH_3:$
केंद्रीय परमाणु में एक अकेला युग्म है और तीन आबंध युग्म हैं। इसलिए, $PH_3$ के प्रकार $AB_3 E$ है। इसलिए, इसका आकार त्रिकोणीय पिरामिडल है।
$H: \underset{H}{\ddot{P}}: H$
4.8 हालांकि $\mathrm{NH}_3$ और $\mathrm{H}_2 \mathrm{O}$ अणुओं के आकार विकृत चतुष्कोणीय हैं, पानी के बंधन कोण अमोनिया के बंधन कोण से कम है। चर्चा कीजिए।
उत्तर दिखाएं
उत्तर
$NH_3$ और $H_2 O$ के आणविक आकृति को दिखाया जा सकता है:

$NH_3$ में केंद्रीय परमाणु $(N)$ एक अकेला युग्म और तीन आबंध युग्म होता है। $H_2 O$ में दो अकेले युग्म और दो आबंध युग्म होते हैं।
$H_2 O$ अणु के ऑक्सीजन परमाणु में दो अकेले युग्म उपस्थित होते हैं जो दो आबंध युग्म को प्रतिकर्षित करते हैं। इस प्रतिकर्षण के बीच बल नाइट्रोजन परमाणु पर एक अकेला युग्म और तीन आबंध युग्म के बीच प्रतिकर्षण की तुलना में अधिक होता है।
क्योंकि $H_2 O$ अणु में आबंध युग्मों पर प्रतिकर्षण $NH_3$ में आबंध युग्मों पर प्रतिकर्षण की तुलना में अधिक होता है, तो पानी के आबंध कोण अमोनिया के आबंध कोण से कम होता है।
4.9 आबंध शक्ति को आबंध क्रम के रूप में कैसे व्यक्त करते हैं?
उत्तर दिखाएं
उत्तर
आबंध शक्ति दो परमाणुओं के बीच आबंधन के बारे में बताती है। आबंध ऊर्जा जितनी अधिक होती है, आबंध उतना मजबूत होता है और आबंध क्रम उतना अधिक होता है।
4.10 आबंध लंबाई को कैसे परिभाषित करते हैं?
उत्तर दिखाएं
उत्तर
आबंध लंबाई को एक अणु में दो आबंधित परमाणुओं के नाभिकों के बीच संतुलित दूरी के रूप में परिभाषित किया जाता है। आबंध लंबाई को उच्च श्रेणी के विद्यार्थियों के लिए आप अधिक जानकारी प्राप्त करेंगे जैसे स्पेक्ट्रोस्कोपी, X-किरण विवर्जन और इलेक्ट्रॉन-विवर्जन तकनीकों द्वारा मापा जाता है। प्रत्येक आबंधित युग्म के परमाणु आबंध लंबाई में योगदान देते हैं। सहसंयोजक आबंध के मामले में, प्रत्येक परमाणु के योगदान को उस परमाणु की सहसंयोजक त्रिज्या के रूप में जाना जाता है।

$R=r_A+r_B\left(R\right.$ आबंध लंबाई है और $r_A$ और $r_B$ परमाणु $A$ और $B$ की सहसंयोजक त्रिज्या हैं)
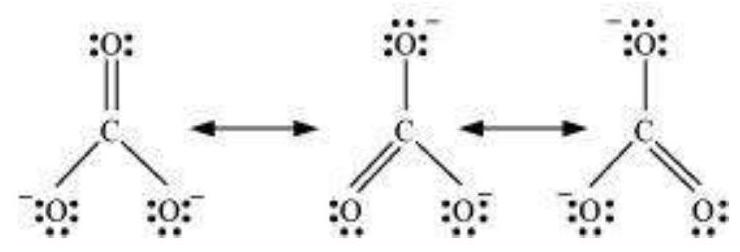
4.11 $\mathrm{CO}_{3}^{2-}$ आयन के संदर्भ में आवर्तन के महत्वपूर्ण पहलू को समझाइए।
उत्तर दिखाएँ
उत्तर
कार्बन और ऑक्सीजन परमाणुओं के बीच दो एकल बंध और एक द्विबंध की उपस्थिति के आधार पर एकल लुईस संरचना अणु को ठीक तरीके से प्रतिनिधित्व नहीं कर सकती क्योंकि यह असमान बंधों को प्रस्तुत करती है। प्रयोगात्मक खोज के अनुसार, $\mathrm{CO}_3^{2-}$ में सभी कार्बन और ऑक्सीजन बंध समान होते हैं। इसलिए कार्बोनेट आयन को नीचे दिखाए गए मानक रूपों के रेजोनेंस मिश्रण के रूप में सर्वोत्तम रूप से वर्णित किया जा सकता है।
4.12 $ \mathrm{H}_3 \mathrm{PO}_3$ को नीचे दिखाए गए संरचनाओं 1 और 2 द्वारा प्रस्तुत किया जा सकता है। क्या ये दोनों संरचनाएँ $ \mathrm{H}_3 \mathrm{PO}_3$ के रेजोनेंस मिश्रण के मानक रूपों के रूप में ली जा सकती हैं? यदि नहीं, तो इसके लिए कारण दीजिए।

उत्तर दिखाएँ
उत्तर
दी गई संरचनाएँ $H_3 PO_3$ के रेजोनेंस मिश्रण के मानक रूपों के रूप में ली जा सकती हैं क्योंकि परमाणुओं के स्थान बदल गए हैं।
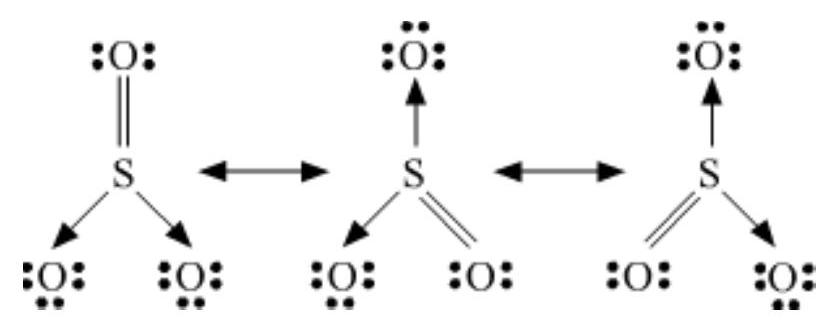
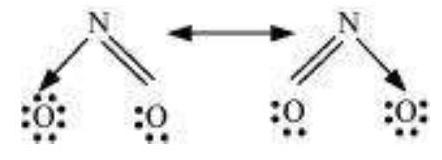
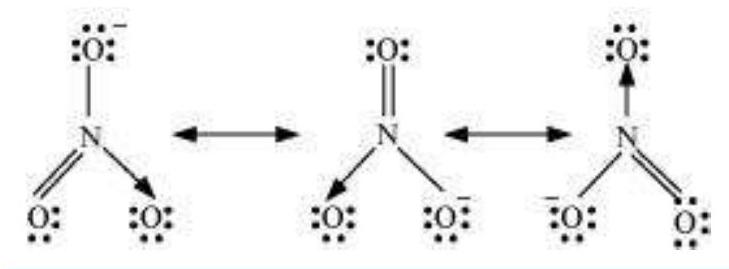
4.13 $\mathrm{SO}_3, \mathrm{NO}_2$ और $\mathrm{NO}_3^{-}$ के रेजोनेंस संरचनाएँ लिखिए।
उत्तर दिखाएँ
उत्तर
रेजोनेंस संरचनाएँ निम्नलिखित हैं:
(a) $SO_3$ :
(b) $NO_2$ :
(c) $NO_3^{-}$:
4.14 निम्नलिखित परमाणुओं के बीच इलेक्ट्रॉन परिवहन को लेविस संकेतों के माध्यम से दिखाइए जिससे आयन बने : (a) $\mathrm{K}$ और $\mathrm{S}$ (b) $\mathrm{Ca}$ और $\mathrm{O}$ (c) $\mathrm{Al}$ और $\mathrm{N}$.
उत्तर दिखाएं
उत्तर
(a) $K$ और $S$ -
$K$ और $S$ के इलेक्ट्रॉनिक विन्यास निम्नलिखित हैं:
$K : 2, 8, 8, 1$
$S : 2,8,6$
सल्फर (S) अपने अष्टक को पूरा करने के लिए 2 अतिरिक्त इलेक्ट्रॉन चाहता है। पोटेशियम (K) के लिए निकटतम नोबल गैस (आर्गन) के बराबर एक इलेक्ट्रॉन अधिक आवश्यक है। इसलिए, इलेक्ट्रॉन परिवहन को निम्नलिखित तरीके से दिखाया जा सकता है:

(b) Ca और O -
$Ca$ और $O$ के इलेक्ट्रॉनिक विन्यास निम्नलिखित हैं :
$Ca : 2,8,8,2$
$O : 2,6$
ऑक्सीजन के लिए अष्टक को पूरा करने के लिए दो अतिरिक्त इलेक्ट्रॉन आवश्यक हैं, जबकि कैल्शियम के लिए निकटतम नोबल गैस (आर्गन) के बराबर दो इलेक्ट्रॉन अधिक हैं। इसलिए, इलेक्ट्रॉन परिवहन निम्नलिखित तरीके से होता है:

(c) Al और $N$ :
$Al$ और $N$ के इलेक्ट्रॉनिक विन्यास निम्नलिखित हैं:
$Al : 2, 8, 3$
$N : 2,5$
नाइट्रोजन के लिए निकटतम नोबल गैस (नीऑन) के बराबर तीन इलेक्ट्रॉन कम हैं, जबकि एल्यूमीनियम के लिए नीऑन के बराबर तीन इलेक्ट्रॉन अधिक हैं। इसलिए, इलेक्ट्रॉन परिवहन को निम्नलिखित तरीके से दिखाया जा सकता है:

4.15 हालांकि, $\mathrm{CO}_2$ और $\mathrm{H}_2 \mathrm{O}$ दोनों त्रि-परमाणुक अणु हैं, लेकिन $\mathrm{H}_2 \mathrm{O}$ अणु के आकार घुमावदार होता है जबकि $\mathrm{CO}_2$ के आकार सीधा होता है। इसे विद्युत द्विध्रुव आघूर्ण के आधार पर समझाइए।
उत्तर दिखाएं
उत्तर
प्रयोगात्मक परिणामों के अनुसार, कार्बन डाइऑक्साइड के द्विध्रुव आघूर्ण शून्य है। यह संभव हो सकता है केवल तभी जब अणु सीधा हो ताकि $C-O$ बंधों के द्विध्रुव आघूर्ण बराबर और विपरीत हों जिससे एक दूसरे को निरस्त कर दें।

परिणामी $\mu=0$ D
दूसरी ओर, $H_2 O$ के द्विध्रुव आघूर्ण का मान $1.84 \hspace{0.8mm} D$ है (हालांकि यह एक त्रि-परमाणुक अणु है जैसे $CO_2$)। द्विध्रुव आघूर्ण के मान से यह सुझाव देता है कि $H_2 O$ अणु की संरचना घुमावदार है जहां $O-H$ बंधों के द्विध्रुव आघूर्ण असमान हैं।

4.16 द्विध्रुव आघूर्ण के महत्व/उपयोगों को लिखिए।
उत्तर दिखाएं
उत्तर
असमान परमाणु अणुओं में, परमाणुओं के विद्युत ऋणात्मकता में अंतर के कारण विद्युत ध्रुवता उत्पन्न होती है। इसके परिणामस्वरूप, अणु के एक सिरे पर धनात्मक आवेश और दूसरे सिरे पर ऋणात्मक आवेश लग जाता है। इसलिए, एक अणु को द्विध्रुव कहा जाता है।
आवेश के मान और धनात्मक-ऋणात्मक आवेश के केंद्रों के बीच दूरी के गुणनफल को अणु के द्विध्रुव आघूर्ण $ \mu $ कहते हैं।
द्विध्रुव आघूर्ण $(\mu)=$ आवेश $(Q) \times$ अलग-अलग आवेश केंद्रों के बीच दूरी $(r)$
इसके अतिरिक्त, द्विध्रुव आघूर्ण के चिह्न और दिशा के बारे में अधिक जानकारी देता है। इसके परिपाटी अनुसार, यह एक तीर द्वारा प्रदर्शित किया जाता है जिसका खोल धनात्मक सिरे पर होता है और छोटा ऋणात्मक सिरे पर होता है। उदाहरण के लिए, HF को इस प्रकार दर्शाया जा सकता है:

इस तीर का चिह्न अणु में इलेक्ट्रॉन घनत्व के विस्थापन की दिशा को दर्शाता है। ध्यान दें कि घुमावदार तीर की दिशा आम द्विध्रुव आघूर्ण सदिश की दिशा के विपरीत होती है।
4.17 विद्युत ऋणात्मकता को परिभाषित करें। यह इलेक्ट्रॉन ग्रहण py से कैसे भिन्न है?
उत्तर दिखाएं
उत्तर
विद्युत ऋणात्मकता एक रासायनिक यौगिक में एक परमाणु के आकर्षण क्षमता को कहते हैं जो बंधन युग्म इलेक्ट्रॉन को अपने केंद्र की ओर आकर्षित करता है।
किसी भी तत्व की विद्युत ऋणात्मकता निरंतर नहीं होती। यह उस तत्व के साथ जिससे यह बंधे होने पर बदलती रहती है। यह एक माप्य राशि नहीं है। यह केवल एक संबंधित संख्या है।
दूसरी ओर, इलेक्ट्रॉन ग्रहण py एक उदासीन गैसीय परमाणु में एक इलेक्ट्रॉन के जोड़ने से एक ऋणायन के निर्माण के दौरान होने वाले enthalpy परिवर्तन को कहते हैं। यह इलेक्ट्रॉन के जोड़े या हटाए जाने पर नकारात्मक या धनात्मक हो सकता है। एक तत्व के इलेक्ट्रॉन ग्रहण py का मान निरंतर होता है जिसे प्रयोगशाला में मापा जा सकता है।
4.18 उपयुक्त उदाहरण के साथ ध्रुवीय सहसंयोजक बंध को समझाइए।
उत्तर दिखाएं
उत्तर
जब दो असमान परमाणु जो विद्युत ऋणात्मकता में अलग होते हैं, सहसंयोजक बंध बनाते हैं, तो बंधन युग्म इलेक्ट्रॉन के समान बाँटे जाने के बजाय बराबर बाँटे जाने के लिए नहीं होते। बंधन युग्म उस परमाणु के नाभिक की ओर विस्थापित हो जाते हैं जो अधिक विद्युत ऋणात्मकता रखता है। इस प्रकार, इलेक्ट्रॉन वितरण विकृत हो जाता है और इलेक्ट्रॉन बादल विद्युत ऋणात्मक परमाणु की ओर विस्थापित हो जाता है।
इस कारण, विद्युत ऋणात्मक परमाणु थोड़ा ऋणावेशित हो जाता है जबकि दूसरा परमाणु थोड़ा धनावेशित हो जाता है। इस प्रकार, अणु में विपरीत ध्रुव विकसित हो जाते हैं और इस प्रकार के बंध को ध्रुवीय सहसंयोजक बंध कहते हैं।
उदाहरण के लिए, $HCl$ में एक ध्रुवीय सहसंयोजक बंध होता है। क्लोरीन परमाणु हाइड्रोजन परमाणु की तुलना में अधिक विद्युत ऋणात्मकता रखता है। इसलिए, बंधन युग्म क्लोरीन की ओर होता है और इसलिए, यह आंशिक ऋणावेश ले लेता है।
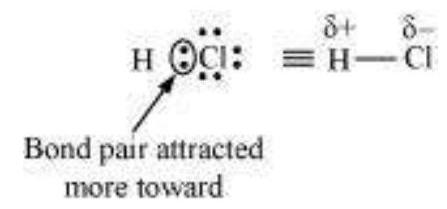
4.19 अणुओं $\mathrm{LiF}, \mathrm{K}_2 \mathrm{O}$, $\mathrm{N}_2, \mathrm{SO}_2$ और $\mathrm{ClF}_3$ में आयनिक चारित्र के बढ़ते क्रम में बंधों को व्यवस्थित करें।
उत्तर दिखाएँ
उत्तर
एक अणु में आयनिक चरित्र उसके बनाने वाले परमाणुओं के विद्युत ऋणात्मकता के अंतर पर निर्भर करता है। अंतर जितना अधिक होगा, अणु के आयनिक चरित्र उतना ही अधिक होगा।
इस आधार पर, दिए गए अणुओं में आयनिक चरित्र के बढ़ते क्रम के अनुसार है:
$N_2 < SO_2 < ClF_3 < K_2 O < LiF $।
4.20 $\mathrm{CH}_{3} \mathrm{COOH}$ की संरचना नीचे दी गई है, जो सही है, लेकिन कुछ बंधन गलत दिखाए गए हैं। सही लेविस संरचना लिखिए।

उत्तर दिखाएँ
उत्तर
एसिटिक अम्ल की सही लेविस संरचना निम्नलिखित है :

4.21 $\mathrm{CH_4}$ के अलावा टेट्राहेड्रल ज्योति के अतिरिक्त, एक अन्य संभावित ज्योति वर्गीय तलीय हो सकती है जिसमें चार $\mathrm{H}$ परमाणु वर्ग के कोनों पर और $\mathrm{C}$ परमाणु इसके केंद्र पर होता है। कारण बताइए कि $\mathrm{CH_4}$ वर्गीय तलीय नहीं हो सकता?
उत्तर दिखाएँ
उत्तर
कार्बन परमाणु की इलेक्ट्रॉनिक विन्यास :
$ _6 C: 1 s^{2} 2 s^{2} 2 p^{2}$
उत्तेजित अवस्था में, कार्बन के ऑर्बिटल चित्र इस प्रकार दर्शाया जा सकता है :
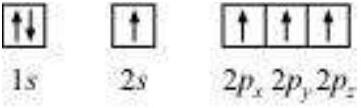
अतः, $CH_4$ अणु में कार्बन परमाणु $s p^{3}$ हाइब्रिडाइजेशन अवस्था में होता है और टेट्राहेड्रल आकृति ले लेता है।
वर्गीय तलीय आकृति के लिए, केंद्रीय परमाणु के हाइब्रिडाइजेशन $d s p^{2}$ होना आवश्यक होता है। हालांकि, कार्बन परमाणु में $d$-ऑर्बिटल नहीं होते हैं जिसके कारण $d s p^{2}$ हाइब्रिडाइजेशन नहीं हो सकता। अतः, $CH_4$ की संरचना वर्गीय तलीय नहीं हो सकती।
अतिरिक्त, वर्गीय समतल में $90^{\circ}$ के कोण के कारण $CH_4$ की स्थायित्व बहुत कम होगी क्योंकि बंधन युग्मों के बीच प्रतिकर्षण उपस्थित होता है। अतः, VSEPR सिद्धांत भी $CH_4$ के टेट्राहेड्रल संरचना को समर्थन देता है।
4.22 स्पष्ट करें कि $\mathrm{BeH_2}$ अणु के द्विध्रुव आघूर्ण शून्य होता है भले ही $\mathrm{Be}-\mathrm{H}$ बंध ध्रुवीय हों।
उत्तर दिखाएं
उत्तर
$\mathrm{BeH_2}$ के Lewis संरचना निम्नलिखित है:
$H: Be: H$
केंद्रीय परमाणु (Be) पर कोई अकेला युग्म नहीं होता और दो बंधन युग्म होते हैं। अतः, $\mathrm{BeH_2}$ के प्रकार $AB_2$ होता है। इसकी संरचना सीधी होती है।

प्रत्येक $H-Be$ बंध के द्विध्रुव आघूर्ण समान होते हैं और विपरीत दिशा में होते हैं। अतः, वे एक दूसरे को निरस्त कर देते हैं। अतः, $\mathrm{BeH_2}$ अणु के द्विध्रुव आघूर्ण शून्य होता है।
4.23 $\mathrm{NH_3}$ और $\mathrm{NF_3}$ में से कौन सा अधिक द्विध्रुव आघूर्ण रखता है और क्यों?
उत्तर दिखाएं
उत्तर
हम $\mathrm{NH}_3$ और $\mathrm{NF}_3$ अणु के एक रोचक मामले के बारे में अध्ययन करते हैं। दोनों अणुओं में नाइट्रोजन परमाणु पर एक अकेला इलेक्ट्रॉन युग्म होता है और इनकी आकृति पिरामिडी होती है। फ्लूओरीन नाइट्रोजन की तुलना में अधिक विद्युत ऋणात्मक होता है, लेकिन $\mathrm{NH_3}$ के द्विध्रुव आघूर्ण $\mathrm{NH}_3\left(4.90 \times 10^{-30} \mathrm{C} \mathrm{m}\right)$ वह ज्यादा होता है जो $\mathrm{NF}_3\left(0.8 \times 10^{-30} \mathrm{C} \mathrm{m}\right)$ के द्विध्रुव आघूर्ण की तुलना में। इसका कारण यह है कि $\mathrm{NH_3}$ के मामले में अकेले इलेक्ट्रॉन युग्म के कारण आवर्त द्विध्रुव के द्विध्रुव आघूर्ण की दिशा एक ही होती है जो $\mathrm{N}-\mathrm{H}$ बंध के परिणामी द्विध्रुव आघूर्ण की दिशा के समान होती है, जबकि $\mathrm{NF}_3$ के मामले में आवर्त द्विध्रुव की दिशा तीन $\mathrm{N}-\mathrm{F}$ बंध के परिणामी द्विध्रुव आघूर्ण की दिशा के विपरीत होती है। अकेले इलेक्ट्रॉन युग्म के कारण आवर्त द्विध्रुव तीन $\mathrm{N}-\mathrm{F}$ बंध के परिणामी द्विध्रुव आघूर्ण के प्रभाव को कम कर देता है, जिसके कारण $\mathrm{NF}_3$ के निम्न द्विध्रुव आघूर्ण होता है जैसा कि नीचे दर्शाया गया है :

इसलिए, $NF_3$ के नेट डायपोल आघूर्ण $NH_3$ के आघूर्ण के कम होता है।
4.24 परमाणु कक्षकों के हाइब्रिडाइजेशन के अर्थ क्या है? $s p, s p^{2}$, $s p^{3}$ हाइब्रिड कक्षकों के आकार का वर्णन करें।
उत्तर दिखाएं
उत्तर
हाइब्रिडाइजेशन को एक सेट के परमाणु कक्षकों के बीच थोड़े अलग ऊर्जा वाले कक्षकों के मिश्रण के रूप में परिभाषित किया जाता है, जिससे एक नए सेट के कक्षकों का निर्माण होता है जो समान ऊर्जा और आकार वाले होते हैं।
उदाहरण के लिए, कार्बन के दो $2 p$-कक्षक एक $2 s$-कक्षक के साथ हाइब्रिडाइजेशन करते हैं जिससे तीन नए $s p^{2}$ हाइब्रिड कक्षक बनते हैं।
इन हाइब्रिड कक्षकों में इलेक्ट्रॉन युग्मों के बीच न्यूनतम प्रतिकर्षण होता है और इसलिए वे अधिक स्थायी होते हैं। हाइब्रिडाइजेशन अणु के ज्यामिति को सूचित करता है।
$s p$ हाइब्रिड कक्षकों के आकार: $s p$ हाइब्रिड कक्षक एक रेखीय आकार रखते हैं। वे $s$ और $p$ कक्षकों के मिश्रण के रूप में बनते हैं जैसा कि नीचे दिखाया गया है:

$s p$-हाइब्रिड
$s p^{2}$ हाइब्रिड कक्षकों के आकार:
$s p^{2}$ हाइब्रिड कक्षक एक $s$-कक्षक और दो $2 p$-कक्षकों के मिश्रण के रूप में बनते हैं। हाइब्रिड कक्षक त्रिकोणीय समतलीय व्यवस्था में व्यवस्थित होते हैं जैसा कि नीचे दिखाया गया है:

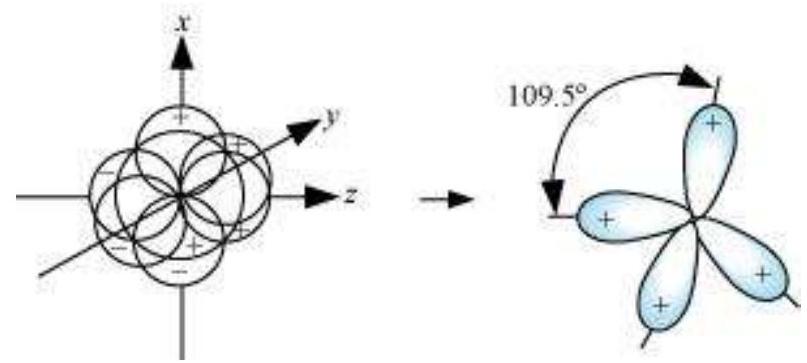
$s p^{3}$ हाइब्रिड कक्षकों के आकार:
चार $s p^{3}$ हाइब्रिड कक्षक एक $s$-कक्षक और तीन $p$-कक्षकों के मिश्रण के रूप में बनते हैं। चार $s p^{3}$ हाइब्रिड कक्षक टेट्राहेड्रल व्यवस्था में व्यवस्थित होते हैं जैसा कि नीचे दिखाया गया है:
4.25 अगले अभिक्रिया में ऐलुमिनियम (Al) परमाणु के हाइब्रिडाइजेशन में कोई परिवर्तन (यदि हो तो) बताइए।
$\mathrm{AlCl_3}+\mathrm{Cl}^{-} \rightarrow \mathrm{AlCl_4}^{-}$
उत्तर दिखाएं
उत्तर
$AlCl_4^{-}$ के निर्माण के लिए, खाली $3 p_z$ ऑर्बिटल भी शामिल हो जाता है और हाइब्रिडाइजेशन $s p^{2}$ से $s p^{3}$ में परिवर्तित हो जाता है। इसके परिणामस्वरूप, आकृति चतुष्फलकीय बन जाती है।

4.26 निम्नलिखित अभिक्रिया के परिणामस्वरूप $\mathrm{B}$ और $\mathrm{N}$ परमाणु के हाइब्रिडाइजेशन में कोई परिवर्तन होता है या नहीं?
$\mathrm{BF_3}+\mathrm{NH_3} \rightarrow \mathrm{F_3} \mathrm{B} - \mathrm{NH_3}$
उत्तर दिखाएं
उत्तर
$\mathrm{BF}_3$ में, $\mathrm{~B}$ $s p^2$ हाइब्रिडिज़ किया गया है और $\mathrm{NH}_3$ में, $\mathrm{~N}$ $s p^3$ हाइब्रिडिज़ किया गया है। अभिक्रिया के बाद, $B$ के हाइब्रिडाइजेशन $s p^3$ में परिवर्तित हो जाता है लेकिन $N$ के हाइब्रिडाइजेशन में कोई परिवर्तन नहीं होता।
4.27 $\mathrm{C_2} \mathrm{H_4}$ और $\mathrm{C_2} \mathrm{H_2}$ अणुओं में कार्बन परमाणुओं के बीच डबल बॉन्ड और ट्रिपल बॉन्ड के निर्माण को दिखाने वाले चित्र बनाइए।
उत्तर दिखाएं
उत्तर
$ C_2 H_4$ :
ईथीन अणु के निर्माण में, एक कार्बन परमाणु के $s p^2$ हाइब्रिड ऑर्बिटल दूसरे कार्बन परमाणु के $s p^2$ हाइब्रिड ऑर्बिटल के साथ अक्षीय अधिरोपण करते हैं ताकि $\mathrm{C}-\mathrm{C}$ सिग्मा बॉन्ड बन जाए। जबकि प्रत्येक कार्बन परमाणु के अन्य दो $s p^2$ हाइब्रिड ऑर्बिटल दो हाइड्रोजन परमाणुओं के साथ $s p^2-s$ सिग्मा बॉन्ड बनाने के लिए उपयोग किए जाते हैं। एक कार्बन परमाणु के अनुहाइब्रिडिज़ ऑर्बिटल $\left(2 p_x\right.$ या $2 p_y$ ) दूसरे कार्बन परमाणु के समान ऑर्बिटल के साथ ओर्थोगोनल अधिरोपण करते हैं ताकि एक कमजोर $\pi$ बॉन्ड बन जाए, जो कार्बन और हाइड्रोजन परमाणुओं के तल के ऊपर और नीचे वितरित दो समान इलेक्ट्रॉन बादलों से बना होता है।

$ C_2 H_2$ :
एथिन मॉलेक्यूल के निर्माण में, दोनों कार्बन परमाणु $s p$-हाइब्रिडीकरण करते हैं जिनके दो अहाइब्रिड ऑर्बिटल होते हैं अर्थात, $2 p_y$ और $2 p_{\mathrm{x}}$।
एक कार्बन परमाणु के एक $s p$ हाइब्रिड ऑर्बिटल दूसरे कार्बन परमाणु के $s p$ हाइब्रिड ऑर्बिटल के अक्षीय अधिच्छेदन से $\mathrm{C}-\mathrm{C}$ सिग्मा बंध बनता है, जबकि प्रत्येक कार्बन परमाणु के अन्य हाइब्रिड ऑर्बिटल अपने अपने हाइड्रोजन परमाणु के आंशिक भरे $s$ ऑर्बिटल के अक्षीय अधिच्छेदन से $\sigma$ बंध बनाते हैं। दोनों कार्बन परमाणुओं के दो अहाइब्रिड $p$ ऑर्बिटल एक दूसरे के ओर ओर ओर अधिच्छेदन करके कार्बन परमाणुओं के बीच दो $\pi$ बंध बनाते हैं। इस प्रकार दोनों कार्बन परमाणुओं के बीच त्रिबंध एक सिग्मा और दो पाई बंधों से बना होता है जैसा कि चित्र में दिखाया गया है।

4.28 निम्नलिखित अणुओं में सिग्मा और पाई बंधों की कुल संख्या क्या है?
(a) $\mathrm{C_2} \mathrm{H_2}$ (b) $\mathrm{C_2} \mathrm{H_4}$
उत्तर दिखाएं
Answer
(a) $\mathrm{C_2} \mathrm{H_2}$
एक कार्बन परमाणु के एक $s p$ हाइब्रिड ऑर्बिटल दूसरे कार्बन परमाणु के $s p$ हाइब्रिड ऑर्बिटल के अक्षीय अधिच्छेदन से $\mathrm{C}-\mathrm{C}$ सिग्मा बंध बनता है, जबकि प्रत्येक कार्बन परमाणु के अन्य हाइब्रिड ऑर्बिटल अपने अपने हाइड्रोजन परमाणु के आंशिक भरे $s$ ऑर्बिटल के अक्षीय अधिच्छेदन से $\sigma$ बंध बनाते हैं। दोनों कार्बन परमाणुओं के दो अहाइब्रिड $p$ ऑर्बिटल एक दूसरे के ओर ओर ओर अधिच्छेदन करके कार्बन परमाणुओं के बीच दो $\pi$ बंध बनाते हैं। इस प्रकार दोनों कार्बन परमाणुओं के बीच त्रिबंध एक सिग्मा और दो पाई बंधों से बना होता है जैसा कि चित्र में दिखाया गया है।

इसलिए, $C_2 H_2$ में तीन सिग्मा और दो पाई बंध होते हैं।
(b) $\mathrm{C_2} \mathrm{H_4}$
इसलिए, एथीन अणु में, कार्बन-कार्बन बंध एक $s p^2-s p^2$ सिग्मा बंध और एक पाई ( $\pi$ ) बंध से बना होता है जो $p$ कक्षकों से बनता है जो हाइब्रिडाइजेशन में नहीं उपयोग किए जाते हैं और अणु के तल के लंबवत होते हैं; बंध लंबाई 134 pm होती है। एक $\mathrm{C}-\mathrm{H}$ बंध $s p^2-s$ सिग्मा बंध होता है जिसकी बंध लंबाई 108 pm होती है। $\mathrm{H}-\mathrm{C}-\mathrm{H}$ बंध कोण $117.6^{\circ}$ होता है जबकि $\mathrm{H}-\mathrm{C}-\mathrm{C}$ कोण $121^{\circ}$ होता है। एथीन में सिग्मा और पाई बंध के निर्माण को चित्र 4.15 में दिखाया गया है।

इसलिए, $C_2 H_4$ में पांच सिग्मा बंध और दो पाई बंध होते हैं।
4.29 $x$-अक्ष को अंतराणु अक्ष के रूप में लें तो निम्नलिखित में से कौन एक सिग्मा बंध बनाएगा और क्यों नहीं बनाएगा? (a) $1 \mathrm{~s}$ और $1 \mathrm{~s}$ (b) $1 \mathrm{~s}$ और $2 p_{\mathrm{x}}$; (c) $2 p_{\mathrm{y}}$ और $2 p_{\mathrm{y}}$ (d) $1 s$ और $2 s$.
उत्तर दिखाएं
उत्तर
$2 p_y$ और $2 p_y$ कक्षक एक सिग्मा बंध बनाएंगे। $x$-अक्ष को अंतराणु अक्ष के रूप में लें तो $2 p_y$ और $2 p_y$ कक्षक लंबवत ओवरलैप करेंगे, जिसके कारण एक पाई ( $\pi$ ) बंध बनेगा।
4.30 निम्नलिखित अणुओं में कार्बन परमाणु के द्वारा किस प्रकार के हाइब्रिड कक्षक का उपयोग किया जाता है?
(a) $\mathrm{CH_3}-\mathrm{CH_3}$;
(b) $\mathrm{CH_3}-\mathrm{CH}=\mathrm{CH_2}$;
(c) $\mathrm{CH_3}-\mathrm{CH_2}-\mathrm{OH}$;
(d) $\mathrm{CH_3}-\mathrm{CHO}$;
(e) $\mathrm{CH_3} \mathrm{COOH}$;
उत्तर दिखाएं
उत्तर
(a) $\mathrm{CH}_3-\mathrm{CH}_3$
दोनों कार्बन परमाणु $s p^3$ हाइब्रिडिज किए गए हैं।
(b) $\mathrm{CH}_3-\mathrm{CH}=\mathrm{CH}_2$
मेथिल समूह के कार्बन परमाणु $s p^3$ हाइब्रिडिज किए गए हैं जबकि अन्य दो कार्बन परमाणु $s p^2$ हाइब्रिडिज किए गए हैं।
(c) $\mathrm{CH}_3-\mathrm{CH}_2-\mathrm{OH}$
दोनों कार्बन परमाणु $s p^3$ हाइब्रिडिज किए गए हैं।
(d) $\mathrm{CH}_3-\mathrm{CHO}$
कार्बन परमाणु के मेथिल समूह के $\mathrm s{p}^3$ हाइब्रिडाइज़्ड होते हैं जबकि दूसरे कार्बन परमाणु $\mathrm s{p}^2$ हाइब्रिडाइज़्ड होते हैं।
(e) $\mathrm{CH}_3 \mathrm{COOH}$
कार्बन परमाणु के मेथिल समूह के $\mathrm s{p}^3$ हाइब्रिडाइज़्ड होते हैं जबकि दूसरे कार्बन परमाणु $\mathrm s{p}^2$ हाइब्रिडाइज़्ड होते हैं।
4.31 आपको बॉंड युग्म और अकेले युग्म इलेक्ट्रॉन के बारे में क्या समझ आता है? प्रत्येक प्रकार के एक उदाहरण देकर दर्शाइए।
उत्तर दिखाएं
Answer
जब दो परमाणु अपने एक या अधिक संयोजक इलेक्ट्रॉन साझा करके बर्फ बनाते हैं, तो उनके बीच एक सहसंयोजक बंध बनता है।
बर्फ बनाने वाले परमाणुओं के बीच साझा इलेक्ट्रॉन युग्म बॉंड युग्म कहलाते हैं। सभी संयोजक इलेक्ट्रॉन बंधन में भाग ले सकते हैं। बंधन में भाग न लेने वाले इलेक्ट्रॉन युग्म अकेले युग्म इलेक्ट्रॉन कहलाते हैं।
उदाहरण के लिए, $C_2 H_6$ (एथेन) में सात बॉंड युग्म होते हैं लेकिन कोई अकेले युग्म नहीं होता।
$\mathrm{\boldsymbol{{H-}\overset{\overset{\huge{H}}{|}}{\underset{\underset{\huge{H}}{|}}{C}}-\overset{\overset{\huge{H}}{|}}{\undersटे{\underset{\underset{\huge{H}}{|}}{{C}}}{-H}}}$
$H_2 O$ में दो बॉंड युग्म और केंद्रीय परमाणु (ऑक्सीजन) पर दो अकेले युग्म होते हैं।

4.32 सिग्मा बंध और पाई बंध के बीच अंतर क्या है?
उत्तर दिखाएं
Answer
सिग्मा बंध और पाई बंध के बीच अंतर निम्नलिखित हैं :
| सिग्मा ( $ \sigma $) बंध | पाई $(\pi)$ बंध |
|---|---|
| (a) इसका निर्माण ऑर्बिटल के सिरे से सिरे ओवरलैप के द्वारा होता है। | इसका निर्माण ऑर्बिटल के लेटरल ओवरलैप के द्वारा होता है। |
| (b) ओवरलैप करने वाले ऑर्बिटल s -s, s- $p$, या p - $p$ हो सकते हैं। |
इन बंधों का निर्माण केवल $p - p$ ऑर्बिटल के ओवरलैप के द्वारा होता है। |
| ((c) यह एक मजबूत बंध है। | यह एक कमजोर बंध है। |
| (d) इलेक्ट्रॉन क्लाउड दो नाभिकों को जोड़ने वाली रेखा के सापेक्ष सममित होता है। | इलेक्ट्रॉन क्लाउड सममित नहीं होता। |
| (e) इसमें एक इलेक्ट्रॉन क्लाउड होता है, जो दो नाभिकों के अक्ष के सापेक्ष सममित होता है। |
दो इलेक्ट्रॉन क्लाउड अणुओं के तल के ऊपर और नीचे विद्यमान होते हैं। |
| (फ) सिग्मा बॉन्ड के बारे में मुक्त घूर्णन संभव है। | पाई बॉन्ड के मामले में घूर्णन सीमित होता है। |
4.33 मूल्य बंधन सिद्धांत के आधार पर $\mathrm{H_2}$ अणु के निर्माण की व्याख्या कीजिए।
उत्तर दिखाएं
उत्तर
मान लीजिए कि दो हाइड्रोजन परमाणु ( $A$ और $B$ ) जिनके नाभिक $(N_A$ और $N_B)$ और इलेक्ट्रॉन $(e_A$ और $e_B)$ हैं, एक रासायनिक प्रतिक्रिया में भाग लेकर हाइड्रोजन अणु के निर्माण करते हैं।
जब $A$ और $B$ बहुत दूर पर होते हैं, तो उनके बीच कोई प्रतिक्रिया नहीं होती। जब वे एक दूसरे के निकट आना शुरू करते हैं, तो आकर्षण और विपरीत बल शुरू हो जाते हैं।
आकर्षण बल निम्नलिखित विस्थापनों में उत्पन्न होता है:
(a) एक परमाणु के नाभिक और उसके इलेक्ट्रॉन के बीच, अर्थात $N_A-e_A$ और $N_B-e_B$।
(b) एक परमाणु के नाभिक और दूसरे परमाणु के इलेकट्रॉन के बीच, अर्थात $N_A-e_B$ और $N_B-e_A$।
विपरीत बल निम्नलिखित विस्थापनों में उत्पन्न होता है:
(a) दो परमाणुओं के इलेक्ट्रॉन के बीच, अर्थात $e_A-e_B$।
(b) दो परमाणुओं के नाभिक के बीच, अर्थात $N_A-N_B$।
आकर्षण बल दो परमाणुओं को एक दूसरे के निकट लाता है, जबकि विपरीत बल उन्हें अलग करने की कोशिश करता है।

नए आकर्षण बल के मापदंड के मान नए विपरीत बल से अधिक होता है। इस कारण दो परमाणु एक दूसरे के निकट आ जाते हैं और संभावित ऊर्जा कम हो जाती है। अंततः एक अवस्था पहुंच जाती है जहां आकर्षण बल का नेट बल विपरीत बल के बराबर हो जाता है और तंत्र के ऊर्जा कम से कम हो जाती है। इस अवस्था में दो हाइड्रोजन परमाणु एक दूसरे के साथ बंध जाते हैं और एक स्थायी अणु के रूप में बन जाते हैं जिसकी बंधन लंबाई 74 पिकोमीटर होती है। इससे डाइहाइड्रोजन अणु के निर्माण के लिए जाता है।
4.34 परमाणु कक्षकों के रूपांतरण के लिए आवश्यक महत्वपूर्ण शर्तों को लिखिए जो अणु कक्षक बनाने के लिए होती हैं।
उत्तर दिखाएं
उत्तर
अणु कक्षक बनाने के लिए परमाणु कक्षकों के निम्नलिखित शर्तों को संतुष्ट करना आवश्यक है:
-
संयोजन करने वाले परमाणु कक्षकों में एक समान या लगभग समान ऊर्जा होनी चाहिए। इसका अर्थ है कि $1 s$ कक्षक $1 s$ कक्षक के साथ संयोजन कर सकता है लेकिन $2 s$ कक्षक के साथ नहीं कर सकता क्योंकि $2 s$ कक्षक की ऊर्जा $1 s$ कक्षक की ऊर्जा से बहुत अधिक होती है। यह तभी सत्य नहीं होता जब परमाणु बहुत अलग हों।
-
संयोजन करने वाले परमाणु कक्षक अणु अक्ष के संबंध में समान सममिति रखना चाहिए। परंपरागत रूप से z-अक्ष को अणु अक्ष के रूप में लिया जाता है। यह ध्यान देने योग्य है कि ऊर्जा में समान या लगभग समान वाले परमाणु कक्षक यदि वे समान सममिति नहीं रखते हैं तो संयोजन नहीं करेंगे। उदाहरण के लिए, एक परमाणु के $2 p_z$ कक्षक दूसरे परमाणु के $2 p_z$ कक्षक के साथ संयोजन कर सकते हैं लेकिन $2 p_x$ या $2 p_y$ कक्षक के साथ नहीं कर सकते हैं क्योंकि उनकी अलग-अलग सममिति होती है।
$\mathrm{O}_2$ अणु के इलेक्ट्रॉनिक विन्यास से स्पष्ट है कि बंधन अणु ऑर्बिटल में दस इलेक्ट्रॉन तथा विरोधी बंधन अणु ऑर्बिटल में छह इलेक्ट्रॉन उपस्थित हैं। इसलिए, इसका बंधन क्रम है
बंधन क्रम $=\dfrac{1}{2}\left[\mathrm{~N}{\mathrm{b}}-\mathrm{N}{\mathrm{a}}\right]=\dfrac{1}{2}[10-6]=2$
उसी तरह, $O_2^{+}$ के इलेक्ट्रॉनिक विन्यास को इस प्रकार लिखा जा सकता है :
$\begin{aligned} & \mathrm{O}_2^{+}:(\sigma 1 s)^2\left(\sigma^* 1 s\right)^2(\sigma 2 s)^2(\sigma * 2 s)^2\left(\sigma 2 \mathrm{p}_z\right)^2 \left(\pi 2 p_x^2=\pi 2 p_y^2\right)\left(\pi^* 2 p_x^1=\pi^* 2 p_y^1\right)\end{aligned}$
$N_b=10$
$N_a=5$
$O_2^{+}$ का बंधन क्रम $=\dfrac{1}{2}(10-5)$
$ \hspace{3.2cm}=2.5$
$O_2^{-}$ आयन के इलेक्ट्रॉनिक विन्यास इस प्रकार होगा :
$\begin{aligned} & \mathrm{O}_2^{-}:(\sigma 1 s)^2\left(\sigma^* 1 s\right)^2(\sigma 2 s)^2(\sigma * 2 s)^2\left(\sigma 2 \mathrm{p}_z\right)^2 \left(\pi 2 p_x^2=\pi 2 p_y^2\right)\left(\pi^* 2 p_x^2=\pi^* 2 p_y^1\right)\end{aligned}$
$N_b=10$
$N_a=7$
$O_2^{-}$ का बंधन क्रम $=\dfrac{1}{2}(10-7)$
$ \hspace{3.2cm} =1.5$
$O_2^{2-}$ आयन के इलेक्ट्रॉनिक विन्यास इस प्रकार होगा :
$\begin{aligned} & \mathrm{O}_2^{2-}:(\sigma 1 s)^2\left(\sigma^* 1 s\right)^2(\sigma 2 s)^2(\sigma * 2 s)^2\left(\sigma 2 \mathrm{p}_z\right)^2 \left(\pi 2 p_x^2=\pi 2 p_y^2\right)\left(\pi^* 2 p_x^2=\pi^* 2 p_y^2\right)\end{aligned}$
$N_b=10$
$N_a=8$
$O_2^{2-}$ का बंधन क्रम $=\dfrac{1}{2}(10-8)$
$ \hspace{3.4cm} =1$
बंधन वियोजन ऊर्जा बंधन क्रम के सीधे अनुपात में होती है। अतः बंधन क्रम जितना अधिक होगा, उतनी अधिक स्थायित्व होगा। इस आधार पर स्थायित्व का क्रम $ O_2^{+} > O_2 > O_2^{-} > O_2^{2-} $ होता है।
4.37 अणु ऑर्बिटल को प्रकट करने में एक धन चिह्न और एक ऋण चिह्न के महत्व को लिखिए।
उत्तर दिखाएं
उत्तर
अणु ऑर्बिटल को तरंग फलन द्वारा प्रकट किया जाता है। एक ऑर्बिटल में धन चिह्न एक धनात्मक तरंग फलन को दर्शाता है जबकि एक ऑर्बिटल में ऋण चिह्न एक ऋणात्मक तरंग फलन को दर्शाता है।
4.38 $\mathrm{PCl_5}$ के मामले में हाइब्रिडाइज़ेशन का वर्णन करें। अक्षीय बंधन तुलनात्मक रूप से समतलीय बंधन से लंबे क्यों होते हैं?
उत्तर दिखाएं
उत्तर
फॉस्फोरस $(Z=15)$ के आधार अवस्था और उत्तेजित अवस्था के बाहरी इलेक्ट्रॉनिक विन्यास नीचे दिए गए हैं।

अब पांच ऑर्बिटल (अर्थात, एक s, तीन p और एक d ऑर्बिटल) हाइब्रिडाइज़ेशन के लिए उपलब्ध हैं जो पांच $s p^3 d$ हाइब्रिड ऑर्बिटल के सेट का निर्माण करते हैं जो त्रिकोणीय बिपिरामिड के पांच कोनों की ओर दिशात्मक होते हैं।

ध्यान दें कि त्रिकोणीय बिपिरामिड ज्यामिति में सभी बंधन कोण समान नहीं होते हैं। $\mathrm{PCl}_5$ में फॉस्फोरस के पांच $s p^3 d$ ऑर्बिटल ब्रोमीन अणुओं के एकल उपस्थित ऑर्बिटल के साथ अधिक बंधन बनाते हैं जो पांच $\mathrm{P}-\mathrm{Cl}$ सिग्मा बंधन का निर्माण करते हैं।
तीन $\mathrm{P}-\mathrm{Cl}$ बंधन एक समतल में होते हैं और एक दूसरे से $120^{\circ}$ के कोण बनाते हैं; इन बंधन को समतलीय बंधन कहा जाता है।
शेष दो $\mathrm{P}-\mathrm{Cl}$ बंधन-एक ऊपर और एक नीचे समतलीय समतल में होते हैं, जो समतल से $90^{\circ}$ के कोण बनाते हैं। इन बंधन को अक्षीय बंधन कहा जाता है।
जैसे कि अक्षीय बंधन युग्म समतलीय बंधन युग्म से अधिक प्रतिकर्षण अनुभव करते हैं, इसलिए अक्षीय बंधन थोड़े लंबे और अतिरिक्त रूप से कम शक्तिशाली होते हैं; जो $\mathrm{PCl}_5$ अणु के अधिक प्रतिक्रियाशील होने के कारण होता है।
4.39 हाइड्रोजन बंध को परिभाषित करें। यह वैन डर वाल्स बलों से कमजोर या मजबूत होता है?
उत्तर दिखाएं
उत्तर
हाइड्रोजन बंध एक आकर्षण बल होता है जो एक अणु के एक विद्युत ऋणात्मक परमाणु के संगत हाइड्रोजन और दूसरे अणु के विद्युत ऋणात्मक परमाणु के बीच कार्य करता है (यह एक ही प्रकार के अणु हो सकते हैं)।
कार्बन और अन्य परमाणुओं के बीच विभिन्न विद्युत ऋणात्मकता के कारण, हाइड्रोजन और विद्युत ऋणात्मक परमाणु के बीच बने बंधन युग्म बहुत दूर तक विस्थापित हो जाते हैं। इस प्रकार हाइड्रोजन परमाणु अन्य परमाणु के सापेक्ष विद्युत धनात्मक बन जाता है और धनावेश ले लेता है।
$\mathrm{H}^{\delta+}-\mathrm{X}^{\delta-}—\mathrm{H}^{\delta+}-\mathrm{X}^{\delta-}—\mathrm{H}^{\delta+}-\mathrm{X}^{\delta-}$
हाइड्रोजन बंधन के मात्रा यौगिक के भौतिक अवस्था पर निर्भर करती है। यह ठोस अवस्था में अधिकतम और गैस अवस्था में न्यूनतम होती है। इसलिए, हाइड्रोजन बंधन यौगिकों के संरचना और गुणों पर मजबूत प्रभाव डालते हैं।
हाइड्रोजन बंधन के दो प्रकार होते हैं:
(1) अंतर-अणुक हाइड्रोजन बंधन : यह एक ही या अलग-अलग यौगिक के दो अलग अणुओं के बीच बनता है। उदाहरण के लिए, HF अणु, अल्कोहल या पानी के अणुओं में हाइड्रोजन बंधन होता है, आदि।
(2) अंतर्मुखी हाइड्रोजन बंधन : यह उस स्थिति में बनता है जब हाइड्रोजन परमाणु एक ही अणु में दो उच्च विद्युत ऋणात्मक ( $\mathrm{F}, \mathrm{O}, \mathrm{N}$ ) परमाणुओं के बीच हो। उदाहरण के लिए, o-नाइट्रोफेनॉल में हाइड्रोजन दो ऑक्सीजन परमाणुओं के बीच होता है।

हाइड्रोजन बंधन वैन डर वॉल्स बल से ज्यादा मजबूत होते हैं क्योंकि हाइड्रोजन बंधन एक अत्यधिक रूप में द्विध्रुव-द्विध्रुव संपर्क के रूप में देखे जाते हैं।
4.40 बंध क्रम के शब्द का क्या अर्थ है? $\mathrm{N_2}, \mathrm{O_2}, \mathrm{O_2}^{+}$ और $\mathrm{O_2}^{-}$ के बंध क्रम की गणना करें।
उत्तर दिखाएं
उत्तर
बंध क्रम को एक अणु में बंधन और विरोधी बंधन कक्षकों में उपस्थित इलेक्ट्रॉनों की संख्या के अंतर के आधा के रूप में परिभाषित किया जाता है।
यदि $N_a$ विरोधी बंधन कक्षक में उपस्थित इलेक्ट्रॉनों की संख्या है, तो $N_b$ बंधन कक्षक में उपस्थित इलेक्ट्रॉनों की संख्या है।
बंध क्रम $=\dfrac{1}{2}(N_b-N_a)$
यदि $N_b>N_a$, तो अणु स्थायी माना जाता है। हालांकि, यदि $N_b \leq N_a$, तो अणु अस्थायी माना जाता है।
बॉन्ड के कोर्ड के $N_2$ की गणना इसके इलेक्ट्रॉनिक विन्यास से की जा सकती है:
$\begin{aligned} & \mathrm{O}_2:(\sigma 1 s)^2\left(\sigma^* 1 s\right)^2(\sigma 2 s)^2(\sigma * 2 s)^2\left(\sigma 2 \mathrm{p}_z\right)^2 \left(\pi 2 p_x^2=\pi 2 p_y^2\right)\end{aligned}$
बंधन इलेक्ट्रॉन की संख्या, $N_b=10$
विरोधी बंधन इलेक्ट्रॉन की संख्या, $N_a=4$
नाइट्रोजन अणु के बॉन्ड कोर्ड $=\dfrac{1}{2}(10-4)$
$ \hspace{5.7cm}=3$
डाइऑक्सीजन अणु में 16 इलेक्ट्रॉन होते हैं, प्रत्येक ऑक्सीजन परमाणु से 8 इलेक्ट्रॉन। ऑक्सीजन अणु के इलेक्ट्रॉनिक विन्यास को इस प्रकार लिखा जा सकता है :
$\begin{aligned} & \mathrm{O}_2:(\sigma 1 s)^2\left(\sigma^* 1 s\right)^2(\sigma 2 s)^2(\sigma * 2 s)^2\left(\sigma 2 \mathrm{p}_z\right)^2 \left(\pi 2 p_x^2=\pi 2 p_y^2\right)\left(\pi^* 2 p_x^1=\pi^* 2 p_y^1\right)\end{aligned}$
$\mathrm{O}_2$ अणु के इलेक्ट्रॉनिक विन्यास से स्पष्ट है कि बंधन अणुओं में 10 इलेक्ट्रॉन तथा विरोधी बंधन अणुओं में 6 इलेक्ट्रॉन होते हैं। इसलिए इसका बॉन्ड कोर्ड है:
बॉन्ड कोर्ड $=\dfrac{1}{2}\left[\mathrm{~N}{\mathrm{b}}-\mathrm{N}{\mathrm{a}}\right]=\dfrac{1}{2}[10-6]=2$
उसी तरह, $O_2^{+}$ के इलेक्ट्रॉनिक विन्यास को इस प्रकार लिखा जा सकता है :
$\begin{aligned} & \mathrm{O}_2^{+}:(\sigma 1 s)^2\left(\sigma^* 1 s\right)^2(\sigma 2 s)^2(\sigma * 2 s)^2\left(\sigma 2 \mathrm{p}_z\right)^2 \left(\pi 2 p_x^2=\pi 2 p_y^2\right)\left(\pi^* 2 p_x^1=\pi^* 2 p_y^1\right)\end{aligned}$
$N_b=10$
$N_a=5$
$O_2^{+}$ के बॉन्ड कोर्ड $=\dfrac{1}{2}(10-5)$
$ \hspace{3.2cm}=2.5$
$O_2^{-}$ आयन के इलेक्ट्रॉनिक विन्यास इस प्रकार होगा :
$\begin{aligned} & \mathrm{O}_2^{-}:(\sigma 1 s)^2\left(\sigma^* 1 s\right)^2(\sigma 2 s)^2(\sigma * 2 s)^2\left(\sigma 2 \mathrm{p}_z\right)^2 \left(\pi 2 p_x^2=\pi 2 p_y^2\right)\left(\pi^* 2 p_x^2=\pi^* 2 p_y^1\right)\end{aligned}$
$N_b=10$
$N_a=7$
$O_2^{-}$ के बॉन्ड कोर्ड $=\dfrac{1}{2}(10-7)$
$ \hspace{3.2cm} =1.5$





