यूनिट 9 समन्वय यौगिक
समन्वय यौगिक आधुनिक अयस्क और जैव-अयस्क रसायन एवं रसायन उद्योग की गाढ़ी धारा हैं।
पिछले यूनिट में हमने सीखा कि संक्रमण धातुएँ इस तरह के अधिकांश यौगिक बनाती हैं जहाँ धातु अणु आयन या उदासीन अणुओं के साथ इलेक्ट्रॉन के साझेदारी के माध्यम से बंधे होते हैं। आधुनिक शब्दावली में ऐसे यौगिकों को समन्वय यौगिक कहा जाता है। समन्वय यौगिकों के रसायन आधुनिक अयस्क रसायन के महत्वपूर्ण और चुनौतीपूर्ण क्षेत्र हैं। रासायनिक बंधन और अणुक रचना के नए अवधारणाओं ने इन यौगिकों के जैविक प्रणालियों में महत्वपूर्ण घटक के रूप में कार्य करने के बारे में ज्ञान प्रदान किया है। क्लोरोफिल, हीमोग्लोबिन और विटामिन $\mathrm{B}_{12}$ क्रमशः मैग्नीशियम, लोहा और कोबाल्ट के समन्वय यौगिक हैं। धातु के विविध उपचार प्रक्रियाएँ, औद्योगिक उत्प्रेरक और विश्लेषणात्मक अपघटकों में समन्वय यौगिकों का उपयोग होता है। समन्वय यौगिक विद्युत चालन, कपड़ों के रंग लगाने और चिकित्सा रसायन में भी कई अनुप्रयोग भी देखे जाते हैं।
5.1 वर्नर के समन्वय यौगिकों के सिद्धांत
अल्फ्रेड वर्नर (1866-1919), एक स्विस रसायन विज्ञानी थे जिन्होंने समन्वय यौगिकों के संरचनाओं के बारे में अपने विचारों को पहले रूप से स्थापित किया। वे एक बड़ी संख्या में समन्वय यौगिकों के तैयार करने और विश्लेषण करने और उनके भौतिक और रासायनिक व्यवहार के अध्ययन के लिए सरल प्रयोगात्मक तकनीकों का उपयोग किया। वर्नर ने धातु आयन के लिए प्राथमिक मोलारत और द्वितीयक मोलारत के अवधारणा को प्रस्तावित किया। द्वितीयक यौगिक जैसे $\mathrm{CrCl_3}, \mathrm{CoCl_2}$ या $\mathrm{PdCl_2}$ के प्राथमिक मोलारत क्रमशः 3, 2 और 2 होती है। कोबाल्ट (III) क्लोराइड के एमोनिया के साथ एक श्रृंखला के यौगिकों में, यह पाया गया कि कुछ क्लोराइड आयन ठंडे पर अतिरिक्त चांदी नाइट्रेट विलयन मिलाने पर $\mathrm{AgCl}$ के रूप में अवक्षेपित हो सकते हैं, लेकिन कुछ विलयन में बच जाते हैं।
| $1 \mathrm{~mol}$ | $\mathrm{CoCl_3} \cdot 6 \mathrm{NH}_{3}$ (पीला) | देता है | $3 \mathrm{~mol} \mathrm{AgCl}$ |
|---|---|---|---|
| $1 \mathrm{~mol}$ | $\mathrm{CoCl_3} \cdot 5 \mathrm{NH_3}$ (लहसुनी) | देता है | $2 \mathrm{~mol} \mathrm{Ag} |
| $1 \mathrm{~mol}$ | $\mathrm{CoCl_3} \cdot 4 \mathrm{NH}_{3}$ (हरा) | देता है | $1 \mathrm{~mol} \mathrm{AgCl}$ |
| $1 \mathrm{~mol}$ | $\mathrm{CoCl_3} \cdot 4 \mathrm{NH}_{3}$ (बैंगनी) | देता है | $1 \mathrm{~mol} \mathrm{AgCl}$ |
इन अवलोकनों के साथ-साथ विलयन में चालकता मापन के परिणाम यदि (i) अभिक्रिया के दौरान कोबाल्ट आयन के साथ छह समूह, या क्लोराइड आयन, या अमोनिया अणु, या दोनों, बंधे रहते हैं और (ii) ये यौगिक तालिका 5.1 में दिखाए गए रूप में सूचित किए गए हैं, जहाँ वर्ग ब्रैकेट में आयतन एक एकल एंटिटी बनते हैं जो अभिक्रिया की स्थितियों के तहत अपघटित नहीं होते हैं, समझाए जा सकते हैं। वर्नर ने धातु आयन के साथ बंधे समूहों की संख्या के लिए “द्वितीयक आवेश” शब्द का प्रस्ताव रखा। इन सभी उदाहरणों में द्वितीयक आवेश छह होते हैं।
तालिका 5.1: कोबाल्ट (III) क्लोराइड-एमोनिया जटिल के रूपांतरण
| रंग | सूत्र | विलयन चालकता संगत है |
|---|---|---|
| पीला | $\left[\mathrm{Co}\left(\mathrm{NH}_3\right)_6\right]^{3+} 3 \mathrm{Cl}^{-}$ | $1: 3$ विद्युत अपघट्य |
| बौवा | $\left[\mathrm{CoCl}\left(\mathrm{NH}_3\right)_5\right]^{2+} 2 \mathrm{Cl}^{-}$ | $1: 2$ विद्युत अपघट्य |
| हरा | $\left[\mathrm{CoCl}_2\left(\mathrm{NH}_3\right)_4\right]^{+} \mathrm{Cl}^{-}$ | $1: 1$ विद्युत अपघट्य |
| बैगनी | $\left[\mathrm{CoCl}_2\left(\mathrm{NH}_3\right)_4\right]^{+} \mathrm{Cl}^{-}$ | $1: 1$ विद्युत अपघट्य |
ध्यान दें कि तालिका 5.1 में अंतिम दो यौगिकों के समान आणविक सूत्र, $\mathrm{CoCl_3} .4 \mathrm{NH_3}$ है, लेकिन भिन्न गुण हैं। ऐसे यौगिकों को आइसोमर कहा जाता है। वर्नर ने 1898 में संयोजन यौगिकों के सिद्धांत का प्रस्ताव रखा। इस सिद्धांत के मुख्य प्रतिपादन निम्नलिखित हैं:
1. संयोजन यौगिकों में धातुएं दो प्रकार के आबंधन (मूल्यांकन)-प्राथमिक और द्वितीयक दिखाई देते हैं।
2. प्राथमिक मूल्यांकन आमतौर पर आयनित होते हैं और ऋणात्मक आयनों द्वारा संतुलित होते हैं।
3. द्वितीयक आबन्धन आयनिक नहीं होते। ये उदासीन अणुओं या नकारात्मक आयनों द्वारा संतृप्त होते हैं। द्वितीयक आबन्धन के बराबर समन्वय संख्या होती है और एक धातु के लिए यह निश्चित होती है।
4. धातु के साथ द्वितीयक आबन्धन द्वारा बंधे आयन/समूह विभिन्न समन्वय संख्याओं के अनुरूप विशिष्ट अंतराल में व्यवस्थित होते हैं।
आधुनिक सूत्रों में, ऐसी अंतराल व्यवस्थाओं को समन्वय बहुफलक कहा जाता है। वर्ग ब्रैकेट में विद्यमान विशिष्टता समन्वय एंटिटी या जटिल होते हैं और वर्ग ब्रैकेट के बाहर विद्यमान आयनों को विपरीत आयन कहा जाता है।
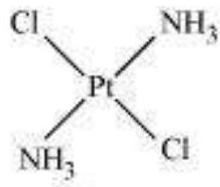
उन्होंने इसके अतिरिक्त यह भी प्रस्तावित किया कि अष्टफलकीय, चतुष्फलकीय और वर्गीय समतलीय ज्यामितीय आकृतियाँ संक्रमण धातुओं के सहसंयोजन यौगिकों में अधिक आम होती हैं। इसलिए, $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{6}\right]^{3+},\left[\mathrm{CoCl}\left(\mathrm{NH_3}\right)_5\right]^{2+}$ और $\left[\mathrm{CoCl_2}\left(\mathrm{NH_3}\right)_4\right]^+$ अष्टफलकीय एंटिटी हैं, जबकि $\left[\mathrm{Ni}(\mathrm{CO})_4\right]$ और $\left[\mathrm{PtCl_4}\right]^{2-}$ क्रमशः चतुष्फलकीय और वर्गीय समतलीय हैं।
उदाहरण 5.1
निम्नलिखित तालिका में दिए गए जलीय विलयन के आधार पर, निम्नलिखित यौगिकों में धातुओं के द्वितीय बंधन को निर्धारित करें:
| सूत्र | प्रति मोल यौगिक के अतिरिक्त $\mathrm{AgNO_3}$ के साथ अवक्षेपित $\mathrm{AgCl}$ के मोल |
|---|---|
| (i) $\mathrm{PdCl_2} \cdot 4 \mathrm{NH_3}$ | 2 |
| (ii) $\mathrm{NiCl_2} \cdot 6 \mathrm{H_2} \mathrm{O}$ | 2 |
| (iii) $\mathrm{PtCl_4} \cdot 2 \mathrm{HCl}$ | 0 |
| (iv) $\mathrm{CoCl_3} \cdot 4 \mathrm{NH_3}$ | 1 |
| (v) $\mathrm{PtCl_2} \cdot 2 \mathrm{NH_3}$ | 0 |
हल
(i) द्वितीयक 4
(ii) द्वितीयक 6
(iii) द्वितीयक 6
(iv) द्वितीयक 6
(v) द्वितीयक 4
एक डबल लवण और एक संकर यौगिक के बीच अंतर
डबल लवण और संकर यौगिक दो या अधिक स्थायी यौगिकों के समान अनुपात में संयोजन से बनते हैं। हालांकि, उनका अंतर यह है कि डबल लवण जैसे कर्नलाइट, $\mathrm{KCl} \cdot \mathrm{MgCl_2} \cdot 6 \mathrm{H_2} \mathrm{O}$, मोहर के लवण, $\mathrm{FeSO_4} \cdot\left(\mathrm{NH_4}\right)_2 \mathrm{SO_4} \cdot 6 \mathrm{H_2} \mathrm{O}$, पोटाश अलम, $\mathrm{KAl}\left(\mathrm{SO_4}\right)_2 \cdot 12 \mathrm{H_2} \mathrm{O}$ आदि पानी में घुलने पर सरल आयनों में पूरी तरह से वियोजित हो जाते हैं। लेकिन संकर आयन जैसे $\left[\mathrm{Fe}(\mathrm{CN})_6\right]^{4-}$ आयन $\mathrm{K_4}\left[\mathrm{Fe}(\mathrm{CN})_6\right]$ में $\mathrm{Fe}^{2+}$ और $\mathrm{CN}^-$ आयनों में वियोजित नहीं होते।

वर्नर 12 दिसंबर, 1866 को फ्रांस के इसलैंस प्रांत में एक छोटे समुदाय में मूल्हाउज़ में पैदा हुए थे। उनका रसायन विज्ञान का अध्ययन कारल्सरू जिला (जर्मनी) में शुरू हुआ और जुरिच (स्विटजरलैंड) में जारी रहा, जहां 1890 में उनकी डॉक्टरेट थीसिस में उन्होंने निश्चित नाइट्रोजन युक्त कार्बनिक पदार्थों के गुणों में अंतर के आधार पर आइसोमरिज्म के आधार पर समझाया। वे वैंट
हॉफ के टेट्राहेड्रल कार्बन परमाणु के सिद्धांत को अपनाया और इसे नाइट्रोजन के लिए संशोधित किया। वर्नर ने भौतिक मापनों के आधार पर जटिल यौगिकों में प्रकाश और विद्युत अंतरों को दिखाया। वास्तव में, वर्नर ने कुछ समन्वय यौगिकों में प्रकाश गतिशीलता की खोज की थी। वह 1895 में 29 वर्ष की आयु में जुरिच के टेक्निस्के होग्स्चुले में एक पूर्ण प्रोफेसर बन गए। अल्फ्रेड वर्नर एक रसायन विज्ञानी और शिक्षा विपणनकर्ता थे। उनके योगदान में समन्वय यौगिकों के सिद्धांत के विकास शामिल था। इस सिद्धांत में वर्नर ने परमाणु और अणुओं के एक दूसरे से जुड़े होने के लिए क्रांतिकारी विचार प्रस्तुत किए थे, जो केवल 1890 से 1893 तक के तीन साल के अंतराल में विकसित किए गए थे। उनके शेष जीवन के दौरान उन्होंने अपने नए विचारों को प्रमाणित करने के लिए प्रयोगात्मक समर्थन एकत्र किया। वर्नर ने 1913 में पहले स्विस रसायन विज्ञानी के रूप में परमाणु जुड़ाव और समन्वय सिद्धांत के कार्य के लिए नोबेल पुरस्कार जीता।
5.2 सहसंयोजन यौगिकों से संबंधित कुछ महत्वपूर्ण शब्दों के अर्थ
(a) सहसंयोजन एंटिटी
एक सहसंयोजन एंटिटी केंद्रीय धातु परमाणु या आयन होता है जो निश्चित संख्या में आयनों या अणुओं से बंधे होता है। उदाहरण के लिए, $\left[\mathrm{CoCl_3}\left(\mathrm{NH_3}\right)_3\right]$ एक सहसंयोजन एंटिटी है जिसमें कोबाल्ट आयन तीन अमोनिया अणुओं और तीन क्लोराइड आयनों द्वारा घिरा होता है। अन्य उदाहरण $\left[\mathrm{Ni}(\mathrm{CO})_4\right],\left[\mathrm{PtCl_2}\left(\mathrm{NH_3}\right)_2\right],\left[\mathrm{Fe}(\mathrm{CN})_6\right]^{4-},\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_6\right]^{3+}$ हैं।
**( ब ) केंद्रीय परमाणु/आयन **
एक संयोजन एंटिटी में, जिसके चारों ओर एक निश्चित ज्यामितीय व्यवस्था में एक निश्चित संख्या में आयन/समूह बंधे होते हैं, वह परमाणु/आयन केंद्रीय परमाणु या आयन कहलाता है। उदाहरण के लिए, संयोजन एंटिटी: $\left[\mathrm{NiCl_2}\left(\mathrm{H_2} \mathrm{O}\right)_4\right]$, $\left[\mathrm{CoCl}\left(\mathrm{NH_3}\right)_5\right]^{2+}$ और $\left[\mathrm{Fe}(\mathrm{CN})_6\right]^{3-}$ में केंद्रीय परमाणु/आयन क्रमशः $\mathrm{Ni}^{2+}, \mathrm{Co}^{3+}$ और $\mathrm{Fe}^{3+}$ हैं। इन केंद्रीय परमाणु/आयनों को भी लुईस अम्ल के रूप में संदर्भित किया जाता है।
( c ) लिगेंड
संयोजन एंटिटी में केंद्रीय परमाणु/आयन के साथ बंधे आयन या अणु लिगेंड कहलाते हैं। ये सरल आयन जैसे $\mathrm{Cl}^{-}$, छोटे अणु जैसे $\mathrm{H_2} \mathrm{O}$ या $\mathrm{NH_3}$, बड़े अणु जैसे $\mathrm{H_2} \mathrm{NCH_2} \mathrm{CH_2} \mathrm{NH_2}$ या $\mathrm{N}\left(\mathrm{CH_2} \mathrm{CH_2} \mathrm{NH_2}\right)_{3}$ या तकनीकी अणु जैसे प्रोटीन भी हो सकते हैं।

जब एक लिगेंड दो डोनर परमाणुओं के माध्यम से बंध सकता है, जैसे कि $\mathrm{H_2} \mathrm{NCH_2} \mathrm{CH_2} \mathrm{NH_2}$ (एथेन-1,2-डाइएमीन) या $\mathrm{C_2} \mathrm{O_4}^{2-}$ (ऑक्सलेट), तो लिगेंड को डीडेंटेट कहा जाता है। जब एक ही लिगेंड में कई डोनर परमाणु होते हैं, जैसे कि $\mathrm{N}\left(\mathrm{CH_2} \mathrm{CH_2} \mathrm{NH_2}\right)_{3}$, तो लिगेंड को पॉलीडेंटेट कहा जाता है। एथिलेनडाइएमिनटेट्राऐसीटेट आयन (EDTA ${ }^{4-}$) एक महत्वपूर्ण छह डेंटेट लिगेंड है। यह केंद्रीय धातु आयन के साथ दो नाइट्रोजन और चार ऑक्सीजन परमाणुओं के माध्यम से बंध सकता है।
जब एक डाइ- या पॉलीडेंटेट लिगेंड अपने दो या अधिक डोनर परमाणुओं का उपयोग एक ही धातु आयन के साथ एक साथ करता है, तो इसे एक चेलेट लिगेंड कहा जाता है। ऐसे लिगेंड के ऐसे लिगेंडिंग समूहों की संख्या को लिगेंड की डेंटिसिटी कहा जाता है। ऐसे यौगिक, जिन्हें चेलेट यौगिक कहा जाता है, एक अनुसमान लिगेंड वाले समान यौगिकों की तुलना में अधिक स्थायी होते हैं। जिन लिगेंड के दो अलग-अलग डोनर परमाणु होते हैं और जो यौगिक में दोनों लिगेंड में से कोई एक के रूप में बंधते हैं, उन्हें अम्बिडेंटेट लिगेंड कहा जाता है। ऐसे लिगेंड के उदाहरण $\mathrm{NO_2}^{-}$ और $\mathrm{SCN}^{-}$ आयन हैं। $\mathrm{NO_2}^{-}$ आयन केंद्रीय धातु परमाणु/आयन के साथ या तो नाइट्रोजन के माध्यम से या ऑक्सीजन के माध्यम से बंध सकता है।

इसी तरह, $\text{SCN}^–$ आयन अपने सल्फर या नाइट्रोजन परमाणु के माध्यम से संयोजन कर सकता है।
( द ) संयोजन संख्या
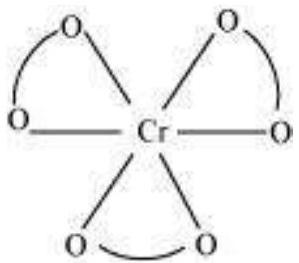
एक धातु आयन की संयोजन संख्या $(\mathrm{CN})$ एक यौगिक में धातु के संयोजन के लिए लिगेंड डोनर परमाणुओं की संख्या को कहते हैं। उदाहरण के लिए, यौगिक आयनों में, $\left[\mathrm{PtCl_6}\right]^{2-}$ और $\left[\mathrm{Ni}\left(\mathrm{NH_3}\right)_4\right]^{2+}$, $\mathrm{Pt}$ और $\mathrm{Ni}$ की संयोजन संख्या क्रमशः 6 और 4 है। इसी तरह, यौगिक आयनों में, $\left[\mathrm{Fe}\left(\mathrm{C_2} \mathrm{O_4}\right)_3\right]^{3-}$ और $\left[\mathrm{Co}(\mathrm{en})_3\right]^{3+}$, $\mathrm{Fe}$ और $\mathrm{Co}$ की संयोजन संख्या 6 है क्योंकि $\mathrm{C_2} \mathrm{O_4} ^{2-}$ और en (एथेन-1,2-डाइएमाइन) द्विपरमाणुक लिगेंड हैं।
यहां ध्यान देने वाली बात यह है कि केंद्रीय परमाणु/आयन के समन्वय संख्या केवल लिगेंड द्वारा केंद्रीय परमाणु/आयन के साथ बनाए गए सिग्मा बंधों की संख्या द्वारा निर्धारित की जाती है। पाई बंध, यदि लिगेंड और केंद्रीय परमाणु/आयन के बीच बने, तो इसके लिए गिने जाते हैं।
(e) समन्वय क्षेत्र
केंद्रीय परमाणु/आयन और इसके संलग्न लिगेंड को वर्ग ब्रैकेट में बंद किया जाता है और इसे समन्वय क्षेत्र के रूप में मिलाकर वर्णित किया जाता है। आयनन योग्य समूह ब्रैकेट के बाहर लिखे जाते हैं और इन्हें विपरीत आयन कहा जाता है। उदाहरण के लिए, जटिल $\mathrm{K_4}\left[\mathrm{Fe}(\mathrm{CN})_6\right]$ में, समन्वय क्षेत्र $\left[\mathrm{Fe}(\mathrm{CN})_6\right]^{4-}$ है और विपरीत आयन $\mathrm{K}^{+}$ है।
(f) समन्वय बहुफलक
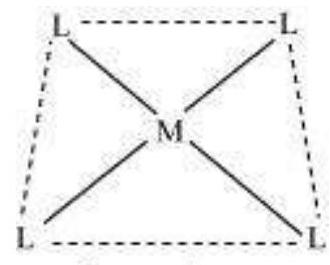
केंद्रीय परमाणु/आयन के सीधे संलग्न लिगेंड परमाणुओं के अंतरिक विन्यास केंद्रीय परमाणु के चारों ओर समन्वय बहुफलक परिभाषित करता है। सबसे आम समन्वय बहुफलक अष्टफलकीय, वर्गीय तलीय और चतुष्कोणीय होते हैं। उदाहरण के लिए, $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_6\right]^{3+}$ अष्टफलकीय होता है, $\left[\mathrm{Ni}(\mathrm{CO})_4\right]$ चतुष्कोणीय होता है और $\left[\mathrm{PtCl_4}\right]^{2-}$ वर्गीय तलीय होता है। चित्र 5.1 विभिन्न समन्वय बहुफलक के आकार दिखाता है।

चित्र 5.1: विभिन्न समन्वय बहुकेंद्रीय यौगिकों के आकार। M केंद्रीय परमाणु/आयन को निरूपित करता है और L, एक एकल दाता लिगेंड को निरूपित करता है।
(g) केंद्रीय परमाणु की ऑक्सीकरण संख्या
एक समन्वय यौगिक में केंद्रीय परमाणु की ऑक्सीकरण संख्या उस आवेश को निरूपित करती है जो उसके लिगेंडों के अपसार के साथ उसके साथ साझा किए गए इलेक्ट्रॉन युग्मों के अपसार के बाद उस परमाणु को बचे हुए आवेश को निरूपित करती है। ऑक्सीकरण संख्या को समन्वय एंटिटी के नाम के बाद रोमन संख्या के रूप में निरूपित किया जाता है। उदाहरण के लिए, $\left[\mathrm{Cu}(\mathrm{CN})_4\right]^{3-}$ में कॉपर की ऑक्सीकरण संख्या +1 है और इसे $\mathrm{Cu}(\mathrm{I})$ के रूप में लिखा जाता है।
(ह) होमोलेप्टिक एवं हेटेरोलेप्टिक संकर यौगिक
जिन यौगिकों में एक धातु केवल एक प्रकार के डोनर समूहों से बंधे होते हैं, जैसे $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_6\right]^{3+}$, उन्हें होमोलेप्टिक यौगिक कहा जाता है। जिन यौगिकों में एक धातु एक से अधिक प्रकार के डोनर समूहों से बंधे होते हैं, जैसे $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_4 \mathrm{Cl_2}\right]^+$, उन्हें हेटेरोलेप्टिक यौगिक कहा जाता है।
5.3 संकर यौगिकों के नामकरण
नामकरण संकर रसायन में महत्वपूर्ण होता है क्योंकि फॉर्मूला वर्णन एवं प्रणालीय नाम लिखने के लिए एक अमूल्य विधि की आवश्यकता होती है, विशेष रूप से जब आइसोमर के साथ काम करते हैं। संकर एंटिटी के लिए अपनाए गए फॉर्मूला एवं नाम अंतरराष्ट्रीय शुद्ध एवं अनुप्रयोग रसायन संघ (IUPAC) के सिफारिशों पर आधारित होते हैं।
5.3.1 मोनोन्यूक्लियर सहसंयोजन एंटिटी के सूत्र
एक यौगिक के सूत्र एक संक्षिप्त उपकरण है जो यौगिक के संगठन के बारे में मूल सूचना को संक्षिप्त और सुविधाजनक तरीके से प्रदान करता है। मोनोन्यूक्लियर सहसंयोजन एंटिटी में एक अकेला केंद्रीय धातु परमाणु होता है। निम्नलिखित नियम जब सूत्र लिखे जाते हैं तब लागू किए जाते हैं:
(i) केंद्रीय परमाणु पहले लिखा जाता है।
(ii) फिर लिगेंड वर्णानुक्रम में सूचीबद्ध होते हैं। लिगेंड के सूची में स्थान के निर्धारण में इसका आवेश नहीं लगता।
(iii) बहुदंती लिगेंड अपने वर्णक्रम में अक्षरानुसार भी सूचीबद्ध होते हैं। संक्षिप्त लिगेंड के मामले में, संक्षिप्त शब्द के पहले अक्षर का उपयोग लिगेंड के वर्णक्रम में स्थिति के निर्धारण के लिए किया जाता है।
(iv) समन्वयन एंटिटी के पूरे सूत्र, चाहे वह आवेशित हो या नहीं, वर्गाकार ब्रैकेट में बंद किया जाता है। जब लिगेंड बहुपदीय होते हैं, तो उनके सूत्र को बॉक्स में बंद किया जाता है। लिगेंड के संक्षिप्त रूप बॉक्स में भी बंद किए जाते हैं।
(v) समन्वयन क्षेत्र में लिगेंड और धातु के बीच कोई अंतराल नहीं होना चाहिए।
(vi) जब एक आवेशित सहसंयोजन एंटिटी के सूत्र को विपरीत आयन के सूत्र के बिना लिखना हो, तो आवेश को वर्ग ब्रैकेट के बाहर एक दाहिने अधिकतम के रूप में दर्शाया जाता है, जिसमें संख्या चिह्न के पहले होती है। उदाहरण के लिए, $\left[\mathrm{Co}(\mathrm{CN})_6\right]^{3-},\left[\mathrm{Cr}\left(\mathrm{H_2} \mathrm{O}\right)_6\right]^{3+}$, आदि।
(vii) धनायन (ओ) के आवेश को ऋणायन (ओ) के आवेश द्वारा संतुलित किया जाता है।
नोट: 2004 के IUPAC ड्राफ्ट में लिगेंड को आवेश के बिना वर्णानुक्रम में व्यवस्थित करने की सिफारिश की गई है।
5.3.2 मोनोन्यूक्लियर सहसंयोजी संयोजनों के नामकरण
सहसंयोजी संयोजनों के नामकरण के लिए जोड़ी नामकरण के सिद्धांतों का पालन किया जाता है। इसलिए, केंद्रीय परमाणु के चारों ओर घिरे समूहों को नाम में पहचाना जाता है। वे केंद्रीय परमाणु के नाम के प्रतिलिपि के रूप में सूचीबद्ध होते हैं और केंद्रीय परमाणु के साथ कोई उपयुक्त गुणक भी शामिल होता है। निम्नलिखित नियम जब सहसंयोजी संयोजनों के नामकरण के लिए उपयोग किए जाते हैं:
(i) धनात्मक और नकारात्मक आवेश वाले सहसंयोजी एककों में पहले धनात्मक आयन के नाम के लिए उपयोग किया जाता है।
(ii) लिगेंड के नाम केंद्रीय परमाणु/आयन के नाम के पहले वर्णमाला क्रम में लिखे जाते हैं। (इस प्रक्रिया को सूत्र लिखने में उलटा किया जाता है)।
(iii) ऋणावेशी लिगेंड के नाम -0 से समाप्त होते हैं, तटस्थ और धनावेशी लिगेंड के नाम अपने अपने होते हैं, बाद में जल के लिए $\mathrm{H_2} \mathrm{O}$ के लिए aqua, $\mathrm{NH_3}$ के लिए ammine, $\mathrm{CO}$ के लिए carbonyl और NO के लिए nitrosyl होता है। संकेंद्री एंटिटी के सूत्र लिखते समय, ये ब्रैकेट ( ) में बंद किए जाते हैं।
(iv) मोनो, डाई, ट्राई आदि प्रत्ययों का उपयोग संकेंद्री एंटिटी में व्यक्तिगत लिगेंड की संख्या को दर्शाने के लिए किया जाता है। जब लिगेंड के नाम में संख्यात्मक प्रत्यय शामिल होते हैं, तो bis, tris, tetrakis आदि शब्दों का उपयोग किया जाता है और इन शब्दों के संदर्भ में लिगेंड को ब्रैकेट में रखा जाता है। उदाहरण के लिए, $\left[\mathrm{NiCl_2}\left(\mathrm{PPh_3}\right)_2\right]$ को डाईक्लोरिडोबिस(ट्रिफेनिल फॉस्फाइन) निकेल(II) के रूप में नामित किया जाता है।
(v) धातु के ऑक्सीकरण अवस्था को धनायन, ऋणायन या उदासीन समन्वय एन्टिटी में रोमन संख्या के रूप में बॉक्स में दिखाया जाता है।
(vi) यदि संकेन्द्रित आयन एक धनायन है, तो धातु का नाम तत्व के नाम के समान होता है। उदाहरण के लिए, एक संकेन्द्रित धनायन में Co को कोबाल्ट कहा जाता है और $\mathrm{Pt}$ को प्लैटिनम कहा जाता है। यदि संकेन आयन एक ऋणायन है, तो धातु के नाम के अंत में -ate संज्ञा लगाई जाती है। उदाहरण के लिए, एक संकेन्द्रित ऋणायन में $\left[\mathrm{Co}(\mathrm{SCN})_4\right]^{2-}$ में Co को कोबाल्टेट कहा जाता है। कुछ धातुओं के लिए, संकेन्द्रित ऋणायन में लैटिन नाम का उपयोग किया जाता है, जैसे कि Fe के लिए फेरेट।
ध्यात करें: 2004 के IUPAC ड्राफ्ट में सुझाव दिया गया है कि ऋणावेशी लिगेंड अंत में –ido से समाप्त होंगे ताकि क्लोरो क्लोरिडो में बदल जाए, आदि।
(vii) उदासीन समन्वय अणु के नामकरण के तरीका उस समन्वय धनावेशी आयन के नामकरण के समान होता है।
निम्नलिखित उदाहरण समन्वय यौगिकों के नामकरण को दर्शाते हैं।
1. $\left[\mathrm{Cr}\left(\mathrm{NH_3}\right)_3\left(\mathrm{H_2} \mathrm{O}\right)_3\right] \mathrm{Cl_3}$ के नामकरण के रूप में: ट्रिआमिनेट्रिआक्वा क्रोमियम(III) क्लोराइड
स्पष्टीकरण: वर्ग ब्रैकेट में समन्वय आयन है, जो धनावेशी है। एमीन लिगेंड के नाम को जल लिगेंड के नाम के आगे अक्षरानुसार रखा जाता है। चूंकि यौगिक में तीन क्लोराइड आयन हैं, इसलिए समन्वय आयन पर आवेश +3 होना चाहिए (क्योंकि यौगिक विद्युत उदासीन है)। समन्वय आयन पर आवेश और लिगेंड पर आवेश के आधार पर धातु की ऑक्सीकरण संख्या की गणना की जा सकती है। इस उदाहरण में, सभी लिगेंड उदासीन अणु हैं। अतः क्रोमियम की ऑक्सीकरण संख्या समन्वय आयन पर आवेश के समान होगी, +3।
ध्यान दें: कैटियन और ऐनियन में धातु के नाम में अंतर होता है, भले ही वे समान धातु आयनों के साथ हों।
2. $\left[\mathrm{Co}\left(\mathrm{H_2} \mathrm{NCH_2} \mathrm{CH_2} \mathrm{NH_2}\right)_3\right]_2\left(\mathrm{SO_4}\right)_3$ का नाम इस प्रकार होता है: ट्रिस(एथेन-1,2-डाइएमीन) कोबाल्ट(III) सल्फेट
स्पष्टीकरण: इस अणु में सल्फेट एक विपरीत ऐनियन है। चूंकि तीन सल्फेट दो जटिल कैटियन के साथ बंधन करते हैं, इसलिए प्रत्येक जटिल कैटियन पर आवेश +3 होता है। इसके अतिरिक्त, एथेन-1,2-डाइएमीन एक उदासीन अणु है, इसलिए जटिल आयन में कोबाल्ट की ऑक्सीकरण संख्या +3 होती है। याद रखें कि आयनिक यौगिक के नाम में कैटियन और ऐनियन की संख्या कभी भी दिखाई नहीं देती है।
3. $\left[\mathrm{Ag}\left(\mathrm{NH_3}\right)_2\right]\left[\mathrm{Ag}(\mathrm{CN})_2\right]$ के नाम के रूप में:
डाइएमिन सिल्वर(I) डाइसाइनाइडो अर्गेंटेट(I)
उदाहरण 5.2 निम्नलिखित संयोजन यौगिकों के सूत्र लिखिए:
(a) टेट्रा एमिन एक्वा क्लोरिडो कोबाल्ट(III) क्लोराइड
(b) पोटेशियम टेट्रा हाइड्रॉक्सिडो जिंकेट(II)
(c) पोटेशियम ट्राइऑक्सालेटो एल्यूमिनेट(III)
(d) डाइक्लोरिडो बिस(एथेन-1,2-डाइएमीन) कोबाल्ट(III)
(e) टेट्रा कार्बोनिल निकल(0)
हल
(a) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{4}\left(\mathrm{H_2} \mathrm{O}\right) \mathrm{Cl}\right] \mathrm{Cl_2}$
(b) $\mathrm{K_2}\left[\mathrm{Zn}(\mathrm{OH})_{4}\right]$
(c) $\mathrm{K_3}\left[\mathrm{Al}\left(\mathrm{C_2} \mathrm{O_4}\right)_{3}\right]$
(d) $\left[\mathrm{CoCl_2}(\mathrm{en})_{2}\right]^{+}$
(e) $\left[\mathrm{Ni}(\mathrm{CO})_{4}\right]$
उदाहरण 5.3 निम्नलिखित संकर यौगिकों के IUPAC नाम लिखिए:
(a) $\left[\mathrm{Pt}\left(\mathrm{NH_3}\right)_{2} \mathrm{Cl}\left(\mathrm{NO_2}\right)\right]$
(b) $\mathrm{K_3}\left[\mathrm{Cr}\left(\mathrm{C_2} \mathrm{O_4}\right)_{3}\right]$
(c) $\left[\mathrm{CoCl_2}(\mathrm{en})_{2}\right] \mathrm{Cl}$
(d) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{5}\left(\mathrm{CO_3}\right)\right] \mathrm{Cl}$
(e) $\mathrm{Hg}\left[\mathrm{Co}(\mathrm{SCN})_{4}\right]$
हल
(a) डाइएमिन क्लोरिडो नाइट्रिटो-N-प्लैटिनम(II)
(b) पोटैशियम ट्राइऑक्सालेटो क्रोमेट(III)
(c) डाइक्लोरिडो बिस(एथेन-1,2-डाइएमीन) कोबाल्ट(III) क्लोराइड
(d) पेंटा एमिन कार्बोनेटो कोबाल्ट(III) क्लोराइड
(e) मर्क्यूरी (I) टेट्राथायोसाइनेटो-S-कोबाल्टेट(III)
अंतर्गत प्रश्न
9.1 निम्नलिखित समन्वय यौगिकों के सूत्र लिखिए:
(i) टेट्रा एमीनी डाइक्वाकोबाल्ट (III) क्लोराइड
(ii) पोटैशियम टेट्रासाइनिडोनिकेलेट (II)
(iii) ट्रीस (एथेन-1,2-डाइएमीन) क्रोमियम (III) क्लोराइड
(iv) एमीनी ब्रोमाइडोक्लोरिनोनिट्रिटो-N-प्लाटिनेट (II)
(v) डाइक्लोरिडोबिस (एथेन-1,2-डाइएमीन) प्लैटिनम (IV) नाइट्रेट
(vi) आयरन (III) हेक्सासाइनिडोफेरेट (II)
उत्तर दिखाएं
उत्तर
(i) $[\mathrm{Co}\mathrm{(H_2O)_2}\mathrm{(NH_3)_4}]\mathrm{Cl_3}$
(ii) $\mathrm{K_2}\left[\mathrm{Ni}(\mathrm{CN})_{4}\right]$
(iii) $\left[\mathrm{Cr}(\text {en})_{3}\right] \mathrm{Cl_3}$
(vi) $\left[\mathrm{Pt}(\mathrm{NH})_{3} \mathrm{BrCl}\left(\mathrm{NO_2}\right)\right]^-$
(v) $[\mathrm{PtCl_2}\text {(en)}_2]\mathrm{(NO_3)_2}$
(vi) $\mathrm{Fe_4}[\mathrm{Fe(CN)_6}]_3$
9.2 निम्नलिखित समन्वय यौगिकों के IUPAC नाम लिखिए:
(i) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{6}\right] \mathrm{Cl_3}$
(ii) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{5} \mathrm{Cl}\right] \mathrm{Cl_2}$
(iii) $\mathrm{K_3}\left[\mathrm{Fe}(\mathrm{CN})_{6}\right]$
(iv) $\mathrm{K_3}\left[\mathrm{Fe}\left(\mathrm{C_2} \mathrm{O_4}\right)_{3}\right]$
(v) $\mathrm{K_2}\left[\mathrm{PdCl_4}\right]$
(vi) $\left[\mathrm{Pt}\left(\mathrm{NH_3}\right)_{2} \mathrm{Cl}\left(\mathrm{NH_2} \mathrm{CH_3}\right)\right] \mathrm{Cl}$
उत्तर दिखाएं
उत्तर
(i) हेक्सा एमीनी कोबाल्ट (III) क्लोराइड
(ii) पेंटा एमीनी क्लोरिडो कोबाल्ट (III) क्लोराइड
(iii) पोटैशियम हेक्सा साइनिडो फेरेट (III)
(iv) पोटैशियम ट्राइ ऑक्सलेटो फेरेट (III)
(v) पोटैशियम टेट्रा क्लोरिडो पैलेडेट (II)
(vi) डाइएमीनी क्लोरिडो (मेथिल एमीन) प्लैटिनम (II) क्लोराइड
5.4 संयोजन सं复합 यौगिकों में आइसोमरिज़म
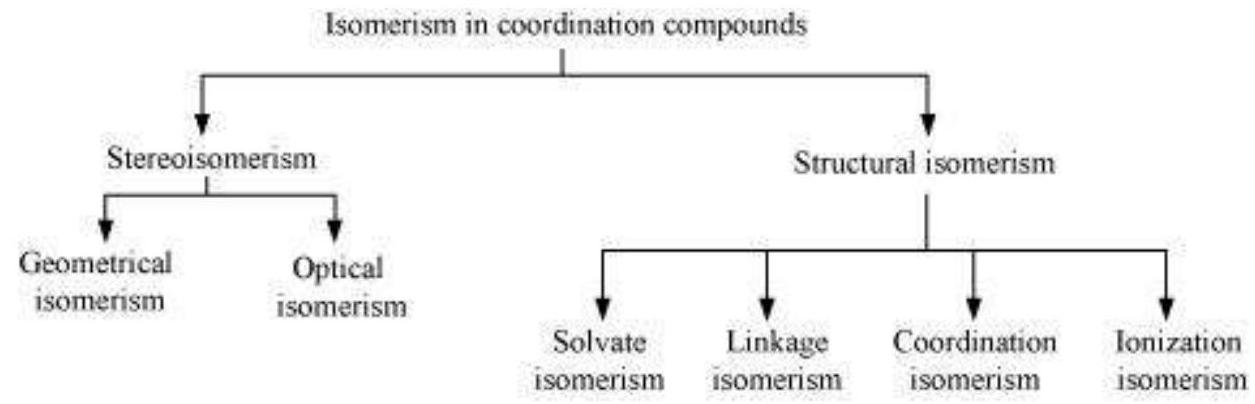
आइसोमर दो या अधिक यौगिक होते हैं जो एक ही रासायनिक सूत्र के साथ होते हैं लेकिन परमाणुओं के विन्यास में अलग होते हैं। अलग विन्यास के कारण वे एक या अधिक भौतिक या रासायनिक गुणों में अलग होते हैं। संयोजन यौगिकों में दो मुख्य प्रकार के आइसोमरिज़म जाने जाते हैं। प्रत्येक को आगे भी उप-वर्गों में विभाजित किया जा सकता है।
(a) स्थानिक आइसोमरिज़म
(i) ज्यामेट्रिक आइसोमरिज़म
(ii) प्रकाशिक आइसॉमरिज़म
(b) संरचनात्मक आइसोमरिज़म
(i) आंतरिक आइसोमरिज़म
(ii) समन्वय आइसोमरिज्म
(iii) आयनीकरण आइसोमरिज्म
(iv) विलायक आइसोमरिज्म
स्थानीय आइसोमर एक ही रासायनिक सूत्र और रासायनिक बंधन रखते हैं लेकिन उनकी अलग-अलग स्थानीय व्यवस्था होती है। संरचनात्मक आइसोमर अलग-अलग बंधन रखते हैं। इन आइसोमर के विस्तारपूर्वक विवरण नीचे दिया गया है।

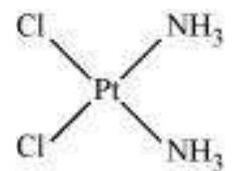
चित्र 5.2: ज्यामितीय आइसोमर (सिस और ट्रांस) $\left[\mathrm{Pt}\left(\mathrm{NH} _{3}\right) _{2} \mathrm{Cl} _{2}\right]$

चित्र 5.3: भौतिक समावयवी (सिस और ट्रांस) $\left[\mathrm{Co}\left(\mathrm{NH} _{3}\right) _{4} \mathrm{Cl} _{2}\right]^{+}$
5.4.1 भौतिक समावयवीता
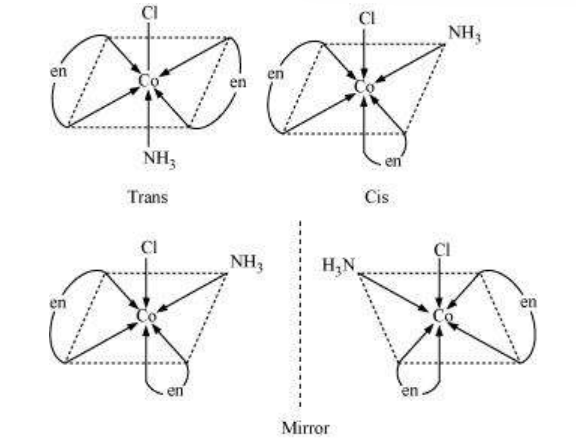
इस प्रकार के समावयवीता के उत्पन्न होने के कारण हेटरोलेपिक संकुल में लिगेंड के अलग-अलग संभावित भौतिक व्यवस्था होती है। इस व्यवहार के महत्वपूर्ण उदाहरण संयोजन संख्या 4 और 6 के संकुल में पाए जाते हैं। एक वर्गीय समतलीय संकुल के सूत्र $\left[\mathrm{MX_2} \mathrm{~L_2}\right]$ ( $\mathrm{X}$ और $\mathrm{L}$ एकल लिगेंड हैं) में, दो लिगेंड $\mathrm{X}$ एक दूसरे के समीप व्यवस्थित हो सकते हैं जिसे सिस समावयवी कहा जाता है, या एक दूसरे के विपरीत व्यवस्थित हो सकते हैं जिसे ट्रांस समावयवी कहा जाता है, जैसा कि चित्र 5.2 में दिखाया गया है।
अन्य वर्गीय तलीय संकर यौगिकों के प्रकार MABXL (जहाँ A, B, X, L एकल लिगेंड हैं) में तीन समावयवी होते हैं- दो सिस और एक ट्रांस। आप इन संरचनाओं को बनाने की कोशिश कर सकते हैं। ऐसा समावयवी टेट्राहेड्रल ज्यामिति में संभव नहीं होता, लेकिन समान व्यवहार फॉर्मूला $\left[\mathrm{MX_2} \mathrm{~L_4}\right]$ के अष्टफलकीय संकर में संभव हो सकता है, जहाँ दो लिगेंड $\mathrm{X}$ एक दूसरे के सिस या ट्रांस दिशा में रह सकते हैं (चित्र 5.3)।
इस प्रकार का समावयवी भी उत्पन्न होता है जब द्विलिगेंड लिगेंड $\mathrm{L}-\mathrm{L}$ [उदाहरण के लिए $\mathrm{NH_2} \mathrm{CH_2} \mathrm{CH_2} \mathrm{NH_2}$ (en)] फॉर्मूला $\left[\mathrm{MX_2}(\mathrm{~L}-\mathrm{L})_{2}\right]$ के संकर में उपस्थित होते हैं (चित्र 5.4)।

चित्र 5.6: $\left[\mathrm{Co}(\mathrm{en})_3\right]^{3+}$ के प्रकाशिक अक्षार (d और l)
एक अन्य प्रकार के ज्यामितीय अक्षार अष्टफलकीय सहसंयोजन एंटिटी के प्रकार $\left[\mathrm{Ma_3} \mathrm{~b_3}\right]$ जैसे $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_3\left(\mathrm{NO_2}\right)_3\right]$ में होते हैं। यदि एक ही लिगेंड के तीन डोनर परमाणु अष्टफलक के एक फेस के कोनों पर स्थित हों, तो हमें चेहरा (fac) अक्षार प्राप्त होता है। जब स्थिति अष्टफलक के मेरिडियन के चारों ओर हों, तो हमें मेरिडियन (mer) अक्षार प्राप्त होता है (चित्र 5.5)।

चित्र 5.5 $\left[\mathrm{Co}\left(\mathrm{NH}_3\right)_3\left(\mathrm{NO}_2\right)_3\right]$ के चेहेज़ (fac) और मेरिडियन (mer) इसोमर
उदाहरण 5.4 चतुष्कोणीय यौगिकों में दो अलग-अलग प्रकार के एकल दाता लिगेंड बर्तन के केंद्रीय धातु आयन के साथ संयोजित होने पर ज्यामेट्रिकल इसोमरी क्यों संभव नहीं होती?
हल
टेट्राहेड्रल संकर अणु ज्यामेट्रिक इसोमरिज्म के दर्शन नहीं करते क्योंकि केंद्रीय परमाणु के संलग्न एक-अंगुलीय लिगेंड के संबंधी स्थिति एक दूसरे से अलग नहीं होती है।
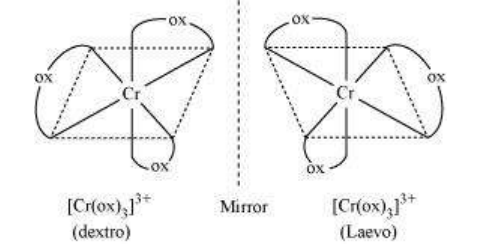
5.4.2 प्रकाश इसोमरिज्म
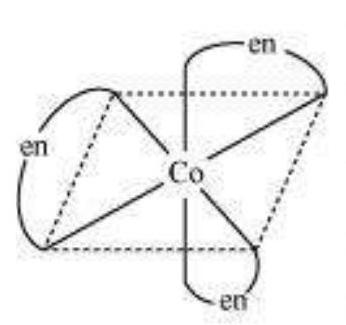
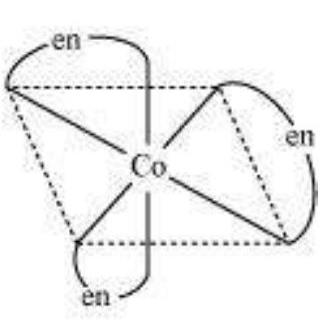
प्रकाश इसोमर एक दूसरे के दर्पण प्रतिबिम्ब होते हैं जो एक दूसरे पर अधिकृत नहीं किए जा सकते हैं। इन्हें एंटीऑपर बताया जाता है। वे अणु या आयन जो एक दूसरे के बराबर नहीं हो सकते हैं, चिरल कहलाते हैं। दो रूपों को दक्षिणावर्त (d) और बायां वर्त (l) के रूप में बताया जाता है, जो एक पोलरिमीटर में ध्रुवीकृत प्रकाश के तल को घुमाने की दिशा पर निर्भर होते हैं (d दाई ओर घुमता है, l बाई ओर घुमता है)। प्रकाश इसोमरिज्म आठ फलकीय संकर अणुओं में द्वि-अंगुलीय लिगेंड वाले संकर में आम होता है (चित्र 5.6)।
चित्र 5.6: $\left[\mathrm{Co}(\mathrm{en}) _{3}\right]^{3+}$ के प्रकाश अपचायक अक्षम ($d$ और $l$)

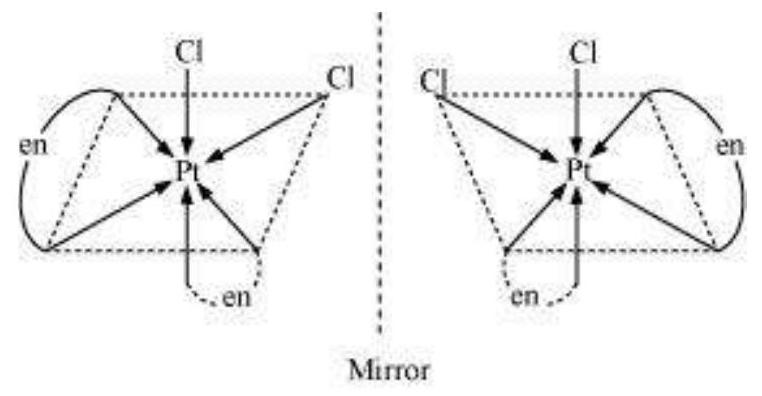
$\left[\mathrm{PtCl}_2(\mathrm{en})_2\right]^{2+}$ प्रकार के सहसंयोजन एंटिटी में केवल समानांतर अक्षम प्रकाश गतिशीलता प्रदर्शित करता है (चित्र 5.7)।
चित्र 5.7: $\left[\mathrm{Pt} \mathrm{Cl} \mathrm{Cl} _{2}(\mathrm{en}) _{2} \mathrm{I}^{2+}\right.$ के प्रकाश अपचायक अक्षम ($d$ और $l$)

उदाहरण 5.5 $\left[\mathrm{Fe}\left(\mathrm{NH}_3\right)_2(\mathrm{CN})_4\right]^{-}$ के योगिक के आकार अनुपाती समावयवी के संरचना बनाइए।
हल

उदाहरण 5.6 निम्नलिखित दो योगिकों में से कौन-सा चिर (प्रकाश गतिशील) है?
(a) cis- $\left[\mathrm{CrCl}_2(\mathrm{ox})_2\right]^{3-}$
(b) trans- $\left[\mathrm{CrCl}_2(\mathrm{ox})_2\right]^{3-}$
समाधान दो अणुओं को निम्नलिखित तरह दर्शाया गया है

(a) cis $-\left[\mathrm{CrCl}_2(\mathrm{ox})_2\right]^{3-}$
(b) trans $-\left[\mathrm{CrCl}_2(\mathrm{ox})_2\right]^{3-}$
दोनों में से, (a) cis - $\left[\mathrm{CrCl}_2(\mathrm{ox})_2\right]^{33}$ चिर (प्रकाशिक रूप से सक्रिय) है।
5.4.3 लिंकेज आइसोमरिज्म
लिंकेज आइसोमरिज्म एक संयोजन यौगिक में उपस्थित अम्बिडेंटेट लिगैंड के कारण उत्पन्न होता है। एक सरल उदाहरण तीन यौगिकों में उपस्थित थायोसाइनेट लिगैंड, $\mathrm{NCS}^{-}$, द्वारा प्रदान किया जाता है, जो नाइट्रोजन के माध्यम से बंधक बन सकता है जिससे M-NCS बनता है या सल्फर के माध्यम से बंधक बन सकता है जिससे M-SCN बनता है। जॉर्गेंसेन ने ऐसे व्यवहार की खोज की जिसमें यौगिक $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{5}\left(\mathrm{NO_2}\right)\right] \mathrm{Cl_2}$ लाल रूप में प्राप्त किया जाता है, जहां नाइट्राइट लिगैंड ऑक्सीजन के माध्यम से बंधक बनता है (-ONO), और पीले रूप में प्राप्त किया जाता है, जहां नाइट्राइट लिगैंड नाइट्रोजन के माध्यम से बंधक बनता है $\left(-\mathrm{NO_2}\right)$.
5.4.4 समन्वय आइसोमरिज्म
इस प्रकार का आइसोमरिज्म एक संकर यौगिक में उपस्थित विभिन्न धातु आयनों के संकर धनायन और ऋणायन एन्टिटीज के बीच लिगेंडों के आदान-प्रदान से उत्पन्न होता है। एक उदाहरण $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_6\right]\left[\mathrm{Cr}(\mathrm{CN})_6\right]$ है, जहाँ $\mathrm{NH_3}$ लिगेंड $\mathrm{Co}^{3+}$ के साथ बंधे होते हैं और $\mathrm{CN}^-$ लिगेंड $\mathrm{Cr}^{3+}$ के साथ बंधे होते हैं। इसके समन्वय आइसोमर $\left[\mathrm{Cr}\left(\mathrm{NH_3}\right)_6\right]\left[\mathrm{Co}(\mathrm{CN})_6\right]$ में, $\mathrm{NH_3}$ लिगेंड $\mathrm{Cr}^{3+}$ के साथ बंधे होते हैं और $\mathrm{CN}^-$ लिगेंड $\mathrm{Co}^{3+}$ के साथ बंधे होते हैं।
5.4.5 आयनन समावेशन
इस प्रकार के समावेशन तब उत्पन्न होते हैं जब एक जटिल लवण में विपरीत आयन खुद एक संभावित लिगेंड हो सकता है और एक लिगेंड को विस्थापित कर सकता है जो फिर से विपरीत आयन बन सकता है। एक उदाहरण इसके आयनन समावेशन द्वारा प्रदान किया जाता है $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_5\left(\mathrm{SO_4}\right)\right] \mathrm{Br}$ और $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_5 \mathrm{Br}\right] \mathrm{SO_4}$।
5.4.6 विलायक समावेशन
इस प्रकार के समावेशन को जब पानी एक विलायक के रूप में शामिल होता है तब ‘जल समावेशन’ के रूप में जाना जाता है। यह आयनन समावेशन के समान है। विलायक समावेशन विभिन्न होते हैं जब एक विलायक अणु धातु आयन के सीधे बंधे होते हैं या बस क्रिस्टल लेटिस में मुक्त विलायक अणु के रूप में उपलब्ध होते हैं। एक उदाहरण इसके जलीय जटिल $\left[\mathrm{Cr}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right] \mathrm{Cl_3}$ (बैंगनी) और इसके विलायक समावेशन $\left[\mathrm{Cr}\left(\mathrm{H_2} \mathrm{O}\right)_5 \mathrm{Cl}^2 \mathrm{Cl_2} \cdot \mathrm{H_2} \mathrm{O}\right].$ (ग्रे-हरा) द्वारा प्रदान किया जाता है।
अंतर्गत प्रश्न
9.3 निम्नलिखित यौगिकों द्वारा प्रदर्शित ईसोमरी के प्रकार संकेत करें और इन ईसोमरों के रूप बनाएं:
(i) $\mathrm{K}[\mathrm{Cr}\mathrm{(H_2O)_2}\mathrm{(C_2O_4)_2}]. $
(ii) $\left[\mathrm{Co}(\mathrm{en})_3\right] \mathrm{Cl_3}$
(iii) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_5\left(\mathrm{NO_2}\right)\right]\left(\mathrm{NO_3}\right)_2$
(iv) $\left[\mathrm{Pt}\left(\mathrm{NH_3}\right)\left(\mathrm{H_2} \mathrm{O}\right) \mathrm{Cl_2}\right]$
उत्तर दिखाएं
उत्तर
(i) $\mathrm{K}[\mathrm{Cr}\mathrm{(H_2O)_2}\mathrm{(C_2O_4)_2}]$ के लिए दोनों ज्यामितीय (सिस-, ट्रांस-) ईसोमर उपस्थित हो सकते हैं। सिस-ईसोमर के लिए भी प्रकाश ईसोमर उपस्थित हो सकते हैं।
ज्यामितीय ईसोमर

ट्रांस-ईसोमर अप्रकाश ईसोमर है। दूसरी ओर, सिस-ईसोमर प्रकाश ईसोमर है।

(ii) $[\mathrm{CO(en)_3}]\mathrm{Cl_3}$ के लिए दो प्रकाश ईसोमर

इस संरचना के लिए दो प्रकाश ईसोमर संभव हैं।

Other than this it can show Ionisation isomerism
(iii) $[\mathrm{Co}\mathrm{(NH_3)_5}\mathrm{(NO_2)}]\mathrm{(NO_3)_2}$
It can show linkage isomerism.

It can also show ionization isomerism.

(iv) Geometrical (cis-, trans-) isomers of $\left[\mathrm{Pt}\left(\mathrm{NH_3}\right)\left(\mathrm{H_2} \mathrm{O}\right) \mathrm{Cl_2}\right]$ can exist.

$\quad \quad $ Cis $\quad \quad \quad$ $\quad \quad \quad \quad$ $\quad \quad \quad$ Trans
9.4 दर्शाएं कि $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_5 \mathrm{Cl}\right] \mathrm{SO_4}$ और $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_5\left(\mathrm{SO_4}\right)\right] \mathrm{Cl}$ आयनीकरण आइजोमर हैं।
उत्तर दिखाएं
Answer
जब आयनीकरण आइजोमर जल में घोले जाते हैं, तो वे अलग-अलग आयन देने के लिए आयनित हो जाते हैं। इन आयन अलग-अलग रासायनिक अभिकर्मकों के साथ अलग-अलग उत्पाद देते हैं।
$ \left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{5} \mathrm{Cl}\right] \mathrm{SO_4}+\mathrm{Ba}^{2+} \longrightarrow \underset{\text{श्वेत अवक्षेप}}{\mathrm{BaSO_4} \downarrow} $
$\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{5} \mathrm{Cl}\right] \mathrm{SO_4}+\mathrm{Ag}^{+} \longrightarrow$ कोई प्रतिक्रिया नहीं
$ {\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{5} \mathrm{SO_4}\right] \mathrm{Cl}+\mathrm{Ba}^{2+} \longrightarrow \text { कोई प्रतिक्रिया नहीं }} $
$ [\mathrm{Co}(\mathrm{NH_3})_{5} \mathrm{SO_4}] \mathrm{Cl}+\mathrm{Ag}^{+} \longrightarrow \underset{\text{श्वेत अवक्षेप }}{\mathrm{AgCl} \downarrow} `
$
5.5 संयोजन यौगिकों में बंधन
वर्नर पहला व्यक्ति थे जिन्होंने संयोजन यौगिकों में बंधन के गुणों का वर्णन किया। लेकिन उनके सिद्धांत कुछ मूल प्रश्नों के उत्तर नहीं दे सकते थे, जैसे कि:
(i) क्यों केवल कुछ तत्वों के पास संयोजन यौगिक बनाने के विशिष्ट गुण होते हैं?
(ii) क्यों संयोजन यौगिकों में बंधन दिशात्मक गुण रखते हैं?
(iii) कोऑर्डिनेशन यौगिकों के विशिष्ट चुंबकीय और प्रकाश गुण क्यों होते हैं?
कोऑर्डिनेशन यौगिकों में बंधन की प्रकृति के बारे में समझ के लिए कई विधियाँ प्रस्तावित की गई हैं, जैसे कि मूल्य बंधन सिद्धांत (VBT), क्रिस्टल क्षेत्र सिद्धांत (CFT), लिगेंड क्षेत्र सिद्धांत (LFT) और अणुक कक्षा सिद्धांत (MOT)। हम इस लेख में VBT और CFT के अनुप्रयोग के आधुनिक उपायों के बारे में बात करेंगे।
सारणी 5.2: कक्षकों की संख्या और हाइब्रिडाइजेशन के प्रकार
| सहसंयोजक संख्या |
हाइब्रिडाइजेशन प्रकार |
हाइब्रिड कक्षकों के अंतरिक वितरण |
|---|---|---|
| 4 | $s p^3$ | चतुष्कोणीय |
| 4 | $d s p^2$ | वर्गीय तलीय |
| 5 | $s p^3 d$ | त्रिकोणीय बिपिरामिडल |
| 6 | $s p^3 d^2$ | अष्टफलकीय |
| 6 | $d^2 s p^3$ | अष्टफलकीय |
मूलतः एक यौगिक की ज्यामिति का अनुमान लगाया जा सकता है जिसके चुंबकीय व्यवहार के बारे में ज्ञान हो, वैलेंस बंड सिद्धांत के आधार पर।

द्विध्रुवी अष्टफलकीय यौगिक में, $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{6}\right]^{3+}$, कोबाल्ट आयन +3 ऑक्सीकरण अवस्था में होता है और इसकी इलेक्ट्रॉनिक विन्यास $3 d^{6}$ होता है। हाइब्रिडाइजेशन योजना चित्र में दिखाई गई है।
छह इलेक्ट्रॉन युग्म, प्रत्येक $\mathrm{NH_3}$ अणु से एक इलेक्ट्रॉन युग्म, छह हाइब्रिड ऑर्बिटल में बैठे होते हैं। इसलिए, यौगिक अष्टफलकीय ज्यामिति के अनुसार होता है और अपरिवर्ती (द्विध्रुवी) होता है क्योंकि अनुपार्श्व इलेक्ट्रॉन की अनुपस्थिति के कारण। इस यौगिक के निर्माण में, क्योंकि आंतरिक $d$ ऑर्बिटल (3d) का उपयोग हाइब्रिडाइजेशन में किया गया है, इसलिए यौगिक, $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{6}\right]^{3+}$ को आंतरिक ऑर्बिटल या निम्न घूर्णन या घूर्णन युग्मित यौगिक कहा जाता है। द्विध्रुवी अष्टफलकीय यौगिक, $\left[\mathrm{CoF_6}\right]^{3-}$, हाइब्रिडाइजेशन में बाहरी ऑर्बिटल $(4 d)$ का उपयोग करता है $\left(s p^{3} d^{2}\right)$. इसलिए इसे बाहरी ऑर्बिटल या उच्च घूर्णन या घूर्णन रहित यौगिक कहा जाता है। इसलिए:


तेट्राहेड्रल संकरणों में एक $\mathrm{s}$ और तीन $\mathrm{p}$ कक्षक संकरित होते हैं जिनसे चार समान कक्षक बनते हैं जो तेट्राहेड्रल व्यवस्था में व्यवस्थित होते हैं। इसका चित्रण नीचे $\left[\mathrm{NiCl_4}\right]^{2-}$ के लिए दिखाया गया है। यहाँ निकल +2 ऑक्सीकरण अवस्था में है और आयन के इलेक्ट्रॉनिक विन्यास $3 d^{8}$ है। संकरण योजना चित्र में दिखाई गई है।
प्रत्येक $\mathrm{Cl}^{-}$ आयन एक युग्म इलेक्ट्रॉन देता है। यह यौगिक प्रामाणिक चुंबकीय है क्योंकि इसमें दो अनुगमन रहित इलेक्ट्रॉन होते हैं। इसी तरह, $\left[\mathrm{Ni}(\mathrm{CO})_4\right] $ चतुष्कोणीय ज्यामिति का रूप ले लेता है लेकिन इसके चुंबकीय गुण शून्य होते हैं क्योंकि निकल शून्य ऑक्सीकरण अवस्था में होता है और इसमें कोई अनुगमन रहित इलेक्ट्रॉन नहीं होते।
वर्गीय तलीय यौगिकों में शामिल होने वाला हाइब्रिडाइजेशन $d s p^{2}$ होता है। एक उदाहरण $\left[\mathrm{Ni}(\mathrm{CN})_{4}\right]^{2-}$ है। यहाँ निकल +2 ऑक्सीकरण अवस्था में होता है और इसकी इलेक्ट्रॉनिक विन्यास $3 d^{8}$ होता है। हाइब्रिडाइजेशन योजना निम्न चित्र में दिखाई गई है:

प्रत्येक हाइब्रिडाइज़ित ऑर्बिटल को साइनाइड आयन से एक इलेक्ट्रॉन युग्म प्राप्त होता है। यह यौगिक द्विध्रुवीय चुंबकीय गुणों वाला है, जैसा कि अनुनयित इलेक्ट्रॉन की अनुपस्थिति से स्पष्ट है।
ध्यान देने योग्य है कि हाइब्रिड ऑर्बिटल वास्तव में अस्तित्व में नहीं होते। वास्तव में, हाइब्रिडीकरण प्रयोग के लिए प्रयुक्त आणविक ऑर्बिटल के तरंग समीकरण के गणितीय अनुप्रयोग है।
5.5.2 संयोजन यौगिकों के चुंबकीय गुण
कोऑर्डिनेशन यौगिकों के चुंबकीय आघूर्ण को चुंबकीय प्रतिस्थापन प्रयोग द्वारा मापा जा सकता है। इन परिणामों का उपयोग अनिर्बाध इलेक्ट्रॉनों की संख्या और इसलिए धातु यौगिकों द्वारा अपनाए गए संरचनाओं के बारे में जानकारी प्राप्त करने के लिए किया जा सकता है। पहले संक्रमण श्रेणी के धातुओं के कोऑर्डिनेशन यौगिकों के चुंबकीय डेटा के बारे में एक आवश्यक अध्ययन कुछ अटूटताओं को खोलता है। तीन इलेक्ट्रॉन तक विशिष्ट $d$ कक्षक में विद्यमान धातु आयनों के लिए, जैसे $\mathrm{Ti}^{3+}\left(d^1\right) ; \mathrm{V}^{3+}$ $\left(d^2\right) ; \operatorname{Cr}^{3+}\left(d^3\right)$; आठकार यौगिकन के लिए दो खाली $d$ कक्षक $4s$ और $4p$ कक्षकों के साथ उपलब्ध होते हैं। इन मुक्त आयनों और उनके कोऑर्डिनेशन एंटिटी के चुंबकीय व्यवहार समान होता है। जब तीन से अधिक $3d$ इलेक्ट्रॉन उपलब्ध हों, तो आठकार यौगिकन के लिए आवश्यक $3d$ कक्षक के जोड़ के लिए अपर्याप्त खाली कक्षक उपलब्ध नहीं होते (हंड के नियम के कारण)। इसलिए, $d^4\left(\mathrm{Cr}^{2+}, \mathrm{Mn}^{3+}\right), d^5\left(\mathrm{Mn}^{2+}, \mathrm{Fe}^{3+}\right), d^6\left(\mathrm{Fe}^{2+}, \mathrm{Co}^{3+}\right)$ मामलों में, एक खाली $d$ कक्षक के जोड़ केवल $3d$ इलेक्ट्रॉन के युग्मन के कारण होता है जो क्रमशः दो, एक और शून्य अनिर्बाध इलेक्ट्रॉन छोड़ता है।
चुंबकीय डेटा अधिकतम चुंबकीय युग्मन के साथ कई मामलों में सहमत हैं, विशेष रूप से $d^{6}$ आयनों वाले संकरण यौगिकों के मामले में। हालांकि, $d^{4}$ और $d^{5}$ आयनों वाले विषम वस्तुओं के साथ अटूटता हो सकती है। $\left[\mathrm{Mn}(\mathrm{CN})_6\right]^{3-}$ के दो अयुग्मित इलेक्ट्रॉनों के चुंबकीय आघूर्ण होता है जबकि $\left[\mathrm{MnCl_6}\right]^{3-}$ के चार अयुग्मित इलेक्ट्रॉनों के प्रारंभिक चुंबकीय आघूर्ण होता है। $\left[\mathrm{Fe}(\mathrm{CN})_6\right]^{3-}$ के एक अयुग्मित इलेक्ट्रॉन के चुंबकीय आघूर्ण होता है जबकि $\left[\mathrm{FeF_6}\right]^{3-}$ के पांच अयुग्मित इलेक्ट्रॉनों के प्रारंभिक चुंबकीय आघूर्ण होता है। $\left[\mathrm{CoF_6}\right]^{3-}$ चार अयुग्मित इलेक्ट्रॉनों के प्रारंभिक चुंबकीय आघूर्ण के साथ प्रारंभिक चुंबकीय होता है जबकि $\left[\mathrm{Co}\left(\mathrm{C_2} \mathrm{O_4}\right)_3\right]^{3-}$ विपरीत चुंबकीय होता है। इस दिखाई देने वाली असामान्यता को आंतरिक कक्षा और बाहरी कक्षा संकरण एंटिटी के निर्माण के आधार पर मूल्य बंधन सिद्धांत द्वारा समझाया जाता है। $\left[\mathrm{Mn}(\mathrm{CN})_6\right]^{3-},\left[\mathrm{Fe}(\mathrm{CN})_6\right]^{3-}$ और $\left[\mathrm{Co}\left(\mathrm{C_2} \mathrm{O_4}\right)_3\right]^{3-}$ आंतरिक कक्षा संकरण होते हैं जो $d^{2} s p^{3}$ हाइब्रिडाइजेशन के साथ होते हैं, पहले दो संकरण प्रारंभिक चुंबकीय होते हैं और बादवाला विपरीत चुंबकीय होता है। दूसरी ओर, $\left[\mathrm{MnCl_6}\right]^{3-},\left[\mathrm{FeF_6}\right]^{3-}$ और $\left[\mathrm{CoF_6}\right]^{3-}$ बाहरी कक्षा संकरण होते हैं जो $s p^{3} d^{2}$ हाइब्रिडाइजेशन के साथ होते हैं और चार, पांच और चार अयुग्मित इलेक्ट्रॉनों के प्रारंभिक चुंबकीय आघूर्ण के संगत होते हैं।
उदाहरण 5.7 $\left[\mathrm{MnBr}_4\right]^{2-}$ के चुंबकीय आघूर्ण (spin only) 5.9 BM है। संकुल आयन के आकार का अनुमान लगाएं?
हल
क्योंकि संकुल आयन में $\mathrm{Mn}^{2+}$ आयन के संकरण संख्या 4 है, इसलिए यह या तो चतुष्कोणीय ( $s p^3$ संकरण) हो सकता है या वर्गीय समतलीय ( $d s p^2$ संकरण) हो सकता है। लेकिन संकुल आयन के चुंबकीय आघूर्ण $5.9 \mathrm{BM}$ होने के कारण, इसका आकार चतुष्कोणीय होना चाहिए न कि वर्गीय समतलीय, क्योंकि $d$ कक्षकों में पांच असुमेवित इलेक्ट्रॉन होते हैं।
5.5.3 मूल्यांकन संयोजकता सिद्धांत की सीमाएं
वैलेंस बॉन्ड सिद्धांत, बड़े आकार में, संयोजकता यौगिकों के निर्माण, संरचना और चुंबकीय व्यवहार की व्याख्या कर सकता है, लेकिन इसके निम्नलिखित कमजोरियां हैं:
(i) इसमें कई मान्यताएं शामिल हैं।
(ii) यह चुंबकीय डेटा की मात्रात्मक व्याख्या नहीं कर सकता।
(iii) यह संयोजकता यौगिकों द्वारा प्रदर्शित रंग की व्याख्या नहीं कर सकता।
(iv) यह संयौजकता यौगिकों की ऊष्मागतिक या गतिक स्थायित्व की मात्रात्मक व्याख्या नहीं कर सकता।
(v) यह 4-संकरण यौगिकों के चतुष्फलकीय और वर्गीय तलीय संरचनाओं के बारे में सटीक विधान नहीं देता।
(vi) यह दुर्बल और मजबूत लिगेंड के बीच अंतर नहीं बताता।
5.5.4 क्रिस्टल क्षेत्र सिद्धांत
क्रिस्टल क्षेत्र सिद्धांत (CFT) एक विद्युत चालकता मॉडल है जिसमें धातु-लिगेंड बंध को विद्युत आकर्षण के कारण उत्पन्न आयनिक बंध माना जाता है। लिगेंड को ऋणात्मक आयनों के मामले में बिंदु आवेश और उदासीन अणुओं के मामले में बिंदु द्विध्रुव माना जाता है। एक अक्षीय गैसीय धातु अणु/आयन में पांच $d$ कक्षक समान ऊर्जा के होते हैं, अर्थात वे अपसमावेशित होते हैं। यह अपसमावेशितता धातु अणु/आयन के चारों ओर गोलीय सममिति वाले ऋणात्मक क्षेत्र के चारों ओर बनी रहती है। हालांकि, जब इस ऋणात्मक क्षेत्र के कारण लिगेंड (या ऋणात्मक छोर वाले द्विध्रुव अणुओं जैसे $\mathrm{NH_3}$ और $\mathrm{H_2O}$) के कारण एक यौगिक में होता है, तो यह असममिति बन जाती है और $d$ कक्षक की अपसमावेशितता दूर हो जाती है। इसके परिणामस्वरूप $d$ कक्षक के विभाजन हो जाता है। विभाजन के पैटर्न क्रिस्टल क्षेत्र की प्रकृति पर निर्भर करता है। अब हम विभिन्न क्रिस्टल क्षेत्रों में इस विभाजन को समझेंगे।
(a) ऑक्टाहेड्रल समन्वय एंटिटी में क्रिस्टल क्षेत्र विभाजन
एक ऑक्टाहेड्रल समन्वय एंटिटी में छह लिगेंड धातु परमाणु/आयन के चारों ओर घिरे होते हैं, तो धातु $d$ कक्षकों में इलेक्ट्रॉन और लिगेंड के इलेक्ट्रॉन (या नकारात्मक आवेश) के बीच प्रतिकर्षण होता है। ऐसा प्रतिकर्षण धातु $d$ कक्षक लिगेंड की दिशा के समानांतर दिशा में बर्बाद होता है जबकि लिगेंड की दिशा से दूर होता है। इसलिए, $d_{x^{2}-y^{2}}$ और $d_{z^{2}}$ कक्षक जो लिगेंड की दिशा के अक्ष के अनुदिश बर्बाद होते हैं, उनके ऊर्जा स्तर में वृद्धि होती है; और $d_{xy}, d_{yz}$ और $d_{xz}$ कक्षक जो अक्ष के बीच दिशा में होते हैं, उनके ऊर्जा स्तर गोलीय क्रिस्टल क्षेत्र में औसत ऊर्जा के संबंध में कम हो जाते हैं। इस प्रकार, लिगेंड इलेक्ट्रॉन-धातु इलेक्ट्रॉन प्रतिकर्षण के कारण $d$ कक्षकों की अप्रतिस्पर्धी अवस्था बर्बाद हो जाती है और तीन कक्षकों के निम्न ऊर्जा वाले $t_{2 \mathrm{~g}}$ सेट और दो कक्षकों के उच्च ऊर्जा वाले $e_{\mathrm{g}}$ सेट बन जाते हैं। लिगेंड के निश्चित ज्यामिति के कारण अप्रतिस्पर्धी स्तरों के विभाजन को क्रिस्टल क्षेत्र विभाजन कहा जाता है और ऊर्जा अंतर को $\Delta_{o}$ (उपसर्ग $o$ ऑक्टाहेड्रल के लिए है) (चित्र 5.8) से दर्शाया जाता है। इसलिए, दो $e_{g}$ कक्षकों की ऊर्जा (3/5) $\Delta_{\mathrm{o}}$ बढ़ जाएगी और तीन $t_{2 \xi}$ कक्षकों की ऊर जाएगी $(2 / 5) \Delta_{0}$।

चित्र 5.8: अष्टफलकीय क्रिस्टल क्षेत्र में d ऑर्बिटल के विभाजन
क्रिस्टल क्षेत्र विभाजन, $\Delta_{0}$, लिगेंड द्वारा उत्पन्न क्षेत्र और धातु आयन पर आवेश पर निर्भर करता है। कुछ लिगेंड ऐसे मजबूत क्षेत्र उत्पन्न कर सकते हैं जहां विभाजन बड़ा होता है, जबकि अन्य लिगेंड कमजोर क्षेत्र उत्पन्न करते हैं और इस कारण $d$ ऑर्बिटल में छोटा विभाजन होता है।
सामान्य रूप से, लिगेंड को उनके क्षेत्र क्षमता के बढ़ते क्रम में नीचे दिए गए क्रम में व्यवस्थित किया जा सकता है:
$$ \begin{aligned} & \mathrm{I}^{-}<\mathrm{Br}^{-}<\mathrm{SCN}^{-}<\mathrm{Cl}^{-}<\mathrm{S}^{2-}<\mathrm{F}^{-}<\mathrm{OH}^{-}<\mathrm{C_2} \mathrm{O_4}^{2-}<\mathrm{H_2} \mathrm{O}<\mathrm{NCS}^{-} \\ &\hspace{5.1cm} <\mathrm{edta}^{4-}<\mathrm{NH_3}<\text { en }<\mathrm{CN}^{-}<\mathrm{CO} \end{aligned} $$
इस क्रम को स्पेक्ट्रोकेमिकल सिरीज कहा जाता है। यह एक प्रयोग के आधार पर निर्धारित सिरीज है जो विभिन्न लिगेंड वाले यौगिकों द्वारा प्रकाश के अवशोषण के आधार पर बनाया गया है। चलो धातु आयन के $d$ कक्षकों में इलेक्ट्रॉनों की व्यवस्था करें जो अष्टफलकीय समन्वय एंटिटी में होते हैं। स्पष्ट रूप से, एकल $d$ इलेक्ट्रॉन निम्न ऊर्जा वाले $t_{2 g}$ कक्षक में बस जाता है। $d^{2}$ और $d^{3}$ समन्वय एंटिटी में, $d$ इलेक्ट्रॉन $t_{2 g}$ कक्षक में एकाकी रूप से बसते हैं, जो हंड के नियम के अनुसार होता है। $d^{4}$ आयनों के लिए, इलेक्ट्रॉन वितरण के दो संभावित पैटर्न उत्पन्न हो सकते हैं: (i) चौथा इलेक्ट्रॉन या तो $t_{2 g}$ स्तर में जा सकता है और एक विद्यमान इलेक्ट्रॉन के साथ युग्म बना सकता है, या (ii) यह युग्मन ऊर्जा के भुगतान के बजाय $e_{\mathrm{g}}$ स्तर में बस सकता है। इन दो संभावनाओं में से कौन सी घटना होती है, इसका निर्धारण क्रिस्टल क्षेत्र विभाजन, $\Delta_{\mathrm{o}}$ और युग्मन ऊर्जा, $\mathrm{P}$ ( $\mathrm{P}$ एक एकल कक्षक में इलेक्ट्रॉन युग्मन के लिए आवश्यक ऊर्जा को प्रतिनिधित करता है) के संबंधी मापदंड पर निर्भर करता है। दो संभावनाएं निम्नलिखित हैं:
(i) यदि $\Delta_{\mathrm{o}}<\mathrm{P}$, तो चौथा इलेक्ट्रॉन एक $e_{\mathrm{g}}$ कक्षक में प्रवेश करता है जिससे विन्यास $t_{2 \mathrm{~g}}^{3} e_{\mathrm{g}}^{1}$ प्राप्त होता है। ऐसे लिगेंड जिनके लिए $\Delta_{\mathrm{o}}<\mathrm{P}$ होता है, कम क्षेत्र लिगेंड कहलाते हैं और उच्च चुंबकीय यौगिक बनाते हैं।
(ii) यदि $\Delta_{\mathrm{o}}>\mathrm{P}$, तो चौथे इलेक्ट्रॉन के $t_{2 g}$ कक्षक में प्रवेश करना ऊर्जा के दृष्टि से अधिक लाभप्रद होता है जिससे विन्यास $t_{2 g}{ }^{4} e_{\mathrm{g}}{ }^{0}$ प्राप्त होता है। ऐसे लिगेंड जो इस प्रभाव को उत्पन्न करते हैं, मजबूत क्षेत्र लिगेंड कहलाते हैं और निम्न चुंबकीय यौगिक बनाते हैं।
गणना दर्शाती है कि $d^{4}$ से $d^{7}$ समन्वय एंटिटी तीव्र क्षेत्र के मामले में दुर्बल क्षेत्र के मामले की तुलना में अधिक स्थायी होते हैं।

चित्र 5.9: $d$ ऑर्बिटल विभाजन एक टेट्राहेड्रल क्रिस्टल क्षेत्र में।
(b) टेट्राहेड्रल समन्वय एंटिटी में क्रिस्टल क्षेत्र विभाजन
टेट्राहेड्रल समन्वय एंटिटी के निर्माण में, $d$ ऑर्बिटल विभाजन (चित्र 5.9) व्युत्क्रमित होता है और एक अष्टफलकीय क्षेत्र विभाजन की तुलना में छोटा होता है। एक ही धातु, एक ही लिगेंड और धातु-लिगेंड दूरी के मामले में, यह दिखाया जा सकता है कि $\Delta_{\mathrm{t}}=(4 / 9) \Delta_{0}$. अतः, ऑर्बिटल विभाजन ऊर्जा के लिए अपर्याप्त बल होता है जो युग्मन को बलपूर्वक करे और इसलिए, निम्न युग्मन वाले विन्यास बहुत घटिया रूप से देखे जाते हैं। अष्टफलकीय और वर्गीय तलीय जटिल जो केंद्रीय सममिति के विशिष्ट होते हैं, उनके लिए ’ $\mathrm{g}$ ’ अधिक विशिष्ट होता है। चूंकि टेट्राहेड्रल जटिल सममिति के अभाव में होते हैं, इन ऊर्जा स्तरों के साथ ’ $\mathrm{g}$ ’ अधिक विशिष्ट नहीं उपयोग किया जाता है।
5.5.5 संयोजन यौगिकों में रंग
पिछले इकाई में, हमने सीखा कि अंतरक्रम धातु यौगिकों की सबसे विशिष्ट विशेषताओं में से एक उनके विस्तारपूर्वक रंग होते हैं। इसका अर्थ यह है कि कुछ दृश्य स्पेक्ट्रम के तरंगदैर्ध्य श्वेत प्रकाश के माध्यम से नमूने के माध्यम से गुजरते हुए हट जाते हैं, इसलिए निकलने वाला प्रकाश श्वेत नहीं होता। यौगिक का रंग अवशोषित रंग के पूरक होता है। पूरक रंग उस तरंगदैर्ध्य से उत्पन्न होता है जो बच जाता है; यदि यौगिक द्वारा हरा प्रकाश अवशोषित होता है, तो यह लाल दिखाई देता है। तालिका 5.3 अवशोषित विभिन्न तरंगदैर्ध्य और देखे गए रंग के संबंध को दर्शाती है।
सारणी 5.3: कोऑर्डिनेशन एंटिटी में प्रकाश के तरंगदैर्ध्य के अवशोषण और देखे जाने वाले रंग के बीच संबंध

कोऑर्डिनेशन यौगिकों में रंग को क्रिस्टल क्षेत्र सिद्धांत के अनुसार आसानी से समझा जा सकता है। उदाहरण के लिए, जटिल $ [\mathrm{Ti}\mathrm{H_2} \mathrm{O}6 ]^{3+}$, जो बैंगनी रंग का होता है। यह एक अष्टफलकीय जटिल है जहां एकल इलेक्ट्रॉन $ (\mathrm{Ti}^{3+} )$ धातु $d$ ऑर्बिटल में $3 d^1$ प्रणाली है और जटिल के आधार अवस्था में $t{2g}$ स्तर पर होता है। इलेक्ट्रॉन के अगले उपलब्ध स्तर $e_g$ स्तर है। यदि जटिल द्वारा नीले-हरे क्षेत्र के प्रकाश के ऊर्जा के संगत अवशोषित हो, तो इलेक्ट्रॉन $t_{2 \mathrm{~g}}$ स्तर से $e_{\mathrm{g}}$ स्तर तक उत्तेजित हो जाएगा $ (t_{2 \mathrm{~g}}{ }^1 e_{\mathrm{g}}{ }^0 \rightarrow t_{2 \mathrm{~g}}{ }^0 e_{\mathrm{g}}{ }^1 )$. इसलिए, जटिल बैंगनी रंग में दिखाई देता है (चित्र 5.10)। क्रिस्टल क्षेत्र सिद्धांत के अनुसार, कोऑर्डिनेशन यौगिकों के रंग को इलेक्ट्रॉन के $d$ - $d$ परिवर्तन के कारण देखा जाता है।

चित्र 5.10: इलेक्ट्रॉन के परिवर्तन के दौरान
ध्यान देने योग्य है कि लिगेंड की अनुपस्थिति में, क्रिस्टल क्षेत्र विभाजन नहीं होता और इसलिए पदार्थ रंगहीन होता है। उदाहरण के लिए, $\left[\mathrm{Ti}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right] \mathrm{Cl_3}$ के गर्म करने पर पानी के अपसारण से यह रंगहीन हो जाता है। इसी तरह, अनुग्रहीत $\mathrm{CuSO_4}$ सफेद होता है, लेकिन $\mathrm{CuSO_4} .5 \mathrm{H_2} \mathrm{O}$ नीला रंग होता है। एक जटिल के रंग पर लिगेंड के प्रभाव को समझने के लिए निम्नलिखित द्वारा देखा जा सकता है:
$$ \underset{\text {green}}{\left[\mathrm{Ni}\left(\mathrm{H}_2 \mathrm{O}\right)_6\right]}^{2+}(\mathrm{aq}) \quad+\text { en (aq) }=\underset{ \text {purple blue}}{\left[\mathrm{Ni}\left(\mathrm{H}_2 \mathrm{O}\right)_4(\mathrm{en})\right]^{2+}(\mathrm{aq})+2} \mathrm{H}_2 \mathrm{O}
$$ $$ \begin{aligned} & {\left[\mathrm{Ni}\left(\mathrm{H}_2 \mathrm{O}\right)_4(\mathrm{en})\right]^{2+}(\mathrm{aq})+\mathrm{en}(\mathrm{aq})=\underset{ \text { नीला/पुरुला}}{\left[\mathrm{Ni}\left(\mathrm{H}_2 \mathrm{O}\right)_2(\mathrm{en})_2\right]^{2+}}(\mathrm{aq})+2 \mathrm{H}_2 \mathrm{O}} \\ & \text { } \\ & {\left[\mathrm{Ni}\left(\mathrm{H}_2 \mathrm{O}\right)_2(\mathrm{en})_2\right]^{2+}(\mathrm{aq})+\text { en }(\mathrm{aq})=\underset{ \text { बैगनी}}{\left[\mathrm{Ni}(\mathrm{en})_3\right]^{2+}(\mathrm{aq})+2 \mathrm{H}
& \end{aligned} $$
इस अनुक्रम को चित्र 5.11 में दिखाया गया है।

चित्र 5.11 निकेल(II) के एथेन-1, 2-डाइएमाइन लिगेंड के बढ़ती संख्या वाले जटिलों के जलीय विलयन।
कुछ ज्वैल के रंग
अंतरक्रम धातु आयन के d ऑर्बिटल में इलेक्ट्रॉनिक स्थानांतरण द्वारा उत्पन्न रंग दैनिक जीवन में अक्सर देखे जाते हैं। रूबी [चित्र 5.12(a)] एल्यूमिनियम ऑक्साइड (Al2O3) है जिसमें लगभग 0.5-1% Cr3+ आयन (d3) होते हैं, जो Al3+ के सामान्य स्थानों में अकेले वितरित होते हैं। हम इन क्रोमियम(III) विशिष्टताओं को एल्यूमिना जालक में एकल आठ फलनीय क्रोमियम(III) जटिल के रूप में देख सकते हैं; इन केंद्रों पर d–d स्थानांतरण रंग के उत्पन्न करते हैं। एमरल्ड [चित्र 5 बी] में Cr3+ आयन बेरिल (Be3Al2Si6O18) खनिज में आठ फलनीय स्थानों पर बसे होते हैं। रूबी में देखे गए अवशोषण बैंड लंबे तरंगदैर्घ्य तक बदल जाते हैं, अर्थात गुलाबी-लाल और नीले रंग, जिसके कारण एमरल्ड हरे रंग के प्रकाश के अपवाह करता है।

चित्र 5.12: (a) रूबी: यह जेमस्टोन मोगोक, म्यांमार से पाया गया था; (b) एमरल्ड: यह जेमस्टोन मुजो, कोलंबिया से पाया गया था।
5.5.6 क्रिस्टल क्षेत्र सिद्धांत की सीमाएं
क्रिस्टल क्षेत्र मॉडल उपचार के बहुत से पहलूओं, जैसे उत्पत्ति, संरचना, रंग और चुंबकीय गुणों के विवरण के लिए सफल है। हालांकि, लिगेंड के बिंदु आवेश होने के अनुमान से यह निष्कर्ष निकलता है कि ऋणात्मक लिगेंड सबसे अधिक विभाजन प्रभाव डालते हैं। वास्तव में, ऋणात्मक लिगेंड स्पेक्ट्रोकेमिकल श्रेणी के निम्न छोर पर होते हैं। इसके अतिरिक्त, इसमें लिगेंड और केंद्रीय परमाणु के बीच बंधन के सहसंयोजक गुण को ध्यान में नहीं लिया गया है। ये क्रिस्टल क्षेत्र सिद्धांत (CFT) की कुछ कमजोरियां हैं, जो लिगेंड क्षेत्र सिद्धांत (LFT) और अणुक कक्षक सिद्धांत द्वारा समझी जाती हैं, जो वर्तमान अध्ययन के दायरे से बाहर हैं।
अंतर्गत प्रश्न
9.5 मूल बंध सिद्धांत के आधार पर समझाइए कि $\left[\mathrm{Ni}(\mathrm{CN})_4\right]^{2-}$ आयन वर्गीय तलीय संरचना वाला होता है और विषम चुंबकीय होता है जबकि $\left[\mathrm{NiCl_4}\right]^{2-}$ आयन चतुष्फलकीय ज्यामिति वाला होता है और चुंबकीय होता है।
उत्तर दिखाएं
उत्तर
$\mathrm{Ni}$ +2 ऑक्सीकरण अवस्था में होता है अर्थात $\mathrm{d}^{8}$ विन्यास में होता है।

इसमें $4 \mathrm{CN}^{-}$ आयन होते हैं। इसलिए, यह चतुष्फलकीय ज्यामिति या वर्गीय तलीय ज्यामिति में हो सकता है। क्योंकि $\mathrm{CN}^{-}$ आयन एक मजबूत क्षेत्र लिगेंड है, इसलिए यह अनुचुंबकीय $3 d$ इलेक्ट्रॉन के युग्मन को कार्य करता है।

अब यह $\mathrm{dsp}^{2}$ हाइब्रिडीकरण करता है। क्योंकि सभी इलेक्ट्रॉन युग्मित हैं, इसलिए यह अनुचुंबकीय है।
$\left[\mathrm{NiCl_4}\right]^{2-}$ के मामले में, क्लोराइड आयन एक कमजोर क्षेत्र लिगेंड है। इसलिए, यह अनुचुंबकीय $3 d$ इलेक्ट्रॉन के युग्मन को नहीं करता है। इसलिए, यह $s p^{3}$ हाइब्रिडीकरण करता है।

इस मामले में दो अनुचुंबकीय इलेक्ट्रॉन होते हैं, इसलिए इसकी प्रकृति चुंबकीय होती है।
9.6 $\left[\mathrm{NiCl_4}\right]^{2-}$ चुंबकीय है जबकि $\left[\mathrm{Ni}(\mathrm{CO})_4\right]$ अनुचुंबकीय है चाहे दोनों चतुष्फलकीय हों। क्यों?
उत्तर दिखाएँ
उत्तर
हालाँकि दोनों $\left[\mathrm{NiCl_4}\right]^{2-}$ और $\left[\mathrm{Ni}(\mathrm{CO})_{4}\right]$ चतुष्कोणीय हैं, उनके चुंबकीय गुण अलग हैं। इसका कारण लिगेंड की प्रकृति में अंतर है। $\mathrm{Cl}^{-}$ एक कम क्षेत्र लिगेंड है और यह असुमेय $3 d$ इलेक्ट्रॉनों के युग्मन का कारण नहीं बनता। इसलिए, $\left[\mathrm{NiCl_4}\right]^{2-}$ प्रामाणिक चुंबकीय है।

$\mathrm{Ni}(\mathrm{CO})_{4}$ में, $\mathrm{Ni}$ शून्य ऑक्सीकरण अवस्था में है, अर्थात इसकी विन्यास $3 d^{8} 4 s^{2}$ है।

लेकिन $\mathrm{CO}$ एक शक्तिशाली क्षेत्र लिगेंड है। इसलिए, यह असुमेय $3 d$ इलेक्ट्रॉनों के युग्मन का कारण बनता है। इसके अलावा, यह $4 \mathrm{~s}$ इलेक्ट्रॉनों को $3 d$ ऑर्बिटल में विस्थापित करता है, जिससे $s p^{3}$ हाइब्रिडाइजेशन उत्पन्न होती है। इस स्थिति में कोई असुमेय इलेक्ट्रॉन नहीं होते हैं, इसलिए $\left[\mathrm{Ni}(\mathrm{CO})_{4}\right]$ विपाकी चुंबकीय है।
9.7 $\left[\mathrm{Fe}\left(\mathrm{H_2} \mathrm{O}\right)_6\right]^{3+}$ बहुत तीव्र प्रामाणिक चुंबकीय है जबकि $\left[\mathrm{Fe}(\mathrm{CN})_6\right]^{3-}$ कम प्रामाणिक चुंबकीय है। समझाइए।
उत्तर दिखाएँ
उत्तर
दोनों $[\mathrm{Fe(H_2O)_6}]^{3+}$ और $[\mathrm{Fe}\mathrm{(CN)_6}]^{3-}$ में, Fe की ऑक्सीकरण अवस्था +3 है, अर्थात इसकी विन्यास $d^{5}$ है।

क्योंकि $\mathrm{CN}^-$ एक मजबूत क्षेत्र लिगेंड है, इसके कारण असुमेक इलेक्ट्रॉनों के युग्मन होता है। अतः, $d$-कक्षक में केवल एक असुमेक इलेक्ट्रॉन बचता है।
इसलिए,
$$ \begin{aligned} \mu & =\sqrt{n(n+2)} \\ & =\sqrt{1(1+2)} \\ & =\sqrt{3} \\ & =1.732\ \mathrm{BM} \end{aligned} $$
दूसरी ओर, $\mathrm{H_2} \mathrm{O}$ एक कम क्षेत्र लिगेंड है। अतः, इसके कारण इलेक्ट्रॉनों के युग्मन नहीं हो सकता। इसका अर्थ है कि असुमेक इलेक्ट्रॉनों की संख्या 5 है।
इसलिए,
$$ \begin{aligned} \mu & =\sqrt{n(n+2)} \\ & =\sqrt{5(5+2)} \\ & =\sqrt{35} \\ & 3.873\ \mathrm{BM} \end{aligned} $$
इस प्रकार, स्पष्ट है कि $[\mathrm{Fe(H_2 O)_6}]^{3+}$ एक मजबूत पैरामैग्नेटिक आयन है, जबकि $[\mathrm{Fe(CN)_6}]^{3-}$ एक कम पैरामैग्नेटिक आयन है।
9.8 समझाइए कि $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_6\right]^{3+}$ एक आंतरिक कक्षक जटिल है जबकि $\left[\mathrm{Ni}\left(\mathrm{NH_3}\right)_6\right]^{2+}$ एक बाहरी कक्षक जटिल है।
उत्तर दिखाएं
उत्तर
| $\left[\mathrm{Co}\left(\mathrm{NH}_3\right)_6\right]^{3+}$ | $\left[\mathrm{Ni}\left(\mathrm{NH}_3\right)_6\right]^{2+}$ |
|---|---|
| कोबाल्ट का ऑक्सीकरण अवस्था $=+3$ | $\mathrm{Ni}$ का ऑक्सीकरण अवस्था $=+2$ |
कोबाल्ट की इलेक्ट्रॉनिक विन्यास $=d^6$  |
निकल की इलेक्ट्रॉनिक विन्यास $=d^8$  |
$\mathrm{NH}_3$ कोबाल्ट के $CO^{3+}$ के लिए एक मजबूत क्षेत्र लिगेंड होता है, जिसके कारण इलेक्ट्रॉनों के युग्मन होता है। अतः, कोबाल्ट $d^2 s p^3$ हाइब्रिडाइजेशन कर सकता है। |
यदि $\mathrm{NH}_3$ इलेक्ट्रॉनों के युग्मन करता है, तो केवल एक $3 d$ कक्षक खाली रहता है। अतः, यह $d^s s p^3$ हाइब्रिडाइजेशन नहीं कर सकता। अतः, यह $s p^3 d^2$ हाइब्रिडाइजेशन करता है। |
|इसलिए, यह एक आंतरिक कक्षक जटिल है।|इसलिए, यह एक बाहरी कक्षक जटिल बनाता है।|
9.9 वर्गीय तल $\left[\mathrm{Pt}(\mathrm{CN})_{4}\right]^{2-}$ आयन में असुमेकित इलेक्ट्रॉनों की संख्या का अनुमान लगाएं।
उत्तर दिखाएं
उत्तर
$\left[\mathrm{Pt}(\mathrm{CN})_{4}\right]^{2-}$
इस जटिल में, $\mathrm{Pt}$ +2 अवस्था में है। यह एक वर्गीय तल संरचना बनाता है। इसका अर्थ है कि यह $d p^{2}$ हाइब्रिडीकरण करता है। अब, $\mathrm{Pd}(+2)$ की इलेक्ट्रॉनिक विन्यास $5 d^{8}$ है।
$\mathrm{CN}^{-}$ एक मजबूत क्षेत्र लिगेंड है जो असुमेकित इलेक्ट्रॉनों के युग्मन को कारण बनता है। इसलिए, $\left[\operatorname{Pt}(\mathrm{CN})_{4}\right]^{2-}$ में कोई असुमेकित इलेक्ट्रॉन नहीं हैं।
9.10 छह जल अंतर्ग्रहण मैंगनीज (II) आयन में पांच असुमेकित इलेक्ट्रॉन होते हैं, जबकि छह श्वेत अंतर्ग्रहण आयन में केवल एक असुमेकित इलेक्ट्रॉन होता है। क्रिस्टल क्षेत्र सिद्धांत का उपयोग करके समझाइए।
Show उत्तर दिखाएं
उत्तर
| $\left[\mathrm{Mn}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right]^{2+}$ | $\left[\mathrm{Mn}(\mathrm{CN})_{6}\right]^{4-}$ |
|---|---|
| $\mathrm{Mn}$ +2 ऑक्सीकरण अवस्था में है। | $\mathrm{Mn}$ +2 ऑक्सीकरण अवस्था में है। |
| इलेक्ट्रॉनिक विन्यास $\mathrm{d}^{5}$ है | इलेक्ट्रॉनिक विन्यास $\mathrm{d}^{5}$ है |
| क्रिस्टल क्षेत्र अष्टफलकीय है। जल एक कमजोर क्षेत्र लिगेंड है। इसलिए, $\left[\mathrm{Mn}\left(\mathrm{H _2} \mathrm{O}\right) _{6}\right] ^{2+}$ में इलेक्ट्रॉनों की व्यवस्था $t _{2g} ^3e_g ^2$ है। | क्रिस्टल क्षेत्र अष्टफलकीय है। साइनाइड एक मजबूत क्षेत्र लिगेंड है। इसलिए, $\left[\mathrm{Mn}(\mathrm{CN}) _{6}\right] ^{4-}$ में इलेक्ट्रॉनों की व्यवस्था $t ^{5} _{2g}e ^{0} _{g}$ है। |
इसलिए, छह जल अंतर्ग्रहण मैंगनीज (II) आयन में पांच असुमेकित इलेक्ट्रॉन होते हैं, जबकि छह श्वेत अंतर्ग्रहण आयन में केवल एक असुमेकित इलेक्ट्रॉन होता है।
5.6 धातु कार्बोनिल में बंधन
होमोलेप्टिक कार्बोनिल (केवल कार्बोनिल लिगेंड वाले यौगिक) अधिकांश अंतरक्रम धातुओं द्वारा बनाए जाते हैं। ये कार्बोनिल सरल, स्पष्ट रूप से परिभाषित संरचना रखते हैं। टेट्राकार्बोनिल निकेल (0) चतुष्कोणीय होता है, पेंटाकार्बोनिल आयरन (0) त्रिकोणीय बिप्रिजमानुपाती होता है जबकि हेक्साकार्बोनिल क्रोमियम (0) अष्टफलकीय होता है।
देकाकार्बोनिलडाइमैंगनीज(0) दो वर्गीय पिरामिड $\mathrm{Mn}(\mathrm{CO})_5$ इकाइयों से बना होता है जो $\mathrm{Mn}-\mathrm{Mn}$ बंध द्वारा जुड़े होते हैं। अक्टा कार्बोनिलडाइकोबाल्ट(0) में दो $\mathrm{CO}$ समूहों द्वारा पुल के रूप में जुड़े $\mathrm{Co}-\mathrm{Co}$ बंध होता है (चित्र 9.13)।
चित्र 5.13 कुछ प्रतिनिधि होमोलेप्टिक धातु कार्बोनिल के संरचनाएं।

मेटल-कार्बन बंधन मेटल कार्बोनाइल में दोनों $\sigma$ और $\pi$ चरित्र रखता है। $\mathrm{M}-\mathrm{C} \sigma$ बंधन मेटल के खाली ऑर्बिटल में कार्बोनिल कार्बन पर एकल इलेक्ट्रॉन युग्म के दान से बनता है। $\mathrm{M}-\mathrm{C} \pi$ बंधन मेटल के भरे हुए $d$ ऑर्बिटल से एक इलेक्ट्रॉन युग्म के दान से बनता है, जो कार्बोन मोनोऑक्साइड के खाली एंटीबंधन $\pi^{*}$ ऑर्बिटल में जाता है। मेटल से लिगेंड बंधन एक संयोग का प्रभाव उत्पन्न करता है जो $\mathrm{CO}$ और मेटल के बीच बंधन को मजबूत करता है (चित्र 5.14)।

चित्र 5.14: कार्बोनिल संकरण में संयोगात्मक बंधन प्रतिक्रिया का उदाहरण।
5.7 संकरण यौगिकों की महत्वता और अनुप्रयोग
संकरण यौगिक बहुत महत्वपूर्ण हैं। ये यौगिक खनिज, पौधों और जानवरों के विश्व में व्यापक रूप से मौजूद हैं और विश्लेषणात्मक रसायन विज्ञान, खनिज उद्योग, जैविक प्रणाली, औद्योगिक और चिकित्सा क्षेत्र में कई महत्वपूर्ण कार्यों के लिए जाने जाते हैं। इनके बारे में नीचे वर्णित किया गया है:
-
समन्वय यौगिक गुणित एवं मात्रात्मक रासायनिक विश्लेषण में कई उपयोग में आते हैं। धातु आयनों के कई लिगेंड (विशेषकर चेलेटिंग लिगेंड) के साथ रंगीन अभिक्रियाएं जो कि समन्वय यौगिक के निर्माण के कारण होती हैं, के आधार पर इनके अनुमान एवं पहचान के लिए कक्षीय एवं उपकरणीय विश्लेषण विधियों का उपयोग किया जाता है। ऐसे रासायनिक अपघटकों के उदाहरण शामिल हैं EDTA, DMG (डाइमेथिल ग्लिकॉक्सिम), $\alpha$-नाइट्रोसो- $\beta$-नैफ्थॉल, क्यूप्रॉन आदि।
-
पानी की कठोरता को $\mathrm{Na_2}$ EDTA के साथ सरल तित्रीकरण द्वारा अनुमानित किया जाता है। $\mathrm{Ca}^{2+}$ एवं $\mathrm{Mg}^{2+}$ आयन एड्टा के साथ स्थायी समन्वय यौगिक बनाते हैं। इन आयनों के चयनात्मक अनुमान के लिए कैल्शियम एवं मैग्नीशियम समन्वय यौगिकों के स्थायिता नियतांक में अंतर के कारण संभव है।
-
कुछ महत्वपूर्ण धातुओं के निष्कर्षण प्रक्रियाओं, जैसे कि चांदी और स्वर्ण के, में संयोजन बनाना एक महत्वपूर्ण भूमिका निभाता है। उदाहरण के लिए, स्वर्ण ऑक्सीजन और पानी की उपस्थिति में सांद्र अपघटन के साथ संयोजन बनाता है और जलीय घोल में $\left[\mathrm{Au}(\mathrm{CN})_{2}\right]^{-}$ के संयोजन एंटिटी के रूप में बनता है। इस घोल से स्वर्ण को धातु के रूप में अपचयन के द्वारा अलग किया जा सकता है।
-
इसी तरह, धातुओं के शुद्धीकरण के लिए उनके संयोजन यौगिकों के निर्माण और बाद में उनके अपघटन के माध्यम से भी प्राप्त किया जा सकता है। उदाहरण के लिए, अशुद्ध निकल को $\left[\mathrm{Ni}(\mathrm{CO})_{4}\right]$ में परिवर्तित किया जाता है, जिसे शुद्ध निकल के रूप में अपघटित किया जाता है।
-
निर्माण यौगिक जैविक प्रणालियों में बहुत महत्वपूर्ण होते हैं। प्रकाश संश्लेषण के लिए ज़िम्मेदार रंगक, क्लोरोफिल, मैग्नीशियम के एक संयोजन यौगिक है। रक्त के लाल रंगक, हीमोग्लोबिन, जो ऑक्सीजन के वहन के लिए कार्य करता है, लोहा के एक संयोजन यौगिक है। विटामिन $\mathrm{B_{12}}$, साइएनोकोबालामाइन, एंटीपेर्निसियस एनीमिया कारक, कोबाल्ट के एक संयोजन यौगिक है। जैविक महत्व के अन्य यौगिकों में संयोजित धातु आयन वाले एंजाइम जैसे, कार्बॉक्सीपेप्टिडेज़ A और कार्बोनिक एनहाइड्रेज़ (जैविक प्रणालियों के एन्जाइम) शामिल हैं।
-
कॉऑर्डिनेशन यौगिकों का उपयोग उद्योग में कई प्रक्रियाओं के रूपांतरण के रूप में किया जाता है। उदाहरण के लिए, रोहडियम कम्प्लेक्स, $\left[\left(\mathrm{Ph_3} \mathrm{P}\right)_{3} \mathrm{RhCl}\right]$, एक विलियम्स कैटलिस्ट है जो एल्कीन के हाइड्रोजनीकरण के लिए उपयोग किया जाता है।
-
आर्टिकल्स को सिरेम और गोल्ड से बहुत धीमी और समान रूप से इलेक्ट्रोप्लेट किया जा सकता है जबकि एक अकेले धातु आयनों के घोल से नहीं। उदाहरण के लिए, $\left[\mathrm{Ag}(\mathrm{CN})_2\right]^{-}$ और $\left[\mathrm{Au}(\mathrm{CN})_2\right]^{-}$ के घोल से।
-
काला-सफेद फोटोग्राफी में, विकसित फिल्म को हाइपो घोल से धोकर निर्माण नहीं हुए $\mathrm{AgBr}$ को घोल बनाने वाला एक जटिल आयन, $\left[\mathrm{Ag}\left(\mathrm{S_2} \mathrm{O_3}\right)_{2}\right]^{3-}$ बनाया जाता है।
-
चेलेट थेरेपी के उपयोग के उपयोग में बढ़ती रुचि है। एक उदाहरण है जब वनस्पति/जानवर प्रणालियों में तलीय धातुओं के विषाकर अनुपात के कारण होने वाली समस्याओं के इलाज के लिए। इसलिए, कॉपर और लोहे के अतिरिक्त मात्रा को चेलेटिंग लिगेंड्स D-पेनिसिलामाइन और डेसफेर्रिओक्साइम बी द्वारा जटिल यौगिकों के निर्माण के माध्यम से हटाया जाता है। लेड पोइजनिंग के इलाज में ईड्टा का उपयोग किया जाता है। कुछ प्लेटिनम के जटिल यौगिक तंत्रिका के विकास को रोकने में प्रभावी होते हैं। उदाहरण के लिए: $cis$-प्लेटिन और संबंधित यौगिक।
सारांश
सह-संयोजन यौगिकों के रासायनिक अध्ययन आधुनिक अयस्क रसायन के महत्वपूर्ण और चुनौतीपूर्ण क्षेत्र में है। पिछले पचास सालों में, इस क्षेत्र में प्रगति नए अवधारणाओं और बंधन एवं अणु संरचना के मॉडल के विकास, रसायन उद्योग में नए उपलब्धियों और जैविक प्रणालियों के क्रिटिकल घटकों के कार्य के गहरे अंतर्दृष्टि प्रदान कर चुके हैं।
सह-संयोजन यौगिक के निर्माण, अभिक्रियाएं, संरचना और बंधन की व्याख्या के पहले वैज्ञानिक प्रयास A. Werner द्वारा किया गया था। उनके सिद्धांत ने एक धातु परमाणु/आयन के द्वारा सह-संयोजन यौगिक में दो प्रकार के संयोजन (प्राथमिक और द्वितीयक) का उपयोग करने की अवधारणा प्रस्तुत की। आधुनिक रसायन की भाषा में, इन संयोजनों को क्रमशः आयनीकरण योग्य (आयनिक) और आयनीकरण अयोग्य (सह-संयोजक) बंधन के रूप में पहचाना गया है। इसोमरिज्म के गुण का उपयोग करते हुए, Werner ने बहुत सारे सह-संयोजन एंटिटी के ज्यामितीय आकार की भविष्यवाणी की।
वैलेंस बंड ति (VBT) संयोजन यौगिकों के निर्माण, चुंबकीय व्यवहार और ज्यामितीय आकृतियों की व्याख्या में उपयोगी होता है। हालांकि, इसके पास चुंबकीय व्यवहार की वैज्ञानिक व्याख्या के लिए मात्रात्मक विवरण नहीं होते हैं और इन यौगिकों के प्रकाश गुणों के बारे में कोई बात नहीं होती है।
क्रिस्टल क्षेत्र सिद्धांत (CFT) संयोजन यौगिकों के लिए आधार बनता है, जो केंद्रीय धातु परमाणु/आयन के d ऑर्बिटल ऊर्जा के अपस्थिति के विघटन के प्रभाव के आधार पर होता है। जब लिगेंड के कारण अलग-अलग क्रिस्टल क्षेत्र (लिगेंड को बिंदु आवेश के रूप में माना जाता है) के कारण d ऑर्बिटल के विघटन के कारण तीव्र और कम क्रिस्टल क्षेत्र में विभिन्न इलेक्ट्रॉनिक व्यवस्थाएं उत्पन्न होती हैं। इस विधि के माध्यम से ऑर्बिटल अलगाव ऊर्जा, चुंबकीय आघूर्ण और स्पेक्ट्रल एवं स्थायित्व पैरामीटर के मात्रात्मक अनुमान लगाए जा सकते हैं। हालांकि, लिगेंड को बिंदु आवेश मानने की धारणा कई सिद्धांतीय कठिनाइयों का कारण बनती है।
मेटल कार्बोनिल में मेटल-कार्बन बंधन में दोनों $\sigma$ और $\pi$ चरित्र उपस्थित होते हैं। लिगेंड से मेटल के बीच $\sigma$ बंध और मेटल से लिगेंड के बीच $\pi$ बंध होता है। इस अद्वितीय संयोगात्मक बंधन के कारण मेटल कार्बोनिल के अनुमानित स्थिरता होती है।
संयोजन यौगिक बहुत महत्वपूर्ण होते हैं। ये यौगिक जैविक प्रणाली के महत्वपूर्ण घटकों के कार्य और संरचना के बारे में महत्वपूर्ण ज्ञान प्रदान करते हैं। संयोजन यौगिक खनन प्रक्रियाओं, विश्लेषणात्मक और चिकित्सा रसायन विज्ञान में व्यापक रूप से उपयोग किए जाते हैं।
अभ्यास प्रश्न
9.1 समन्वय यौगिकों में बंधन को वर्नर के प्रतिपादनों के आधार पर समझाइए।
उत्तर दिखाएं
उत्तर
वर्नर के प्रतिपादन समन्वय यौगिकों में बंधन को निम्नलिखित तरीके से समझाते हैं:
(i) एक धातु दो प्रकार के मोलरता दर्शाती है, अर्थात् प्राथमिक और द्वितीयक मोलरता। प्राथमिक मोलरता नकारात्मक आयनों द्वारा संतुलित होती है, जबकि द्वितीयक मोलरता नकारात्मक और उदासीन आयनों द्वारा संतुलित होती है।
आधुनिक भाषा में, प्राथमिक मोलरता धातु आयन के ऑक्सीकरण अंक के समान होती है, जबकि द्वितीयक मोलरता धातु आयन के समन्वय संख्या के समान होती है।
(ii) एक धातु आयन के केंद्रीय परमाणु के चारों ओर एक निश्चित संख्या में द्वितीयक मोलरता होती है। इसके अतिरिक्त, ये मोलरता समन्वय यौगिक के निश्चित ज्यामिति के अनुसार अंतरिक अंतर के दिशा में व्यापक होती है।
(iii) प्राथमिक मोलरता आमतौर पर आयनित होती है, जबकि द्वितीयक मोलरता आयनित नहीं होती है।
9.2 $\mathrm{FeSO_4}$ विलयन को $\left(\mathrm{NH_4}\right)_{2} \mathrm{SO_4}$ विलयन के 1:1 मोलर अनुपात में मिश्रित करने पर $\mathrm{Fe}^{2+}$ आयन के परीक्षण के परिणाम आते हैं, लेकिन $\mathrm{CuSO_4}$ विलयन को जलीय अमोनिया के 1:4 मोलर अनुपात में मिश्रित करने पर $\mathrm{Cu}^{2+}$ आयन के परीक्षण के परिणाम नहीं आते हैं। क्यों?
उत्तर दिखाएं
उत्तर
$\mathrm{(NH_4)_2} \mathrm{SO_4}+\mathrm{FeSO_4}+6 \mathrm{H_2} \mathrm{O} \longrightarrow \underset{\text{मोहर के लवण}}{\mathrm{FeSO_4} \cdot\mathrm{(NH_4)_2} \mathrm{SO_4} \cdot 6 \mathrm{H_2} \mathrm{O}}$
$\mathrm{CuSO_4}+4 \mathrm{NH_3}+5 \mathrm{H_2} \mathrm{O} \longrightarrow \underset{\text{तेत्रामिनोकॉपर(II) सल्फेट}}{\left[\mathrm{Cu}\left(\mathrm{NH_3}\right)_{4}\right] \mathrm{SO_4} \cdot 5 \mathrm{H_2} \mathrm{O}}$
दोनों यौगिक, अर्थात् $\mathrm{FeSO_4} \cdot \mathrm{(NH_4)_2} \mathrm{SO_4} \cdot 6 \mathrm{H_2} \mathrm{O}$ और $[\mathrm{Cu}\mathrm{(NH_3)_4}] \mathrm{SO_4} \cdot 5 \mathrm{H_2} \mathrm{O}$, एक संयोजन यौगिक के श्रेणी में आते हैं जिनमें केवल एक मुख्य अंतर है, अर्थात् पहला एक द्विसल लवण का उदाहरण है, जबकि दूसरा एक समन्वय यौगिक है।
एक डबल लवण एक योगात्मक यौगिक होता है जो ठोस अवस्था में स्थायी होता है लेकिन घोल के रूप में अपने संघटक आयनों में विखंडित हो जाता है। इन यौगिकों में अपने संघटकों के व्यक्तिगत गुण प्रकट होते हैं। उदाहरण के लिए, $\mathrm{FeSO_4} \cdot\left(\mathrm{NH_4}\right)_{2} \mathrm{SO_4} \cdot 6 \mathrm{H_2} \mathrm{O}$ अपने संघटक आयनों $\mathrm{Fe}^{2+}, \mathrm{NH}^{4+}$, और $\mathrm{SO_4}{ }^{-2}$ में विखंडित हो जाता है। इसलिए, यह $\mathrm{Fe}^{2+}$ आयनों के लिए धनात्मक परीक्षण देता है।
एक सह-संयोजन यौगिक एक योगात्मक यौगिक होता है जो ठोस अवस्था में तथा घोल के रूप में अपनी पहचान को बरकरार रखता है। हालांकि, संघटकों के व्यक्तिगत गुण खो देते हैं। यह इसलिए होता है कि $\left[\mathrm{Cu}\left(\mathrm{NH_3}\right)_{4}\right] \mathrm{SO_4} \cdot 5 \mathrm{H_2} \mathrm{O}$ $\mathrm{Cu}^{2+}$ के लिए परीक्षण नहीं दिखाता है। $\left[\mathrm{Cu}\mathrm{(NH_3)_4}\right] \mathrm{SO_4} \cdot 5 \mathrm{H_2} \mathrm{O}$ के घोल में उपस्थित आयन $\left[\mathrm{Cu}\mathrm{(NH_3)_4}\right]^{2+}$ और $\mathrm{SO_4}{ }^{2-}$ होते हैं।
9.3 निम्नलिखित के दो उदाहरणों के साथ समझाइए: सह-संयोजन एंटिटी, लिगेंड, सह-संयोजन संख्या, सह-संयोजन बहुफलक, होमोलेप्टिक और हेटेरोलेप्टिक।
उत्तर दिखाएं
Answer
(i) सह-संयोजन एंटिटी:
एक सह-संयोजन एंटिटी एक विद्युत चार्जित रेडिकल या वस्तु होती है जो धनात्मक या नकारात्मक चार्ज को ले रही होती है। सह-संयोजन एंटिटी में, केंद्रीय परमाणु या आयन के चारों ओर एक संख्या में उदासीन अणुओं या नकारात्मक आयनों (जिन्हें लिगेंड कहा जाता है) के द्वारा घेरा होता है। उदाहरण के लिए:
$$ \begin{aligned} & {\left[\mathrm{Ni}\mathrm{(NH_3)_6}\right]^{2+},\left[\mathrm{Fe}\mathrm{(CN)_6}\right]^{4+}=\text { धनात्मक यौगिक }} \\ & {\left[\mathrm{PtCl_4}\right]^{2-}, \quad\left[\mathrm{Ag}\mathrm{(CN)_2}\right]^{-}=\text { नकारात्मक यौगिक }} \\ & {\left[\mathrm{Ni}\mathrm{(CO)_4}\right], \quad\left[\mathrm{Co}\mathrm{(NH_3)_4} \mathrm{Cl_2}\right] {=\text { उदासीन यौगिक }}} \end{aligned} $$
(ii) लिगेंड
एक सह-संयोजन एंटिटी या सह-संयोजन यौगिक में धनात्मक अणुओं या नकारात्मक आयनों जो धातु आयन के चारों ओर घेरे होते हैं।
लिगेंड के रूप में जाने जाते हैं। उदाहरण के लिए, $\stackrel{\large{\cdot \cdot} }{\mathrm{N}}\mathrm{H_3}, \mathrm{H_2} \stackrel{\large{\cdot \cdot}}{\mathrm{O}}, \mathrm{Cl^-} , \mathrm{OH}^{-}$. लिगेंड आमतौर पर ध्रुवीय प्रकृति के होते हैं और कम से कम एक असंयोजी इलेक्ट्रॉन युग्म के साथ होते हैं।
(iii) समन्वय संख्या:
समन्वय क्षेत्र में केंद्रीय धातु परमाणु के आवेशित अणुओं या नकारात्मक आयनों की कुल संख्या को केंद्रीय धातु परमाणु की समन्वय संख्या कहते हैं। इसे इसकी लिगेंसी के रूप में भी संदर्भित किया जाता है।
उदाहरण के लिए:
(a) समन्वय यौगिक, $\mathrm{K_2}\left[\mathrm{PtCl_6}\right]$ में, छह क्लोराइड आयन $\mathrm{Pt}$ के समन्वय क्षेत्र में जुड़े हुए हैं। अतः $\mathrm{Pt}$ की समन्वय संख्या 6 है।
(b) इसी तरह, समन्वय यौगिक $\left[\mathrm{Ni}\left(\mathrm{NH_3}\right)_{4}\right] \mathrm{Cl_2}$ में, केंद्रीय परमाणु (Ni) की समन्वय संख्या 4 है।
(vi) समन्वय बहुफलक:
केंद्रीय परमाणु के समन्वय क्षेत्र में जुड़े लिगेंड के अंतर्गत अंतर्विन्यास को केंद्रीय परमाणु के समन्वय बहुफलक के रूप में परिभाषित किया जाता है। उदाहरण के लिए:
(a)
चौकोर तलीय
(b) चतुष्फलकीय
चतुष्फलकीय
(v) समान लिगेंड यौगिक:
ये वे यौगिक हैं जिनमें धातु आयन केवल एक प्रकार के डोनर समूह से जुड़े होते हैं।
उदाहरण: $\left[\mathrm{Co}\mathrm{(NH_3)_6}\right]^{3+},\left[\mathrm{PtCl_4}\right]^{2-}$ आदि।
(vi) विषम लिगेंड यौगिक:
हेटरोलेप्टिक कम्प्लेक्स वे कम्प्लेक्स होते हैं जिनमें केंद्रीय धातु आयन एक से अधिक प्रकार के डोनर समूह से बंधे होते हैं।
उदाहरण के लिए: $\left[\mathrm{Co}\mathrm{(NH_3)_4} \mathrm{Cl_2}\right]^{+},\left[\mathrm{Co}\mathrm{(NH_3)_5} \mathrm{Cl}\right]^{2+}$
9.4 एकल-दंडी, द्विदंडी और अम्बिडेंटेट लिगेंड के अर्थ क्या हैं? प्रत्येक के दो उदाहरण दीजिए।
उत्तर दिखाएं
उत्तर
एक लिगेंड में एक या अधिक अनुमानित इलेक्ट्रॉन युग्म हो सकते हैं जो लिगेंड के डोनर साइट कहलाते हैं। अब, इन डोनर साइट की संख्या के आधार पर लिगेंड को निम्नलिखित वर्गीकृत किया जा सकता है:
(a) एकल-दंडी लिगेंड: वे लिगेंड जिनमें केवल एक डोनर साइट होती है एकल-दंडी लिगेंड कहलाते हैं। उदाहरण के लिए: $\stackrel{\large{\cdot \cdot} }{\mathrm{N}}\mathrm{H_3}, \mathrm{Cl}^{-}$ आदि।
(b) द्विदंडी लिगेंड: वे लिगेंड जिनमें दो डोनर साइट होती है द्विदंडी लिगेंड कहलाते हैं। उदाहरण के लिए:
(a) एथेन-1,2-डाइएमीन
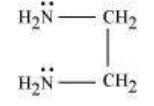
(b) ऑक्सलेट आयन
$\left(\mathrm{C_2} \mathrm{O_4}^{2-}\right)$ या $\begin{array}{l} \mathrm{COO}^{-} \\ | \\ \mathrm{COO}^{-} \end{array}$
(c) अम्बिडेंटेट लिगेंड:
वे लिगेंड जो केंद्रीय धातु आयन के साथ दो अलग-अलग परमाणुओं के माध्यम से जुड़ सकते हैं (लेकिन एक बार में केवल एक परमाणु) अम्बिडेंटेट लिगेंड कहलाते हैं। उदाहरण के लिए:
(a)
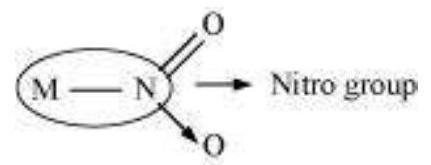
(डोनर परमाणु $\mathrm{N}$ है)
(The donor atom is oxygen)
(b)
(The donor atom is $\mathrm{S}$ )

(The donor atom is $\mathrm{N}$ )
9.5 निम्नलिखित संकर एंटिटी में धातुओं के ऑक्सीकरण संख्या निर्धारित कीजिए:
(i) $\left[\mathrm{Co}\left(\mathrm{H_2} \mathrm{O}\right)(\mathrm{CN})(\mathrm{en})_2\right]^{2+}$
(ii) $\left[\mathrm{CoBr_2}(\mathrm{en})_2\right]^{+}$
(iii) $\left[\mathrm{PtCl_4}\right]^{2-}$
(iv) $\mathrm{K_3}\left[\mathrm{Fe}(\mathrm{CN})_6\right]$
(v) $\left[\mathrm{Cr}\left(\mathrm{NH_3}\right)_3 \mathrm{Cl_3}\right]$
उत्तर दिखाएं
Answer
(i) $\left[\mathrm{Co}\left(\mathrm{H_2} \mathrm{O}\right)(\mathrm{CN})(\mathrm{en})_{2}\right]^{2+}$
मान लीजिए $\mathrm{Co}$ का ऑक्सीकरण संख्या $x$ है।
कम्प्लेक्स का आवेश +2 है।
$\begin{array}{cccccccr} [\mathrm{Co} & & \left(\mathrm{H_2} \mathrm{O}\right) & &(\mathrm{CN}) && \left.(\mathrm{en})_{2}\right]^{2+} &\\ \downarrow & &\downarrow && \downarrow & &\downarrow & \\ x &+ & 0 &+ & (-1)& + &2(0)& =+2 \\ &&& x & -1 & = & +2 & \\ &&&& x & = & +3& \end{array}$
(ii) $\left[\mathrm{CoBr_2}(\mathrm{en})_2\right]^{+}$
$\begin{array}{cccccc} [\mathrm{Co} & & \mathrm{(Br)_2} & & \left.\mathrm{(en)_2}\right]^{+} &\\ \downarrow & &\downarrow && \downarrow & \\ x &+ & 2(-1) &+ & 2(0)& = &+1 \\ x&-&2 & = & +1& \\ x & = & +3& \end{array}$
(iii) $\left[\mathrm{Pt}(\mathrm{Cl})_{4}\right]^{2-}$
मान लीजिए Pt का ऑक्सीकरण संख्या $x$ है।
चार्ज जटिल पर -2 है ।
$\begin{array}{cccc} [\mathrm{Pt} & & \left(\mathrm{Cl_4}\right) \left. \right]^{2-} &\\ \downarrow & &\downarrow & & \\ x &+ & 4(-1) &= & -2 \\ x & = & +2 \\ \end{array}$
(iv) $\mathrm{K_3}\left[\mathrm{Fe}(\mathrm{CN})_{6}\right]$
$\begin{array}{cccc} [\mathrm{Fe} & & \mathrm{(CN)_6} \left. \right]^{3-} &\\ \downarrow & &\downarrow & & \\ x &+ & 6(-1) &= & -3 \\ x & = & +3 \\ \end{array}$
(v) $\left[\mathrm{Cr}\left(\mathrm{NH_3}\right)_3 \mathrm{Cl_3}\right]$
$\begin{array}{cccccc} [\mathrm{Cr} & & \mathrm{(NH_3)_3} & & \left.\mathrm{(Cl)_3}\right] &\\ \downarrow & &\downarrow && \downarrow & \\ x &+ & 3(0) &+ & 3(-1)& = &0 \\ x & = & +3& \end{array}$
9.6 IUPAC नियमों के अनुसार निम्नलिखित के सूत्र लिखिए:
(i) टेट्राहाइड्रोक्सिडोजिंकेट(II)
(ii) पोटेशियम टेट्राक्लोरिडोपैलेडेट(II)
(iii) डाइएमिनेडीक्लोरिडोप्लैटिनम(II)
(iv) पोटेशियम टेट्रासाइनिडोनिकेलेट(II)
(v) पेंटा एमिनीनिट्रिटो-O-कोबाल्ट(III)
(vi) हेक्सा एमिनिकोबाल्ट(III) सल्फेट
(vii) पोटेशियम ट्राइ(ऑक्सलेटो)क्रोमेट(III)
(viii) हेक्सा एमिनिप्लैटिनम(IV)
(ix) टेट्राब्रोमिडोकूप्रेट(II)
(x) पेंटा एमिनीनिट्रिटो-N-कोबाल्ट(III)
उत्तर दिखाएं
Answer
(i) $\left[\mathrm{Zn}(\mathrm{OH})_{4}\right]^{2-}$
(ii) $\mathrm{K_2}\left[\mathrm{PdCl_4}\right]$
(iii) $\left[\mathrm{Pt}\left(\mathrm{NH_3}\right)_{2} \mathrm{Cl_2}\right]$
(iv) $\mathrm{K_2}\left[\mathrm{Ni}(\mathrm{CN})_{4}\right]$
(v) $\left[\mathrm{Co}(\mathrm{ONO})\left(\mathrm{NH_3}\right)_{5}\right]^{2+}$
(vi) $\left[\mathrm{Co}\mathrm{(NH_3)_6}\right]_2\mathrm{(SO_4)_3}$
(vii) $\mathrm{K_3}\left[\mathrm{Cr}\left(\mathrm{C_2} \mathrm{O_4}\right)_{3}\right]$
(viii) $\left[\mathrm{Pt}\left(\mathrm{NH_3}\right)_{6}\right]^{4+}$
(ix) $\left[\mathrm{Cu}(\mathrm{Br})_{4}\right]^{2-}$
(x) $\left[\mathrm{Co}\left(\mathrm{NO_2}\right)\left(\mathrm{NH_3}\right)_{5}\right]^{2+}$
9.7 IUPAC नियमों के अनुसार निम्नलिखित के प्रणालीय नाम लिखिए:
(i) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{6}\right] \mathrm{Cl_3}$
(ii) $\left[\mathrm{Pt}\left(\mathrm{NH_3}\right)_{2} \mathrm{Cl}\left(\mathrm{NH_2} \mathrm{CH_3}\right)\right] \mathrm{Cl}$
(iii) $\left[\mathrm{Ti}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right]^{3+}$
(iv) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{4} \mathrm{Cl}\left(\mathrm{NO_2}\right)\right] \mathrm{Cl}$
(v) $\left[\mathrm{Mn}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right]^{2+}$
(vi) $\left[\mathrm{NiCl_4}\right]^{2-}$
(vii) $\left[\mathrm{Ni}\left(\mathrm{NH_3}\right)_{6}\right] \mathrm{Cl_2}$
(viii) $\left[\mathrm{Co}(\mathrm{en})_{3}\right]^{3+}$
(ix) $\left[\mathrm{Ni}(\mathrm{CO})_{4}\right]$
उत्तर दिखाएं
Answer
(i) षट्काम्मीनकोबाल्ट(III) क्लोराइड
(ii) द्विअम्मीनक्लोरिडो(मेथिलएमीन) प्लैटिनम(II) क्लोराइड
(iii) षट्क्वाटिटिनियम(III) आयन
(iv) टेट्रा-अम्मीनीक्लोरिडोनिट्रिटो-N-कोबाल्ट(III) क्लोराइड
(v) षट्क्वाटमैंगनीज(II) आयन
(vi) टेट्राक्लोरिडोनिकेलेट(II) आयन
(vii) षट्काम्मीननिकेल(II) क्लोराइड
(viii) ट्रिस(एथेन-1, 2-डाइएमीन) कोबाल्ट(III) आयन
(ix) टेट्राकार्बोनिलनिकेल(0)
9.8 संयोजन यौगिकों के लिए संभावित विभिन्न प्रकार के समावयवी रूप सूचित करें, और प्रत्येक के एक उदाहरण दें।
उत्तर दिखाएं
Answer
(a) ज्यामितीय समावयवी:
इस प्रकार के समावयवी विषमलेपिक संकेंद्रित यौगिकों में सामान्य होते हैं। इसके उत्पन्न होने के कारण लिगेंड के विभिन्न संभावित ज्यामितीय व्यवस्था होती है। उदाहरण के लिए:
समान अभिकर्मक
अनुक्रमित समान अभिकर्मक
(b) प्रकाश अभिकर्मकता:
इस प्रकार की अभिकर्मकता चिरल अणुओं में उत्पन्न होती है। अभिकर्मक एक दूसरे के दर्पण छवि होते हैं और एक दूसरे पर ठीक नहीं ठहर सकते हैं।
$\left[\mathrm{Co}(\mathrm{en})_{3}\right]^{3+}$ (दक्षिणावर्त)
$\left[\mathrm{Co}(\mathrm{en})_{3}\right]^{3+}$(वामावर्त)
(c) आंतरिक अभिकर्मकता: इस प्रकार की अभिकर्मकता ऐम्बिडेंटेट लिगेंड वाले जटिलों में पाई जाती है। उदाहरण के लिए:
$\underset {\text{पीला रूप}} {[\mathrm{Co}\mathrm{(NH_3)_5}\mathrm{(NO_2)}] \mathrm{Cl_2}}$ और $\underset {\text{लाल रूप}} {[\mathrm{Co}\mathrm{(NH_3)_5}(\mathrm{ONO}) \mathrm{Cl_2}]}$
पीला रूप लाल रूप
(d) समन्वय अभिकर्मकता:
इस प्रकार की अभिकर्मकता जब लिगेंड अलग-अलग धातु आयनों के समन्वय विशिष्ट धनात्मक और ऋणात्मक एंटिटी के बीच बदल जाते हैं तो उत्पन्न होती है।
$\left[\mathrm{Co}\mathrm{(NH_3)_6}\right]\left[\mathrm{Cr}\mathrm{(CN)_6}\right]$ और $\left[\mathrm{Cr}\mathrm{(NH_3)_6}\right]\left[\mathrm{Co}\mathrm{(CN)_6}\right]$
(e) आयनन अभिकर्मकता:
इस प्रकार की अभिकर्मकता जब एक विपरीत आयन एक लिगेंड के स्थान पर जाता है तो उत्पन्न होती है। इसलिए, जब एक घोल में पानी में घोले जाने पर विभिन्न आयन देते हैं लेकिन संघटन एक ही हो तो इन्हें आयनन अभिकर्मक कहते हैं। उदाहरण के लिए, $\left(\mathrm{Co}\mathrm{(NH_3)_5} \mathrm{SO_4}\right) \mathrm{Br}$ और $[\mathrm{Co}\mathrm{(NH_3)_5} \mathrm{Br} ]\mathrm{SO_4}$
(f) सॉल्वेट आइसोमरिज़म:
सॉल्वेट आइसोमर विभेदित होते हैं यह तय करते हैं कि सॉल्वेंट अणु धातु आयन के साथ सीधे बंधे हैं या क्रिस्टल लैटिस में मुक्त सॉल्वेंट अणु के रूप में मौजूद हैं।
$\underset{\text{बैंगनी}}{\left[\mathrm{Cr}\mathrm{(H_2O)_6}\right] \mathrm{Cl_3}\cdot \mathrm{H_2O}}$
$\underset{\text{ग्रे-हरा}}{\left[\mathrm{Cr}\mathrm{(H_2O)_5 \mathrm Cl }\right] \mathrm{Cl_2}\cdot \mathrm{H_2O}}$
9.9 निम्नलिखित संयोजन एंटिटिज़ में कितने ज्यामितीय आइसोमर संभव हैं?
(i) $\left[\mathrm{Cr}\left(\mathrm{C_2} \mathrm{O_4}\right)_3\right]^{3-}$
(ii) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_3 \mathrm{Cl_3}\right]$
उत्तर दिखाएं
उत्तर
(i) $\left[\mathrm{Cr}\left(\mathrm{C_2} \mathrm{O_4}\right)_{3}\right]^{3-}$ के लिए कोई ज्यामितीय आइसोमर संभव नहीं है क्योंकि यह एक द्विदंडी लिगेंड है।
(ii) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{3} \mathrm{Cl_3}\right]$
दो ज्यामितीय आइसोमर संभव हैं।
फेसियल
मेरिडियन
9.10 निम्नलिखित विकिरण आइसोमर के संरचनाएं बनाइए:
(i) $\left[\mathrm{Cr}\left(\mathrm{C_2} \mathrm{O_4}\right)_3\right]^{3-}$
(ii) $\left[\mathrm{PtCl_2}(\mathrm{en})_2\right]^{2+}$
(iii) $\left[\mathrm{Cr}\left(\mathrm{NH_3}\right)_2 \mathrm{Cl_2}(\mathrm{en})\right]^{+}$
उत्तर दिखाएं
Answer
(i) $\left[\mathrm{Cr}\left(\mathrm{C_2} \mathrm{O_4}\right)_{3}\right]^{3-}$
(ii) $\left[\mathrm{PtCl_2}(\mathrm{en})_{2}\right]^{2+}$
(iii) $\left[\mathrm{Cr}\left(\mathrm{NH_3}\right)_{2} \mathrm{Cl_2}(\mathrm{en})\right]^{+}$
9.11 सभी इसोमर (ज्यामितीय और प्रकाशिक) बनाएं:
(i) $\left[\mathrm{CoCl_2}(\mathrm{en})_2\right]^{+}$
(ii) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right) \mathrm{Cl}(\mathrm{en})_2\right]^{2+}$
(iii) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_2 \mathrm{Cl_2}(\mathrm{en})\right]^{+}$
उत्तर दिखाएं
Answer
(i) $\left[\mathrm{CoCl_2}(\mathrm{en})_{2}\right]^{+}$
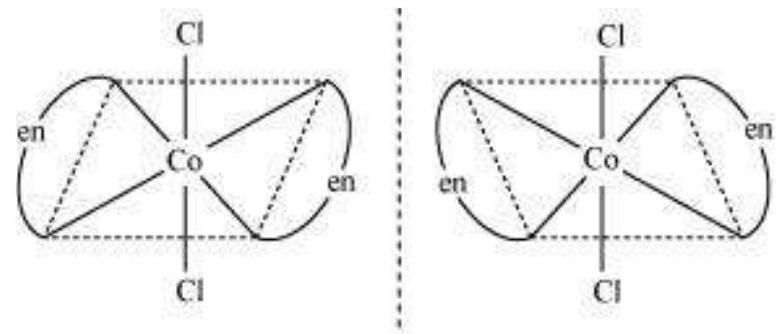
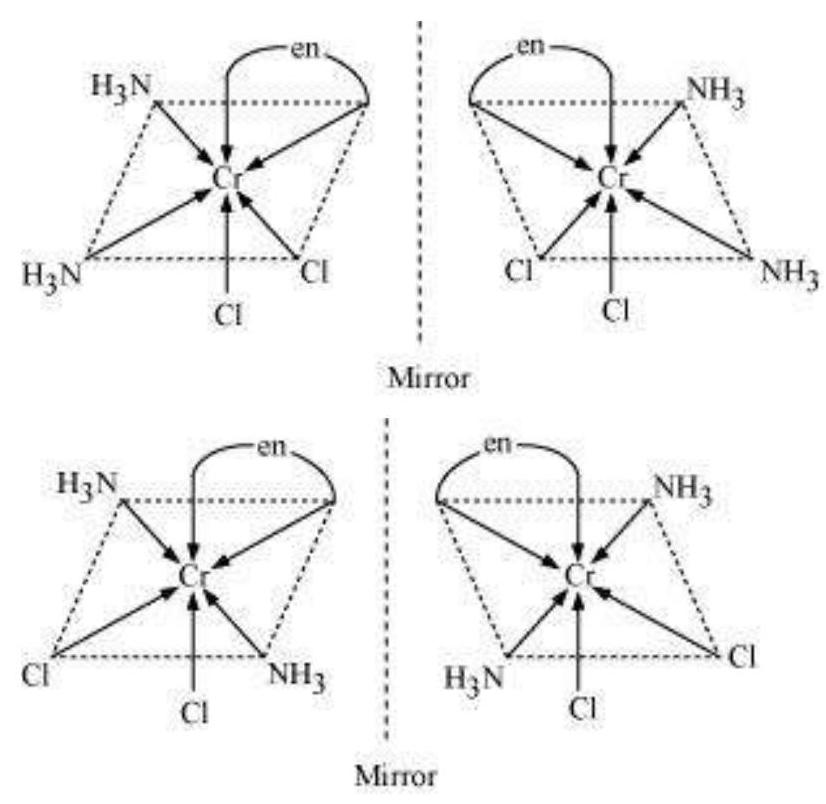
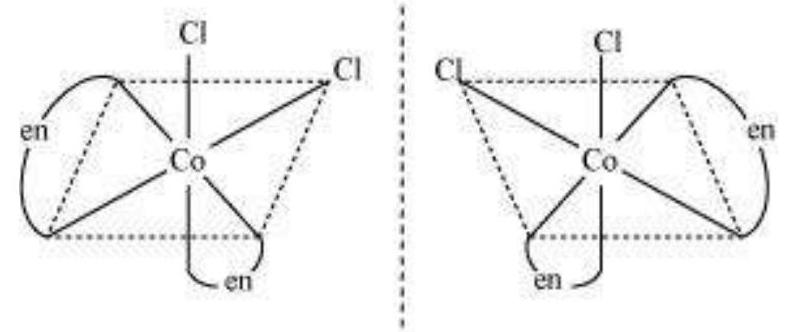
Trans $\left[\mathrm{CoCl_2}(\mathrm{en})_{2}\right]^{+}$ इसोमर-प्रकाशिक अक्रिय
(दर्पण छवि एक दूसरे के उपरिच्छेदी हैं)
Cis $\left[\mathrm{CoCl_2}(\mathrm{en})_{2}\right]^{+}$ इसोमर-प्रकाशिक रूप से सक्रिय
(असुमेलन दर्पण छवियाँ)
कुल मिलाकर, तीन इसोमर संभव हैं।
(ii) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right) \mathrm{Cl}(\text { en })_{2}\right]^{2+}$
अनुक्रमित इसोमर प्रकाशिक रूप से असक्रिय होते हैं।
संकर इसोमर प्रकाशिक रूप से सक्रिय होते हैं।
कुल मिलाकर, तीन इसोमर संभव हैं।
(iii) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{2} \mathrm{Cl_2}(\mathrm{en})\right]^{+}$

दिए गए यौगिक के लिए कुल मिलाकर, चार इसोमर हो सकते हैं जिनमें संकर रूप प्रकाशिक रूप से सक्रिय होता है और दो अनुक्रमित रूप प्रकाशिक रूप से असक्रिय होते हैं।
9.12 $\left[\mathrm{Pt}\left(\mathrm{NH_3}\right)(\mathrm{Br})(\mathrm{Cl})(\mathrm{py})\right]$ के सभी यांत्रिक इसोमर लिखिए और इनमें से कितने वस्तुओं के प्रकाशिक इसोमर दिखाई देंगे?
उत्तर दिखाएं
Answer
$\left[\mathrm{Pt}\left(\mathrm{NH_3}\right)(\mathrm{Br})(\mathrm{Cl})(\mathrm{py})\right.$

उपरोक्त इसोमर में से कोई भी प्रकाशिक इसोमर नहीं दिखाई देगा। वे सभी वर्गीय तलीय हैं और एक सममिति तल के अंतर्गत आते हैं।
9.13 जलीय कॉपर सल्फेट घोल (नीला रंग) देता है:
(i) जलीय पोटेशियम फ्लुओराइड के साथ हरा अवक्षेप और
(ii) एक चमकदार हरे रंग के घोल में जलीय पोटैशियम क्लोराइड। इन प्रयोग के परिणामों को समझाइए।
उत्तर दिखाएं
उत्तर
जलीय $\mathrm{CuSO_4}$ के रूप में $\left[\mathrm{Cu}\mathrm{(H_2O)_4}\right] \mathrm{SO_4}$ में मौजूद होता है। इसका नीला रंग $\left[\mathrm{Cu}\mathrm{(H_2O)_4}\right]^{2+}$ आयनों की उपस्थिति के कारण होता है।
(i) जब KF डाला जाता है:
$$ \left[\mathrm{Cu}\left(\mathrm{H_2} \mathrm{O}\right)_{4}\right]^{2+}+4 \mathrm{~F}^{-} \longrightarrow \underset{\text { (हरा) }}{[\mathrm{Cu(F)_4 } ]^{2-}} + 4 \mathrm {H_2O} $$
(ii) जब $\mathrm{KCl}$ डाला जाता है:
$$ \left[\mathrm{Cu}\left(\mathrm{H_2} \mathrm{O}\right)_{4}\right]^{2+}+4 \mathrm{Cl}^{-} \longrightarrow \underset{\text{(चमकदार हरा)}}{\left[\mathrm{CuCl_4}\right]^{2-}}+4 \mathrm{H_2} \mathrm{O} $$
दोनों मामलों में, कम बल लगाने वाले लिगेंड पानी को $\mathrm{F}^{-} $ और $\mathrm{Cl}^{-}$ आयनों द्वारा प्रतिस्थापित कर दिया जाता है।
9.14 जब अत्यधिक जलीय $\mathrm{KCN}$ तांबा सल्फेट के जलीय घोल में डाला जाता है तो बनने वाला संयोजन एंटिटी क्या होता है? जब $\mathrm{H_2} \mathrm{~S}(\mathrm{~g})$ इस घोल में पार किया जाता है तो तांबा सल्फाइड के अवक्षेप के लिए कारण क्या है?
उत्तर दिखाएं
उत्तर
$\mathrm{CuSO_4{(a q)}}+4 \mathrm{KCN{(a q)}} \longrightarrow \mathrm{K_2[Cu(CN)_4]} {(aq)} + \mathrm{K_2SO_4 {(aq)}} $
अर्थात, $\left[\mathrm{Cu}\mathrm{(H_2O)_4}\right]^{2+}+4 \mathrm{CN}^{-} \longrightarrow\left[\mathrm{Cu}\mathrm{(CN)_4}\right]^{2-}+4 \mathrm{H_2} \mathrm{O}$
इस प्रक्रिया में बनने वाला संयोजन एंटिटी $\mathrm{K_2[Cu(CN)_4]} . \mathrm{K_2}[\mathrm{Cu}\mathrm{(CN)_4}]$ एक बहुत स्थिर जटिल है, जो पानी में डाले जाने पर $\mathrm{Cu^{2+}}$ आयन देने के लिए विघटित नहीं होता। इसलिए, $\mathrm{Cu}^{2+}$ आयन तब तक अवक्षेपित नहीं होते हैं जब तक $\mathrm{H_2S {(g)}}$ घोल में पार नहीं किया जाता।
9.15 मूल्य बंध तर्क के आधार पर निम्नलिखित संयोजन एंटिटी में बंधन की प्रकृति के बारे में चर्चा कीजिए:
(i) $\left[\mathrm{Fe}(\mathrm{CN})_6\right]^{4-}$
(ii) $\left[\mathrm{FeF_6}\right]^{3-}$
(iii) $\left[\mathrm{Co}\left(\mathrm{C_2} \mathrm{O_4}\right)_{3}\right]^{3-}$
(iv) $\left[\mathrm{CoF_6}\right]^{3-}$
उत्तर दिखाएं
Answer
(i) $\left[\mathrm{Fe}(\mathrm{CN})_{6}\right]^{4-}$
ऊपर के समन्वयन यौगिक में, लौहा $ \mathrm{+II}$ ऑक्सीकरण अवस्था में होता है।
$\mathrm{Fe}^{2+}$ : इलेक्ट्रॉनिक विन्यास $3 d^{6}$ होता है
$\mathrm{Fe}^{2+}$ आयन के ऑर्बिटल:

क्योंकि $\mathrm{CN}^{-}$ एक मजबूत क्षेत्र लिगेंड है, इसके कारण $3 d$ इलेक्ट्रॉन के अनुनयन के लिए अनुनयन नहीं होता है।

केंद्रीय धातु आयन के चारों ओर छह लिगेंड हैं, इसलिए सबसे उपलब्ध हाइब्रिडाइजेशन $d^{2} s p^{3}$ है।
$\mathrm{Fe}^{2+}$ के $d^{2} s p^{3}$ हाइब्रिड ऑर्बिटल:
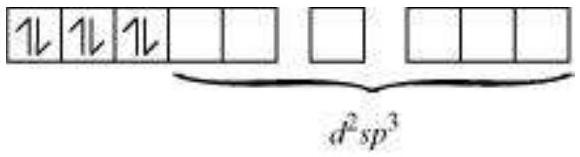
$\mathrm{CN}^{-}$ आयनों से 6 इलेक्ट्रॉन युग्म $d^{2} s p^{3}$ हाइब्रिड ऑर्बिटल में बैठे हैं।
तब,
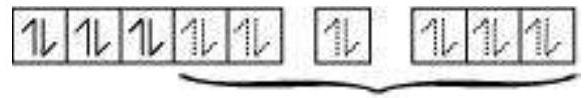
6 इलेक्ट्रॉन युग्म $6\ \mathrm{CN}^{-}$ आयनों से। अतः, यौगिक की ज्यामिति अष्टफलकीय है और यौगिक विषुवतीय (क्योंकि कोई अनुनयन इलेक्ट्रॉन नहीं है) है।
(ii) $\left[\mathrm{FeF_6}\right]^{3}$
इस यौगिक में, $\mathrm{Fe}$ का ऑक्सीकरण अवस्था +3 है।
$\mathrm{Fe}^{+3}$ आयन के ऑर्बिटल:
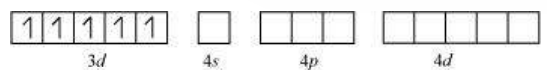
यहाँ 6 $\mathrm{~F}^{-}$ आयन हैं। इसलिए, यह $d^{2} s p^{3}$ या $s p^{3} d^{2}$ हाइब्रिडाइजेशन करेगा। क्योंकि $\mathrm{F}^{-}$ एक कम शक्ति क्षेत्र लिगेंड है, इसलिए यह $3 d$ ऑर्बिटल में इलेक्ट्रॉन के युग्मन का कारण नहीं बनता। इसलिए, सबसे संभावित हाइब्रिडाइजेशन $s p^{3} d^{2}$ है।
$\mathrm{Fe}$ के $s p^{3} d^{2}$ हाइब्रिडाइजेशन ऑर्बिटल:
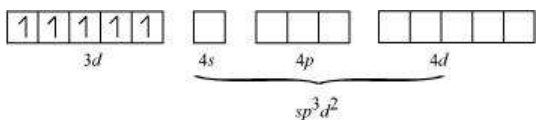
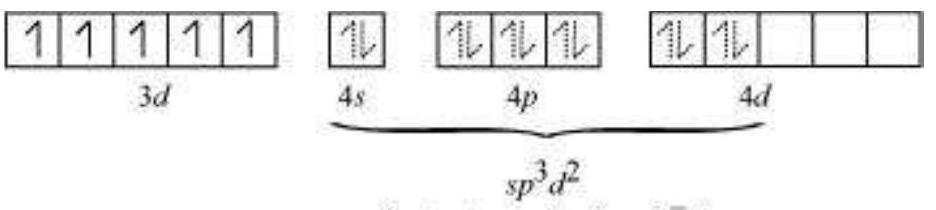
$\mathrm{F}^{-}$ आयन से 6 इलेक्ट्रॉन युग्म। इसलिए, यौगिक की ज्यामिति अष्टफलकीय ज्यामिति है।
(iii) $\left[\mathrm{Co}\left(\mathrm{C_2} \mathrm{O_4}\right)_{3}\right]^{3-}$
दिए गए यौगिक में कोबाल्ट +3 ऑक्सीकरण अवस्था में है।
$\mathrm{Co}^{3+}$ आयन के ऑर्बिटल:
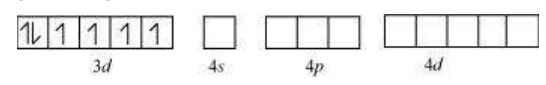
ऑक्सलेट एक कम शक्ति क्षेत्र लिगेंड है। इसलिए, यह $3 d$ ऑर्बिटल में इलेक्ट्रॉन के युग्मन का कारण नहीं बनता। चूंकि 6 लिगेंड हैं, हाइब्रिडाइजेशन $s p^{3} d^{2}$ या $d^{2} s p^{3}$ हो सकती है।
$s p^{3} d^{2}$ हाइब्रिडीकरण $\mathrm{Co}^{3+}$ के

3 ऑक्सलेट आयनों (ऑक्सलेट आयन एक द्विदंतीय लिगेंड है) से 6 इलेक्ट्रॉन युग्म $s p^{3} d^{2}$ ऑर्बिटल में बसे हुए हैं।

इसलिए, यौगिक की ज्यामिति अष्टफलकीय पाया जाता है।
(iv) $\left[\mathrm{CoF_6}\right]^{3-}$
कोबाल्ट +3 ऑक्सीकरण अवस्था में होता है।
$\mathrm{Co}^{3+}$ आयन के ऑर्बिटल:
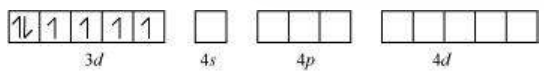
फ्लुओराइड आयन एक कम बल वाला लिगेंड है। यह $3 d$ इलेक्ट्रॉन के युग्मन का कारण नहीं बन सकता। इस कारण, $\mathrm{Co}^{3+}$ आयन $s p^{3} d^{2}$ हाइब्रिडीकरण करेगा।
$\mathrm{Co}^{3+}$ आयन के $s p^{3} d^{2}$ हाइब्रिडीकरण ऑर्बिटल हैं:
9.16 अष्टफलकीय क्रिस्टल क्षेत्र में $d$ ऑर्बिटल के विभाजन को दिखाने के लिए चित्र बनाएं।
उत्तर दिखाएं
उत्तर
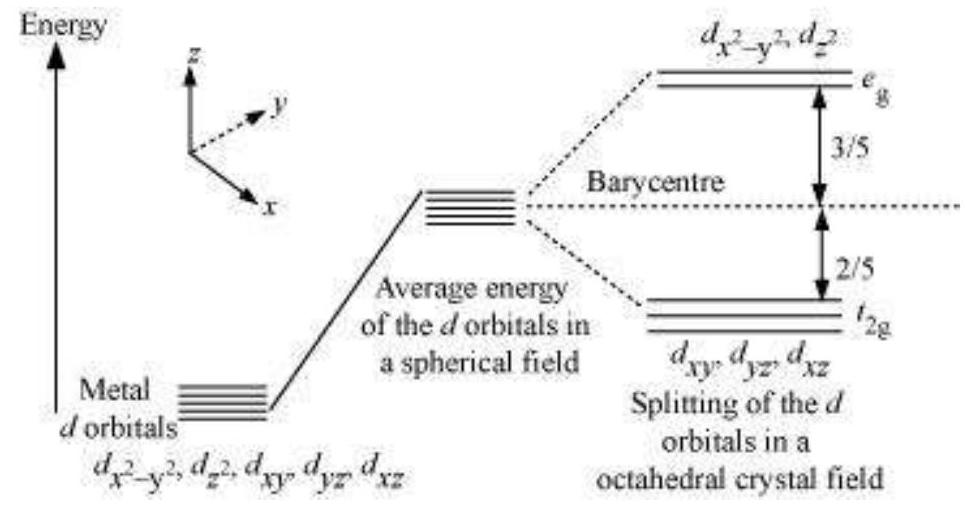
अष्टफलकीय क्षेत्र में $d$ ऑर्बिटल के विभाजन इस तरह होता है कि $d_{x^{2}-y^{2}}, d_{z^{2}}$ ऊर्जा में वृद्धि करते हैं और $e_{g}$ स्तर बनाते हैं, जबकि $d_{x y}, d_{y z}$ और $d_{xz}$ ऊर्जा में गिरते हैं और $t_{2 g}$ स्तर बनाते हैं।
9.17 स्पेक्ट्रोकेमिक श्रेणी क्या है? कम क्षेत्र लिगेंड और तीव्र क्षेत्र लिगेंड में अंतर समझाइए।
उत्तर दिखाएं
उत्तर
एक स्पेक्ट्रोकेमिक श्रेणी विभिन्न लिगेंड के आवेश विभाजन ऊर्जा (CFSE) मान के बढ़ते क्रम में व्यवस्थित करती है। श्रेणी के दाहिने छोर पर तीव्र क्षेत्र लिगेंड होते हैं जबकि बाएँ छोर पर कम क्षेत्र लिगेंड होते हैं। इसके अतिरिक्त, तीव्र क्षेत्र लिगेंड $d$ कक्षकों में अधिक विभाजन करते हैं जबकि कम क्षेत्र लिगें उनमें कम विभाजन करते हैं।
$ \mathrm{I}^{-} < \mathrm{Br}^{-} < \mathrm{S}^{2-}<\mathrm{SCN}^{-}<\mathrm{Cl}^{-}<\mathrm{N_3}<\mathrm{F}^{-}<\mathrm{OH}^{-}<\mathrm{C_2} \mathrm{O_4}{ }^{2-}< \mathrm{H_2} \mathrm{O}<\mathrm{NCS}^{-} < \mathrm{H}^{-}<\mathrm{CN}^{-}<\mathrm{NH_3}<$ en $< \mathrm{SO_3}{ }^{2-}<\mathrm{NO_2}^{-}<$ phen $<\mathrm{CO}$
9.18 क्रिस्टल क्षेत्र विभाजन ऊर्जा क्या है? एक संकर निर्माण एंटिटी में $d$ कक्षकों की वास्तविक व्यवस्था के लिए $\Delta_{\mathrm{o}}$ के मान कैसे निर्धारित करता है?
उत्तर दिखाएं
उत्तर
एक समान विभाजन $d$-कक्षक (एक गोलीय क्षेत्र परिवेश में) लिगेंड की उपस्थिति में दो स्तरों में विभाजित हो जाते हैं अर्थात $e_{g}$ और $t_{2 g}$। लिगेंड की उपस्थिति के कारण विभाजित समान स्तरों के विभाजन को क्रिस्टल-क्षेत्र विभाजन कहते हैं जबकि दो स्तरों $e_{g}$ और $t_{2 \mathrm{~g}}$ के बीच ऊर्जा अंतर को क्रिस्टल-क्षेत्र विभाजन ऊर्जा कहते हैं। इसे $\Delta_{0}$ से नोट किया जाता है।
कक्षकों के विभाजन के बाद, इलेक्ट्रॉनों के भराव का कार्य शुरू हो जाता है। तीन $t_{2 g}$ कक्षकों में प्रत्येक में एक इलेक्ट्रॉन भर जाने के बाद, चौथे इलेक्ट्रॉन के भराव के दो तरीके हो सकते हैं। यह $e_{g}$ कक्षक में प्रवेश कर सकता है (जिससे $t_{2 g}{ }^{3} e_{\mathrm{g}}{ }^{1}$ इलेक्ट्रॉनिक व्यवस्था बनती है) या $t_{2 \mathrm{~g}}$ कक्षक में इलेक्ट्रॉनों के युग्मन कर सकता है (जिससे $t_{2 g}{ }^{4} e_{g}{ }^{0}$ इलेक्ट्रॉनिक व्यवस्था बनती है)। यदि एक लिगेंड के $\Delta_{0}$ मान युग्मन ऊर्जा (P) से कम हो, तो इलेक्ट्रॉन $e_{g}$ कक्षक में प्रवेश करते हैं। दूसरी ओर, यदि एक लिगेंड के $\Delta_{0}$ मान युग्मन ऊर्जा (P) से अधिक हो, तो इलेक्ट्रॉन $t_{2 g}$ कक्षक में प्रवेश करते हैं।
9.19 $\left[\mathrm{Cr}\left(\mathrm{NH_3}\right)_6\right]^{3+}$ प्रामाणिक चुंबकीय है जबकि $\left[\mathrm{Ni}(\mathrm{CN})_4\right]^{2-}$ विपरीत चुंबकीय है। क्यों?
उत्तर दिखाएं
उत्तर
$\mathrm{Cr}$ +3 ऑक्सीकरण अवस्था में है अर्थात $d^{3}$ विन्यास। इसके अतिरिक्त, $\mathrm{NH_3}$ एक कम क्षेत्र लिगेंड है जो $3d$ ऑर्बिटल में इलेक्ट्रॉन के युग्मन को कारण बनता है नहीं।
$\mathrm{Cr}^{3+}$

इसलिए, यह $d^{2} s p^{3}$ हाइब्रिडाइजेशन करता है और $3d$ ऑर्बिटल में इलेक्ट्रॉन अयुग्मित रहते हैं। इसलिए, यह प्रामाणिक चुंबकीय प्रकृति का है।
$\left[\mathrm{Ni}(\mathrm{CN})_{4}\right]^{2-}$ में, Ni +2 ऑक्सीकरण अवस्था में है अर्थात $d^{8}$ विन्यास।
$\mathrm{Ni}^{2+}$
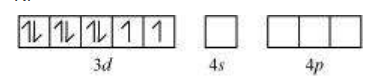
$\mathrm{CN}^{-}$ एक शक्तिशाली क्षेत्र लिगेंड है। यह $3d$ ऑर्बिटल इलेक्ट्रॉन के युग्मन को कारण बनता है। फिर, $\mathrm{Ni}^{2+}$ $d s p^{2}$ हाइब्रिडाइजेशन करता है।
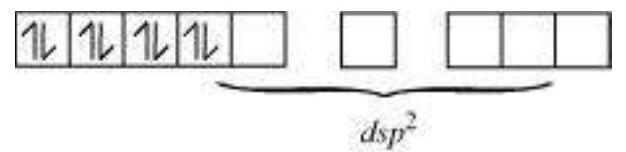
क्योंकि कोई अयुग्मित इलेक्ट्रॉन नहीं है, इसलिए यह विपरीत चुंबकीय है।
9.20 $\left[\mathrm{Ni}\left(\mathrm{H_2} \mathrm{O}\right)_6\right]^{2+}$ के घोल हरा होता है लेकिन $\left[\mathrm{Ni}(\mathrm{CN})_4\right]^{2-}$ के घोल रंगहीन होता है। क्यों?
उत्तर दिखाएं
उत्तर
$[\mathrm{Ni(H_2O)_6}]^{2+}$ में निम्न ऊर्जा स्तर से द-इलेक्ट्रॉन ऊँचे ऊर्जा स्तर में उत्प्रेरित हो सकते हैं अर्थात $d-d$ परिवर्तन की संभावना होती है। इसलिए, $\mathrm{Ni(H_2O)_6}]^{2+}$ रंगीन होता है।
In $\left[\mathrm{Ni}(\mathrm{CN}) _{4}\right]^{2 \cdot}$, इलेक्ट्रॉन सभी युग्मित हो जाते हैं क्योंकि $\mathrm{CN}^{-}$ एक मजबूत क्षेत्र लिगेंड है। अतः, $\left[\mathrm{Ni}(\mathrm{CN}) _{4}\right]^{2-}$ में $d-d$ संक्रमण संभव नहीं है। इसलिए, यह रंगहीन होता है।
9.21 $\left[\mathrm{Fe}(\mathrm{CN})_6\right]^{4-}$ और $\left[\mathrm{Fe}\left(\mathrm{H_2} \mathrm{O}\right)_6\right]^{2+}$ तनु विलयन में अलग-अलग रंगों के होते हैं। क्यों?
उत्तर दिखाएं
Answer
एक निश्चित संकर यौगिक के रंग के निर्धारण में क्रिस्टल-क्षेत्र विभाजन ऊर्जा, $\Delta$ के मान पर निर्भर करता है। इस CFSE के मान लिगेंड की प्रकृति पर निर्भर करता है। $\left[\mathrm{Fe}(\mathrm{CN}) _{6}\right]^{4-}$ और $\left[\mathrm{Fe}\left(\mathrm{H_2} \mathrm{O}\right) _{6}\right]^{2+}$ के मामले में रंग अलग होता है क्योंकि इनमें CFSE में अंतर होता है। अब, $CN^{-}$ एक मजबूत क्षेत्र लिगेंड है जिसका CFSE मान पानी के CFSE मान से अधिक होता है। इसका अर्थ यह है कि अंतर $d-d$ संक्रमण के लिए ऊर्जा अवशोषण में अंतर होता है। इसलिए, प्रसारित रंग में भी अंतर होता है।
9.22 धातु कार्बोनाइल के बंधन की प्रकृति के बारे में चर्चा करें।
उत्तर दिखाएं
Answer
(i) कार्बोनिल के कार्बन के इलेक्ट्रॉन युग्म के दान से धातु परमाणु के खाली ऑर्बिटल में $M \leftarrow C$ सिग्मा बंध का निर्माण होता है। यह दाता अधिरंजन होता है।
(ii) भरे हुए धातु d-ऑर्बिटल से वैकल्पिक बंधन अंतर अणुओं के $\pi^ *$ अंतर बंधन ऑर्बिटल में इलेक्ट्रॉन के दान से $M \rightarrow C \pi$ बंध का निर्माण होता है। यह पीछे का दान या पीछे का बंधन होता है। यह एक सहभागी प्रभाव उत्पन्न करता है और CO और धातु के बीच बंध को मजबूत करता है।
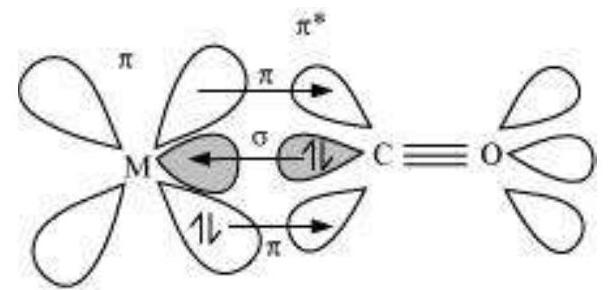
धातु कार्बोनाइल में सहभागी बंधन
9.23 निम्नलिखित यौगिकों में केंद्रीय धातु आयन के ऑक्सीकरण अवस्था, $d$ ऑर्बिटल उपस्थिति और समन्वय संख्या बताइए:
(i) $\mathrm{K_3}\left[\mathrm{Co}\left(\mathrm{C_2} \mathrm{O_4}\right)_3\right]$
(ii) cis- $\left[\mathrm{CrCl_2}(\mathrm{en})_{2}\right] \mathrm{Cl}$
(iii) $\left(\mathrm{NH_4}\right)_{2}\left[\mathrm{CoF_4}\right]$
(iv) $\left[\mathrm{Mn}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right] \mathrm{SO_4}$
उत्तर दिखाएं
उत्तर
(i) $\mathrm{K_3}\left[\mathrm{Co}\left(\mathrm{C_2} \mathrm{O_4}\right)_{3}\right]$
केंद्रीय धातु आयन Co है।
इसकी समन्वय संख्या 6 है।
ऑक्सीकरण अवस्था निम्नलिखित रूप में दी जा सकती है:
$x-6=-3$
$x=+3$
$\mathrm{Co}^{3+}$ के $d$ ऑर्बिटल उपस्थिति $t_{2 g}{ }^{6} e_{g}{ }^{0}$ है।
(ii) cis- $\left[\mathrm{Cr}(\mathrm{en})_{2} \mathrm{Cl_2}\right] \mathrm{Cl}$
केंद्रीय धातु आयन $\mathrm{Cr}$ है।
समन्वय संख्या 6 है।
ऑक्सीकरण अवस्था निम्नलिखित रूप में दी जा सकती है:
$x+2(0)+2(-1)=+1$
$x-2=+1$
$x=+3$
$\mathrm{Cr}^{3+}$ के $d$ ऑर्बिटल उपस्थिति $t_{2 g}{ }^{3}$ है।
(iii) $\left(\mathrm{NH_4}\right)_{2}\left[\mathrm{CoF_4}\right]$
केंद्रीय धातु आयन Co है।
समन्वय संख्या 4 है।
ऑक्सीकरण अवस्था निम्नलिखित रूप में दी जा सकती है:
$x-4=-2$
$x=+2$
$\mathrm{Co}^{2+}$ के $d$ ऑर्बिटल उपस्थिति $\mathrm{e}{ }^{4} t_{2}{ }^{3}$ है।
(iv) $\left[\mathrm{Mn}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right] \mathrm{SO_4}$
केंद्रीय धातु आयन Mn है।
समन्वय संख्या 6 है।
ऑक्सीकरण अवस्था निम्नलिखित रूप में दी जा सकती है:
$x+0=+2$
$x=+2$
$\mathrm{Mn}$ के $d$ ऑर्बिटल उपस्थिति $t_{2g}{ }^{3} e_{g}{ }^{2}$ है।
9.24 निम्नलिखित प्रत्येक यौगिक के IUPAC नाम लिखिए और ऑक्सीकरण अवस्था, इलेक्ट्रॉनिक विन्यास और समन्वय संख्या का संकेत दें। साथ ही, यौगिक की स्थानिक रासायनिक विन्यास और चुंबकीय आघूर्ण भी बताइए:
(i) $\mathrm{K}\left[\mathrm{Cr}\left(\mathrm{H_2} \mathrm{O}\right)_{2}\left(\mathrm{C_2} \mathrm{O_4}\right)_2\right] \cdot 3 \mathrm{H_2} \mathrm{O}$
(ii) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{5} \mathrm{Cl}\right] \mathrm{Cl_2}$
(iii) $\left[\mathrm{CrCl_3}(\mathrm{py})_{3}\right]$
(iv) $\mathrm{Cs}\left[\mathrm{FeCl_4}\right]$
(v) $\mathrm{K_4}\left[\mathrm{Mn}(\mathrm{CN})_{6}\right]$
उत्तर दिखाएं
Answer
(i) पोटेशियम डाइएक्वाडाइऑक्सलेटोक्रोमेट (III) ट्राइहाइड्रेट।
क्रोमियम की ऑक्सीकरण अवस्था $=3$
इलेक्ट्रॉनिक विन्यास: $3 d^{3}: t_{2 g}{ }^{3}$
कोऑर्डिनेशन संख्या $=6$
आकृति: अष्टफलकीय
स्थानिक रासायनिक विन्यास:
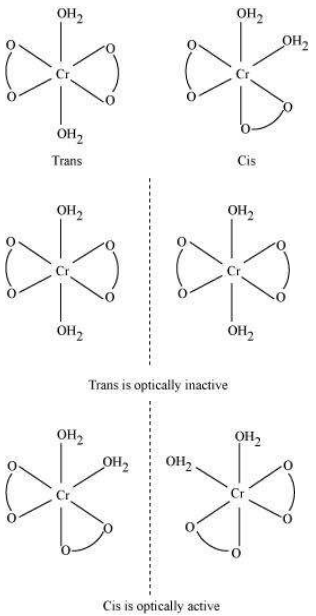
चुंबकीय आघूर्ण, $= \sqrt{n(n+2)}$
$=\sqrt{3(3+2)}$
$=\sqrt{15}\ \mathrm{BM}=3.873\ \mathrm{BM}$
(ii) $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{5} \mathrm{Cl}\right] \mathrm{Cl_2}$
IUPAC नाम: पेंटा एमीनी क्लोरिडो कोबाल्ट (III) क्लोराइड
कोबाल्ट की ऑक्सीकरण अवस्था $=+3$
कोऑर्डिनेशन संख्या $=6$
आकृति: अष्टफलकीय।
इलेक्ट्रॉनिक विन्यास: $d^{6}: t_{2g}{ }^{6}$.
स्थानिक रासायनिक विन्यास:

दिए गए यौगिक के लिए केवल एक आइसोमर संभव है।
चुंबकीय आघूर्ण $=0\ \mathrm{BM}$
(iii) $[\mathrm{CrCl_3}(\mathrm{py})_{3}]$
IUPAC नाम: ट्राइक्लोरिडो ट्राइपिरिडीन क्रोमियम (III)
क्रोमियम की ऑक्सीकरण अवस्था $=+3$
$ d^{3} $ के लिए इलेक्ट्रॉनिक विन्यास $ t_{2g}{ }^{3} $
कोऑर्डिनेशन संख्या $=6$
आकृति: अष्टफलकीय।
स्थानिक रासायनिक विन्यास:
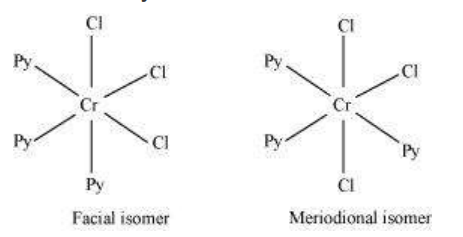
केवल मेरिडियन आइसोमर चुंबकीय अक्रिय है जबकि फेसियल आइसोमर चुंबकीय क्रियशील है इसलिए कुल तीन आइसोमर होंगे।
चुंबकीय आघूर्ण, $=\sqrt{n(n+2)}$
$=\sqrt{3(3+2)}$
$=\sqrt{15}\ \mathrm{BM}=3.873\ \mathrm{BM}$
(iv) $\mathrm{Cs}\left[\mathrm{FeCl_4}\right]$
IUPAC नाम: कैसियम टेट्राक्लोरोफेरेट (III)
$\mathrm{Fe}$ का ऑक्सीकरण अवस्था $=+3$
$ d^{5} $ की इलेक्ट्रॉनिक विन्यास: $ e_{g}{ }^{2} t_{2 g}{ }^{3} $
कोऑर्डिनेशन संख्या $=4$
आकृति: चतुष्फलकीय
स्टीरियोकेमिस्ट्री: प्रकाश के अनुप्रस्थ अक्षित
चुंबकीय आघूर्ण:
$=\sqrt{n(n+2)}$
$=\sqrt{5(5+3)}$
$=\sqrt{35}\ \mathrm{BM}=5.916\ \mathrm{BM}$
(v) $\mathrm{K_4}\left[\mathrm{Mn}(\mathrm{CN})_{6}\right]$
पोटेशियम हेक्सासाइनोमैंगनेट(II)
मैंगनीज का ऑक्सीकरण अवस्था $=+2$
इलेक्ट्रॉनिक विन्यास: $d^{5}: t_{2 g}{ }^{5}$
कोऑर्डिनेशन संख्या $=6$
आकृति: अष्टफलकीय।
स्टीरियोकेमिस्ट्री: प्रकाश के अनुप्रस्थ अक्षित
चुंबकीय आघूर्ण, $=\sqrt{n(n+2)}$
$=\sqrt{1(1+2)}$
$=\sqrt{3}$
$=1.732\ \mathrm{BM}$
9.25 क्रिस्टल क्षेत्र सिद्धांत के आधार पर $\left[\mathrm{Ti}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right]^{3+}$ कम्प्लेक्स के बैंगनी रंग की व्याख्या कीजिए।
उत्तर दिखाएं
कम्प्लेक्स $\left[\mathrm{Ti}\left(\mathrm{H}2 \mathrm{O}\right)6\right]^{3+}$ में, Ti परमाणु की ऑक्सीकरण अवस्था +3 है। इसकी बाहरी इलेक्ट्रॉनिक विन्यास $3 \mathrm{d}^1$ है। इसमें एक असुम्पन इलेक्ट्रॉन होता है। यह असुम्पन इलेक्ट्रॉन $t{2 g}$ स्तर से $\mathrm{e}{\mathrm{g}}$ स्तर में लाल रंग के प्रकाश के अवशोषण के कारण उत्तेजित होता है और इसलिए बैंगनी रंग का दिखाई देता है।

9.26 चेलेट अपघटन के अर्थ क्या है? एक उदाहरण दीजिए।
उत्तर दिखाएं
उत्तर
जब एक लिगेंड धातु आयन के साथ ऐसे तरीके से जुड़ता है जो एक वलय बनाता है, तो धातु-लिगेंड संयोजन अधिक स्थायी पाया जाता है। अन्य शब्दों में, हम कह सकते हैं कि वलय वाले संकुल बिना वलय वाले संकुल की तुलना में अधिक स्थायी होते हैं। इसे चेलेट अपघटन कहते हैं।
उदाहरण के लिए:
$ \begin{aligned} \mathrm{Ni^{2+} {(a q)}}+6 \mathrm{NH _3{(a q)}} \rightleftharpoons & {\left[\mathrm{Ni}\left(\mathrm{NH _3}\right) _{6}\right]^{2+} {(a q)} } \\ `
& \log \beta=7.99 \\ \mathrm{Ni^{2+} {(a q)}}+3 \mathrm{en {(a q)}} \rightleftharpoons & {\left[\mathrm{Ni}(\mathrm{en}) _{3}\right] ^{2+}{(a q)} } \\ & \log \beta=18.1 \\ & \text { (अधिक स्थायी) } \end{aligned} $
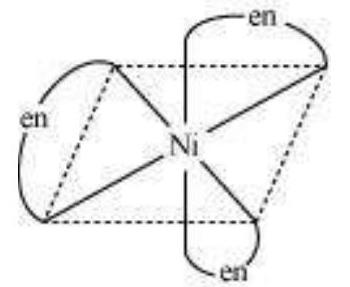
9.27 प्रत्येक स्थिति में उदाहरण देकर संयोजन यौगिकों के भूमिका के बारे में ब्रिफ चर्चा करें:
(i) जैविक प्रणालियों में
(ii) चिकित्सा रसायन विज्ञान में
(iii) विश्लेषणात्मक रसायन विज्ञान में
(iv) धातुओं के निष्कर्षण/खनन में
उत्तर दिखाएं
Answer
(i) जैविक प्रणालियों में संयोजन यौगिकों की भूमिका:
हम जानते हैं कि प्रकाश संश्लेषण के लिए क्लोरोफिल रंगक की उपस्थिति के कारण संभव होता है। यह रंगक मैग्नीशियम के एक संयोजन यौगिक है। मनुष्य के जैविक प्रणाली में कई संयोजन यौगिक महत्वपूर्ण भूमिका निभाते हैं। उदाहरण के लिए, रक्त के ऑक्सीजन-वाहक, अर्थात हीमोग्लोबिन, लोहा के एक संयोजन यौगिक है।
(ii) चिकित्सा रसायन विज्ञान में संयोजन यौगिकों की भूमिका:
कुछ प्लैटिन के संयोजन यौगिक (उदाहरण के लिए, सिस-प्लैटिन) का उपयोग कैंसर के विकास को रोकने के लिए किया जाता है।
(iii) विश्लेषणात्मक रसायन विज्ञान में संयोजन यौगिकों की भूमिका:
लवण विश्लेषण के दौरान, कई मूल धनात्मक अपघटकों का पता लगाया जाता है, जो विभिन्न प्रतिरक्षकों के साथ अपने रंग के परिवर्तन के कारण दिखाई देते हैं। ये रंग परिवर्तन विभिन्न लिगेंडों के साथ मूल धनात्मक अपघटकों द्वारा बनाए गए संयोजन यौगिकों या जटिलों के परिणाम होते हैं।
(iv) धातुओं के निष्कर्षण या खनन में संयोजन यौगिकों की भूमिका:
कुछ धातुओं के अपने अयस्क से निष्कर्षण की प्रक्रिया में संयोजन के निर्माण के लिए आवश्यकता होती है। उदाहरण के लिए, जलीय विलयन में, स्वर्ण कायनाइट आयनों के साथ संयोजन बनाता है जो $\left[\mathrm{Au}(\mathrm{CN})_{2}\right]$ होता है। इस विलयन से बाद में जिंक धातु के योग के द्वारा स्वर्ण को निष्कर्षित किया जाता है।
9.28 विलयन में संकुल $\mathrm{Co}\left(\mathrm{NH_3}\right)_6 \mathrm{Cl_2}$ से कितने आयन उत्पन्न होते हैं?
(i) 6
(ii) 4
(iii) 3
(iv) 2
उत्तर दिखाएँ
उत्तर
(iii) दिया गया संकुल $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{6}\right] \mathrm{Cl_2}$ के रूप में लिखा जा सकता है
इसलिए, $\left[\mathrm{Co}\left(\mathrm{NH_3}\right)_{6}\right]^{+}$ एवं दो $\mathrm{Cl}^{-}$ आयन उत्पन्न होते हैं।
9.29 निम्नलिखित आयनों में से किसके चुंबकीय आघूर्ण मान सर्वाधिक है?
(i) $\left[\mathrm{Cr}\left(\mathrm{H_2} \mathrm{O}\right)_6\right]^{3+}$
(ii) $\left[\mathrm{Fe}\left(\mathrm{H_2} \mathrm{O}\right)_6\right]^{2+}$
(iii) $\left[\mathrm{Zn}\left(\mathrm{H_2} \mathrm{O}\right)_6\right]^{2+}$
उत्तर दिखाएँ
उत्तर
(i) $\left[\mathrm{Cr}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right]^{3+}$ में असुमेलित इलेक्ट्रॉनों की संख्या = 3
तब, $=\sqrt{n(n+2)}$
$=\sqrt{3(3+2)}$
$=\sqrt{15}=3.873\ \mathrm{BM}$
(ii) $\left[\mathrm{Fe}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right]^{2+}$ में असुमेलित इलेक्ट्रॉनों की संख्या = 4
तब, $=\sqrt{4(4+2)}$
$=\sqrt{24}\ \mathrm{BM}=4.899\ \mathrm{BM}$
(iii) $\left[\mathrm{Zn}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right]^{2+}$ में असुमेलित इलेक्ट्रॉनों की संख्या = 0
अतः $\left[\mathrm{Fe}\left(\mathrm{H_2} \mathrm{O}\right)_{6}\right]^{2+}$ के चुंबकीय आघूर्ण मान सर्वाधिक है।
9.30 निम्नलिखित में से सबसे स्थायी संकुल है
(i) $\left[\mathrm{Fe}\left(\mathrm{H}_2 \mathrm{O}\right)_6\right]^{3+}$
(ii) $\left[\mathrm{Fe}\left(\mathrm{NH}_3\right)_6\right]^{3+}$
(iii) $\left[\mathrm{Fe}\left(\mathrm{C}_2 \mathrm{O}_4\right)_3\right]^{3-}$
(iv) $\left[\mathrm{FeCl}_6\right]^{3-}$
उत्तर दिखाएँ
उत्तर
हम जानते हैं कि एक संकुल की स्थायित्व चेलेटन द्वारा बढ़ जाती है। अतः सबसे स्थायी संकुल $\left[\mathrm{Fe}\left(\mathrm{C_2} \mathrm{O_4}\right)_{3}\right]^{3 .}$ है।
9.31 निम्नलिखित के लिए दृश्य तरंगदैर्ध्य के अवशोषण के सही क्रम क्या होगा:
$$ \left[\mathrm{Ni}\left(\mathrm{NO_2}\right)_6\right]^{4-},\left[\mathrm{Ni}\left(\mathrm{NH_3}\right)_6\right]^{2+},\left[\mathrm{Ni}\left(\mathrm{H_2} \mathrm{O}\right)_6\right]^{2+} ? $$
उत्तर दिखाएं
उत्तर
सभी तीन यौगिकों में केंद्रीय धातु आयन समान है। अतः दृश्य क्षेत्र में अवशोषण लिगेंड पर निर्भर करता है। लिगेंड के CFSE मान के आवेश श्रेणी में वृद्धि के क्रम में निम्नलिखित है:
$\mathrm{H_2} \mathrm{O}<\mathrm{NH_3}<\mathrm{NO_2}^{-}$
इसलिए, अवलोकन किए गए क्रिस्टल-क्षेत्र विभाजन के मान निम्नलिखित क्रम में होंगे: $\Delta _{\left(\mathrm{H _2} \mathrm{O}\right)}<\Delta _{\left(\mathrm{NH _3}\right)}<\Delta _{\left(\mathrm{NO _2}^{-}\right)}$
अतः दृश्य क्षेत्र में अवशोषण की तरंगदैर्ध्य निम्नलिखित क्रम में होंगी:
$\left[\mathrm{Ni}\left(\mathrm{H _2} \mathrm{O}\right) _{6}\right]^{2+}>\left[\mathrm{Ni}\left(\mathrm{NH_3}\right) _{6}\right]^{2+}>\left[\mathrm{Ni}\left(\mathrm{NO _2}\right) _{6}\right]^{4}$





