यूनिट 12 एल्डिहाइड, केटोन और कार्बॉक्सिलिक अम्ल
कार्बोनिल यौगिक अपने अनुप्रयोगों के कारण अनुप्रस्थ रसायन विज्ञान में बहुत महत्वपूर्ण हैं। वे कपड़ों, स्वादिष्ट तैयारी, प्लास्टिक और दवाओं के घटक हैं।
पिछले यूनिट में, आपने कार्बन-ऑक्सीजन एकल बंधन वाले कार्बनिक यौगिकों के बारे में अध्ययन किया है। इस यूनिट में, हम कार्बन-ऑक्सीजन द्विबंधन ( $>\mathrm{C}=\mathrm{O}$ ) वाले कार्बनिक यौगिकों के बारे में अध्ययन करेंगे, जिन्हें कार्बोनिल समूह कहा जाता है, जो अनुप्रस्थ रसायन विज्ञान में सबसे महत्वपूर्ण फंक्शनल समूहों में से एक है।
अल्डिहाइड में, कार्बोनिल समूह एक कार्बन और हाइड्रोजन के साथ जुड़ा होता है, जबकि केटोन में यह दो कार्बन परमाणुओं के साथ जुड़ा होता है। जब कार्बोनिल समूह के कार्बन कार्बन या हाइड्रोजन और हाइड्रॉक्सिल समूह (-OH) के ऑक्सीजन के साथ जुड़ा होता है, तो ऐसे कार्बोनिल यौगिकों को कार्बोक्सिलिक अम्ल कहा जाता है। जब कार्बन कार्बन या हाइड्रोजन और $-\mathrm{NH}_{2}$ समूह के नाइट्रोजन या हैलोजन के साथ जुड़ा होता है, तो ऐसे यौगिकों को क्रमशः एमाइड और एसिल हैलाइड कहा जाता है। एस्टर और ऐनहाइड्राइड कार्बोक्सिलिक अम्ल के अवलोकन हैं। इन वर्गों के यौगिों के सामान्य सूत्र नीचे दिए गए हैं:

अल्डिहाइड, केटोन और कार्बॉक्सिलिक अम्ल पादप और जन्तु जगत में व्यापक रूप से पाए जाते हैं। वे जीवन के बायोकेमिकल प्रक्रमों में महत्वपूर्ण भूमिका निभाते हैं। वे प्रकृति के गंध और स्वाद में योगदान देते हैं, उदाहरण के लिए, वैनिलिन (वैनिला बीन से), सलिसिलिक अल्डिहाइड (मैडो शॉट से) और सिनेमैल्डिहाइड (दारूचीन से) बहुत खूबसूरत गंध देते हैं।

इनका उपयोग खाद्य पदार्थों और चिकित्सा उत्पादों में गंध जोड़ने के लिए किया जाता है। इन फैमिली के कुछ सदस्य तेजाब (जैसे ऐसीटोन) के रूप में उत्पादित किए जाते हैं और चिपकाने के लिए, पेंट, रेजिन, गंधा, प्लास्टिक, कपड़े आदि जैसे सामग्रियों के निर्माण के लिए भी उपयोग किए जाते हैं।
8.1 कार्बोनिल समूह के नामकरण और संरचना
8.1.1 नामांकन
I. एल्डिहाइड और केटोन
एल्डिहाइड और केटोन सरलतम और सबसे महत्वपूर्ण कार्बोनिल यौगिक हैं।
एल्डिहाइड और केटोन के नामांकन के दो प्रणालियाँ होती हैं।
(a) सामान्य नाम
एल्डिहाइड और केटोन के अक्सर उनके IUPAC नाम के बजाय सामान्य नाम द्वारा जाना जाता है। अधिकांश एल्डिहाइड के सामान्य नाम उनके संगत कार्बोक्सिलिक अम्ल [अनुच्छेद 8.6.1] के सामान्य नाम से लिये जाते हैं, जहाँ अम्ल के अंत $-ic$ को एल्डिहाइड से बदल दिया जाता है। इसी तरह, नाम अम्ल या एल्डिहाइड के मूल स्रोत के लैटिन या ग्रीक शब्द को दर्शाते हैं। कार्बन शृंखला में स्थान ग्रीक अक्षर $\alpha, \beta, \gamma, \delta$ आदि द्वारा इंगित किया जाता है। $\alpha$-कार्बन वह होता है जो एल्डिहाइड समूह के सीधे जुड़ा होता है, $\beta$-कार्बन अगला होता है, आदि। उदाहरण के लिए

केटोन के सामान्य नाम दो ऐल्किल या ऐरिल समूहों के नाम से बनाए जाते हैं जो कार्बोनिल समूह के साथ जुड़े होते हैं। विस्थापकों के स्थान को ग्रीक वर्णों $\alpha~ \alpha^{\prime}, \beta~ \beta^{\prime}$ आदि द्वारा इंगित किया जाता है, जो कार्बोनिल समूह के समीपस्थ कार्बन परमाणुओं से शुरू होता है, जिन्हें $\alpha~ \alpha^{\prime}$ के रूप में दर्शाया जाता है। कुछ केटोन के ऐतिहासिक सामान्य नाम हैं, सरलतम डाइमेथिल केटोन को एसिटोन कहा जाता है। ऐल्किल फेनिल केटोन के नाम आमतौर पर एसिल समूह के नाम को “फेनोन” शब्द के सामेने जोड़कर दिया जाता है। उदाहरण के लिए

(b) IUPAC नाम
खुले शृंखला वाले एल्डिहाइड और केटोन के IUPAC नाम उनके संगत एल्केन के नाम से निर्मित किए जाते हैं, जहां अंत $–e$ को $–al$ और $–one$ से बदल दिया जाता है। एल्डिहाइड के मामले में सबसे लंबी कार्बन शृंखला को एल्डिहाइड समूह के कार्बन पर से गिना जाता है, जबकि केटोन के मामले में गिनाना कार्बोनिल समूह के करीब वाले छोर से शुरू होता है। प्रतिस्थापक शब्दों को अपने स्थान के साथ अक्षरानुक्रम में प्रीफिक्स किया जाता है। चक्रीय केटोन के मामले में भी इसी तरह की नियम लागू होती है, जहां कार्बोनिल कार्बन को एक संख्या दी जाती है। जब एल्डिहाइड समूह एक चक्र पर जुड़ा होता है, तो चक्रीय एल्केन के पूरे नाम के बाद “carbaldehyde” की विस्तारित विस्तार जोड़ दिया जाता है। चक्र के कार्बन परमाणुओं की गिनती एल्डिहाइड समूह से जुड़े कार्बन पर से शुरू होती है। बेंजीन चक्र पर एल्डिहाइड समूह वाले सरलतम औषधीय एल्डिहाइड का नाम “benzenecarbaldehyde” होता है। हालांकि, IUP,AC द्वारा “benzaldehyde” का सामान्य नाम भी स्वीकृत है। अन्य औषधीय एल्डिहाइड के नाम अतिरिक्त बेंजल्डिहाइड के रूप में दिया जाता है।

कुछ एल्डिहाइड और कीटोन के सामान्य और IUPAC नाम तालिका 8.1 में दिए गए हैं।
तालिका 8.1: कुछ एल्डिहाइड और कीटोन के सामान्य और IUPAC नाम

8.1.2 कार्बोनिल समूह की संरचना
कार्बोनिल कार्बन परमाणु $s p^{2}$-हाइब्रिडाइज़्ड होता है और तीन सिग्मा ( $\sigma$ ) बंध बनाता है। कार्बन के चौथा वैलेंस इलेक्ट्रॉन अपने $p$-कक्षक में रहता है और ऑक्सीजन के $p$-कक्षक के साथ ओवरलैप करके एक $\pi$-बंध बनाता है। इसके अतिरिक्त, ऑक्सीजन परमाणु के दो असंयोजी इलेक्ट्रॉन युग्म भी होते हैं। इस प्रकार, कार्बोनिल कार्बन और इसके तीन परमाणु एक ही तल में होते हैं और $\pi$-इलेक्ट्रॉन बादल इस तल के ऊपर और नीचे होता है। बंध कोण लगभग $120^{\circ}$ होते हैं, जो त्रिकोणीय समतलीय संरचना की उम्मीद के अनुरूप है (चित्र 8.1)।
चित्र 8.1 कार्बोनिल समूह के निर्माण के लिए ऑर्बिटल आरेख

कार्बन-ऑक्सीजन द्विबंध ऑक्सीजन के तुलना में कार्बन की उच्च विद्युत ऋणात्मकता के कारण ध्रुवीय होता है। अतः, कार्बोनिल कार्बन एक ऋणात्मक (लेविस अम्ल) केंद्र होता है और कार्बोनिल ऑक्सीजन एक धनात्मक (लेविस बेस) केंद्र होता है। कार्बोनिल यौगिकों में उच्च द्विध्रुव आघूर्ण होता है और एथर की तुलना में ध्रुवीय होते हैं। कार्बोनिल समूह की उच्च ध्रुवता को एक उदासीन (A) और एक द्विध्रुव (B) संरचना के बीच अनुवाद के आधार पर समझा जाता है जैसा कि चित्र में दिखाया गया है।

8.2 ऐल्डिहाइड और केटों के निर्माण
ऐल्डिहाइड और केटों के निर्माण के कुछ महत्वपूर्ण विधियाँ निम्नलिखित हैं:
8.2.1 ऐल्डिहाइड और केटों के निर्माण
1. एल्कोहल के ऑक्सीकरण द्वारा
एल्डिहाइड और केटोन आमतौर पर प्राथमिक और द्वितीयक एल्कोहल के ऑक्सीकरण द्वारा तैयार किए जाते हैं (यूनिट 11, कक्षा XII)।
2. एल्कोहल के डिहाइड्रोजनीकरण द्वारा
इस विधि का उपयोग वाष्पशील एल्कोहल के लिए उपयुक्त होता है और यह औद्योगिक अनुप्रयोग में भी उपयोगी होती है। इस विधि में एल्कोहल वाष्प भारी धातु उत्प्रेरक $(\mathrm{Ag}$ या $\mathrm{Cu})$ पर गुजरती हैं। प्राथमिक और द्वितीयक एल्कोहल क्रमशः एल्डिहाइड और केटोन बनाते हैं (यूनिट 11, कक्षा XII)।
3. हाइड्रोकार्बन से
(i) एल्कीन के ओजोनोलाइसिस द्वारा: जैसा कि हम जानते हैं, एल्कीन के ओजोनोलाइसिस के बाद जिंक धूल और पानी के साथ अभिक्रिया एल्डिहाइड, केटोन या एल्कीन के प्रतिस्थापन पैटर्न के आधार पर दोनों के मिश्रण के रूप में होती है (यूनिट 13, कक्षा XI)।
(ii) एल्काइन के हाइड्रोलाइसिस द्वारा: एथिलीन के जल के साथ अधिकार एच2एसओ4 और एचजीएसओ4 की उपस्थिति में एसिटेल्डिहाइड बनाता है। अन्य सभी एल्काइन इस अभिक्रिया में केटोन बनाते हैं (यूनिट 13, कक्षा XI)।
8.2.2 एल्डिहाइड के तैयारी
1. एसिल क्लोराइड (अम्ल क्लोराइड) से
एसिल क्लोराइड (एसिड क्लोराइड) को बारियम सल्फेट पर पालडियम कैटलिस्ट की उपस्थिति में हाइड्रोजनीकरण के माध्यम से अपचयित किया जाता है। इस अभिक्रिया को रोजेनमंड अपचयन कहते हैं।

2. नाइट्राइल और एस्टर से
नाइट्राइल को हाइड्रोक्लोरिक अम्ल की उपस्थिति में स्टैन्नस क्लोराइड की उपस्थिति में संगत इमाइन में अपचयित किया जाता है, जिसके जलअपघटन से संगत एल्डिहाइड प्राप्त होते हैं।

इस प्रतिक्रिया को स्टेफ़न प्रतिक्रिया कहते हैं।
एक वैकल्पिक तरीका यह है कि नाइट्राइल को डाइआइसोब्यूटिल एल्कोहल हाइड्राइड, (DIBAL-H) द्वारा चयनात्मक रूप से रेडकर ऐमीन के रूप में बनाया जाता है, जिसके बाद जल अपघटन द्वारा एल्डिहाइड बनाया जाता है:

उतना ही, एस्टर भी DIBAL-H के साथ एल्डिहाइड में घटाए जाते हैं।

3. हाइड्रोकार्बन से
आरोमैटिक एल्डिहाइड (बेंजल्डिहाइड और इसके अनुप्रस्थ वस्तुएं) निम्नलिखित विधियों द्वारा आरोमैटिक हाइड्रोकार्बन से तैयार किए जाते हैं:
(i) मेथिलबेंज़ीन के ऑक्सीकरण द्वारा
गहरे ऑक्सीकरण एजेंट टॉलूईन और इसके अनुप्रस्थ वस्तुएं बेंजोइक अम्ल में ऑक्सीकृत करते हैं। हालांकि, उपयुक्त रासायनिक एजेंटों के साथ ऑक्सीकरण को एल्डिहाइड चरण पर ही रोका जा सकता है जो मेथिल समूह को एक अंतराल बनाते हैं जो आगे ऑक्सीकरण के लिए कठिन होते हैं। इसके लिए निम्नलिखित विधियां उपयोग में लाई जाती हैं।
(a) क्रोमिल क्लोराइड $\left(\mathrm{CrO_2} \mathrm{Cl_2}\right)$ का उपयोग : क्रोमिल क्लोराइड मेथिल समूह को क्रोमियम जटिल के रूप में ऑक्सीकरण करता है, जिसके हाइड्रोलिज़ करने पर संगत बेंज़ल्डिहाइड बनता है।

इस प्रतिक्रिया को ईटार्ड प्रतिक्रिया कहते हैं।
(b) क्रोमिक ऑक्साइड $\left(\mathrm{CrO_3}\right)$ का उपयोग : टॉलूईन या टॉलूईन के विस्थापित यौगिक को ऐसीटिक ऐनहाइड्राइड में क्रोमिक ऑक्साइड के साथ अभिक्रिया कराने पर बेंजिलिडीन डाइएसीटेट बनता है। बेंजिलिडीन डाइएसीटेट को जलीय अम्ल के साथ हाइड्रोलिज़ करके संगत बेंज़ल्डिहाइड प्राप्त किया जा सकता है।

(ii) ओपर शैली चिल्लीकरण के बाद हाइड्रोलिज़िस द्वारा
टॉलूईन के ओपर शैली चिल्लीकरण से बेंजल क्लोराइड प्राप्त होता है, जिसके हाइड्रोलिज़िस द्वारा बेंजल डेहाइड बनता है। यह बेंजल डेहाइड के उत्पादन के एक व्यापारिक विधि है।

(iii) गैटरमैन - कोच अभिक्रिया
जब बेंजीन या इसके अवतरण अनुपस्थिति में अनुपस्थिति में अनुपस्थिति में अनुपस्थिति में अनुपस्थिति में अनुपस्थिति में अनुपस्थिति में अनुपस्थिति में अनुपस्थ एल्यूमिनियम क्लोराइड या क्यूप्रस क्लोराइड की उपस्थिति में कार्बन मोनोऑक्साइड और हाइड्रोजन क्लोराइड के साथ अभिक्रिया कराई जाती है, तो इससे बेंजैल्डिहाइड या बेंजैल्डिहाइड के अवतरण प्राप्त होते हैं।

इस अभिक्रिया को गैटरमैन-कोच अभिक्रिया कहा जाता है।
8.2.3 केटोन के तैयार करना
1. एसिल क्लोराइड से
एसिल क्लोराइड को डाइएल्किल कैडमियम के साथ उपचार देने से केटोन बनते हैं। डाइएल्किल कैडमियम को कैडमियम क्लोराइड के अभिक्रिया के माध्यम से ग्रिगनार्ड अभिकरक से तैयार किया जाता है।
$$ \begin{aligned} & 2 \mathrm{R}-\mathrm{Mg}-\mathrm{X}+\mathrm{CdCl_2} \longrightarrow \mathrm{R_2} \mathrm{Cd}+2 \mathrm{Mg}(\mathrm{X}) \mathrm{Cl} \end{aligned} $$
$$ \mathrm{2R^\prime}-\underset{\large\mathrm{O}}{\underset{\text{||}}{\mathrm{C}}} - \mathrm{Cl} + \mathrm{R_2Cd} \longrightarrow \mathrm{2R^\prime}-\underset{\large\mathrm{O}}{\underset{\text{||}}{\mathrm{C}}} - \mathrm{R} + \mathrm{CdCl_2}
$$
2. नाइट्राइल से
नाइट्राइल को ग्रिग्नार्ड रासायनिक अभिकर्मक के साथ उपचार करके उसके बाद हाइड्रोलिज़ करने से केटोन प्राप्त होता है।

3. बेंजीन या व्युत्पन्न बेंजीन से
जब बेंजीन या व्युत्पन्न बेंजीन को एसिड क्लोराइड के उपस्थिति में एनहाइड्रोस एल्यूमिनियम क्लोराइड के साथ उपचार किया जाता है, तो इससे संगत केटोन प्राप्त होता है। इस अभिक्रिया को रीडेल-क्राफ्ट एसिलेशन अभिक्रिया कहते हैं।

उदाहरण 8.1 निम्नलिखित परिवर्तनों के लिए अभिकर्मकों के नाम दीजिए:
(i) हेक्सेन-1-ऑल से हेक्सेनल
(ii) साइक्लोहेक्सेनॉल से साइक्लोहेक्सेनोन
(iii) $p$-फ्लूओरोटॉलूईन से
(iv) एथेननाइट्राइल से एथेनल $p$-फ्लूओरोबेंजल्डिहाइड
(v) एलील एल्कोहल से प्रोपेनल
(vi) ब्यूट-2-ईन से एथेनल
हल
(i) $\mathrm{C_5} \mathrm{H_5} \mathrm{NH}^{+} \mathrm{CrO_3} \mathrm{Cl}-(\mathrm{PCC})$
(ii) शुद्ध $\mathrm{CrO_3}$
(iii) $\mathrm{CrO_3}$ ऐसीटिक ऐनहाइड्राइड की उपस्थिति में
(iv) (डाइआइसोब्यूटिल) एल्यूमिनियम 1.$\mathrm{CrO_2} \mathrm{Cl_2}$ 2. $\mathrm{HOH}$
(v) PCC हाइड्राइड (DIBAL-H)
(vi) $\mathrm{O_3} / \mathrm{H_2} \mathrm{O}-\mathrm{Zn}$ धूल
8.3 भौतिक गुण
एल्डिहाइड और कीटोन के भौतिक गुण निम्नलिखित तरीके से वर्णित किए गए हैं।
मेथेनल कमरे के तापमान पर एक गैस है। एथेनल कमरे के तापमान पर एक वाष्पशील तरल है। अन्य एल्डिहाइड और कीटोन कमरे के तापमान पर तरल या ठोस होते हैं। एल्डिहाइड और कीटोन के क्वथनांक, तुलनात्मक अणुभार वाले हाइड्रोकार्बन और ईथर के अपेक्षाकृत अधिक होते हैं। इसका कारण एल्डिहाइड और कीटोन में द्विध्रुव-द्विध्रुव परस्पर क्रिया के कारण कमजोर अणुओं के संगठन होता है। इसके अतिरिक्त, इनके क्वथनांक, तुलनात्मक अणुभार वाले एल्कोहल के अपेक्षाकृत कम होते हैं क्योंकि इनमें अंतराणुक हाइड्रोजन बंधन की अनुपस्थिति होती है। निम्नलिखित यौगिकों के अणुभार 58 और 60 हैं जो बढ़ते क्रम में क्वथनांक के अनुसार व्यवस्थित किए गए हैं।
| b.p.(K) | Molecular Mass | |
|---|---|---|
| n-Butane | 273 | 58 |
| Methoxyethane | 281 | 60 |
| Propanal | 322 | 58 |
| Acetone | 329 | 58 |
| Propan-1-ol | 370 | 60 |
अल्डिहाइड और केटोन के निम्न सदस्य जैसे मेथेनल, एथेनल और प्रोपेनोन पानी के साथ सभी अनुपात में मिश्रण कर सकते हैं, क्योंकि वे पानी के साथ हाइड्रोजन बंधन बनाते हैं।

हालाँकि, एल्डिहाइड और केटोन के विलेयता एल्किल शृंखला की लंबाई बढ़ने के साथ-साथ तेजी से कम हो जाती है। सभी एल्डिहाइड और केटोन बेंज़ीन, ईथर, मेथनॉल, क्लोरोफॉर्म आदि जैसे कार्बनिक विलायकों में अच्छी तरह से विलेय होते हैं। छोटे एल्डिहाइड तीखे और तीखे गंध वाले होते हैं। जैसे ही अणु के आकार बढ़ता है, गंध कम तीखी और अधिक फूंसी वाली हो जाती है। वास्तविक रूप से, कई प्राकृतिक एल्डिहाइड और केटोन फूंसी और स्वाद निर्माण एजेंटों के मिश्रण में उपयोग किए जाते हैं।
उदाहरण 8.2 निम्नलिखित यौगिकों को उनके क्वथनांक के बढ़ते क्रम में व्यवस्थित कीजिए:
$\mathrm{CH_3} \mathrm{CH_2} \mathrm{CH_2} \mathrm{CHO},\quad \mathrm{CH_3} \mathrm{CH_2} \mathrm{CH_2} \mathrm{CH_2} \mathrm{OH},\quad \mathrm{H_5} \mathrm{C_2}-\mathrm{O}-\mathrm{C_2} \mathrm{H_5},\quad \mathrm{CH_3} \mathrm{CH_2} \mathrm{CH_2} \mathrm{CH_3}$
हल इन यौगिकों के अणुभार 72 से 74 के बीच है। केवल ब्यूटेन-1-ऑल अणुओं के बीच व्यापक अंतराणुक हाइड्रोजन बंधन के कारण संबंधित होते हैं, इसलिए ब्यूटेन-1-ऑल के क्वथनांक सबसे अधिक होगा। ब्यूटेनल ईथेनऑक्सी ईथेन की तुलना में अधिक ध्रुवीय है। इसलिए, पहले के अंतराणुक द्विध्रुव-द्विध्रुव आकर्षण बल अधिक होते हैं। $n$-पेंटेन अणुओं में केवल कमजोर वैन डर वाल्स बल होते हैं। इसलिए, दिए गए यौगिकों के क्वथनांक के बढ़ते क्रम निम्नलिखित हैं:
$\mathrm{CH_3} \mathrm{CH_2} \mathrm{CH_2} \mathrm{CH_3}<\mathrm{H_5} \mathrm{C_2}-\mathrm{O}-\mathrm{C_2} \mathrm{H_5}<\mathrm{CH_3} \mathrm{CH_2} \mathrm{CH.
8.4 रासायनिक अभिक्रियाएं
क्योंकि एल्डिहाइड और केटोन दोनों कार्बोनिल कार्य करणीय समूह के साथ उपस्थित होते हैं, इनके एक दूसरे के समान रासायनिक अभिक्रियाएं होती हैं।
1. न्यूक्लिओफिलिक योग अभिक्रियाएं
अल्कीन में देखे जाने वाले इलेक्ट्रॉन अभिकर्षी योग अभिक्रियाओं के विपरीत, एल्डिहाइड और केटोन न्यूक्लिओफिलिक योग अभिक्रियाएं अनुभव करते हैं।
(i) न्यूक्लिओफिलिक योग अभिक्रियाओं के यांत्रिक चरण
एक न्यूक्लिओफिल एल्डिहाइड और केटोन के ध्रुवीकृत कार्बोनिल समूह के इलेक्ट्रॉन अभिकर्षी कार्बन परमाणु पर लगभग एल्कोनिल कार्बन के $s p^{2}$ हाइब्रिडाइज़्ड ऑर्बिटल के तल के लम्बवत दिशा में हमला करता है (चित्र 8.2)। इस प्रक्रिया में कार्बन के हाइब्रिडाइज़ेशन से $s p^{2}$ से $s p^{3}$ में परिवर्तन होता है और एक टेट्राहेड्रल एल्कॉक्साइड अंतराल उत्पन्न होता है। यह अंतराल अभिक्रिया माध्यम से एक प्रोटॉन को अपनाकर विद्युत रूप से उदासीन उत्पाद बनाता है। इस प्रक्रिया का परिणाम चित्र 8.2 में दिखाए गए अनुसार कार्बन-ऑक्सीजन द्विबंध पर $\mathrm{Nu}^{-}$ और $\mathrm{H}^{+}$ के योग होता है।

चित्र 8.2: कार्बोनिल कार्बन पर न्यूक्लिओफिलिक हमला
(ii) प्रतिक्रियाशीलता
एल्डिहाइड न्यूक्लिओफिलिक योग क्रियाओं में केटोन की तुलना में सामान्यतः अधिक प्रतिक्रियाशील होते हैं, जिसमें स्थानीय और विद्युत आवेश के कारण होता है। स्थानीय दृष्टि से, केटोन में दो अपेक्षाकृत बड़े समूहों की उपस्थिति कार्बोनिल कार्बन पर न्यूक्लिओफिल के पहुँचने को रोकती है, जबकि एल्डिहाइड में केवल एक ऐसा समूह होता है। विद्युत आवेश के दृष्टि से, एल्डिहाइड केटोन की तुलना में अधिक प्रतिक्रियाशील होते हैं क्योंकि दो ऐल्किल समूह अधिक प्रभावपूर्वक कार्बोनिल कार्बन के विद्युत धनात्मकता को कम करते हैं।
उदाहरण 8.3 आप बेंजल्डिहाइड और प्रोपेनल में न्यूक्लिओफिल योग अभिक्रिया में बेंजल्डिहाइड की अधिक या कम प्रतिक्रियाशीलता की उम्मीद करेंगे? अपने उत्तर की व्याख्या करें।
हल बेंजल्डिहाइड के कार्बोनिल समूह के कार्बन परमाणु कम विद्युत धनात्मक होता है जबकि प्रोपेनल में कार्बोनिल समूह के कार्बन परमाणु अधिक विद्युत धनात्मक होता है।

बेंजल्डिहाइड में कार्बोनिल समूह की विद्युत धनात्मकता अनुनाद के कारण कम हो जाती है जैसा कि नीचे दिखाया गया है और इसलिए यह प्रोपेनल की अपेक्षा कम प्रतिक्रियाशील होता है।
(iii) कार्बोक्सिलिक अम्लों के नाभिक योग एवं नाभिक योग-उत्पादन अभिक्रियाओं के कुछ महत्वपूर्ण उदाहरण:
(a) हाइड्रोजन साइनाइड (HCN) का योग: एल्डिहाइड एवं केटोन एल्डिहाइड एवं केटोन हाइड्रोजन साइनाइड ( $\mathrm{HCN}$ ) के साथ अभिक्रिया करके साइनोहाइड्रिन बनाते हैं। यह अभिक्रिया शुद्ध HCN के साथ बहुत धीमी गति से होती है। इसलिए, इसे एक क्षारक द्वारा उत्प्रेरित किया जाता है और उत्पन्न साइनाइड आयन $\left(\mathrm{CN}^{-}\right)$ एक शक्तिशाली नाभिक होता है जो कार्बोनिल यौगिकों में आसानी से योग करके संगत साइनोहाइड्रिन बनाता है। साइनोहाइड्रिन संश्लेषण के महत्वपूर्ण मध्यस्थ होते हैं।

(ब) सोडियम हाइड्रोजन सल्फाइट के योग: सोडियम हाइड्रोजन सल्फाइट एल्डिहाइड और केटोन के साथ योग करता है और योग उत्पाद बनाता है।
अधिकांश एल्डिहाइड के लिए सामान्यतः साम्यावस्था दाहिने ओर और अधिकांश केटोन के लिए बाएँ ओर होती है, जिसके कारण स्थानीय अवरोधन के कारण। हाइड्रोजन सल्फाइट योग यौगिक पानी में घुलनशील होता है और इसे तनु खनिज अम्ल या क्षारक के साथ उपचार करके मूल कार्बोनिल यौगिक में परिवर्तित किया जा सकता है। इसलिए, ये एल्डिहाइड के अलग करने और सफ़ाई के लिए उपयोगी होते हैं।

(c) ग्रिग्नार्ड अभिकर्मकों के योग: (इकाई 7, कक्षा XII के संदर्भ में देखें)।
(d) एल्कोहल के योग: एल्डिहाइड शुष्क हाइड्रोजन क्लोराइड की उपस्थिति में एक तुल्यांक एकल हाइड्रोक्सिल एल्कोहल के साथ अभिक्रिया करते हैं और एल्कोक्सी एल्कोहल अंतराल बनाते हैं, जिसे हेमीएसिटल कहा जाता है, जो आगे एक अतिरिक्त एल्कोहल अणु के साथ अभिक्रिया करते हैं और $a~ gem$-डाइएल्कोक्सी यौगिक बनाते हैं, जिसे एसिटल कहा जाता है, जैसा कि अभिक्रिया में दिखाया गया है।
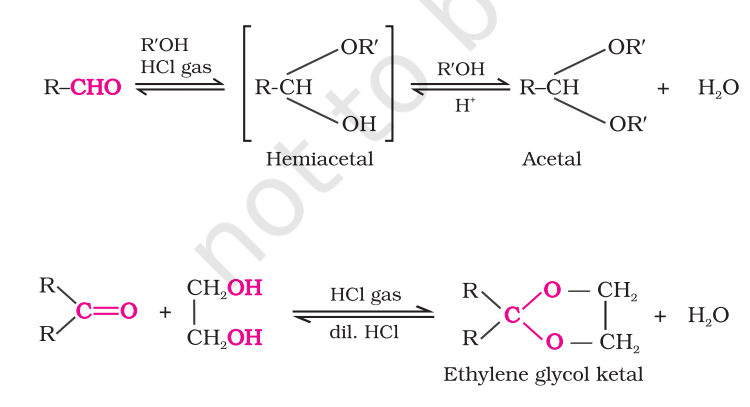
केटोन एथिलीन ग्लाईकॉल के समान शर्तों में अभिक्रिया करते हैं और एथिलीन ग्लाईकॉल केटल के रूप में चक्रीय उत्पाद बनाते हैं।
शुष्क हाइड्रोजन क्लोराइड कार्बोनिल यौगिकों के ऑक्सीजन को प्रोटॉनिकरण करता है और इस प्रकार कार्बोनिल कार्बन की इलेक्ट्रॉन अभिकर्षी बल को बढ़ाता है जिससे एथिलीन ग्लाईकॉल के न्यूक्लियोफिलिक हमला सुगम हो जाता है। एसीटल और केटल जलीय खनिज अम्लों के साथ हाइड्रोलाइज़ किए जाते हैं जिससे क्रमशः संगत एल्डिहाइड और केटोन प्राप्त होते हैं।
(e) अमोनिया एवं इसके अपवाहक: न्यूक्लिओफाइल, जैसे अमोनिया एवं इसके अपवाहक $\mathrm{H_2} \mathrm{~N}-\mathrm{Z}$ एल्डिहाइड एवं कीटोन के कार्बोनिल समूह में जुड़ते हैं। अभिक्रिया उत्क्रमणीय होती है एवं अम्ल द्वारा उत्प्रेरित होती है। साम्य तीव्र विलयन के माध्यम से मध्यवर्ती के जल अपघटन द्वारा उत्पाद के निर्माण की ओर झुकता है जिससे $>C=N-Z$ बनता है।

$$ \mathrm{Z}=\text { ऐल्किल, ऐरिल, } \mathrm{OH}, \mathrm{NH_2}, \mathrm{C_6} \mathrm{H_5} \mathrm{NH}, \mathrm{NHCONH_2} \text {, आदि } $$
सारणी 8.2- संतुलन उत्पाद के निर्माण के पक्ष में है क्योंकि मध्यवर्ती के तेजी से जल अपघटन से $>\mathrm{C}=\mathrm{N}-\mathrm{Z}$ का निर्माण होता है।

2. कमी
(i) ऐल्कोहल में कमी: ऐल्डिहाइड और केटोन सोडियम बोरोहाइड्राइड $\left(\mathrm{NaBH_4}\right)$ या लिथियम ऐलुमिनियम हाइड्राइड $\left(\mathrm{LiAlH_4}\right)$ द्वारा या कैटलिटिक हाइड्रोजनेशन द्वारा क्रमशः प्राथमिक और द्वितीयक ऐल्कोहल में कमी पाते हैं (इकाई 7, कक्षा XII)।
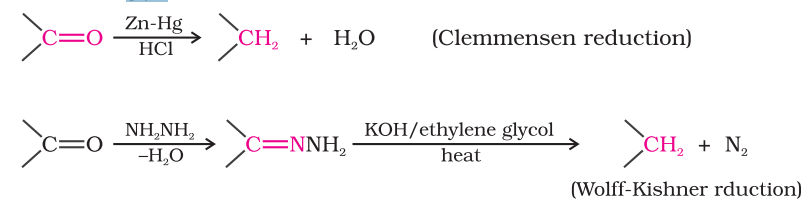
(ii) हाइड्रोकार्बन में कमी: ऐल्डिहाइड और केटोन के कार्बोनिल समूह को जिंक एमलगम और सांद्रित हाइड्रोक्लोरिक अम्ल के साथ उपचार के द्वारा $\mathrm{CH_2}$ समूह में कमी पाते हैं [क्लेमेन्सन कमी] या हाइड्राजीन के साथ उच्च क्वथन बिंदु वाले विलायक जैसे एथिलीन ग्लाइकॉल में गर्म करके सोडियम या पोटैशियम हाइड्रॉक्साइड के साथ उपचार के द्वारा (वॉल्फ-किशनर कमी)।
बर्नहार्ड टॉलेन्स (1841-1918) जर्मनी के गॉटिंगेन विश्वविद्यालय के रसायन विज्ञान के प्रोफेसर थे।
3. ऑक्सीकरण
एल्डिहाइड अपने ऑक्सीकरण अभिक्रियाओं में केटोन्स से भिन्न होते हैं। एल्डिहाइड सामान्य ऑक्सीकारक एजेंटों, जैसे नाइट्रिक अम्ल, पोटैशियम परमैंगनेट, पोटैशियम डाइक्रोमेट आदि के साथ उपचार के दौरान आसानी से कार्बॉक्सिलिक अम्ल में ऑक्सीकृत हो जाते हैं। भले ही शांत ऑक्सीकारक एजेंट, मुख्य रूप से टॉलेन्स का अभिकरक और फेलिंग्स का अभिकरक भी एल्डिहाइड को ऑक्सीकृत करते हैं।
$$\mathrm{R-CHO} \xrightarrow{\mathrm{[O]}}\mathrm{R-COOH} $$
कीटोन के आमतौर पर तीव्र शर्तों में, अर्थात, मजबूत ऑक्सीकरण एजेंट और उच्च तापमान पर ऑक्सीकृत किया जाता है। उनके ऑक्सीकरण में कार्बन-कार्बन बंध के तोड़ने के माध्यम से होता है जिससे मूल कीटोन की तुलना में कम संख्या में कार्बन परमाणु वाले कार्बॉक्सिलिक अम्ल के मिश्रण के उत्पादन होता है।

The mild oxidising agents given below are used to distinguish aldehydes from ketones:
(i) Tollens’ test: On warming an aldehyde with freshly prepared ammoniacal silver nitrate solution (Tollens’ reagent), a bright silver mirror is produced due to the formation of silver metal. The aldehydes are oxidised to corresponding carboxylate anion. The reaction occurs in alkaline medium.
$\mathrm{RCHO}+2\left[\mathrm{Ag}\left(\mathrm{NH_3}\right)_{2}\right]^{+}+3 \overline{\mathrm{O}} \mathrm{H} \longrightarrow \mathrm{RCO} \overline{\mathrm{O}}+2 \mathrm{Ag}+2 \mathrm{H_2} \mathrm{O}+4 \mathrm{NH_3}$
(ii) फेलिंग के परीक्षण: फेलिंग रासायनिक द्रव्य दो समाधानों, फेलिंग घोल A और फेलिंग घोल B से बना होता है। फेलिंग घोल A जलीय कॉपर सल्फेट होता है और फेलिंग घोल B क्षारीय सोडियम पोटैशियम टारटेट (रोचेल साल्ट) होता है। इन दोनों घोलों को परीक्षण से पहले समान मात्रा में मिश्रित किया जाता है। एल्डिहाइड को फेलिंग रासायनिक द्रव्य के साथ गर्म करने पर लाल-भूरा अवक्षेप प्राप्त होता है। एल्डिहाइड उनके संगत कार्बोक्सिलेट एनियन में ऑक्सीकृत हो जाते हैं। औषधीय एल्डिहाइड इस परीक्षण में प्रतिक्रिया नहीं देते हैं।
$$ \mathrm{R}-\mathrm{CHO}+2 \mathrm{Cu}^{2+}+5 \overline{\mathrm{O}} \mathrm{H} \longrightarrow \underset{\text { लाल-भूरा अवक्षेप }}{\mathrm{RCO} \overline{\mathrm{O}}+\mathrm{Cu_2} \mathrm{O}+3 \mathrm{H_2} \mathrm{O}} $$
$$
(iii) मेथिल कीटोन के ऑक्सीकरण हैलोफॉर्म प्रतिक्रिया द्वारा: ऐल्डिहाइड और कीटोन जिनमें कार्बोनिल कार्बन पर कम से कम एक मेथिल समूह जुड़ा होता है (मेथिल कीटोन), सोडियम हाइपोहैलाइट द्वारा ऑक्सीकृत होते हैं जिससे उनके संगत कार्बोक्सिलिक अम्ल के सोडियम लवण बनते हैं जो कार्बोनिल यौगिक के तुलना में एक कार्बन कम होता है। मेथिल समूह हैलोफॉर्म में परिवर्तित हो जाता है। यदि अणु में कार्बन-कार्बन डबल बांड उपस्थित हो, तो इस ऑक्सीकरण के प्रभाव नहीं पड़ता।

Iodoform reaction with sodium hypoiodite is also used for detection of $\mathrm{CH_3} \mathrm{CO}$ group or $\mathrm{CH_3} \mathrm{CH}(\mathrm{OH})$ group which produces $\mathrm{CH_3} \mathrm{CO}$ group on oxidation.
उदाहरण 8.4
एक आवृत्ति यौगिक (A) जिसका अणुसूत्र $\mathrm{C_8} \mathrm{H_8} \mathrm{O}$ है, 2,4-DNP अभिकर्मक के साथ लाल-पीला अवक्षेप बनाता है और नैत्रिक तन्य विलयन की उपस्थिति में आयोडीन के साथ गरम करने पर पीला अवक्षेप देता है। यह टॉलेन्स के या फेलिंग के अभिकर्मक को कम नहीं करता है, और ब्रोमीन जल या बेयरर के अभिकर्मक के साथ रंग नहीं छोड़ता है। च्रोमिक अम्ल के तीव्र ऑक्सीकरण से यह एक कार्बॉक्सिलिक अम्ल (B) बनाता है जिसका अणुसूत्र $\mathrm{C_7} \mathrm{H_6} \mathrm{O_2}$ है। यौगिक (A) और (B) की पहचान करें और शामिल रासायनिक अभिक्रियाओं की व्याख्या करें।
हल (A) 2,4-डीएनपी अवतरण बनाता है। इसलिए, यह एल्डिहाइड या केटोन है। क्योंकि यह टॉलेन्स या फेलिंग अभिकर्मक को कम नहीं करता, (A) एक केटोन होना चाहिए। (A) आयोडोफॉर्म परीक्षण के लिए प्रतिक्रिया करता है। इसलिए, यह एक मेथिल केटोन होना चाहिए। (A) के अणुसूत्र से अधिक असंतृप्तता की उपस्थिति को दर्शाता है, लेकिन इसके ब्रोमीन जल या बेयरर के अभिकर्मक को अपचाय नहीं करता। इससे एक औषधीय वलय के कारण असंतृप्तता की उपस्थिति को दर्शाया जाता है।
केटोन के ऑक्सीकरण उत्पाद के रूप में विचार करते हुए, यह एक कार्बोक्सिलिक अम्ल होना चाहिए। $(\mathrm{B})$ के अणुसूत्र से यह बेंजोइक अम्ल होना चाहिए और अतः (A) एक एकल विस्थापित औषधीय मेथिल केटोन होना चाहिए। (A) के अणुसूत्र से यह फेनिल मेथिल केटोन (एसिटोफेनोन) होना चाहिए। अभिक्रियाएँ निम्नलिखित हैं:


4. ए-हाइड्रोजन के कारण अभिक्रियाएं
एल्डिहाइड और केटोन के α-हाइड्रोजन की अम्लता: एल्डिहाइड और केटोन के कारण α-हाइड्रोजन की अम्लीय प्रकृति के कारण वे कई अभिक्रियाएं अनुभव करते हैं।
कार्बोनिल यौगिकों के $\alpha$-हाइड्रोजन परमाणुओं की अम्लता कार्बोनिल समूह के मजबूत इलेक्ट्रॉन अवसादी प्रभाव और संयोजन आधार के रेजोनेंस द्वारा स्थायित्व के कारण होती है।

(i) एल्डोल संघनन: ऐल्डिहाइड और केटोन जिनमें कम से कम एक $\alpha$-हाइड्रोजन होता है, तनु क्षारक की उपस्थिति में एक अभिक्रिया के माध्यम से $\beta$-हाइड्रोक्सी ऐल्डिहाइड (एल्डोल) या $\beta$-हाइड्रोक्सी केटोन (केटोल) बनाते हैं। इस अभिक्रिया को एल्डोल अभिक्रिया कहते हैं।

नाम “aldol” दो फंक्शनल ग्रुप, एल्डिहाइड और एल्कोहल के नाम से लिया गया है जो उत्पादों में मौजूद होते हैं। एल्डोल और केटोल आसानी से पानी को छोड़कर $\alpha, \beta$-अस्थायी कार्बोनिल यौगिक बनाते हैं जो एल्डोल संघनन उत्पाद होते हैं और इस अभिक्रिया को एल्डोल संघनन कहा जाता है। हालांकि केटोन एल्कोहल और केटो ग्रुप वाले केटोल (केटो और एल्कोहल ग्रुप वाले यौगिक) बनाते हैं, लेकिन केटोन के अभिक्रियाओं के लिए सामान्य नाम “एल्डोल संघनन” अभी भी लागू होता है क्योंकि उनकी एल्डिहाइड के साथ समानता होती है।
(ii) क्रॉस ऐल्डोल कंडेन्सेशन: जब दो अलग-अलग एल्डिहाइड और / या केटोन के बीच ऐल्डोल कंडेन्सेशन किया जाता है, तो इसे क्रॉस ऐल्डोल कंडेन्सेशन कहा जाता है। यदि दोनों में $\alpha$-हाइड्रोजन परमाणु उपस्थित हों, तो यह चार उत्पादों के मिश्रण के रूप में देता है। इसका उदाहरण नीचे एथेनल और प्रोपेनल के मिश्रण के ऐल्डोल अभिक्रिया द्वारा दिया गया है।

5. अन्य अभिक्रियाएँ
(i) कैनिजारो अभिक्रिया: ऐल्डिहाइड जो अल्फा-हाइड्रोजन परमाणु नहीं रखते, तीव्र अम्लीय विलयन की उपस्थिति में गरम करने पर स्व-ऑक्सीकरण एवं अपचयन (असमानुपाती) अभिक्रिया दर्शाते हैं। इस अभिक्रिया में, एक ऐल्डिहाइड अणु एल्कोहॉल में अपचयित हो जाता है जबकि दूसरा कार्बॉक्सिलिक अम्ल लवण में ऑक्सीकृत हो जाता है।

(ii) विद्युत धनात्मक प्रतिस्थापन अभिक्रिया: औषधीय ऐल्डिहाइड एवं केटोन वलय में विद्युत धनात्मक प्रतिस्थापन अभिक्रिया दर्शाते हैं, जहां कार्बोनिल समूह एक अक्रियकर एवं $meta$-निर्देशक समूह के रूप में कार्य करता है।

8.5 एल्डिहाइड और केटों के उपयोग
रसायन उद्योग में एल्डिहाइड और केटों का उपयोग विलायक, अन्य उत्पादों के संश्लेषण के शुरुआती सामग्री और रासायनिक अभिकर्मक के रूप में किया जाता है। फॉर्मेल्डिहाइड बायोलॉजिकल स्पेसिमेंस के संरक्षण के लिए उपयोग किए जाने वाले फॉर्मलिन (40%) घोल के रूप में जाना जाता है और बेकलाइट (ए फेनॉल-फॉर्मल्डिहाइड रेजिन), यूरिया-फॉर्मल्डिहाइड चिप्स और अन्य पॉलीमर उत्पादों के निर्माण के लिए भी उपयोग किया जाता है। एसिटल्डिहाइड मुख्य रूप से एसिटिक अम्ल, एथिल एसिटेट, विनिल एसिटेट, पॉलीमर और दवाओं के निर्माण में शुरुआती सामग्री के रूप में उपयोग किया जाता है। बेंजल्डिहाइड सुगंध उद्योग और रंग उद्योग में उपयोग किया जाता है। एसिटोन और एथिल मेथिल केटोन आम औद्योगिक विलायक हैं। कई एल्डिहाइड और केटों, जैसे कि ब्यूटिरल्डिहाइड, वैनिलिन, एसिटोफेनोन, कैम्फ़र आदि, अपनी गंध और स्वाद के कारण जाने जाते हैं।
कार्बॉक्सिलिक अम्ल
कार्बन यौगिक जिनमें कार्बॉक्सिल सक्रिय समूह, $-\mathrm{COOH}$ होता है, कार्बॉक्सिलिक अम्ल कहलाते हैं। कार्बॉक्सिल समूह, एक कार्बोनिल समूह के साथ एक हाइड्रॉक्सिल समूह के जुड़े होते हैं, इसलिए इसका नाम कार्बॉक्सिल है। कार्बॉक्सिलिक अम्ल अलिफैटिक $(\mathrm{RCOOH})$ या आरोमैटिक $(\mathrm{ArCOOH})$ हो सकते हैं, जिन्हें कार्बॉक्सिलिक कार्बन पर जुड़े ऐल्किल या ऐरिल समूह के आधार पर निर्धारित किया जाता है। प्रकृति में बहुत सारे कार्बॉक्सिलिक अम्ल पाए जाते हैं। कुछ अलिफैटिक कार्बॉक्सिलिक अम्ल के उच्च अणुक्रम $(\mathrm{C_12}-\mathrm{C_18})$ जिन्हें फैटी अम्ल कहा जाता है, प्राकृतिक वसा में ग्लिसरॉल के एस्टर के रूप में पाए जाते हैं। कार्बॉक्सिलिक अम्ल अन्य कई महत्वपूर्ण कार्बनिक यौगिकों के आरंभिक सामग्री के रूप में कार्य करते हैं, जैसे कि एनहाइड्राइड, एस्टर, अम्ल क्लोराइड, एमाइड आदि।
8.6 कार्बॉक्सिल समूह के नामकरण एवं संरचना
8.6.1 नामकरण
कार्बॉक्सिलिक अम्ल जैसे कि प्राकृतिक स्रोत से पहले उपलब्ध होने वाले अनेक आवेगीय यौगिकों में से एक हैं, इनमें से बहुत से अपने सामान्य नामों से जाने जाते हैं। सामान्य नाम अंत में $-ic$ एसिड के प्रतीक के साथ समाप्त होते हैं और इनके प्राकृतिक स्रोत के लैटिन या ग्रीक नाम से निकाले गए हैं। उदाहरण के लिए, फॉर्मिक एसिड $(\mathrm{HCOOH})$ लाल कीड़ों (लैटिन: formica जो कीड़ा के अर्थ में है) से पहली बार प्राप्त किया गया था, एसेटिक एसिड $\left(\mathrm{CH_3} \mathrm{COOH}\right)$ एक एसिड (लैटिन: acetum, जो एक एसिड के अर्थ में है) से, ब्यूटिरिक एसिड $\left(\mathrm{CH_3} \mathrm{CH_2} \mathrm{CH_2} \mathrm{COOH}\right)$ खारा बर्फ (लैटिन: butyrum, जो बर्फ के अर्थ में है) से प्राप्त किया गया था।
IUPAC प्रणाली में, एलिफैटिक कार्बॉक्सिलिक अम्लों के नामकरण में, संगत एल्केन के नाम में से $-e$ के स्थान पर “oic acid” लिखा जाता है। कार्बॉक्सिल कार्बन के नंबरिंग के लिए, कार्बॉक्सिल कार्बन को एक संख्या दी जाती है। एक से अधिक कार्बॉक्सिल समूह वाले यौगिकों के नामकरण में, कार्बॉक्सिल समूह छोड़े गए एल्किल शैली के नंबरिंग की जाती है और कार्बॉक्सिल समूह की संख्या के लिए “dicarboxylic acid”, “tricarboxylic acid” आदि गुणनफल प्रतिशब्द के साथ मूल एल्किल शैली के नाम में जोड़ दिया जाता है। $-\mathrm{COOH}$ समूहों के स्थान को गुणनफल प्रतिशब्द के सामने अरबी संख्या द्वारा इंगित किया जाता है। कुछ कार्बॉक्सिलिक अम्ल तथा उनके सामान्य और IUPAC नाम तालिका 8.3 में सूचीबद्ध हैं।
सारणी 8.3 कुछ कार्बॉक्सिलिक अम्लों के नाम एवं संरचना

8.6.2 कार्बॉक्सिल समूह की संरचना
कार्बॉक्सिलिक अम्लों में, कार्बॉक्सिल कार्बन के बंधन एक तल में होते हैं और लगभग $120^{\circ}$ के कोण पर अलग होते हैं। कार्बॉक्सिल कार्बन कार्बोनिल कार्बन की तुलना में कम इलेक्ट्रॉन अभिकर्षी होता है क्योंकि नीचे दिखाए गए संभावित रेजोनेंस संरचना के कारण:

8.7 कार्बॉक्सिलिक अम्लों के निर्माण के विधियाँ
कार्बॉक्सिलिक अम्लों के निर्माण के कुछ महत्वपूर्ण विधियाँ निम्नलिखित हैं।
1. मुख्य अल्कोहल और एल्डिहाइड से
मुख्य अल्कोहल सामान्य ऑक्सीकारक जैसे पोटैशियम परमैंगनेट $\left(\mathrm{KMnO_4}\right)$ के साथ उपचार से आसानी से कार्बॉक्सिलिक अम्ल में ऑक्सीकृत हो जाते हैं, जो उदासीन, अम्लीय या क्षारीय माध्यम में हो सकते हैं या पोटैशियम डाइक्रोमेट $\left(\mathrm{K_2} \mathrm{Cr_2} \mathrm{O_7}\right)$ और क्रोमियम ट्राइऑक्साइड $\left(\mathrm{CrO_3}\right)$ के साथ अम्लीय माध्यम में (जॉन्स रासायनिक तैयारी)।
$$ \begin{aligned} & \mathrm{RCH_2} \mathrm{OH} \xrightarrow[2 \cdot \mathrm{H_3} \mathrm{O}]{\text { l. क्षारीय } \mathrm{KMnO_4}} \mathrm{RCOOH} \\
& \underset{\substack{\text { 1-डेकेनॉल }}}{\mathrm{CH_3}\left(\mathrm{CH_2}\right)_8 \mathrm{CH_2} \mathrm{OH}} \mathrm{CrO_3} \xrightarrow [\text { जॉन्स अभिकर्मक }]{\mathrm{H_2} \mathrm{SO_4}} \underset{\text { डेकेनॉइक अम्ल }}{\mathrm{CH_3}\left(\mathrm{CH_2}\right)_8 \mathrm{COOH}} \end{aligned} $$
अम्लीय अम्ल अपने अल्डिहाइड से आरामदायक ऑक्सीकरण एजेंट के प्रयोग द्वारा भी तैयार किए जाते हैं (अनुच्छेद 8.4)।
2. एल्किलबेंज़ीन से
एरोमैटिक अम्लीय अम्ल एल्किल बेंज़ीन के तीव्र ऑक्सीकरण के माध्यम से क्रोमिक अम्ल या अम्लीय या क्षारीय पोटैशियम परमैंगनेट के साथ तैयार किए जा सकते हैं। चाहे ओर शैड शैड की लंबाई कितनी भी हो, ओर शैड का पूरा शैड अम्लीय समूह तक ऑक्सीकृत हो जाता है। प्राथमिक और द्वितीयक एल्किल समूह इस प्रकार ऑक्सीकृत होते हैं जबकि तृतीयक समूह प्रभावित नहीं होता। उचित रूप से स्थान बदले गए एल्कीन भी इन ऑक्सीकरण एजेंटों के साथ अम्लीय अम्ल में ऑक्सीकृत हो जाते हैं (इकाई 13, कक्षा XI देखें)।

3. नाइट्राइल और एमाइड से
नाइट्राइल को $\mathrm{H}^{+}$ या $\mathrm{OH}$ कैटलॉस्ट की उपस्थिति में एमाइड में अपचयित किया जाता है और फिर अम्ल में अपचयित किया जाता है। आसान अभिक्रिया शर्तों का उपयोग अभिक्रिया को एमाइड चरण पर रोकने के लिए किया जाता है।

4. ग्रिग्नार्ड रासायनिक अभिकर्मकों से
ग्रिग्नार्ड अभिकर्मक कार्बोनिक अम्ल के लवण बनाते हैं जो तत्काल पश्चात खनिज अम्ल के साथ अम्लीकरण के बाद संगत कार्बोक्सिलिक अम्ल देते हैं।

हम जानते हैं कि ग्रिग्नार्ड अभिकर्मक और नाइट्राइल अल्किल हैलाइड से तैयार किए जा सकते हैं (इकाई 6, कक्षा XII देखें)। उपरोक्त विधियाँ (3 और 4) अल्किल हैलाइड को अल्किल हैलाइड में उपस्थित कार्बन परमाणुओं की तुलना में एक अतिरिक्त कार्बन परमाणु वाले संगत कार्बोक्सिलिक अम्ल में परिवर्तित करने के लिए उपयोगी हैं (श्रेणी के उत्थान में)।
5. एसील हैलाइड और ऐनहाइड्राइड से
एसिड क्लोराइड जल के साथ हाइड्रोलाइज़ करने पर कार्बॉक्सिलिक अम्ल बनाते हैं या जलीय क्षार के साथ आसानी से हाइड्रोलाइज़ होकर कार्बॉक्सिलेट आयन बनाते हैं जिन्हें अम्लीय विलयन के साथ अम्लीकृत करने पर संगत कार्बॉक्सिलिक अम्ल प्राप्त होते हैं। विपरीत ऐनहाइड्राइड जल के साथ हाइड्रोलाइज़ होकर संगत अम्ल (अम्ल) बनाते हैं।

6. एस्टर से
एस्टर के अम्लीय हाइड्रोलिज़ करने से सीधे कार्बॉक्सिलिक अम्ल प्राप्त होते हैं जबकि क्षारीय हाइड्रोलिज़ करने से कार्बॉक्सिलेट प्राप्त होते हैं, जिन्हें अम्लीकरण से संगत कार्बॉक्सिलिक अम्ल प्राप्त होते हैं।

उदाहरण 8.5
(i) ब्यूटेन-1-ऑल से ब्यूटैनोइक अम्ल
(ii) बेंजिल ऐल्कोहल से फेनिल एथेनोइक अम्ल
(iii) 3-नाइट्रोब्रोमोबेंजीन से 3-नाइट्रोबेंज़ोइक अम्ल
(iv) 4-मेथिलएस्टरफेनोन से बेंज़ीन-1,4-डाइकार्बोक्सिलिक अम्ल
(v) साइक्लोहेक्सीन से हेक्सेन-1,6-डाइऑइक अम्ल
(vi) ब्यूटैनल से ब्यूटैनोइक अम्ल।
हल

अंतर्गत प्रश्न
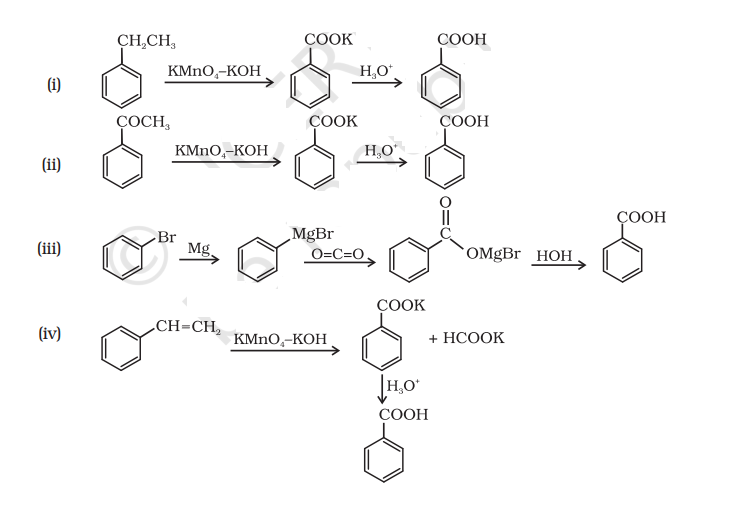
12.7 निम्नलिखित प्रत्येक यौगिक को बेंजोइक अम्ल में कैसे परिवर्तित किया जा सकता है।
(i) एथिलबेंज़ीन
(ii) ऐसीटोफ़ेनोन
(iii) ब्रोमोबेंज़ीन
(iv) फ़ेनिलएथीन (स्टाइरीन)
उत्तर दिखाएं
उत्तर
12.8 नीचे दिए गए युग्मों में से आप किस अम्ल को अधिक तीव्र अम्ल मानेंगे?
(i) ${CH}_3 {CO}_2 {H}$ या ${CH}_2 {FCO}_2 {H}$
(ii) ${CH}_2 {FCO}_2 {H}$ या ${CH}_2 {ClCO}_2 {H}$
(iii) ${CH}_2 {FCH}_2 {CH}_2 {CO}_2 {H}$ या ${CH}_3 {CHFCH}_2 {CO}_2 {H}$

उत्तर दिखाएं
उत्तर

8.8 भौतिक गुण
कमर के तापमान पर नौ कार्बन परमाणु तक के एलिफैटिक कार्बॉक्सिलिक अम्ल रंगहीन तरल होते हैं जो अप्रिय गंध रखते हैं। उच्च अम्ल वसाई ठोस होते हैं और उनकी कम वाष्पशीलता के कारण उनकी गंध लगभग नहीं महसूस की जाती है। कार्बॉक्सिलिक अम्ल तुलनात्मक अणुभार वाले एल्डिहाइड, केटोन और एल्कोहल के अपेक्षाकृत उच्च उबलने के बिंदु वाले तरल होते हैं। इसका कारण अधिक विस्तारपूर्वक अंतराणुक हाइड्रोजन बंधन के कारण कार्बॉक्सिलिक अम्ल अणुओं के संगठन है। हाइड्रोजन बंध वाष्प अवस्था में भी पूरी तरह से टूट नहीं जाते। वास्तव में, अधिकांश कार्बॉक्सिलिक अम्ल वाष्प अवस्था में या अप्रोटिक विलायक में डाइमर के रूप में विद्यमान रहते हैं।

सरल एलिफैटिक कार्बॉक्सिलिक अम्ल जिनमें चार कार्बन परमाणु तक होते हैं, पानी में मिश्रणीय होते हैं क्योंकि वे पानी के साथ हाइड्रोजन बंधन के निर्माण के कारण होते हैं। मिश्रणीयता कार्बन परमाणुओं की संख्या बढ़ने के साथ-साथ कम हो जाती है। उच्च कार्बॉक्सिलिक अम्ल पानी में विलयनीय नहीं होते हैं क्योंकि हाइड्रोकार्बन भाग के बढ़ते हाइड्रोफोबिक अंतरक्रिया के कारण। बेंजोइक अम्ल, सरलतम एरोमैटिक कार्बॉक्सिलिक अम्ल, ठंडे पानी में लगभग अविलयनीय होता है। कार्बॉक्सिलिक अम्ल बेंजीन, ईथर, अल्कोहल, क्लोरोफॉर्म आदि ऐसे कम ध्रुवीय आगनिक विलायकों में भी विलयनीय होते हैं।
8.9 रासायनिक अभिक्रियाएं
कार्बॉक्सिलिक अम्लों की अभिक्रियाएं निम्नलिखित वर्गों में वर्गीकृत की जाती हैं:
8.9.1 $\mathrm{O}-\mathrm{H}$ बंध के तोड़ वाली अभिक्रियाएं
अम्लता
धातुओं और क्षारकों के साथ अभिक्रियाएं
कार्बॉक्सिलिक अम्ल, ऐल्कोहॉल की तरह, धनात्मक विद्युत धातुओं के साथ हाइड्रोजन उत्सर्जित करते हैं और क्षारकों के साथ फ़ेनॉल के समान लवण बनाते हैं। हालांकि, फ़ेनॉल के विपरीत, वे कार्बोनेट और हाइड्रोजन कार्बोनेट जैसे कमज़ोर क्षारकों के साथ अभिक्रिया करते हैं और कार्बन डाइऑक्साइड उत्सर्जित करते हैं। इस अभिक्रिया का उपयोग एक आवेगीय यौगिक में कार्बॉक्सिल समूह की उपस्थिति का पता लगाने के लिए किया जाता है।
$$ \begin{aligned} & 2 \mathrm{R}-\mathrm{COOH}+2 \mathrm{Na} \longrightarrow \underset{\text { सोडियम कार्बॉक्सिलेट }}{2 \mathrm{R}-\mathrm{CO} \overline{\mathrm{O}} \mathrm{Na}}+\mathrm{H} _{2} \\ \end{aligned} $$
$$ \begin{aligned} & \mathrm{R}-\mathrm{COOH}+\mathrm{NaOH} \longrightarrow \mathrm{R}-\mathrm{COO} \mathrm{N}^{+}+\mathrm{H} _{2} \mathrm{O} \\ & \mathrm{R}-\mathrm{COOH}+\mathrm{NaHCO} _{3} \longrightarrow \mathrm{R}-\mathrm{CO} \overline{\mathrm{O} N} \mathrm{Na}^{+}+\mathrm{H} _{2} \mathrm{O}+\mathrm{CO} _{2}
\end{aligned} $$
कार्बॉक्सिलिक अम्ल पानी में घुलकर रेजोनेंस द्वारा स्थायीकृत कार्बॉक्सिलेट एनियन और हाइड्रोनियम आयन देते हैं।

उपरोक्त अभिक्रिया के लिए:
$$ K_{e q}=\frac{\left[\stackrel{+}{\mathrm{H_3}}\right][\mathrm{RCO} \stackrel{-}{\mathrm{O}}]}{\left[\mathrm{H_2} \mathrm{O}\right][\mathrm{RCOOH}]} \quad K_{a}=K_{e q}\left[\mathrm{H_2} \mathrm{O}\right]=\frac{[\stackrel{+}{\mathrm{H}}][\mathrm{RCO} \stackrel{-}{\mathrm{RC}}]}{[\mathrm{RCOOH}]} $$
$$
जहाँ $K_{e q}$, साम्य स्थिरांक है और $K_{a}$ अम्ल वियोजन स्थिरांक है।
सुविधा के लिए, एक अम्ल की शक्ति आमतौर पर इसके $\mathrm{p} K_{a}$ मान द्वारा निरूपित की जाती है, न कि इसके $K_{a}$ मान द्वारा।
$$ \mathrm{p} K_{a}=-\log K_{a} $$
हाइड्रोक्लोरिक अम्ल का $\mathrm{p} K_{a}$ मान -7.0 है, जबकि ट्राइफ्लूओरोएसिटिक अम्ल (सबसे मजबूत कार्बॉक्सिलिक अम्ल), बेंजोइक अम्ल और एसिटिक अम्ल के $\mathrm{p} K_{a}$ मान क्रमशः 0.23, 4.19 और 4.76 हैं।
कम $\mathrm{p} K_{a}$ मान वाला अम्ल अधिक मजबूत होता है (एक प्रोटॉन दाता के रूप में अधिक अच्छा होता है)। मजबूत अम्लों के $\mathrm{p} K_{a}$ मान $< 1$ होते हैं, $\mathrm{p} K_{a}$ मान 1 और 5 के बीच वाले अम्लों को मध्यम रूप से मजबूत अम्ल माना जाता है, $\mathrm{p} K_{a}$ मान 5 और 15 के बीच वाले अम्लों को कमजोर अम्ल माना जाता है, और $\mathrm{p} K_{a}$ मान $>15$ वाले अम्लों को बहुत कमजोर अम्ल माना जाता है।
कार्बॉक्सिलिक अम्ल खनिज अम्ल के कमजोर होते हैं, लेकिन वे अल्कोहल और कई सरल फीनॉल की तुलना में अधिक अम्लीय होते हैं ( $\mathrm{p} K_{a}$ लगभग 16 होता है और फीनॉल के लिए 10 होता है)। वास्तव में, कार्बॉक्सिलिक अम्ल अब तक आप द्वारा अध्ययन किए गए सबसे अम्लीय अप्राकृतिक यौगिक हैं। आप पहले से ही जानते हैं कि फीनॉल अल्कोहल की तुलना में अधिक अम्लीय क्यों होते हैं। कार्बॉक्सिलिक अम्ल की तुलना में फीनॉल की अधिक अम्लीयता की व्याख्या भी इसी तरह की जा सकती है। कार्बॉक्सिलिक अम्ल के संयुग्मी बेस, कार्बॉक्सिलेट आयन, दो समान उपस्थिति वाले रेजोनेंस संरचनाओं द्वारा स्थायी होता है जहां नकारात्मक आवेश अधिक विद्युत ऋणात्मक ऑक्सीजन पर होता है। फीनॉल के संयुग्मी बेस, फीनॉक्साइड आयन, जहां नकारात्मक आवेश कम विद्युत ऋणात्मक कार्बन पर होता है, असमान रेजोनेंस संरचनाओं द्वारा स्थायी होता है। अतः, फीनॉक्साइड आयन में रेजोनेंस कम महत्वपूर्ण होता है जितना कि कार्बॉक्सिलेट आयन में होता है। इसके अतिरिक्त, कार्बॉक्सिलेट आयन में नकारात्मक आवेश दो विद्युत ऋणात्मक ऑक्सीजन पर वितरित होता है जबकि फीनॉक्साइड आयन में यह एक ऑक्सीजन पर और कम विद्युत ऋणात्मक कार्बन पर कम प्रभावपूर्ण रूप से वितरित होता है (यूनिट 11, कक्षा XII)। अतः, कार्बॉक्सिलेट आयन कार्बॉक्सिलिक अम्ल की तुलना में फीनॉक्साइड आयन की तुलना में अधिक स्थायी होता है, इसलिए कार्बॉक्सिलिक अम्ल फीनॉल की तुलना में अधिक अम्लीय होते हैं।
साइक्लिक कार्बॉक्सिलिक अम्लों के अम्लता पर प्रतिस्थापक के प्रभाव: प्रतिस्थापक अम्ल के संयुग्मी बेस के स्थायित्व पर प्रभाव डाल सकते हैं और इस प्रकार अम्लता पर भी प्रभाव डाल सकते हैं। इलेक्ट्रॉन अवसादी समूह अम्लता को बढ़ाते हैं, क्योंकि वे इंडक्टिव और/या रेजोनेंस प्रभावों के माध्यम से नकारात्मक आवेश के वितरण के माध्यम से संयुग्मी बेस को स्थायी बनाते हैं। विपरीत, इलेक्ट्रॉन दाता समूह अम्लता को कम करते हैं, क्योंकि वे संयुग्मी बेस को अस्थायी बनाते हैं।
इलेक्ट्रॉन अवसादक समूह (EWG) कार्बॉक्सिलेट एनियन को स्थायी बनाता है और अम्ल को मजबूत बनाता है

इलेक्ट्रॉन दाता समूह (EDG) कार्बॉक्सिलेट एनियन को अस्थायी बनाता है और अम्ल को दुर्बल बनाता है
निम्नलिखित समूहों के प्रभाव के अम्लता के बढ़ते क्रम में क्रम $\mathrm{Ph}<\mathrm{I}<\mathrm{Br}<\mathrm{Cl}<\mathrm{F}<\mathrm{CN}<\mathrm{NO_2}<\mathrm{CF_3}$ है
इस प्रकार, निम्नलिखित अम्लों को अम्लता के बढ़ते क्रम में व्यवस्थित किया गया है (pKa मानों के आधार पर):
$ \begin{array}{l} \mathrm{CF_3COOH > CCl_3COOH > CHCl_2COOH > NO_2CH_2COOH > NC-CH_2COOH >} \\ \xleftarrow{} \end{array} $
$ \begin{array}{l} \mathrm{FCH_2COOH > ClCH_2COOH > BrCH_2COOH > HCOOH > ClCH_2CH_2COOH >} \\ \text{(continue) } \xleftarrow{} \end{array} $
$ \begin{array}{l} \mathrm{C_6H_5COOH > C_6H_5CH_2COOH > CH_3COOH > CH_3CH_2COOH} \\ \text{(continue) } \xleftarrow{} \end{array} $
साइक्लोहेक्सेन के अणु में एक अनुप्रस्थ बंधन के कारण एक अतिरिक्त अनुप्रस्थ बंधन उपस्थित होता है। इसके कारण अणु के आकार में वृद्धि होती है और इसके अणु के आकार के कारण इसके अणु के आकार में वृद्धि होती है।

8.9.2 $\mathbf{C}-\mathbf{O H}$ बंध के तोड़ के संबंधित अभिक्रियाएं
1. ऐनहाइड्राइड के निर्माण
कार्बोक्सिलिक अम्ल ताप और खनिज अम्ल जैसे $\mathrm{H_2} \mathrm{SO_4}$ या $\mathrm{P_2} \mathrm{O_5}$ के साथ गरम करने पर संगत ऐनहाइड्राइड बनाते हैं।

2. एस्टरीकरण
कार्बॉक्सिलिक अम्ल अम्ल या फीनॉल के साथ एक खनिज अम्ल जैसे सांद्र $\mathrm{H_2} \mathrm{SO_4}$ या $\mathrm{HCl}$ गैस की उपस्थिति में एस्टर बनाया जाता है।
$$ \mathrm{RCOOH}+\mathrm{R}^{\prime} \mathrm{OH} \rightleftharpoons \stackrel{\mathrm{H}^{+}}{\rightleftharpoons} \mathrm{RCOOR}^{\prime}+\mathrm{H_2} \mathrm{O} $$
कार्बॉक्सिलिक अम्ल के एस्टरीकरण के यांत्रिक तंत्र:
कार्बॉक्सिलिक अम्ल के अल्कोहल के साथ एस्टरीकरण एक प्रकार की न्यूक्लिओफिलिक एसिल स्थानांतरण है। कार्बोनिल ऑक्सीजन के प्रोटॉनीकरण के द्वारा कार्बोनिल समूह को न्यूक्लिओफिलिक योग के लिए सक्रिय किया जाता है। टेट्राहेड्रल अंतराल में प्रोटॉन परिवहन द्वारा हाइड्रॉक्सिल समूह को –+OH2 समूह में परिवर्तित किया जाता है, जो एक बेहतर छोड़ने वाला समूह होता है और इसे उदासीन पानी के रूप में छोड़ दिया जाता है। इस तरह बने हुए प्रोटॉनीकृत एस्टर अंत में एक प्रोटॉन खोकर एस्टर के रूप में बन जाता है।
3. $\mathrm{PCl_5}, \mathrm{PCl_3}$ और $\mathrm{SOCl_2}$ के साथ अभिक्रिया
कार्बोक्सिलिक अम्ल के हाइड्रॉक्सिल समूह के व्यवहार ऐल्कोहल के समान होता है और इसे $\mathrm{PCl_5}, \mathrm{PCl_3}$ या $\mathrm{SOCl_2}$ के साथ अभिक्रिया के द्वारा क्लोरीन परमाणु द्वारा आसानी से प्रतिस्थापित किया जा सकता है। थियोनिल क्लोराइड $\left(\mathrm{SOCl_2}\right)$ पसंद किया जाता है क्योंकि अन्य दो उत्पाद गैसीय होते हैं और अभिक्रिया मिश्रण से बाहर निकल जाते हैं, जिससे उत्पादों के पूर्वोत्पादन को सरल बनाया जा सकता है।
$$ \begin{aligned} & \mathrm{RCOOH}+\mathrm{PCl} _{5} \longrightarrow \mathrm{RCOCl}+\mathrm{PCl} _{3}+\mathrm{HCl} \\ & 3 \mathrm{RCOOH}+\mathrm{PCl} _{3} \longrightarrow 3 \mathrm{RCOCl}+\mathrm{H} _{3} \mathrm{PO} _{3} \\ & \mathrm{RCOOH}+\mathrm{SOCl} _{2} \longrightarrow \mathrm{RCOCl}+\mathrm{SO} _{2}+\mathrm{HCl} \end{aligned} $$
4. अमोनिया के साथ अभिक्रिया
कार्बॉक्सिलिक अम्ल अमोनिया के साथ अभिक्रिया करते हैं जिससे अमोनियम लवण बनता है जिसके आगे उच्च तापमान पर गरम करने पर एमाइड बनते हैं। उदाहरण के लिए:

8.9.3 $(-\mathrm{COOH})$ समूह के साथ अभिक्रियाएँ
1. अपचयन
कार्बॉक्सिलिक अम्ल लिथियम ऐलुमिनियम हाइड्राइड या बेहतर डाइबोरेन द्वारा प्राथमिक ऐल्कोहल में अपचयित किए जाते हैं। डाइबोरेन ऐस्टर, नाइट्रो, हैलो आदि ऐसे कार्यकारी समूह को आसानी से अपचयित नहीं करता। सोडियम बोरोहाइड्राइड कार्बॉक्सिल समूह को अपचयित नहीं करता।
$$ \text { R-COOH } \xrightarrow[\text { (ii) } \mathrm{H_3} \mathrm{O}^{+}]{\text {(i) } \mathrm{LiAlH_4} / \text { ether } \quad \text { or } \mathrm{B_2} \mathrm{H_6}} \mathrm{R}-\mathrm{CH_2} \mathrm{OH} $$
$$
2. डेकार्बॉक्सिलेशन
कार्बॉक्सिलिक अम्ल अपने सोडियम लवणों को सोडलाइम (NaOH और CaO के 3:1 के अनुपात में) के साथ गर्म करने पर कार्बनिक यौगिक बनाते हैं और कार्बन डाइऑक्साइड खो देते हैं। यह अभिक्रिया डेकार्बॉक्सिलेशन कहलाती है।
$$\mathrm{R-COONa} \xrightarrow [\mathrm {NaOH ~& ~CaO}]{\mathrm{Heat}} \mathrm{R-H+Na_2CO_3}$$
कार्बॉक्सिलिक अम्ल के क्षार धातु लवण भी अपने जलीय विलयन के विद्युत अपघटन के द्वारा डेकार्बॉक्सिलेशन करते हैं और अम्ल के ऐल्किल समूह में उपस्थित कार्बन परमाणुओं की संख्या के दुगुने कार्बनिक यौगिक बनाते हैं। यह अभिक्रिया कोल्बे विद्युत अपघटन कहलाती है (यूनिट 9, कक्षा XI)।
8.9.4 हाइड्रोकार्बन भाग में प्रतिस्थापन अभिक्रियाएं
1. हैलोजनीकरण
एक $\alpha$-हाइड्रोजन वाले कार्बॉक्सिलिक अम्ल $\alpha$-स्थिति पर क्लोरीन या ब्रोमीन के साथ अभिक्रिया करते हैं और छोटी मात्रा में लाल फॉस्फोरस की उपस्थिति में $\alpha$-हैलोकार्बॉक्सिलिक अम्ल बनाते हैं। यह अभिक्रिया Hell-Volhard-Zelinsky अभिक्रिया के रूप में जानी जाती है।

2. वलय प्रतिस्थापन
सांत्वनीय कार्बॉक्सिलिक अम्ल विद्युत धनात्मक प्रतिस्थापन अभिक्रियाएं अपचायक एवं मेटा-निर्देशक समूह के रूप में कार्बॉक्सिल समूह के कारण होती हैं। वे हालांकि, फ्रेडेल-क्राफ्ट्स अभिक्रिया नहीं होती (कारण कार्बॉक्सिल समूह अपचायक होता है और कातलाइजर एल्यूमिनियम क्लोराइड (लीविस अम्ल) कार्बॉक्सिल समूह के साथ बंध जाता है)।

अंतर्गत प्रश्न
8.8 नीचे दिए गए युग्मों में से आप किस अम्ल को अधिक क्षमता वाला मानेंगे?
(i) $\mathrm{CH} _{3} \mathrm{CO} _{2} \mathrm{H}$ अथवा $\mathrm{CH} _{2} \mathrm{FCO} _{2} \mathrm{H}$
(ii) $\mathrm{CH} _{2} \mathrm{FCO} _{2} \mathrm{H}$ अथवा $\mathrm{CH} _{2} \mathrm{ClCO} _{2} \mathrm{H}$
(iii) $\mathrm{CH} _{2} \mathrm{FCH} _{2} \mathrm{CH} _{2} \mathrm{CO} _{2} \mathrm{H}$ अथवा $\mathrm{CH} _{3} \mathrm{CHFCH} _{2} \mathrm{CO} _{2} \mathrm{H}$
(iv) 
8.10 कार्बोक्सिलिक अम्लों के उपयोग
मेथेनोइक अम्ल रबर, टेक्सटाइल, रंग बर्निंग, चमड़ा और विद्युत चालन उद्योगों में उपयोग किया जाता है। एथेनोइक अम्ल खाद्य उद्योग में एक विलायक और एक चावल के रूप में उपयोग किया जाता है। हेक्सेनडाइओइक अम्ल नाइलॉन-6, 6 के निर्माण में उपयोग किया जाता है। बेंजोइक अम्ल के एस्टर गंधा कला में उपयोग किए जाते हैं। सोडियम बेंजोएट खाद्य संरक्षक के रूप में उपयोग किया जाता है। उच्च वसीय अम्ल शामक और शोधक बनाने के लिए उपयोग किए जाते हैं।
सारांश
एल्डिहाइड, केटोन और कार्बोक्सिलिक अम्ल कार्बोनिल समूह वाले कुछ महत्वपूर्ण कार्बनिक यौगिकों के वर्ग हैं। ये अत्यधिक ध्रुवीय अणु हैं। इसलिए, वे तुलनात्मक अणु द्रव्यमान वाले हाइड्रोकार्बन और कम ध्रुवीय यौगिकों के तुलना में उच्च तापमान पर उबलते हैं। निम्न वर्ग के अणु पानी में अधिक घुलनशील होते हैं क्योंकि वे पानी के साथ हाइड्रोजन बंधन बनाते हैं। उच्च वर्ग के अणु, कार्बन अणुओं के जल अपवाद शृंखला के बड़े आकार के कारण पानी में अघुलनशील होते हैं लेकिन सामान्य अपचायक विलायकों में घुलनशील होते हैं। एल्डिहाइड प्राथमिक एल्कोहल के डिहाइड्रोजनीकरण या नियंत्रित ऑक्सीकरण और एसिल हैलाइड के नियंत्रित या चयनात्मक अपचायन से बनाए जाते हैं। औषधीय एल्डिहाइड भी (i) क्रोमिल क्लोराइड या $\mathrm{CrO_3}$ के उपस्थिति में मेथिलबेंज़ीन के ऑक्सीकरण, (ii) कार्बन मोनोऑक्साइड और हाइड्रोक्लोरिक अम्ल के उपस्थिति में एरिल के फॉर्मिलेशन, और (iii) क्यूप्रस क्लोराइड या बेंजल क्लोराइड के हाइड्रोलिज़ करने से भी बनाए जा सकते हैं। केटोन द्वितीयक एल्कोहल के ऑक्सीकरण और एल्किन के हाइड्रेटेशन से बनाए जाते हैं। केटोन एसिल क्लोराइड के डाइएल्किलकैडमियम के साथ अभिक्रिया से भी बनाए जाते हैं। औषधीय केटोन के निर्माण के लिए एक अच्छा विधि है फ्राइडेल-क्राफ्ट्स एसिलेशन जिसमें एसिल क्लोराइड या एनहाइड्राइड के साथ एरोमेटिक हाइड्रोकार्बन के एसिलेशन के द्वारा बनाए जाते हैं। एल्डिहाइड और केटोन दोनों एल्कीन के ओजोनोलिज़ करने से बनाए जा सकते हैं। एल्डिहाइड और केटोन कार्बोनिल समूह पर नाभिकस्थ योग अभिक्रिया करते हैं जिनमें कई नाभिकस्थ अभिकरक शामिल होते हैं, जैसे, $\mathrm{HCN}, \mathrm{NaHSO_3}$, एल्कोहल (या डाइएल्कोहल),
अमोनिया अपवाहक, और ग्रिग्नार्ड अपवाहक। एल्डिहाइड और केटोन में $\alpha$-हाइड्रोजन अम्लीय होते हैं। अतः एल्डिहाइड और केटोन जिनमें कम से कम एक $\alpha$-हाइड्रोजन होता है, एक क्षार की उपस्थिति में एल्डोल संघनन करते हैं ताकि $\alpha$-हाइड्रोक्सीएल्डिहाइड (एल्डोल) और $\alpha$-हाइड्रोक्सीकेटोन (केटोल) के रूप में बने। जिन एल्डिहाइड में $\alpha$-हाइड्रोजन नहीं होता है, वे केंद्रीय क्षार की उपस्थिति में कैनिजारो अभिक्रिया अनुभव करते हैं। एल्डिहाइड और केटोन $\mathrm{NaBH_4}, \mathrm{LiAlH_4}$, या कैटलिटिक हाइड्रोजनेशन द्वारा एल्कोहल में रूपांतरित हो जाते हैं। एल्डिहाइड और केटोन के कार्बोनिल समूह को क्लेमेंसन अपवाहन या वॉल्फ-किशनर अपवाहन द्वारा मेथिलीन समूह में अपवाहित किया जा सकता है। एल्डिहाइड कम शक्ति वाले ऑक्सीकरण अभिकरकों जैसे टॉलेंस के अभिकरक और फेलिंग के अभिकरक द्वारा आसानी से कार्बोक्सिलिक अम्ल में ऑक्सीकृत हो जाते हैं। इन ऑक्सीकरण अभिक्रियाओं का उपयोग एल्डिहाइड को केटोन से विभेद करने के लिए किया जाता है। कार्बोक्सिलिक अम्ल प्राथमिक एल्कोहल, एल्डिहाइड और एल्कीन के ऑक्सीकरण द्वारा, नाइट्राइल के हाइड्रोलिसिस द्वारा, और ग्रिग्नार्ड अपवाहक के कार्बोनिक डाइऑक्साइड के साथ अभिक्रिया द्वारा बनाए जाते हैं। ऐरोमैटिक कार्बोक्सिलिक अम्ल ऐल्किलबेंज़ीन के ओर्थो-चैन ऑक्सीकरण द्वारा भी बनाए जाते हैं। कार्बोक्सिलिक अम्य एल्कोहल और अधिकांश सरल फेनॉल की तुलना में काफी अम्लीय होते हैं। कार्बोक्सिलिक अम्ल $\mathrm{LiAlH_4}$ द्वारा प्राथमिक एल्कोहल में रूपांतरित हो जाते हैं, या एथर विलयन में बोरोन के डाइबोरेन द्वारा बेहतर रूप से, और लाल फास्फोरस की उपस्थिति में $\mathrm{Cl_2}$ और $\mathrm{Br_2}$ के साथ $\alpha$-हैलोजनेशन भी होता है (हेल-वॉल्हर्ड जेलिंस्की अभिक्रिया)। मेथेनल, एथेनल, प्रोपेनोन, बेंज़ल्डिहाइड, फॉर्मिक अम्ल, एसिटिक अम्ल और बेंज़ोइक अम्ल उद्योग में बहुत उपयोगी यौगिक हैं।







