यूनिट 11 एल्कोहल, फीनॉल और ईथर
एल्कोहल, फीनॉल और ईथर डिटर्जेंट, एंटीसेप्टिक और सुगंध के निर्माण के मूल यौगिक हैं।
आप जानते हैं कि एक हाइड्रोकार्बन में एक या एक से अधिक हाइड्रोजन परमाणुओं के स्थान पर अन्य परमाणु या परमाणुओं के समूह द्वारा प्रतिस्थापन एक नए यौगिक के निर्माण के लिए जिम्मेदार होता है, जो विशिष्ट गुणों और अनुप्रयोगों के साथ अलग-अलग होता है। एल्कोहल और फीनॉल के निर्माण के लिए एक हाइड्रोकार्बन में, क्रमशः एलिफैटिक और आरोमैटिक हाइड्रोजन परमाणु के स्थान पर $-\mathrm{OH}$ समूह द्वारा प्रतिस्थापन होता है। इन वर्गों के यौगिक उद्योग और दैनिक जीवन दोनों में व्यापक रूप से उपयोग में लाए जाते हैं। उदाहरण के लिए, क्या आपने कभी ध्यान दिया है कि लकड़ी के मेजबान के लिए उपयोग किए जाने वाले सामान्य शराब मुख्य रूप से हाइड्रॉक्सिल समूह वाले एथेनॉल यौगिक के मिश्रण होती है। हम खाने वाला चीनी, कपड़ों के लिए उपयोग किए जाने वाले कॉटन, लिखने के लिए उपयोग किए जाने वाले कागज सभी $-\mathrm{OH}$ समूह वाले यौगिकों से बने होते हैं। केवल कागज के बिना जीवन के बारे में सोचें; कोई किताबें, नोटबुक, अखबार, नकद नोट, चेक, सर्टिफिकेट आदि नहीं होंगे। जो अखबार बेहद सुंदर तस्वीरें और रोचक कहानियां ले आते हैं, वे हमारे जीवन से अदृश्य हो जाएंगे। यह वास्तव में एक अलग दुनिया होती।
एक एल्कोहल एक या एक से अधिक हाइड्रॉक्सिल $(\mathrm{OH})$ समूहों को एलिफैटिक प्रणाली के कार्बन परमाणुओं के सीधे जुड़े होते हैं $\left(\mathrm{CH_3} \mathrm{OH}\right)$ जबकि फीनॉल में $-\mathrm{OH}$ समूहों को एरोमैटिक प्रणाली के कार्बन परमाणुओं के सीधे जुड़े होते हैं $\left(\mathrm{C_6} \mathrm{H_5} \mathrm{OH}\right)$।
एक हाइड्रोकार्बन में हाइड्रोजन परमाणु को एल्कॉक्सी या एरिलोक्सी समूह (R-O/Ar-O) से प्रतिस्थापित करने से एक अन्य वर्ग के यौगिकों के निर्माण होता है जिन्हें ‘ईथर्स’ कहते हैं, उदाहरण के लिए, $\mathrm{CH_3} \mathrm{OCH_3}$ (डाइमेथिल ईथर)। आप ईथर्स को एल्कोहल या फीनॉल के हाइड्रॉक्सिल समूह के हाइड्रोजन परमाणु को एल्किल या एरिल समूह से प्रतिस्थापित करके बने यौगिकों के रूप में भी देख सकते हैं। इस इकाई में, हम तीन वर्ग के यौगिकों के रासायनिक अध्ययन के बारे में चर्चा करेंगे, अर्थात — एल्कोहल, फीनॉल और ईथर्स।
7.1 वर्गीकरण
अपचायकों के वर्गीकरण उनके अध्ययन को प्रणालीय बनाता है और इसलिए सरल बनाता है। इसलिए, हम पहले जानेंगे कि एल्कोहल, फीनॉल और ईथर कैसे वर्गीकृत होते हैं?
7.1.1 एल्कोहल— एकल, द्विलेखी, त्रिलेखी या बहुलेखी एल्कोहल
एल्कोहल और फीनॉल को एकल, द्विलेखी, त्रिलेखी या बहुलेखी यौगिक के रूप में वर्गीकृत किया जा सकता है, जिनमें क्रमशः अपनी संरचना में एक, दो, तीन या कई हाइड्रॉक्सिल समूह होते हैं, जैसा कि नीचे दिया गया है:
$ \underset{\text{एकलेखी}}{\mathrm{C_2}\mathrm{H_5}\mathrm{OH}} `
\quad\quad\quad$ $\underset{\text{द्विहाइड्रिक}}{\underset{\large\mathrm{CH_2}\mathrm{OH}}{\large\underset{\text{|}}{\mathrm{C}}\mathrm{H_2OH}}}$ $\quad\quad\quad$ $ \large\underset{\text{त्रिहाइड्रिक}}{\large\stackrel{\stackrel{\large\mathrm{CH_2OH}}{\large\stackrel{\text{|}}{\mathrm{C}}\mathrm{HOH}}}{\large\stackrel{\large\text{|}}{\mathrm{C}}\mathrm{H_2OH}}} $
एकल हाइड्रिक एल्कोहॉल को उस कार्बन परमाणु के हाइब्रिडाइजेशन के आधार पर और भी वर्गीकृत किया जा सकता है जिस पर हाइड्रॉक्सिल समूह जुड़ा होता है।
(i) $\mathrm{C_s p^{3}}-\mathrm{OH}$ बंध वाले यौगिक: इस श्रेणी के एल्कोहल में, $-\mathrm{OH}$ समूह एक एल्किल समूह के $s p^{3}$ हाइब्रिडाइज्ड कार्बन पर जुड़ा होता है। इन्हें निम्नलिखित तरीके से और वर्गीकृत किया जाता है:
प्राथमिक, द्वितीयक और तृतीयक एल्कोहल: इन तीन प्रकार के एल्कोहल में, $-\mathrm{OH}$ समूह क्रमशः प्राथमिक, द्वितीयक और तृतीयक कार्बन पर जुड़ा होता है, जैसा कि नीचे चित्र में दिखाया गया है:

अल्लीलिक एल्कोहॉल: इन एल्कोहॉल में, - $\mathrm{OH}$ समूह एक ऐल्लीलिक कार्बन पर जुड़ा होता है, जो कार्बन-कार्बन डबल बॉन्ड के समीप एक $s p^{3}$ हाइब्रिडाइज्ड कार्बन पर होता है। उदाहरण के लिए:

बेंजिलिक एल्कोहॉल: इन एल्कोहॉल में, $-\mathrm{OH}$ समूह एक ऐरोमैटिक वलय के समीप एक $s p^{3}$-हाइब्रिडाइज्ड कार्बन पर जुड़ा होता है। उदाहरण के लिए:

अल्लीलिक और बेंजिलिक एल्कोहॉल प्राथमिक, द्वितीयक या तृतीयक हो सकते हैं।
(ii) $\mathrm{C_s p^{2}}-\mathrm{OH}$ बंध वाले यौगिक: इन एल्कोहॉल में - $\mathrm{OH}$ समूह एक कार्बन-कार्बन डबल बंध पर बंधा होता है, अर्थात एक विनाइलिक कार्बन या एक ऐरिलिक कार्बन पर। इन एल्कोहॉल को विनाइलिक एल्कोहॉल के रूप में भी जाना जाता है।
विनाइलिक एल्कोहॉल: $\mathrm{CH_2}=\mathrm{CH}-\mathrm{OH}$
अंतर्गत अनुच्छेद प्रश्न
11.1 निम्नलिखित को प्राथमिक, द्वितीयक और तृतीयक एल्कोहल के रूप में वर्गीकृत करें:

उत्तर दिखाएं
उत्तर
प्राथमिक एल्कोहल $\rightarrow$ (i), (ii), (iii)
द्वितीयक एल्कोहल $\rightarrow$ (iv), (v)
तृतीयक एल्कोहल $\rightarrow$ (vi)
11.2 उपरोक्त परीक्षा में अल्लिल एल्कोहल की पहचान करें
उत्तर दिखाएं
उत्तर
(ii) और (vi) में दिए गए एल्कोहल अल्लिल एल्कोहल हैं।
7.1.2 फीनॉल— एकहाइड्रिक, द्विहाइड्रिक एवं त्रिहाइड्रिक फीनॉल

7.1.3 ईथर
ईथर को सरल या सममित कहा जाता है, यदि ऑक्सीजन परमाणु के संलग्न ऐल्किल या ऐरिल समूह समान हों, और मिश्रित या असममित कहा जाता है, यदि दो समूह अलग-अलग हों। डाइएथिल ईथर, $\mathrm{C_2} \mathrm{H_5} \mathrm{OC_2} \mathrm{H_5}$, एक सममित ईथर है जबकि $\mathrm{C_2} \mathrm{H_5} \mathrm{OCH_3}$ और $\mathrm{C_2} \mathrm{H_5} \mathrm{OC_6} \mathrm{H_5}$ असममित ईथर हैं।
7.2 नामांकन
(अ) एल्कोहल: एल्कोहल का सामान्य नाम एल्किल समूह के सामान्य नाम से बनाया जाता है और इसमें “एल्कोहल” शब्द को जोड़ दिया जाता है। उदाहरण के लिए, $\mathrm{CH_3} \mathrm{OH}$ मेथिल एल्कोहल होता है।
IUPAC प्रणाली के अनुसार, एल्कोहल का नाम उस एल्केन से लिया जाता है जिससे एल्कोहल बनता है, इसमें एल्केन के ‘ए’ के स्थान पर ‘ऑल’ के प्रतिस्थापन के द्वारा बनाया जाता है। विस्थापक के स्थान को संख्याओं द्वारा इंगित किया जाता है। इसके लिए, सबसे लंबी कार्बन श्रृंखला (मातृ श्रृंखला) को जल ऑक्सीजन समूह के करीब वाले सिरे से गिना जाता है। $-\mathrm{OH}$ समूह और अन्य विस्थापक के स्थान को उन कार्बन परमाणुओं की संख्या द्वारा इंगित किया जाता है जिन पर ये जुड़े होते हैं। बहुहाइड्रोक्सी एल्कोहल के नामकरण में, एल्केन के ‘ए’ को बरकरार रखा जाता है और ‘ऑल’ के साथ जोड़ दिया जाता है। $-\mathrm{O}$ समूह की संख्या को ‘डाई’, ‘ट्राई’, आदि गुणन प्रतिशब्द के साथ ‘ऑल’ के साथ जोड़कर बताया जाता है। $-\mathrm{OH}$ समूह के स्थान को उपयुक्त स्थान निर्देशक द्वारा इंगित किया जाता है, उदाहरण के लिए, $\mathrm{HO}-\mathrm{CH_2}-\mathrm{CH_2}-\mathrm{OH}$ को एथेन-1, 2-डाईऑल के रूप में नामित किया जाता है। तालिका 7.1 कुछ एल्कोहल के सामान्य और IUPAC नाम दिए गए हैं।
तालिका 7.1: कुछ एल्कोहल के सामान्य और IUPAC नाम

साइक्लिक एल्कोहल के नाम बनाने में “cyclo” प्रत्यय का उपयोग किया जाता है और —OH समूह को C–1 पर जुड़े होने की गणना की जाती है।

(b) फीनॉल: बेंजीन के सबसे सरल हाइड्रॉक्सी अपशिष्ट फीनॉल है। यह इसका सामान्य नाम है और यह एक स्वीकृत IUPAC नाम भी है। फीनॉल की संरचना में बेंजीन वलय शामिल होता है, इसलिए इसके विस्थापित यौगिकों में सामान्य नामों में “ऑर्थो” (1,2- द्विविस्थापित), “मेटा” (1,3- द्विविस्थापित) और “पेरा” (1,4- द्विविस्थापित) शब्द अक्सर उपयोग किए जाते हैं।

बेंजीन के डाइहाइड्रॉक्सी अवतरण बेंजीन डाइऑल के रूप में जाने जाते हैं, जैसे 1, 2-, 1, 3- और 1, 4-बेंजीन डाइऑल।

(c) ईथर्स: ईथर्स के सामान्य नाम एल्किल/ ऐरिल समूहों के नाम से बनाए जाते हैं, जो वर्णक्रम में अलग-अलग शब्दों के रूप में लिखे जाते हैं और अंत में ‘ईथर’ शब्द जोड़ दिया जाता है। उदाहरण के लिए, $\mathrm{CH_3} \mathrm{OC_2} \mathrm{H_5}$ ईथिल मेथिल ईथर होता है।
सारणी 7.2: कुछ ईथर के सामान्य और IUPAC नाम

यदि दोनों ऐल्किल समूह समान हों, तो ऐल्किल समूह के सामने ‘डाई’ के प्रतिशब्द का उपयोग किया जाता है। उदाहरण के लिए, $\mathrm{C_2} \mathrm{H_5} \mathrm{OC_2} \mathrm{H_5}$ डाईएथिल ईथर है।
IUPAC नामकरण प्रणाली के अनुसार, ईथर को एक हाइड्रोकार्बन अवतरण के रूप में देखा जाता है, जहां एक हाइड्रोजन परमाणु को -OR या -OAr समूह द्वारा प्रतिस्थापित किया जाता है, जहां $\mathrm{R}$ और Ar क्रमशः ऐल्किल और ऐरिल समूह को प्रतिनिधित्व करते हैं। बड़ा (R) समूह पarent हाइड्रोकार्बन के रूप में चुना जाता है। कुछ ईथर के नाम सारणी 7.2 में उदाहरण के रूप में दिए गए हैं।
उदाहरण 7.1
निम्नलिखित यौगिकों के IUPAC नाम दीजिए:

हल
(i) 4-क्लोरो-2,3-डाइमेथिलपेंटेन-1-ऑल
(ii) 2-एथॉक्सीप्रोपेन
(iii) 2,6-डाइमेथिलफीनॉल
(iv) 1-एथॉक्सी-2-नाइट्रोसाइक्लोहेक्जेन
अंतर्गत प्रश्न
11.3 IUPAC प्रणाली के अनुसार निम्नलिखित यौगिकों के नाम लिखिए।

उत्तर दिखाएँ
उत्तर
(i) 4-क्लोरो-3-एथिल-2-(1-मेथिलएथिल)-ब्यूटेन-1-ऑल
(ii) 2, 5-डाइमेथिलहेक्सेन-1, 3-डाइऑल
(iii) 3-ब्रोमोसाइक्लोहेक्सेनॉल
(iv) हेक्स-1-एन-3-ऑल
(v) 2-ब्रोमो-3-मेथिलब्यूट-2-एन-1-ऑल
7.3 कार्यकारी समूहों के संरचना
अल्कोहल में, $-\mathrm{OH}$ समूह के ऑक्सीजन कार्बन से एक सिग्मा $(\sigma)$ बंध द्वारा जुड़ा होता है, जो कार्बन के $s p^{3}$ हाइब्रिडाइज्ड ऑर्बिटल और ऑक्सीजन के $s p^{3}$ हाइब्रिडाइज्ड ऑर्बिटल के ओवरलैप से बनता है। चित्र 7.1 मेथनॉल, फीनॉल और मेथॉक्सीमेथेन के संरचनात्मक पहलूओं को दर्शाता है।

चित्र 7.1: मेथनॉल, फीनॉल और मेथॉक्सीमेथेन के संरचना
अल्कोहल में बंधन कोण  त्रिकोणीय कोण $\left(109^{\circ}-28^{\prime}\right)$ से थोड़ा कम होता है। इसके कारण ऑक्सीजन के असंयोजक इलेक्ट्रॉन युग्मों के बीच प्रतिकर्षण होता है। फीनॉल में $-\mathrm{OH}$ समूह एक औषधीय वलय के $s p^{2}$ हाइब्रिडाइज्ड कार्बन पर जुड़ा होता है। फीनॉल में कार्बन-ऑक्सीजन बंधन की लंबाई $(136 \mathrm{pm})$ मेथनॉल में बंधन की लंबाई से थोड़ी कम होती है। इसके कारण
त्रिकोणीय कोण $\left(109^{\circ}-28^{\prime}\right)$ से थोड़ा कम होता है। इसके कारण ऑक्सीजन के असंयोजक इलेक्ट्रॉन युग्मों के बीच प्रतिकर्षण होता है। फीनॉल में $-\mathrm{OH}$ समूह एक औषधीय वलय के $s p^{2}$ हाइब्रिडाइज्ड कार्बन पर जुड़ा होता है। फीनॉल में कार्बन-ऑक्सीजन बंधन की लंबाई $(136 \mathrm{pm})$ मेथनॉल में बंधन की लंबाई से थोड़ी कम होती है। इसके कारण
(i) आंशिक द्विबंध गुण के कारण, ऑक्सीजन के असंयोजी इलेक्ट्रॉन युग्म के साथ औषधीय वलय के संयोजन के कारण (अनुच्छेद 7.4.4) और
(ii) ऑक्सीजन के जुड़े कार्बन के $s p^{2}$ हाइब्रिड अवस्था।
ईथर में, ऑक्सीजन पर चार इलेक्ट्रॉन युग्म, अर्थात् दो बंध युग्म और दो अकेले इलेक्ट्रॉन युग्म, लगभग टेट्राहेड्रल व्यवस्था में व्यवस्थित होते हैं। दो बड़े (-R) समूहों के बीच प्रतिकर्षण के कारण बंध कोण टेट्राहेड्रल कोण से थोड़ा अधिक होता है। $\mathrm{C}-\mathrm{O}$ बंध लंबाई $(141 \mathrm{pm})$ ऐल्कोहल में लगभग समान होती है।
7.4 एल्कोहल एवं फीनॉल
एल्कोहल निम्नलिखित विधियों द्वारा तैयार किए जाते हैं:
7.4.1 एल्कोहल के तैयार करना
1. एल्कीन से
(i) अम्ल कातलिस्ट विलयन द्वारा: एल्कीन अम्ल के उपस्थिति में जल के साथ अभिक्रिया करके एल्कोहल बनाते हैं। असममित एल्कीन के मामले में, योग अभिक्रिया मार्कोनिकोव के नियम के अनुसार होती है।

मेकैनिज्म प्रतिक्रिया के मेकैनिज्म में निम्नलिखित तीन चरण शामिल हैं:
चरण 1: $\mathrm{H_3} \mathrm{O}^{+}$ के विद्युताकर्षी आक्रमण द्वारा एल्कीन के प्रोटॉनीकरण से कार्बोकेटियन के निर्माण।

चरण 2: जल के न्यूक्लिओफिलिक आक्रमण कार्बोकेटियन पर।

स्टेप 3: डिप्रोटोनेशन करके एल्कोहल के निर्माण के लिए।

हाइड्रोबोरेशन - ऑक्सीकरण की खोज 1959 में H.C. ब्राउन द्वारा पहले रिपोर्ट की गई थी। ब्राउन ने बोरॉन से बने कार्बनिक यौगिकों पर अपने अध्ययनों के लिए 1979 में रसायन विज्ञान के नोबेल पुरस्कार के साथ G. विटिग के साथ इस पुरस्कार को साझा किया।
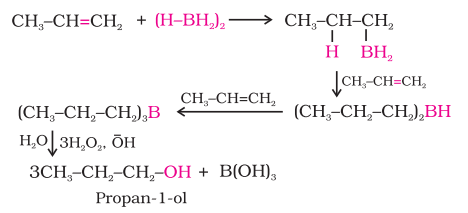
(ii) हाइड्रोबोरेशन-ऑक्सीकरण द्वारा: डाइबोरेन $\left(\mathrm{BH_3}\right)_{2}$ एल्कीन के साथ अभिक्रिया करके त्रिअल्किल बोरेन के रूप में योग उत्पाद देता है। इसे जलीय सोडियम हाइड्रॉक्साइड की उपस्थिति में हाइड्रोजन पेरोक्साइड के साथ ऑक्सीकृत करके एल्कोहल बनाया जाता है।

बोरेन के डबल बॉंड पर जोड़ने की प्रक्रिया इस प्रकार होती है कि बोरॉन परमाणु वह sp² कार्बन पर जुड़ जाता है जो अधिक हाइड्रोजन परमाणुओं के साथ बर्बाद होता है। इस प्रकार बने एल्कोहल के लगभग जैसे लगता है कि यह एल्कीन पर वाटर के जोड़ने के विपरीत तरीके से मार्कोवनिकोव के नियम के विपरीत बना हो। इस अभिक्रिया में एल्कोहल की उत्पादन दर अद्वितीय होती है।
2. कार्बोनिल यौगिकों से
(i) एल्डिहाइड और केटोन के अपचयन द्वारा: एल्डिहाइड और केटोन को उपस्थित उत्प्रेरक (कैटलिटिक हाइड्रोजनेशन) की उपस्थिति में हाइड्रोजन के योग से संगत एल्कोहल में अपचयित किया जाता है। सामान्य उत्प्रेरक एक छोटे कणों वाला धातु जैसे प्लेटिनम, पैलेडियम या निकल होता है। यह एल्डिहाइड और केटोन के साथ सोडियम बोरोहाइड्राइड $\left(\mathrm{NaBH_4}\right)$ या लिथियम एल्यूमिनियम हाइड्राइड $\left(\mathrm{LiAlH_4}\right)$ के कार्य कराकर भी बनाया जाता है। एल्डिहाइड प्राथमिक एल्कोहल देते हैं जबकि केटोन द्वितीयक एल्कोहल देते हैं।
$$ \mathrm{RCHO} + \mathrm{H_2} \xrightarrow[]{\mathrm{Pd}} \mathrm{RCH_2} \mathrm{OH}\\ $$
$$ \mathrm{RCOR^\prime} \xrightarrow[]{\mathrm{NaBH _4}} \mathrm{R}- \underset{\large\mathrm{OH}}{\large\underset{\text{|}}{\mathrm{C}} \mathrm{H}}-\mathrm{R^\prime} $$
चारे रासायनिक अभिकर्मकों के सामने लिखे संख्या यह दर्शाते हैं कि दूसरा अभिकर्मक केवल जब पहले अभिकर्मक के साथ अभिक्रिया पूर्ण हो जाए तभी उपयोग किया जाता है।
(ii) कार्बॉक्सिलिक अम्ल और ईस्टर के अपचयन द्वारा: लिथियम ऐलुमिनियम हाइड्राइड, एक मजबूत अपचायक एजेंट, कार्बॉक्सिलिक अम्ल को प्राथमिक ऐल्कोहल में उत्कृष्ट दक्षता से अपचयित करता है।
$$ \mathrm{RCOOH} \xrightarrow[\text{(ii)}\mathrm{H_2O}]{\text{(i)} \mathrm{LiAlH_4}} \mathrm{RCH_2} \mathrm{OH} $$
हालांकि, $\mathrm{LiAlH_4}$ एक महँगा रासायनिक अभिकर्मक है, और इसलिए, केवल विशेष रसायनों के निर्माण के लिए उपयोग किया जाता है। व्यावसायिक रूप से, अम्लों को एल्कोहल में बदलने के लिए उन्हें एस्टर में परिवर्तित करके (अनुच्छाया 7.4.4), फिर उनके अपचयन के लिए हाइड्रोजन की उपस्थिति में एक कातलिस्ट के साथ अपचयन किया जाता है (कैटलिटिक हाइड्रोजनेशन)।
$$ \mathrm{RCOOH} \xrightarrow[\mathrm{H}^{+}]{\mathrm{R}^{\prime} \mathrm{OH}} \mathrm{RCOOR}^{\prime} \xrightarrow[\text { Catalyst }]{\mathrm{H_2}} \mathrm{RCH_2} \mathrm{OH}+\mathrm{R}^{\prime} \mathrm{OH} $$
$$
3. ग्रिग्नार्ड रासायनिक अभिकर्मकों से
ग्रिग्नार्ड रासायनिक अभिकर्मकों (यूनिट 10, कक्षा XII) के एल्डिहाइड और केटोन के साथ अभिक्रिया से एल्कोहल बनते हैं।
अभिक्रिया का पहला चरण ग्रिग्नार्ड रासायनिक अभिकर्मक के न्यूक्लियोफिलिक योग के रूप में कार्बोनिल समूह के साथ योग होता है जिससे एक योग के उत्पाद बनता है। योग के उत्पाद के हाइड्रोलिज़ करने से एल्कोहल प्राप्त होता है।

ग्रिग्नार्ड रासायनिक अभिकर्मकों के मेथेनल के साथ अभिक्रिया से प्राथमिक एल्कोहल, अन्य एल्डिहाइड के साथ द्वितीयक एल्कोहल और केटोन के साथ तृतीयक एल्कोहल बनते हैं।
समान अल्डिहाइड और कीटोन का उपयोग करते हुए सामान्य अभिक्रियाएँ निम्नलिखित हैं:

आप ध्यान देंगे कि अभिक्रिया मेथेनल के साथ प्राथमिक एल्कोहल, अन्य अल्डिहाइड के साथ द्वितीयक एल्कोहल और कीटोन के साथ तृतीयक एल्कोहल उत्पन्न करती है।
उदाहरण 7.2 निम्नलिखित अभिक्रियाओं से उत्पादों के संरचना और IUPAC नाम दें:
(a) ब्यूटैनल के कैटलिटिक अपचयन।
(b) तनु सल्फ्यूरिक अम्ल की उपस्थिति में प्रोपीन की जलीकरण।
(c) प्रोपैनोन के मेथिल मैग्नीशियम ब्रोमाइड के साथ अभिक्रिया तथा उसके पश्चात जलअपघटन।
हल

7.4.2 फीनॉल के तैयारी
फीनॉल, जिसे कार्बोलिक अम्ल के रूप में भी जाना जाता है, उपचार शताब्दी के प्रारंभिक दौर में कोयला गैल के अलग करने से पहली बार प्राप्त किया गया था। आजकल, फीनॉल को औद्योगिक रूप से संश्लेषित रूप से उत्पादित किया जाता है। प्रयोगशाला में, फीनॉल को बेंजीन अवतरणों से निम्नलिखित किसी भी विधि द्वारा तैयार किया जाता है:
1. हैलोएरीन से क्लोरोबेंजीन को $\mathrm{NaOH}$ के साथ $623 \mathrm{~K}$ ताप और 320 वायुमंडलीय दबाव पर गलाया जाता है। उत्पादित सोडियम फेनॉक्साइड के अम्लीकरण से फेनॉल प्राप्त किया जाता है (यूनिट 10, कक्षा XII)।

2. बेंज़ीन सल्फोनिक अम्ल से बेंज़ीन को ऑल्इम के साथ सल्फोनेट किया जाता है और उत्पादित बेंज़ीन सल्फोनिक अम्ल को मल्टन सोडियम हाइड्रॉक्साइड के साथ गर्म करके सोडियम फेनॉक्साइड में परिवर्तित किया जाता है। सोडियम लवण के अम्लीकरण से फेनॉल प्राप्त किया जाता है।

3. डाइऐजोनियम लवण से एक डाइऐजोनियम लवण एक औषधीय प्राथमिक ऐमीन को नाइट्रस अम्ल $\left(\mathrm{NaNO_2}+\mathrm{HCl}\right)$ के साथ 273-278 K पर उपचार देकर बनाया जाता है। डाइऐजोनियम लवण को जल या तनु अम्ल के साथ गर्म करके फेनॉल में हाइड्रोलाइज़ किया जा सकता है (यूनिट 13, कक्षा XII)।

वैश्विक फीनॉल के उत्पादन के अधिकांश भाग कुमीन से होते हैं।
4. कुमीन से फीनॉल को कार्बनिक यौगिक, कुमीन से निर्मित किया जाता है। कुमीन (आइसोप्रोपिलबेंज़ीन) हवा की उपस्थिति में ऑक्सीकृत किया जाता है ताकि कुमीन हाइड्रॉपरऑक्साइड बने। इसे तनु अम्ल के साथ उपचार द्वारा फीनॉल और एसिटोन में परिवर्तित किया जाता है। इस अभिक्रिया के उत्पाद के रूप में एसिटोन भी इस विधि द्वारा बड़े पैमाने पर प्राप्त किया जाता है।

अंतर्गत प्रश्न
11.4 निम्नलिखित अल्कोहलों को मेथेनल पर उपयुक्त ग्रिग्नार्ड अभिकर्मक के अभिक्रिया द्वारा कैसे बनाया जाता है?

उत्तर दिखाएँ
उत्तर
(i)

(ii)

11.5 निम्नलिखित अभिक्रियाओं के उत्पादों के संरचना लिखिए:

उत्तर दिखाएँ
उत्तर

7.4.3 भौतिक गुण
अल्कोहल एवं फीनॉल दो भागों से मिलकर बने होते हैं, एक अल्किल/एरिल समूह एवं एक हाइड्रॉक्सिल समूह। अल्कोहल एवं फीनॉल के गुण मुख्य रूप से हाइड्रॉक्सिल समूह के कारण होते हैं। अल्किल एवं एरिल समूहों की प्रकृति इन गुणों को सरलता से प्रभावित करती है।
क्वथनांक
अल्कोहल एवं फीनॉल के क्वथनांक तेल के अणुओं की संख्या बढ़ने के साथ बढ़ते हैं (वैं डर वाल्स बलों में वृद्धि)। अल्कोहल में, कार्बन शृंखला में शाखा के बढ़ने के साथ क्वथनांक घटते हैं (क्योंकि सतह क्षेत्रफल कम होने के साथ वैं डर वाल्स बल घटते हैं)।
–OH समूह एल्कोहल और फीनॉल में अंतरमोलेकुलर हाइड्रोजन बंधन में शामिल होता है, जैसा कि नीचे दिखाया गया है:

चिंताजनक बात यह है कि एल्कोहल और फीनॉल के क्वथनांक अन्य वर्ग के योग्य अणुभार वाले यौगिकों, जैसे हाइड्रोकार्बन, ईथर, हैलोएल्केन और हैलोएरीन की तुलना में अधिक होते हैं। उदाहरण के लिए, एथेनॉल और प्रोपेन के अणुभार लगभग समान हैं लेकिन उनके क्वथनांक में बहुत अंतर होता है। मेथॉक्सीमेथेन के क्वथनांक दोनों क्वथनांक के बीच होता है।

अल्कोहल के उच्च क्वथनांक मुख्य रूप से उनमें अंतरमोलेकुलर हाइड्रोजन बंधन की उपस्थिति के कारण होते हैं, जो ईथर और हाइड्रोकार्बन में अनुपस्थित होता है।
घुलनशीलता
अल्कोहल और फीनॉल के पानी में घुलनशीलता उनकी पानी के अणुओं के साथ हाइड्रोजन बंध बनाने की क्षमता के कारण होती है, जैसा कि दिखाया गया है। अल्किल/अरिल (हाइड्रोफोबिक) समूह के आकार के साथ घुलनशीलता कम हो जाती है। कई निम्न अणुभार वाले अल्कोहल पानी में सभी अनुपातों में मिश्रण कर सकते हैं।

उदाहरण 7.3 निम्नलिखित यौगिकों को उनके उबलने के बिंदु के बढ़ते क्रम में व्यवस्थित करें:
(a) पेंटेन-1-ऑल, ब्यूटेन-1-ऑल, ब्यूटेन-2-ऑल, एथेनॉल, प्रोपेन-1-ऑल, मेथेनॉल।
(b) पेंटेन-1-ऑल, एन-ब्यूटेन, पेंटेनल, एथॉक्सीईथेन।
हल
(a) मेथेनॉल, एथेनॉल, प्रोपेन-1-ऑल, ब्यूटेन-2-ऑल, ब्यूटेन-1-ऑल, पेंटेन-1-ऑल।
(b) एन-ब्यूटेन, एथॉक्सीईथेन, पेंटेनल और पेंटेन-1-ऑल।
7.4.4 रासायनिक अभिक्रियाएं
अल्कोहल एक विस्तृत यौगिक होते हैं। वे न्यूक्लिओफाइल और इलेक्ट्रॉनिल दोनों के रूप में अभिक्रिया करते हैं। जब अल्कोहल न्यूक्लिओफाइल के रूप में अभिक्रिया करते हैं, तो $\mathrm{O}-\mathrm{H}$ के बीच के बंध टूट जाता है। अल्कोहल न्यूक्लिओफाइल के रूप में

(ii) जब वे इलेक्ट्रॉनिल के रूप में अभिक्रिया करते हैं, तो $\mathrm{C}-\mathrm{O}$ के बीच के बंध टूट जाता है। प्रोटोनित अल्कोहल इस प्रकार अभिक्रिया करते हैं।

प्रोटोनित अल्कोहल एक इलेक्ट्रॉनिक अभिकर्मक के रूप में
$\mathrm{O}-\mathrm{H}$ और $\mathrm{C}-\mathrm{O}$ बंध के अपघटन के आधार पर, अल्कोहल और फ़ेनॉल के अभिक्रियाएँ दो वर्गों में विभाजित की जा सकती हैं:
(a) O–H बंध के अपघटन वाली अभिक्रियाएँ
1. अल्कोहल और फ़ेनॉल की अम्लता
(i) धातुओं के साथ अभिक्रिया: अल्कोहल और फ़ेनॉल सक्रिय धातुओं जैसे सोडियम, पोटेशियम और एल्यूमिनियम के साथ अभिक्रिया करते हैं और संगत अल्कॉक्साइड/फ़ेनॉक्साइड और हाइड्रोजन उत्पन्न करते हैं।

इसके अलावा, फीनॉल पानी के सोडियम हाइड्रॉक्साइड के साथ अभिक्रिया करके सोडियम फीनॉक्साइड बनाते हैं।

उपरोक्त अभिक्रियाएँ दर्शाती हैं कि एल्कोहल और फीनॉल प्रकृति में अम्लीय होते हैं। वास्तव में, एल्कोहल और फीनॉल ब्रॉन्स्टेड अम्ल होते हैं, अर्थात वे एक शक्तिशाली क्षारक (B:) के साथ एक प्रोटॉन दान कर सकते हैं।

(ii) एल्कोहल की अम्लता: एल्कोहल के अम्लीय गुण $\mathrm{O}-\mathrm{H}$ बंध के ध्रुवीय प्रकृति के कारण होते हैं। एक इलेक्ट्रॉन दाता समूह $\left(-\mathrm{CH_3},-\mathrm{C_2} \mathrm{H_5}\right)$ ऑक्सीजन पर इलेक्ट्रॉन घनत्व को बढ़ाता है, जो $\mathrm{O}-\mathrm{H}$ बंध की ध्रुवता को कम करता है। इसके कारण अम्लता कम हो जाती है। इस कारण से, एल्कोहल की अम्लता निम्न क्रम में कम होती है:

अल्कोहल जल की तुलना में कम अम्लीय होते हैं। इसका उदाहरण एक ऐल्कॉक्साइड के साथ जल की अभिक्रिया द्वारा दिया जा सकता है।

इस अभिक्रिया से स्पष्ट होता है कि जल एक बेहतर प्रोटॉन दाता (अर्थात, अम्लीय बल अधिक) होता है। इस अभिक्रिया में हम यह भी देखते हैं कि एक ऐल्कॉक्साइड आयन एक हाइड्रॉक्साइड आयन की तुलना में एक बेहतर प्रोटॉन ग्रहीत होता है, जो इस बात को सुझाता है कि ऐल्कॉक्साइड अधिक क्षारीय होते हैं (सोडियम एथॉक्साइड सोडियम हाइड्रॉक्साइड की तुलना में अधिक क्षारीय होता है)।
अल्कोहल ब्रॉनस्टेड क्षारक के रूप में भी कार्य करते हैं। इसके कारण ऑक्सीजन पर असंयोजी इलेक्ट्रॉन युग्म की उपस्थिति होती है, जो उन्हें प्रोटॉन ग्रहणकर्ता बनाती है।
(iii) फीनॉल की अम्लता: फीनॉल की अम्लता: फीनॉल के धातुओं (जैसे, सोडियम, एल्यूमिनियम) और सोडियम हाइड्रॉक्साइड के साथ अभिक्रिया से इसकी अम्लीय प्रकृति का अनुमान लगाया जा सकता है। फीनॉल में हाइड्रॉक्सिल समूह, बेंजीन वलय के $s p^{2}$ हाइब्रिडाइज्ड कार्बन पर बर्बर रूप से जुड़ा होता है जो एक इलेक्ट्रॉन अवशोषक समूह के रूप में कार्य करता है। इस कारण, फीनॉल अणु में चार्ज वितरण, जैसा कि इसके रेजोनेंस संरचनाओं में दिखाया गया है, फीनॉल में $-\mathrm{OH}$ समूह के ऑक्सीजन को धनात्मक बनाता है।

फ़ीनॉल के जलीय सोडियम हाइड्रॉक्साइड के साथ अभिक्रिया इस बात को दर्शाती है कि फ़ीनॉल एल्कोहल और पानी की तुलना में अधिक अम्लीय होता है। चलो देखें कि एक यौगिक में हाइड्रॉक्सिल समूह एक औषधीय वलय के साथ जुड़ा हो तो वह एक ऐल्किल समूह के साथ जुड़े हाइड्रॉक्सिल समूह वाले यौगिक की तुलना में कितना अधिक अम्लीय होता है।
अल्कोहल और फीनॉल के आयनीकरण के तरीके इस प्रकार होते हैं:

फीनॉल में $s p^{2}$ हाइब्रिडाइज़्ड कार्बन की उच्च विद्युत ऋणात्मकता के कारण, ऑक्सीजन पर इलेक्ट्रॉन घनत्व कम हो जाता है। इसके परिणामस्वरूप $\mathrm{O}-\mathrm{H}$ बंध की ध्रुवता बढ़ जाती है और फीनॉल के आयनीकरण की दर अल्कोहल की तुलना में अधिक हो जाती है। अब हम एल्कॉक्साइड और फीनॉक्साइड आयन के स्थायित्व की जांच करेंगे। एल्कॉक्साइड आयन में नकारात्मक आवेश ऑक्सीजन पर स्थानांतरित होता है जबकि फीनॉक्साइड आयन में आवेश विस्थापित होता है। नकारात्मक आवेश के विस्थापन (संरचनाएं I-V) के कारण फीनॉक्साइड आयन अधिक स्थायी होता है और फीनॉल के आयनीकरण को बढ़ावा देता है। फीनॉल में भी आवेश का विस्थापन होता है, लेकिन इसकी रेज़ोनेंस संरचनाएं आवेश विभाजन के कारण होती हैं जिसके कारण फीनॉल अणु फीनॉक्साइड आयन की तुलना में कम स्थायी होता है।

स्थानांतरित फीनॉल में, इलेक्ट्रॉन अवसादक समूहों जैसे नाइट्रो समूह की उपस्थिति फीनॉल की अम्लता को बढ़ाती है। ऐसा प्रभाव उस समूह के ओर्थो और पेरा स्थिति पर उपस्थित होने पर अधिक तीव्र होता है। इसका कारण यह है कि जब समूह ओर्थो या पेरा स्थिति पर होता है तो फीनॉक्साइड आयन में नकारात्मक आवेश के प्रभावी वितरण के कारण होता है। दूसरी ओर, इलेक्ट्रॉन उत्सर्जक समूहों, जैसे ऐल्किल समूह, आमतौर पर फीनॉक्साइड आयन के निर्माण के लिए अनुकूल नहीं होते हैं, जिसके कारण अम्लता कम हो जाती है। उदाहरण के लिए, क्रेसॉल्स फीनॉल की तुलना में कम अम्लीय होते हैं।
$\mathrm{pK_a}$ के मान जितना अधिक होगा, अम्ल उतना कम शक्तिशाली होगा।
तालिका 7.3: कुछ फीनॉल और एथेनॉल के $\mathrm{pK} _{\mathrm{a}}$ मान
| यौगिक | सूत्र | $\mathbf{p K} _{\mathrm{a}}$ |
|---|---|---|
| $o$-नाइट्रोफीनॉल | $o-\mathrm{O}_2 \mathrm{~N}-\mathrm{C}_6 \mathrm{H}_4-\mathrm{OH}$ | 7.2 |
| $m$-नाइट्रोफीनॉल | $m-\mathrm{O}_2 \mathrm{~N}-\mathrm{C}_6 \mathrm{H}_4-\mathrm{OH}$ | 8.3 |
| $p$-नाइट्रोफीनॉल | $p-\mathrm{O}_2 \mathrm{~N}-\mathrm{C}_6 \mathrm{H}_4-\mathrm{OH}$ | 7.1 |
| फीनॉल | $\mathrm{C}_6 \mathrm{H}_5-\mathrm{OH}$ | 10.0 | | $o$-क्रेसॉल | $o-\mathrm{CH}_3-\mathrm{C}_6 \mathrm{H}_4-\mathrm{OH}$ | 10.2 | | $m$-क्रेसॉल | $m-\mathrm{CH}_3 \mathrm{C}_6 \mathrm{H}_4-\mathrm{OH}$ | 10.1 | | $p$-क्रेसॉल | $p-\mathrm{CH}_3-\mathrm{C}_6 \mathrm{H}_4-\mathrm{OH}$ | 10.2 | | एथेनॉल | $\mathrm{C}_2 \mathrm{H}_5 \mathrm{OH}$ | 15.9 |
ऊपर के डेटा से आप ध्यान देंगे कि फीनॉल एथेनॉल की तुलना में मिलियन गुना अम्लीय है।
उदाहरण 7.4 निम्नलिखित यौगिकों को उनकी अम्लता के बढ़ते क्रम में व्यवस्थित करें:
प्रोपेन-1-ऑल, 2,4,6-ट्राइनाइट्रोफेनॉल, 3-नाइट्रोफेनॉल, 3,5-डाइनाइट्रोफेनॉल, फेनॉल, 4-मेथिलफेनॉल।
हल
प्रोपेन-1-ऑल, 4-मेथिलफेनॉल, फेनॉल, 3-नाइट्रोफेनॉल, 3,5-डाइनाइट्रोफेनॉल, 2,4,6-ट्राइनाइट्रोफेनॉल।
2. ऐसीटिलेशन
अल्कोहल और फेनॉल कार्बोक्सिलिक अम्ल, अम्ल क्लोराइड और अम्ल एनहाइड्राइड के साथ अभिक्रिया करके एस्टर बनाते हैं।
$\mathrm{Ar} / \mathrm{ROH}+\mathrm{R}^{\prime}-\mathrm{COOH} \stackrel{\mathrm{H}^{+}}{\rightleftharpoons} \mathrm{Ar} / \mathrm{ROCOR}^{\prime}+\mathrm{H_2} \mathrm{O}$
$\mathrm{Ar} / \mathrm{R}-\mathrm{OH}+\left(\mathrm{R}^{\prime} \mathrm{CO}\right)_{2} \mathrm{O} \stackrel{\mathrm{H}^{+}}{\rightleftharpoons} \mathrm{Ar} / \mathrm{ROCOR}^{\prime}+\mathrm{R}^{\prime} \mathrm{COOH}$
$\mathrm{R} / \mathrm{ArOH}+\mathrm{R}^{\prime} \mathrm{COCl} \xrightarrow{\text { Pyridine }} \mathrm{R} / \mathrm{ArOCOR}^{\prime}+\mathrm{HCl}$
एस्पिरिन के गुण दर्द निवारक, विरोधी भड़काऊ और ज्वर नियंत्रक होते हैं।
कार्बोक्सिलिक अम्ल और अम्ल ऐनहाइड्राइड के साथ अभिक्रिया अधिकांशतः सांद्र अमोनिया अम्ल की छोटी मात्रा की उपस्थिति में की जाती है। अभिक्रिया विपरीत दिशा में हो सकती है, इसलिए जल के निर्माण के तुरंत बाद जल को हटा दिया जाता है। अम्ल क्लोराइड के साथ अभिक्रिया एक आधार (पाइरिडीन) की उपस्थिति में की जाती है ताकि अभिक्रिया के दौरान उत्पन्न होने वाला $\mathrm{HCl}$ निष्प्रभावी कर दिया जा सके। यह संतुलन को दाहिने ओर विस्थापित करता है। एल्कोहल या फेनॉल में ऐसीटिल $\left(\mathrm{CH_3} \mathrm{CO}\right)$ समूह के प्रवेश को ऐसीटिलेशन कहा जाता है। साइलिक अम्ल की ऐसीटिलेशन एस्पिरिन के निर्माण के लिए जाना जाता है।

(b) अल्कोहल में कार्बन - ऑक्सीजन (C–O) बंध के तोड़ वाले अभिक्रियाएँ
अल्कोहल में कार्बन - ऑक्सीजन ( $\mathrm{C}-\mathrm{O}$ ) बंध के तोड़ वाली अभिक्रियाएँ
1. हाइड्रोजन हैलाइड के साथ अभिक्रिया: अल्कोहल हाइड्रोजन हैलाइड के साथ अभिक्रिया करके ऐल्किल हैलाइड बनाते हैं (इकाई 6, कक्षा XII देखें)।
$$ \mathrm{ROH}+\mathrm{HX} \rightarrow \mathrm{R}-\mathrm{X}+\mathrm{H_2} \mathrm{O} $$
$$
तीन श्रेणियों के एल्कोहल के $\mathrm{HCl}$ के साथ अभिक्रिया के अलग-अलग अभिक्रियाशीलता के कारण उन्हें एक दूसरे से अलग किया जा सकता है (लुकस परीक्षण). एल्कोहल लुकस अभिकर्मक (गैल्न एचसीएल और जीन क्ल 2) में घुले रहते हैं जबकि उनके हैलाइड अघुलनशील होते हैं और विलयन में काला धुंआ उत्पन्न करते हैं। तृतीयक एल्कोहल के मामले में, वे तुरंत काला धुंआ उत्पन्न करते हैं क्योंकि वे आसानी से हैलाइड बनाते हैं। प्राथमिक एल्कोहल कमरे के तापमान पर काला धुंआ उत्पन्न नहीं करते हैं।
2. फॉस्फोरस ट्राइहैलाइड के साथ अभिक्रिया: एल्कोहल फॉस्फोरस ट्राइब्रोमाइड के साथ अभिक्रिया करके ऐल्किल ब्रोमाइड में परिवर्तित हो जाते हैं (अध्याय 10, कक्षा XII देखें)।
3. विलयन: एल्कोहल एक प्रोटिक अम्ल, जैसे कि सांकेतिक $\mathrm{H_2} \mathrm{SO_4}$ या $\mathrm{H_3} \mathrm{PO_4}$, या कैटलिस्ट जैसे अन्हाइड्रोस जिंक क्लोराइड या एल्यूमिना के साथ उपचार के द्वारा एक एल्कीन बनाने के लिए विलयन (जल के एक अणु के निकालना) होता है।
एथेनॉल को 443 $\mathrm{~K}$ पर सांकेतिक $\mathrm{H_2} \mathrm{SO_4}$ के साथ गरम करके विलयन होता है।
$$ \mathrm{C_2} \mathrm{H_5} \mathrm{OH} \xrightarrow[443 \mathrm{~K}]{\mathrm{H_2} \mathrm{SO_4}} \mathrm{CH_2}=\mathrm{CH_2}+\mathrm{H_2} \mathrm{O} $$
$$
$$ \mathrm{C} _{2} \mathrm{H} _{5} \mathrm{OH} \xrightarrow[443 \mathrm{~K}]{\mathrm{H} _{2} \mathrm{SO} _{4}} \mathrm{CH} _{2}=\mathrm{CH} _{2}+\mathrm{H} _{2} \mathrm{O} $$
द्वितीयक और तृतीयक एल्कोहॉल आसान शर्तों में विलयन कर देते हैं। उदाहरण के लिए

इस प्रकार, एल्कोहॉल के विलयन करने की संबंधित आसानी निम्नलिखित क्रम में होती है:
तृतीयक > द्वितीयक > प्राथमिक
ईथेनॉल के विस्थापन के यांत्रिक कार्य निम्नलिखित चरणों में होता है:
तृतीयक कार्बोकेटियन अधिक स्थायी होते हैं और इसलिए द्वितीयक और प्राथमिक कार्बोकेटियन की तुलना में आसानी से बनते हैं; तृतीयक ऐल्कोहॉल विस्थापन के लिए सबसे आसान होते हैं।
यांत्रिक कार्य
चरण 1: ऐल्कोहॉल के प्रोटॉनिकरण के निर्माण।

स्टेप 2: कार्बोकेशन के गठन: यह सबसे धीमा कदम है और अत: अभिक्रिया का गति निर्धारण कदम है।
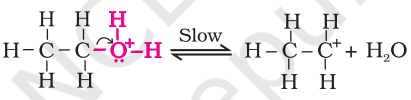
स्टेप 3: एथीन के गठन एक प्रोटॉन के उत्सर्जन द्वारा।

अम्ल जो कदम 1 में उपयोग किया जाता है, कदम 3 में छोड़ दिया जाता है। संतुलन को दाईं ओर ले जाने के लिए, एथीन को उत्पादन होते ही हटा दिया जाता है।
4. ऑक्सीकरण: एल्कोहॉल के ऑक्सीकरण में, कार्बन-ऑक्सीजन डबल बंध के निर्माण के साथ $\mathrm{O}-\mathrm{H}$ और $\mathrm{C}-\mathrm{H}$ बंधों का तोड़ आता है।

ऐसा तोड़ और बंध के निर्माण ऑक्सीकरण अभिक्रियाओं में होता है। ये अभिक्रियाएं भी डिहाइड्रोजनेशन अभिक्रियाएं कहलाती हैं क्योंकि इनमें एल्कोहॉल अणु से डाइहाइड्रोजन के नुकसान के साथ होता है। ऑक्सीकरण करने वाले एजेंट के आधार पर, प्राथमिक एल्कोहॉल को एल्डिहाइड में ऑक्सीकृत किया जाता है जो फिर से कार्बॉक्सिलिक अम्ल में ऑक्सीकृत किया जाता है।

मजबूत ऑक्सीकारक जैसे अम्लीय पोटैशियम परमैंगनेट का उपयोग एल्कोहल से कार्बॉक्सिलिक अम्ल प्राप्त करने के लिए किया जाता है। $\mathrm{CrO_3}$ एनहाइड्रोस माध्यम में एल्डिहाइड के अलग करने के लिए ऑक्सीकारक के रूप में उपयोग किया जाता है।
प्राथमिक एल्कोहल को एल्डिहाइड में अच्छी आयतन वाले ऑक्सीकरण के लिए एक बेहतर अभिकरक पिरिडिनियम क्लोरोक्रोमेट (PCC) होता है, जो क्रोमियम ट्राइऑक्साइड के साथ पिरिडीन और $\mathrm{HCl}$ के साथ एक यौगिक होता है।
$$ \mathrm{CH} _{3}-\mathrm{CH}=\mathrm{CH}-\mathrm{CH} _{2} \mathrm{OH} \xrightarrow{\mathrm{PCC}} \mathrm{CH} _{3}-\mathrm{CH}=\mathrm{CH}-\mathrm{CHO} $$
सेकंडरी एल्कोहॉल क्रोमिक एनहाइड्राइड $\left(\mathrm{CrO_3}\right)$ द्वारा कीटोन में ऑक्सीकृत हो जाते हैं।

तृतीयक एल्कोहॉल ऑक्सीकरण अभिक्रिया में भाग नहीं ले लेते। मजबूत अभिक्रिया शर्तों जैसे मजबूत ऑक्सीकारक $\left(\mathrm{KMnO_4}\right)$ और उच्च तापमान पर विभिन्न $\mathrm{C}-\mathrm{C}$ बंधों के विघटन के लिए एक एसिड विलयन बनता है जिसमें कम संख्या में कार्बन परमाणु होते हैं।

जब किसी प्राथमिक या द्वितीयक एल्कोहल के वाष्प तीव्र गर्मी के तहत तांबे के ऊपर $573 \mathrm{~K}$ के ताप पर गुजरते हैं, तो डिहाइड्रोजनन क्रिया होती है और एल्डिहाइड या केटोन बनते हैं जबकि तृतीयक एल्कोहल वियोजन के अनुसार अपचयित होते हैं।
शरीर में मेथेनॉल और एथेनॉल के जैविक ऑक्सीकरण संगत एल्डिहाइड के निर्माण के बाद अम्ल के रूप में बनते हैं। कभी-कभी शराबी लोग त्रुटि से मेथेनॉल के साथ एथेनॉल के मिश्रण को पी लेते हैं जिसे अपचयित एल्कोहल भी कहते हैं। शरीर में मेथेनॉल के ऑक्सीकरण के दौरान
पहले मेथेनल और फिर मेथेनोइक अम्ल में बदल जाता है, जो आंखों के नुकसान और मृत्यु का कारण बन सकता है। मेथेनॉल विषाक्त रोगी के लिए त्वचा के माध्यम से तैयार किए गए एथेनॉल के अंतर्वेगीय इंफ्यूजन द्वारा उपचार किया जाता है। ऐल्डिहाइड (HCHO) के अम्ल में ऑक्सीकरण के लिए जिम्मेदार एंजाइम के अत्यधिक कार्य करते हैं, जिससे किडनी मेथेनॉल को उत्सर्जित करने के लिए समय बर्बाद होता है।
(c) फीनॉल के अभिक्रियाएं
केवल फीनॉल द्वारा निम्नलिखित अभिक्रियाएं होती हैं।
1. इलेक्ट्रोफिलिक औषधीय विस्थापन
फीनॉल में औषधीय वलय पर होने वाली अभिक्रियाएं इलेक्ट्रोफिलिक विस्थापन अभिक्रियाएं होती हैं (यूनिट 9, क्लास XI)। बेंजीन वलय पर जुड़े -OH समूह इलेक्ट्रोफिलिक विस्थापन के लिए वलय को सक्रिय करते हैं। इसके अलावा, इन स्थितियों में वलय के ओर्थो और पेरा स्थान इलेक्ट्रॉन समृद्ध हो जाते हैं क्योंकि -OH समूह द्वारा उत्पन्न रेजोनेंस प्रभाव के कारण। रेजोनेंस संरचनाएं फीनॉल के अम्लता के अंतर्गत दिखाई गई हैं।
सामान्य विद्युत धनात्मक और विलेय विस्थापन अभिक्रियाएं जो फीनॉल में होती हैं निम्नलिखित हैं:
(i) नाइट्रेशन: निम्न तापमान (298 K) पर तनु नाइट्रिक अम्ल के साथ फीनॉल ओर्थो और पेरा नाइट्रोफीनॉल के मिश्रण का उत्पादन करता है।

ओर्थो और पेरा समावयवी को भाप विभाजन द्वारा अलग किया जा सकता है। ओ-नाइट्रोफीनॉल अपने अंतर्मुखी जलीय बंधन के कारण भाप विलेय होता है जबकि पी-नाइट्रोफीनॉल अंतराणुक जलीय बंधन के कारण अणुओं के संघटन के कारण कम विलेय होता है।

2, 4, 6 - ट्राइनाइट्रोफीनॉल तीन इलेक्ट्रॉन अवसादी $-\mathrm{NO}_2$ समूहों की उपस्थिति के कारण एक मजबूत अम्ल है जो हाइड्रोजन आयन के विमुक्ति को सुगम बनाते हैं।
केंद्रित नाइट्रिक अम्ल के साथ फीनॉल को 2,4,6-ट्राइनाइट्रोफीनॉल में परिवर्तित किया जाता है। उत्पाद को सामान्यतः पिक्रिक अम्ल के रूप में जाना जाता है। अभिक्रिया के उत्पाद की आयोजन दर कम होती है।

अब आजकल पिक्रिक अम्ल को फीनॉल को पहले सांद्र अमोनिया अम्ल के साथ अभिक्रिया कराकर फीनॉल-2,4-डाइसल्फोनिक अम्ल में परिवर्तित करने और फिर सांद्र नाइट्रिक अम्ल के साथ अभिक्रिया कराकर 2,4,6-ट्राइनाइट्रोफीनॉल प्राप्त करके बनाया जाता है। क्या आप इन अभिक्रियाओं के समीकरण लिख सकते हैं?
(ii) हैलोजनीकरण: फीनॉल को ब्रोमीन के साथ अभिक्रिया कराने पर अलग-अलग प्रयोगात्मक स्थितियों में अलग-अलग अभिक्रिया उत्पाद बनते हैं।
(a) जब अभिक्रिया कम ध्रुवता वाले विलायकों जैसे $\mathrm{CHCl_3}$ या $\mathrm{CS_2}$ में तथा कम तापमान पर की जाती है, तो मोनोब्रोमोफ़ेनॉल बनते हैं।

बेंजीन की सामान्य विलेयता लेविस अम्ल की उपस्थिति में, जैसे $\mathrm{FeBr_3}$ (एकांतर श्रेणी XII, इकाई 6), होती है, जो हैलोजन अणु के ध्रुवीकरण को प्रेरित करता है। फ़ेनॉल के मामले में, ब्रोमीन अणु के ध्रुवीकरण को लेविस अम्ल की अनुपस्थिति में भी होता है। इसके कारण बेंजीन वलय पर जुड़े $-\mathrm{OH}$ समूह के बहुत उत्प्रेरक प्रभाव के कारण है।
(b) फीनॉल को ब्रोमीन जल के साथ उपचार देने पर $2,4,6$-ट्राइब्रोमोफीनॉल के रूप में सफेद अवक्षेप बनता है।

उदाहरण 7.5
निम्नलिखित अभिक्रियाओं से अपेक्षित मुख्य उत्पादों के संरचना लिखिए:
(a) 3-मेथिलफीनॉल की मोनोनिट्रेशन
(b) 3-मेथिलफीनॉल की डाइनिट्रेशन
(c) फीनिल मेथेनोएट की मोनोनिट्रेशन।
हल $-\mathrm{OH}$ और $-\mathrm{CH_3}$ समूहों के संयुक्त प्रभाव आगंतुक समूह के स्थान के निर्धारण में महत्वपूर्ण भूमिका निभाते हैं।

2. कोल्बे की अभिक्रिया
फीनॉल को सोडियम हाइड्रॉक्साइड के साथ उपचार करके उत्पन्न फीनॉक्साइड आयन एसिलेन विस्थापन अभिक्रिया के प्रति फीनॉल की तुलना में अधिक प्रतिक्रियाशील होता है। इसलिए, इसके साथ कार्बोनिक ऑक्साइड (एक कमजोर धनात्मक अभिकारक) के एसिलेन विस्थापन अभिक्रिया होती है। इस अभिक्रिया का मुख्य उत्पाद अंतर्गत एसिड है।

3. रिमर-टिमैन अभिक्रिया
फीनॉल को क्लोरोफॉर्म के साथ सोडियम हाइड्रॉक्साइड की उपस्थिति में अभिक्रिया कराने पर बेंजीन वलय के ओर्थो स्थान पर –CHO समूह जोड़ दिया जाता है। इस अभिक्रिया को रिमर-टिमैन अभिक्रिया कहते हैं।
अपचयन वाला बेंजल क्लोराइड अल्कली की उपस्थिति में जल अपघटित होकर साइलिकल डिहाइड्रोजेन बनाता है।

4. फीनॉल के जिंक धूल के साथ अभिक्रिया
फीनॉल को जिंक धूल की उपस्थिति में गरम करके बेंजीन में परिवर्तित किया जाता है।

5. ऑक्सीकरण
फीनॉल के क्रोमिक अम्ल के साथ ऑक्सीकरण से एक संयोजी डाइकेटोन के रूप में जाना जाता है, जिसे बेंजो क्विनोन कहते हैं। हवा की उपस्थिति में फीनॉल धीरे-धीरे गहरे रंग के मिश्रण में ऑक्सीकृत हो जाते हैं, जिनमें क्विनोन शामिल होते हैं।
अंतर्गत प्रश्न
11.6 जब निम्नलिखित में से प्रत्येक एल्कोहल (a) ${HCl}-{ZnCl_2}$ (b) ${HBr}$ और (c) ${SOCl_2}$ के साथ अभिक्रिया करता है तो आप किन उत्पादों की अपेक्षा करेंगे?
(i) ब्यूटेन-1-ऑल
(ii) 2-मेथिलब्यूटेन-2-ऑल
उत्तर दिखाएं
उत्तर
(a)
(i) $\underset{\text{ब्यूटेन-1-ऑल}}{{CH_3}-{CH_2}-{CH_2}-{CH_2}-{OH}} \xrightarrow{{HCl} - {ZnCl_2}} \text { कोई अभिक्रिया नहीं }$
प्राथमिक एल्कोहल तापमान के अतिरिक्त लुकस अभिकर्मक $\left({HCl}-{ZnCl_2}\right)$ के साथ अप्रभावी रूप से अभिक्रिया करते हैं।
(ii)

तृतीयक एल्कोहल तापमान के अतिरिक्त लुकस अभिकर्मक के साथ तुरंत अभिक्रिया करते हैं
(b)
(i) $\underset{\text{ब्यूटेन-1-ऑल}}{{CH_3} {CH_2} {CH_2} {CH_2} {OH}}+{HBr} \xrightarrow{{-H_2O}}\underset{\text{1-ब्रोमोब्यूटेन}}{{CH_3} {CH_2} {CH_2} {CH_2} {Br}}$
(ii)

(c)
(i) $\underset{\text{ब्यूटेन-1-ऑल}}{{CH_3} {CH_2} {CH_2} {CH_2} {OH}}+{SOCl_2} \longrightarrow \underset{\text{1-क्लोरोब्यूटेन}}{{CH_3} {CH_2} {CH_2} {CH_2} {Cl}}+{SO_2}+{HCl}$
(ii)

11.7 अम्ल उत्प्रेरक वियोजन द्वारा निम्नलिखित के मुख्य उत्पाद का अनुमान लगाएं
(i) 1-मेथिलसाइक्लोहेक्सेनऑल और
(ii) ब्यूटेन-1-ऑल
उत्तर दिखाएं
उत्तर
(i)

(ii) ब्यूट-1-ईन और ब्यूट-2-ईन के मिश्रण। ब्यूट-2-ईन मुख्य उत्पाद होता है क्योंकि व्युत्क्रमण के कारण द्वितीयक कार्बोकेटियन बनता है।
$\underset{\text{ब्यूटन-1-ऑल}}{{CH_3} {CH_2} {CH_2} {CH_2} {OH}} \xrightarrow[{H^+}]{\text { विस्खलन }} \underset{\substack{\text{ब्यूट-2-ईन }\\ \text{(मुख्य उत्पाद)}}}{{CH_3} {CH}={CHCH_3}}+\underset{\substack{\text{ब्यूट-1-ईन }\\ \text{(कम उत्पाद)}}}{{CH_3} {CH_2}{CH=CH_2}}$
11.8 ओर्थो और पैरा नाइट्रोफीनॉल फीनॉल की तुलना में अधिक अम्लीय होते हैं। संगत फीनॉक्साइड आयन के रेजोनेंस संरचना बनाइए।
उत्तर दिखाएं
उत्तर
फीनॉक्साइड आयन के रेजोनेंस संरचना :

$p$-नाइट्रोफीनॉक्साइड आयन के रेजोनेंस संरचना :

$o$-नाइट्रोफीनॉक्साइड आयन के रेजोनेंस संरचना :

यह देखा जा सकता है कि नाइट्रो समूह की उपस्थिति फीनॉक्साइड आयन के स्थायित्व को बढ़ाती है।
11.9 निम्नलिखित अभिक्रियाओं में शामिल अभिक्रिया समीकरण लिखिए:
(i) रीमर-टीमैन अभिक्रिया
(ii) कोल्बे अभिक्रिया
उत्तर दिखाएँ
उत्तर
(i) रीमर-टिमैन अभिक्रिया

(ii) कोल्बे अभिक्रिया

7.5 कुछ व्यावसायिक रूप से महत्वपूर्ण ऐल्कोहल
मेथनॉल और एथेनॉल दो व्यावसायिक रूप से महत्वपूर्ण ऐल्कोहलों में से हैं।
1. मेथनॉल
मेथनॉल, $\mathrm{CH_3} \mathrm{OH}$, जिसे ‘लकड़ी का आत्मा’ भी कहा जाता है, लकड़ी के विनाशक विघटन द्वारा उत्पादित किया जाता था। आज, अधिकांश मेथनॉल को उच्च दबाव और तापमान तथा $\mathrm{ZnO}-\mathrm{Cr_2} \mathrm{O_3}$ कैटलिस्ट की उपस्थिति में कार्बन मोनोऑक्साइड के कैटलिटिक हाइड्रोजनेशन द्वारा उत्पादित किया जाता है।
$$ \mathrm{CO}+2 \mathrm{H} _{2} \xrightarrow[\substack{200-300 \text { atm } \\ 573-673 \mathrm{~K}}]{\mathrm{ZnO}-\mathrm{Cr} _{2} \mathrm{O} _{3}} \mathrm{CH} _{3} \mathrm{OH} $$
$$
मेथनॉल एक रंगहीन तरल पदार्थ है जो 337 K पर उबलता है। यह प्रकृति में बहुत विषैला होता है। मेथनॉल के भी छोटी मात्रा के सेवन से दृष्टि खो जाती है और बड़ी मात्रा के सेवन से तकनीकी रूप से मृत्यु भी हो सकती है। मेथनॉल पेंट, वैर्निश आदि में एक विलायक के रूप में उपयोग किया जाता है और मुख्य रूप से फॉर्मल्डिहाइड बनाने के लिए उपयोग किया जाता है।
2. एथेनॉल
एथेनॉल, $\mathrm{C_2} \mathrm{H_5} \mathrm{OH}$, फर्मेंटेशन के द्वारा व्यापारिक रूप से प्राप्त किया जाता है, सबसे पुरानी विधि शर्करा से होती है। मोलासी, गन्ना या फलों जैसे अंगूर में शर्करा को एन्जाइम इन्वर्टेज की उपस्थिति में ग्लूकोज और फ्रक्टोज में परिवर्तित किया जाता है, (जिनका सूत्र $\mathrm{C_6} \mathrm{H_12} \mathrm{O_6}$ होता है)। ग्लूकोज और फ्रक्टोज एक अन्य एन्जाइम, जीमेज की उपस्थिति में फर्मेंटेशन करते हैं, जो यीस्ट में पाया जाता है।
$$\begin{aligned} & \mathrm{C} _{12} \mathrm{H} _{22} \mathrm{O} _{11}+\mathrm{H} _2 \mathrm{O} \xrightarrow{\text { Invertase }} \underset{\text{ Glucose }}{\mathrm{C} _6 \mathrm{H} _{12} \mathrm{O} _6}+\underset{\text{ Fructose }}{\mathrm{C} _6 \mathrm{H} _{12} \mathrm{O} _6} \\ \\ & \mathrm{C} _6 \mathrm{H} _{12} \mathrm{O} _6 \xrightarrow{\text { Zymase }} 2 \mathrm{C} _2 \mathrm{H} _5 \mathrm{OH}+2 \mathrm{CO} _2 \\ & \end{aligned}$$
अनारक्षित शराब बनाने में, अंगूठी शर्करा और यीस्ट के स्रोत होते हैं। जब अंगूठी पकती है, तो शर्करा की मात्रा बढ़ती जाती है और यीस्ट बाहरी त्वचा पर बढ़ता है। जब अंगूठी कस दी जाती है, तो शर्करा और एंजाइम एक साथ आ जाते हैं और फर्मेंटेशन शुरू हो जाता है। फर्मेंटेशन अनारक्षित शर्तों में होता है, अर्थात हवा की अनुपस्थिति में। फर्मेंटेशन के दौरान कार्बन डाइऑक्साइड छोड़ी जाती है।
एथनॉल के स्वागत केंद्रीय तंत्रिका प्रणाली पर कार्य करता है। मध्यम मात्रा में, यह निर्णय लेने की क्षमता को प्रभावित करता है और बाधाओं को कम करता है। उच्च तीव्रता में यह उल्टी और चेतना के नुकसान का कारण बनता है। भले ही उच्च तीव्रता में, यह आत्मस्पंदन श्वास के साथ बाधा डालता है और मृत्यु का कारण बन सकता है।
जब निर्मित अल्कोहल की प्रतिशतता 14 प्रतिशत से अधिक हो जाती है, तो ज़िमेज़ के कार्य को बाधा पहुंचती है। यदि हवा फर्मेंटेशन मिश्रण में प्रवेश करती है, तो हवा के ऑक्सीजन एथनॉल को एथेनोइक अम्ल में ऑक्सीकृत करता है, जो फिर से शराब के स्वाद को नष्ट कर देता है।
एथेनॉल एक रंगहीन तरल पदार्थ है जिसका क्वथनांक $351 \mathrm{~K}$ है। यह पेंट उद्योग में एक विलायक के रूप में तथा कई कार्बन यौगिकों के तैयार करने में प्रयोग किया जाता है। व्यावसायिक एल्कोहल को पीने के लिए अयोग्य बनाने के लिए इसमें कुछ कॉपर सल्फेट (इसे रंग देने के लिए) तथा पाइरिडीन (एक खास गंध वाला तरल) मिलाया जाता है। इसे एल्कोहल के अपचायन के रूप में जाना जाता है।
आजकल, बड़ी मात्रा में एथेनॉल एथीन के जलीकरण द्वारा प्राप्त किया जाता है (अनुच्छेद 7.4)।
7.6 ईथर्स
7.6.1 ईथर्स के तैयार करना
1. एल्कोहल के वाष्पीकरण द्वारा
एल्कोहल प्रोटिक अम्ल $\left(\mathrm{H_2} \mathrm{SO_4}, \mathrm{H_3} \mathrm{PO_4}\right)$ की उपस्थिति में वाष्पीकरण करते हैं। प्रतिक्रिया उत्पाद के निर्माण, अल्कीन या ईथर के अनुसार, प्रतिक्रिया की स्थितियों पर निर्भर करता है। उदाहरण के लिए, सल्फ्यूरिक अम्ल की उपस्थिति में एथेनॉल के वाष्पीकरण से एथीन बनता है $443 \mathrm{~K}$ पर। $413 \mathrm{~K}$ पर, ईथोक्सीईथेन अधिकतम उत्पाद होता है।

डाइएथिल ईथर का व्यापक रूप से श्वास लेने वाला अनाइस्थेटिक के रूप में उपयोग किया गया है। लेकिन इसके धीमे प्रभाव और अच्छा नहीं लगने वाले बाहर आने के अवधि के कारण, इसे अनाइस्थेटिक के रूप में अन्य यौगिकों द्वारा बदल दिया गया है।
ईथर के निर्माण की प्रक्रिया एक न्यूक्लियोफिलिक द्विअणुक प्रतिक्रिया $\left(\mathrm{S_\mathrm{N}} 2\right)$ है जिसमें एल्कोहल अणु के एक प्रोटॉनिकृत एल्कोहल पर हमला होता है, जैसा कि नीचे दिखाया गया है:

एल्कोहल के अम्लीय वियोजन द्वारा एल्कीन के निर्माण के साथ-साथ एक ईथर के निर्माण के लिए विस्थापन प्रतिक्रिया भी संबंधित है।
विधि प्राथमिक ऐल्किल समूह वाले ईथर के तैयार करने के लिए उपयुक्त है। ऐल्किल समूह अवरोधित नहीं होना चाहिए और तापमान को निम्न रखा जाना चाहिए। अन्यथा अभिक्रिया ऐल्कीन के निर्माण के अनुकूल हो जाती है। जब ऐल्कोहॉल द्वितीयक या तृतीयक होता है, तो अभिक्रिया $\mathrm{S_N1}$ पथ पर होती है, जिसके बारे में आप उच्च वर्ग में सीखेंगे। हालांकि, द्वितीयक और तृतीयक ऐल्कोहॉल के जलनुक्त ईथर के रूप में विघटन करना असफल रहता है क्योंकि उदासीनकरण विस्थापन के बजाय प्रतिस्थापन के साथ प्रतियोगिता करता है और फलस्वरूप ऐल्कीन आसानी से बन जाते हैं।
क्या आप बता सकते हैं कि ऐथिल मेथिल ईथर के तैयार करने के लिए बिमोलेक्युलर डीहाइड्रेशन क्यों उपयुक्त नहीं है?
एलेक्सेंडर विलियम विलियमसन (1824–1904) लंदन में एक स्कॉटिश परिवार के बच्चे के रूप में पैदा हुए थे। 1849 में, वह लंदन विश्वविद्यालय कॉलेज में रसायन विज्ञान के प्रोफेसर बन गए।
2. विलियमसन संश्लेषण
यह सममित और असममित ईथर के तैयार करने के लिए एक महत्वपूर्ण प्रयोगशाला विधि है। इस विधि में, एक ऐल्किल हैलाइड नैत्रिक ऐल्कॉक्साइड के साथ अभिक्रिया कराई जाती है।

ईथर जिनमें स्थानांतरित ऐल्किल समूह (द्वितीयक या तृतीयक) होते हैं, इस विधि द्वारा भी तैयार किए जा सकते हैं। अभिक्रिया में प्राथमिक ऐल्किल हैलाइड पर ऐल्कॉक्साइड आयन के $\mathrm{S_N2}$ हमला होता है।

अगर ऐल्किल हैलाइड प्राथमिक होता है तो अधिक अच्छे परिणाम प्राप्त होते हैं। द्वितीयक और तृतीयक ऐल्किल हैलाइड के मामले में उद्हरण विस्थापन के स्थान पर अपचयन प्रतिस्पर्धा करता है। यदि एक तृतीयक ऐल्किल हैलाइड का उपयोग किया जाता है, तो एल्कीन ही अभिक्रिया उत्पाद होता है और ईथर का निर्माण नहीं होता। उदाहरण के लिए, $\mathrm{CH_3ONa}$ के $\mathrm{(CH_3)_3C–Br}$ से अभिक्रिया में केवल 2-मेथिलप्रोपीन बनता है।

इसलिए एल्कॉक्साइड न केवल न्यूक्लिओफाइल होते हैं बल्कि एक शक्तिशाली क्षारक भी होते हैं। वे एल्किल हैलाइड के साथ अभिक्रिया करते हैं जिसके परिणामस्वरूप उनके एलिमिनेशन अभिक्रिया होती है।
उदाहरण 7.6 निम्नलिखित अभिक्रिया t-ब्यूटिल एथिल ईथर के निर्माण के लिए उपयुक्त नहीं है
$ \mathrm{C_2H_5ONa} + \mathrm{CH_3}- \underset{\large\mathrm{CH_3}}{\large\underset{\large\text{|}}{\stackrel{\stackrel{\large\mathrm{CH_3}}{\text{|}}}{\large\mathrm{C}}}}-\mathrm{Cl} \longrightarrow \mathrm{CH_3}- \underset{\large\mathrm{CH_3}}{\large\underset{\large\text{|}}{\stackrel{\stackrel{\large\mathrm{CH_3}}{\text{|}}}{\large\mathrm{C}}}} - \mathrm{C_2H_5} $
(i) इस अभिक्रिया का मुख्य उत्पाद क्या होगा?
(ii) टै-ब्यूटिल एथिल ईथर के तैयारी के लिए एक उपयुक्त अभिक्रिया लिखिए।
हल
(i) दी गई अभिक्रिया का मुख्य उत्पाद 2-मेथिलप्रोप-1-ईन है। इसका कारण यह है कि सोडियम एथॉक्साइड एक मजबूत न्यूक्लिफाइल जैसे ही एक मजबूत क्षारक भी है। अतः एलिमिनेशन अभिक्रिया प्रतिस्थापन अभिक्रिया के बजाय अधिक प्रभावी होती है।

फीनॉल इस विधि द्वारा एथर में भी परिवर्तित होते हैं। इसमें फीनॉल को फीनॉक्सी मोईटी के रूप में उपयोग किया जाता है।

7.6.2 भौतिक गुण
एथर में $\mathrm{C}-\mathrm{O}$ बंध ध्रुवीय होती हैं और इसलिए एथर के एक नेट द्विध्रुव आघूर्ण होता है। एथर की कम ध्रुवता उनके क्वथनांकों पर अप्रभावी होती है जो तुलनात्मक अणुभार वाले एल्केन के क्वथनांकों के समान होते हैं लेकिन एल्कोहल के क्वथनांक की तुलना में काफी कम होते हैं, जैसा कि नीचे दिए गए मामलों में दिखाया गया है:
| सूत्र | $\mathrm{CH} _{3}\left(\mathrm{CH} _{2}\right) _{3} \mathrm{CH} _{3}$ | $\mathrm{C} _{2} \mathrm{H} _{5}-\mathrm{O}-\mathrm{C} _{2} \mathrm{H} _{5}$ | $\mathrm{CH} _{3}\left(\mathrm{CH} _{2}\right) _{3}-\mathrm{OH}$ |
|---|---|---|---|
| $\mathrm{n}$-पेंटेन | एथॉक्सीएथेन | ब्यूटेन-1-ऑल | |
| क्वथनांक/ $\mathbf{K}$ | 309.1 | 307.6 | 390 |
अल्कोहल और ईथर के बीच बड़ा अंतर बर्फीले बंधन के उपस्थिति के कारण होता है जो अल्कोहल में होता है।
ईथर के पानी के साथ मिश्रण क्षमता उसी अणुभार वाले अल्कोहल के समान होती है। दोनों एथॉक्सीएथेन और ब्यूटेन-1-ऑल लगभग समान मात्रा में पानी के साथ मिश्रण करते हैं, अर्थात 7.5 और $9 \mathrm{~g}$ प्रति $100 \mathrm{~mL}$ पानी के लिए क्रमशः, जबकि पेंटेन पानी के साथ लगभग अमिश्रणीय होता है। आप इस अवलोकन की व्याख्या कर सकते हैं? इसका कारण यह है कि जैसे अल्कोहल, ईथर के ऑक्सीजन भी पानी के अणुओं के साथ हाइड्रोजन बंधन बना सकते हैं, जैसा कि नीचे दिखाया गया है:

7.6.3 रासायनिक अभिक्रियाएं
1. ईथर में C–O बंध के तोड़ना
ईथर फंक्शनल ग्रुप में सबसे कम प्रतिक्रियाशील होते हैं। ईथर में $\mathrm{C}-\mathrm{O}$ बंध के तोड़ना अत्यधिक शर्तों तथा हाइड्रोजन हैलाइड के अतिरिक्त मात्रा में होता है। डाइएल्किल ईथर की अभिक्रिया दो एल्किल हैलाइड अणु उत्पन्न करती है।
$$ \begin{aligned} & \mathrm{R}-\mathrm{O}-\mathrm{R}+\mathrm{HX} \longrightarrow \mathrm{RX}+\mathrm{R}-\mathrm{OH} \\
& \mathrm{R}-\mathrm{OH}+\mathrm{HX} \longrightarrow \mathrm{R}-\mathrm{X}+\mathrm{H_2} \mathrm{O} \end{aligned} $$
उन ईथर्स के भी अपघटन एक तरह से होता है जिनमें दो अलग-अलग एल्किल समूह होते हैं।
$$ \mathrm{R}-\mathrm{O}-\mathrm{R}^{\prime}+\mathrm{HX} \longrightarrow \mathrm{R}-\mathrm{X}+\mathrm{R}^{\prime}-\mathrm{OH} $$
उन ईथर्स के भी अपघटन एक तरह से होता है जिनमें दो अलग-अलग एल्किल समूह होते हैं।
हाइड्रोजन हैलाइड के प्रतिक्रिया क्रम इस प्रकार होता है: $\mathrm{HI}>\mathrm{HBr}>\mathrm{HCl}$। ईथर्स के अपघटन तीव्र $\mathrm{HI}$ या $\mathrm{HBr}$ के साथ उच्च तापमान पर होता है।
मेकैनिज़्म
एथर के अम्लीय अत्यधिक विलयन HI के साथ अभिक्रिया एथर अणु के प्रोटॉनीकरण से शुरू होती है।
स्टेप 1:

अभिक्रिया $\mathrm{HBr}$ या $\mathrm{HI}$ के साथ होती है क्योंकि ये रासायनिक अभिकरक अत्यधिक अम्लीय होते हैं।
स्टेप 2:
आयोडाइड एक अच्छा न्यूक्लिफाइल होता है। यह एथर के स्टेप 1 में बने ऑक्सोनियम आयन के सबसे कम विस्तारित कार्बन पर हमला करता है और $\mathrm{S_N2}$ मेकैनिज़्म के माध्यम से एल्कोहल अणु को विस्थापित करता है। इस प्रकार, दो अलग-अलग एल्किल समूह वाले मिश्रित एथर के विघटन में बने एल्कोहल और एल्किल आयोडाइड की प्रकृति एल्किल समूह की प्रकृति पर निर्भर करती है। जब प्राथमिक या द्वितीयक एल्किल समूह उपस्थित होते हैं, तो यह निम्न एल्किल समूह एल्किल आयोडाइड बनाता है ($\mathrm{S_N2}$ अभिक्रिया)।

जब $\mathrm{HI}$ अतिरिक्त मात्रा में होता है और अभिक्रिया उच्च तापमान पर की जाती है, तो एथेनॉल एक अन्य अणु के साथ $\mathrm{HI}$ के साथ अभिक्रिया करता है और एथिल आयोडाइड में परिवर्तित हो जाता है।
चरण 3:

हालांकि, जब एक ऐल्किल समूह एक तृतीयक समूह होता है, तो निर्मित हैलाइड एक तृतीयक हैलाइड होता है। इसका कारण अभिक्रिया के चरण 2 में, छोड़ने वाले समूह (HO–CH3) के छोड़ जाने से एक अधिक स्थायी कार्बोकेटियन $[(\mathrm{CH_3)_3C^+}]$ बनता है, और अभिक्रिया $\mathrm{S_N1}$ योगिक के माध्यम से चलती है।

अनिसॉल के मामले में, मेथिलफेनिल ऑक्सोनियम आयन, 
ईथर के प्रोटॉनीकरण से बनता है। $\mathrm{O}-\mathrm{CH_3}$ के बीच बंध $\mathrm{O}-\mathrm{C_6} \mathrm{H_5}$ के बीच बंध की तुलना में कमजोर है क्योंकि फ़ेनिल समूह के कार्बन $s p^{2}$ हाइब्रिडाइज़्ड होता है और इसमें आंशिक डबल बंध चरित्र होता है।
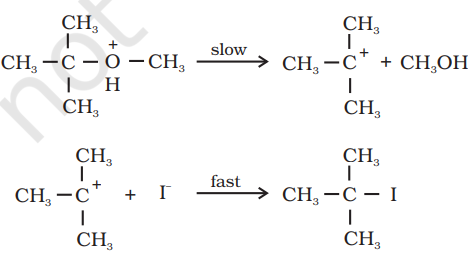
इसलिए $I^-$ आयन के हमले से $\mathrm{O}-\mathrm{CH_3}$ बंध टूटकर $\mathrm{CH_3I}$ बनता है। फ़ेनॉल आगे अभिक्रिया करके हैलाइड नहीं बनाते क्योंकि फ़ेनॉल के $s p^{2}$ हाइब्रिडाइज़्ड कार्बन के लिए आवश्यक न्यूक्लियोफिलिक स्थानांतरण अभिक्रिया करना संभव नहीं होता।
उदाहरण 7.7 प्रत्येक निम्नलिखित ईथर को HI के साथ गरम करके बनने वाले मुख्य उत्पादों को बताइए।

हल


(ई) हैलोजनीकरण: फेनिलएल्किल ईथर बेंजीन वलय में सामान्य हैलोजनीकरण करते हैं, उदाहरण के लिए, एनिसोल एथेनोइक अम्ल में ब्रोमीन के साथ ब्रोमीनीकरण करता है, आयरन (III) ब्रोमाइड कैटलिस्ट के अनुपस्थिति में भी। इसका कारण मेथॉक्सी समूह द्वारा बेंजीन वलय के सक्रियण के कारण है। पैरा आइसोमर 90% आयतन में प्राप्त होता है।

(ii) फ्रेडेल-क्रॉफ्ट्स अभिक्रिया: ऐनिसोल फ्रेडेल-क्रॉफ्ट्स अभिक्रिया के अंतर्गत अभिक्रिया करता है, अर्थात अल्किल और एसिल समूह अल्किल हैलाइड और एसिल हैलाइड के साथ अनुपस्थिति में एनहाइड्रोस एल्यूमिनियम क्लोराइड (एक लेविस अम्ल) के कैटलिस्ट के साथ अनुपस्थिति में ओर्थो और पेरा स्थितियों पर प्रवेश करते हैं।

(iii) नाइट्रेशन: एनिसोल तीव्र सल्फ्यूरिक और नाइट्रिक अम्ल के मिश्रण के साथ अभिक्रिया करता है और ओर्थो और पेरा नाइट्रोएनिसोल के मिश्रण का उत्पादन करता है।

अंतर्गत प्रश्न
11.10 एथेनॉल एवं 3-मेथिलपेंटेन-2-ऑल के उपयोग से 2-एथॉक्सी-3-मेथिलपेंटेन के विलियमसन संश्लेषण के अभिक्रिया लिखिए।
उत्तर दिखाएं
उत्तर

11.11 निम्नलिखित में से कौन सा अभिकर्मक सेट 1-मेथॉक्सी-4-नाइट्रोबेंज़ीन के निर्माण के लिए उपयुक्त है और क्यों?

उत्तर दिखाएं
उत्तर
1-मेथॉक्सी-4-नाइट्रोबेंज़ीन के निर्माण के लिए सेट (ii) एक उपयुक्त अभिकर्मक सेट है।

सेट (i) में सोडियम मेथॉक्साइड $\left({CH_3} {ONa}\right)$ एक मजबूत न्यूक्लिफाइल एवं एक मजबूत क्षारक है। अतः, एक उद्हरण अभिक्रिया विस्थापन अभिक्रिया के बजाय अधिक प्रभुत्व रखती है।
11.12 निम्नलिखित अभिक्रियाओं के उत्पादों की भविष्यवाणी करें:

उत्तर दिखाएं
उत्तर
(i)
$ \underset{n-\text{प्रोपिलमेथिल ईथर}}{{CH_3}-{CH_2}-{CH_2}-{O}-{CH_3}}+{HBr} \longrightarrow \underset{\text{प्रोपेनॉल}}{{CH_3}-{CH_2}-{CH_2}-{OH}}+ \underset{\text{ब्रोमोमेथेन}}{{CH_3}-{Br}}$
(ii)

(iii)

(iv)
$ \underset{\text { tert -Butyl ethyl ether }}{\left({CH_3}\right) _{3} {C}-{OC _2} {H_5}} \xrightarrow{{HI}} \underset{\text { tert } \text {-Butyliodide }}{\left({CH _3}\right) _{3} {C}-{I}}+\underset{\text{Ethanol}}{{C _2} {H _5} {OH}} $
सारांश
अल्कोहल एवं फीनॉल को (i) हाइड्रॉक्सिल समूहों की संख्या के आधार पर एवं (ii) $s p^{3}$ या $s p^{2}$ हाइब्रिडाइजेशन वाले कार्बन परमाणु के आधार पर वर्गीकृत किया जाता है। ईथर को ऑक्सीजन परमाणु पर लगे समूहों के आधार पर वर्गीकृत किया जाता है।
अल्कोहल को (1) एल्कीन के हाइड्रोलाइज़ेशन द्वारा तैयार किया जा सकता है (i) अम्ल की उपस्थिति में एवं (ii) हाइड्रोबोरेशन-ऑक्सीकरण अभिक्रिया द्वारा (2) कार्बोनिल यौगिकों से (i) उत्प्रेरकीय अपचयन एवं (ii) ग्रिग्नार्ड अभिकरक के क्रिया द्वारा। फीनॉल को (1) हैलोएरीन में हैलोजन परमाणु के स्थान पर (i) एवं ऐरिल सल्फोनिक अम्ल में सल्फोनिक अम्ल समूह के स्थान पर (ii) $-\mathrm{OH}$ समूह द्वारा प्रतिस्थापन द्वारा (2) डाइज़ोनियम लवण के हाइड्रोलाइज़ेशन द्वारा एवं (3) उद्योग में क्यूमीन से तैयार किया जा सकता है।
अल्कोहल अन्य यौगिकों की तुलना में उच्च उबलने के बिंदु पर होते हैं, जैसे कि हाइड्रोकार्बन, ईथर और एकल अणुक द्रव्यमान के समान अणुभार वाले हैलोएल्केन। अल्कोहल, फीनॉल और ईथर के पानी के साथ अंतराणुक हाइड्रोजन बंधन बनाने की क्षमता उन्हें पानी में विलय्य बनाती है।
अल्कोहल और फीनॉल प्राकृतिक अम्लीय प्रकृति के होते हैं। फीनॉल में इलेक्ट्रॉन अवसादक समूह इसकी अम्लीय शक्ति को बढ़ाते हैं और इलेक्ट्रॉन विस्तारक समूह इसे कम करते हैं।
अल्कोहल हाइड्रोजन हैलाइड के साथ न्यूक्लिओफिलिक प्रतिस्थापन करते हैं जिससे एल्किल हैलाइड प्राप्त होते हैं। अल्कोहल के जलने से एल्कीन प्राप्त होते हैं। ऑक्सीकरण के द्वारा प्राथमिक अल्कोहल मृदु ऑक्सीकारक एजेंट के साथ एल्डिहाइड बनाते हैं और शक्तिशाली ऑक्सीकारक एजेंट के साथ कार्बॉक्सिलिक अम्ल बनाते हैं। द्वितीयक अल्कोहल केटोन बनाते हैं। तृतीयक अल्कोहल ऑक्सीकरण के प्रति प्रतिरोधी होते हैं।
फीनॉल में $-\mathrm{OH}$ समूह की उपस्थिति एरोमैटिक किस्म के वल्कन के प्रति इलेक्ट्रॉन अभिकर्षी विस्थापन के लिए सक्रिय करती है और अनुमान वस्तु को अधोलंब और पारस्परिक स्थानों पर निर्देशित करती है जो अनुनाद प्रभाव के कारण होता है। फीनॉल के रिमर-टिमैन अभिक्रिया साइलिकल्डिहाइड देती है। सोडियम हाइड्रॉक्साइड की उपस्थिति में, फीनॉल फीनॉक्साइड आयन बनाता है जो फीनॉल से अधिक प्रतिक्रियाशील होता है। इसलिए, क्षारीय माध्यम में फीनॉल कोल्बे की अभिक्रिया के अधीन होता है।
ईथर बनाए जा सकते हैं (i) ऐल्कोहल के जल अपसारण और (ii) विलियम्सन संश्लेषण द्वारा। ईथर के क्वथनांक एल्केन के जैसे होते हैं जबकि उनकी विलेयता समान अणुभार वाले ऐल्कोहल के जैसी होती है। ईथर में $\mathrm{C}-\mathrm{O}$ बंध हाइड्रोजन हैलाइड द्वारा तोड़ दी जा सकती है। इलेक्ट्रॉन अभिकर्षी विस्थापन में, ऐल्कॉक्सी समूह एरोमैटिक किस्म के वल्कन के प्रति सक्रिय करता है और अनुमान वस्तु को अधोलंब और पारस्परिक स्थानों पर निर्देशित करता है।
अभ्यास
11.1 निम्नलिखित यौगिकों के IUPAC नाम लिखिए:

उत्तर दिखाएं
उत्तर
(i) 2, 2, 4-ट्राइमेथिलपेंटेन-3-ऑल
(ii) 5-एथिलहेप्टेन-2, 4-डाइऑल
(iii) ब्यूटेन-2, 3-डाइऑल
(iv) प्रोपेन-1, 2, 3-ट्राइऑल
(v) 2-मेथिलफीनॉल
(vi) 4-मेथिलफीनॉल
(vii) 2, 5-डाइमेथिलफीनॉल
(viii) 2, 6-डाइमेथिलफीनॉल
(ix) 1-मेथॉक्सी-2-मेथिलप्रोपेन
(x) एथॉक्सीबेंज़ीन
(xi) 1-फीनॉक्सीहेप्टेन
(xii) 2-एथॉक्सीब्यूटेन
11.2 निम्नलिखित IUPAC नाम वाले यौगिकों के संरचना चित्र लिखिए:
(i) 2-मेथिलब्यूटेन-2-ऑल
(ii) 1-फीनिलप्रोपेन-2-ऑल
(iii) 3,5-डाइमेथिलहेक्सेन-1, 3, 5-ट्राइऑल
(iv) 2,3-डाइएथिलफीनॉल
(v) 1-एथॉक्सीप्रोपेन
(vi) 2-एथॉक्सी-3-मेथिलपेंटेन
(vii) साइक्लोहेक्सिलमेथनॉल
(viii) 3-साइक्लोहेक्सिलपेंटेन-3-ऑल
(ix) साइक्लोपेंट-3-एन-1-ऑल
(x) 4-क्लोरो-3-एथिलब्यूटेन-1-ऑल.
उत्तर दिखाएं
उत्तर
(i)

(ii)

(iii)

(iv)

(v)
${CH_3}-{CH_2}-{O}-{CH_2}-{CH_2}-{CH_3}$
(vi)

(vii)

(viii)

(ix)

(x)

11.3 (i) अणुसूत्र ${C_5} {H_{12}} {O}$ वाले सभी समावयवी एल्कोहल के संरचना चित्र बनाइए और उनके IUPAC नाम दीजिए।
(ii) प्रश्न 11.3 (i) के एल्कोहल के समावयवी को प्राथमिक, द्वितीयक और तृतीयक एल्कोहल के रूप में वर्गीकृत कीजिए।
उत्तर दिखाएं
Answer
(i) अणुसूत्र ${C_5} {H_{12}} {O}$ वाले सभी समावयवी एल्कोहल के संरचना चित्र नीचे दिए गए हैं:
(a) ${CH_3-CH_2-CH_2-CH_2-CH_2-OH}$
पेंटेन-1-ऑल $\left(1^{\circ}\right)$
(b)

2-मेथिलब्यूटेन-1-ऑल $\left(1^{\circ}\right)$
(c)

3-मेथिलब्यूटेन-1-ऑल $\left(1^{\circ}\right)$
(d)

2, 2-डाइमेथिलप्रोपेन-1-ऑल $\left(1^{\circ}\right)$
(e)

पेंटेन-2-ऑल (2°)
(f)

3-मेथिलब्यूटेन-2-ऑल (2°)
(g)

पेंटेन-3-ऑल $\left(2^{\circ}\right)$
(h)

2-मेथिलब्यूटेन-2-ऑल $(3^\circ)$
(ii)
$\text{प्राथमिक एल्कोहल : पेंटेन-1-ऑल ; 2-मेथिलब्यूटेन-1-ऑल ; 3-मेथिलब्यूटेन-1-ऑल ; 2, 2 - डाइमेथिलप्रोपेन-1-ऑल .}$
$\text{द्वितीयक एल्कोहल : पेंटेन-2-ऑल ; 3-मेथिलब्यूटेन-2-ऑल ; पेंटेन-3-ऑल .}$
$\text{तृतीयक एल्कोहल : 2-मेथिलब्यूटेन-2-ऑल . }$
11.4 बताइए कि प्रोपेनॉल का क्वथनांक ब्यूटेन के क्वथनांक से अधिक क्यों होता है?
उत्तर दिखाएं
उत्तर
प्रोपेनॉल में $-{OH}$ समूह के उपस्थिति के कारण अंतरमोलेकुलीय ${H}$-बंधन बनते हैं। दूसरी ओर, ब्यूटेन में ऐसा नहीं होता है।

इसलिए, हाइड्रोजन बंधों को तोड़ने के लिए अतिरिक्त ऊर्जा की आवश्यकता होती है। इस कारण, प्रोपेनॉल का क्वथनांक ब्यूटेन के क्वथनांक से अधिक होता है।
11.5 अपेक्षाकृत जल में एल्कोहल हाइड्रोकार्बन की तुलना में अधिक विलेय होते हैं। इस तथ्य की व्याख्या कीजिए।
उत्तर दिखाएं
उत्तर
एल्कोहल में $-{OH}$ समूह के उपस्थिति के कारण जल के साथ ${H}$-बंधन बनाते हैं। जबकि हाइड्रोकार्बन जल के साथ ${H}$-बंधन बनाने में असमर्थ होते हैं।

अत: एल्कोहल हाइड्रोकार्बन की तुलना में अपेक्षाकृत जल में अधिक विलेय होते हैं।
11.6 हाइड्रोबोरेशन-ऑक्सीकरण अभिक्रिया के अर्थ क्या है? एक उदाहरण द्वारा इसकी व्याख्या कीजिए।
उत्तर दिखाएं
उत्तर
बोरेन के योग तथा उसके बाद ऑक्सीकरण के अभिक्रिया को हाइड्रोबोरेशन-ऑक्सीकरण अभिक्रिया कहते हैं। उदाहरण के लिए, प्रोपीन के हाइड्रोबोरेशन-ऑक्सीकरण अभिक्रिया द्वारा प्रोपेन-1-ऑल बनता है। इस अभिक्रिया में, प्रोपीन डाइबोरेन $\left({BH_3}\right)_{2}$ के साथ अभिक्रिया करके त्रिअल्किल बोरेन के रूप में एक योग उत्पाद बनाता है। इस योग उत्पाद को जलीय सोडियम हाइड्रॉक्साइड की उपस्थिति में हाइड्रोजन परॉक्साइड द्वारा एल्कोहल में ऑक्सीकृत किया जाता है।
11.7 अणुसूत्र ${C_7} {H_8} {O}$ वाले मोनोहाइड्रिक फीनॉल के संरचना एवं IUPAC नाम दीजिए।
उत्तर दिखाएं
उत्तर

11.8 ओर्थो एवं पेरा नाइट्रोफीनॉल के मिश्रण को भाप अपसादन द्वारा अलग करते समय, भाप वाले विलेय वह कौन सा समावयवी होगा? कारण बताइए।
उत्तर दिखाएं
उत्तर
ओर्थो एवं पेरा समावयवी को भाप अपसादन द्वारा अलग किया जा सकता है। o-नाइट्रोफीनॉल भाप वाला होता है क्योंकि इसमें अंतराणुक हाइड्रोजन बंधन होता है जबकि p-नाइट्रोफीनॉल कम वाला होता है क्योंकि अंतराणुक हाइड्रोजन बंधन अणुओं के संघटन के कारण होता है।

11.9 क्यूमीन से फीनॉल के तैयार करने के रासायनिक अभिक्रिया समीकरण दीजिए।
उत्तर दिखाएं
उत्तर
फीनॉल क्षमता वाला हाइड्रोकार्बन, क्यूमीन से निर्मित किया जाता है। क्यूमीन (आइसोप्रॉपिलबेंजीन) हवा की उपस्थिति में ऑक्सीकृत किया जाता है ताकि क्यूमीन हाइड्रोपरऑक्साइड बने। इसे तनु अम्ल के साथ उपचार द्वारा फीनॉल एवं एसिटोन में परिवर्तित किया जाता है। एसिटोन, इस अभिक्रिया का एक उपभेद उत्पाद है, जो इस विधि द्वारा बड़े पैमाने पर प्राप्त किया जाता है।

11.10 क्लोरोबेंजीन से फीनॉल के तैयार करने के रासायनिक अभिक्रिया के समीकरण लिखिए।
उत्तर दिखाएं
उत्तर
क्लोरोबेंजीन को ${NaOH}$ (623 {~K} ताप एवं 320 वायुमंडलीय दबाव पर) गलित करके सोडियम फीनॉक्साइड बनाया जाता है, जिसे अम्लीकरण द्वारा फीनॉल प्राप्त किया जाता है।

11.11 एथीन के जलन के योग में एथेनॉल के निर्माण के यांत्रिक तंत्र को लिखिए।
उत्तर दिखाएं
उत्तर
एथीन के जलन के योग में एथेनॉल के निर्माण के यांत्रिक तंत्र में तीन चरण होते हैं।
चरण 1: एथीन के इलेक्ट्रॉन अभिकर्षी आक्रमण द्वारा ${H_3} {O}^{+}$ द्वारा प्रोटॉनिकरण एवं कार्बोकेटियन के निर्माण:
${H_2} {O}+{H}^{+} \longrightarrow {H_3} {O}^{+}$

चरण 2: जल के नाभिक आक्रमण कार्बोकेटियन पर:

चरण 3: प्रोटॉन के अपसारण एथेनॉल के निर्माण के लिए:

11.12 आपको बेंजीन, सांद्र ${H_2} {SO_4}$ और ${NaOH}$ दिया गया है। इन अभिकर्मकों का उपयोग करके फेनॉल के निर्माण के रासायनिक समीकरण लिखिए।
उत्तर दिखाएं
उत्तर
बेंजीन को ऑल्इम एवं बेंजीन सल्फोनिक अम्ल के साथ सल्फोनेट करके बेंजीन सल्फोनिक अम्ल के निर्माण के बाद गलित सोडियम हाइड्रॉक्साइड के साथ गर्म करके सोडियम फेनॉक्साइड बनाया जाता है। सोडियम लवण के अम्लीयकरण से फेनॉल प्राप्त होता है।

11.13 बताइए कि आप कैसे संश्लेषित करेंगे:
(i) एक उपयुक्त एल्कीन से 1-फेनिल एथेनॉल।
(ii) एल्किल हैलाइड के माध्यम से एसएन 2 अभिक्रिया द्वारा साइक्लोहेक्सिल मेथनॉल का उत्पादन।
(iii) पेंटेन-1-ऑल का उत्पादन एक उपयुक्त एल्किल हैलाइड का उपयोग करते हुए?
उत्तर दिखाएं
उत्तर
(i) एसिड-कैटलिस्ट एथिलबेंज़ीन (स्टाइरीन) के हाइड्रोलिसिस द्वारा 1-फेनिल एथेनॉल का संश्लेषण किया जा सकता है।

(ii) जब क्लोरोमेथिल साइक्लोहेक्सेन सोडियम हाइड्रॉक्साइड के साथ अभिक्रिया करता है, तो साइक्लोहेक्सिल मेथनॉल प्राप्त होता है।

(iii) जब 1-क्लोरोपेंटेन को ${NaOH}$ के साथ अभिक्रिया कराया जाता है, तो पेंटेन-1-ऑल उत्पन्न होता है।
$\underset{\text { 1-क्लोरोपेंटेन }}{{CH_3} {CH_2} {CH_2} {CH_2} {CH_2} {Cl}} +{NaOH} \longrightarrow \underset{\text { पेंटेन-1-ऑल }}{{CH_3} {CH_2} {CH_2} {CH_2} {CH_2} {OH}}+{NaCl}$
11.14 फीनॉल के अम्लीय प्रकृति को दिखाने वाले दो अभिक्रियाएं दीजिए। फीनॉल की अम्लता को एथेनॉल के साथ तुलना कीजिए।
उत्तर दिखाएं
उत्तर
फीनॉल की अम्लीय प्रकृति को निम्नलिखित दो अभिक्रियाओं द्वारा प्रदर्शित किया जा सकता है:
(i) फीनॉल सोडियम के साथ अभिक्रिया करके सोडियम फीनॉक्साइड बनाता है और ${H_2}$ गैस उत्पन्न करता है।

(ii) फीनॉल सोडियम हाइड्रॉक्साइड के साथ अभिक्रिया करके सोडियम फीनॉक्साइड और पानी के उत्पाद के रूप में बनता है।

फीनॉल की अम्लता एथेनॉल की अपेक्षा अधिक होती है। इसका कारण यह है कि एक प्रोटॉन खो जाने के बाद, फीनॉक्साइड आयन अनुरूपजन के माध्यम से स्थायित्म प्राप्त करता है जबकि एथॉक्साइड आयन ऐसा नहीं करता।

11.15 क्यों ओर्थो नाइट्रोफीनॉल ओर्थो मेथॉक्सीफीनॉल की अपेक्षा अधिक अम्लीय होता है?
उत्तर दिखाएं
उत्तर

नाइट्रो-समूह एक इलेक्ट्रॉन खींचता हुआ समूह है। ओर्थो स्थिति में इस समूह की उपस्थिति ए ओ-एच बंध में इलेक्ट्रॉन घनत्व को कम कर देती है। इस कारण एक प्रोटॉन खोना आसान हो जाता है। इसके अतिरिक्त, प्रोटॉन खो जाने के बाद बने ओ-नाइट्रोफीनॉक्साइड आयन को अनुरूपजन द्वारा स्थायित्म प्राप्त हो जाता है। इसलिए, ओर्थो नाइट्रोफीनॉल एक शक्तिशाली अम्ल है।
दूसरी ओर, मेथॉक्सी समूह एक इलेक्ट्रॉन देने वाला समूह है। इसलिए, इस समूह की उपस्थिति ओ-एच बंध में इलेक्ट्रॉन घनत्व को बढ़ा देती है और इस कारण प्रोटॉन को आसानी से खोना नहीं सम्भव होता।
इस कारण, ओर्थो-नाइट्रोफीनॉल ओर्थो-मेथॉक्सीफीनॉल की अपेक्षा अधिक अम्लीय होता है।
11.16 बेंजीन वलय के एक कार्बन पर जुड़े -OH समूह किस प्रकार एलेक्ट्रॉन अभिसरण अभिक्रिया के लिए बेंजीन वलय को सक्रिय करता है?
उत्तर दिखाएं
उत्तर
- OH समूह एक इलेक्ट्रॉन देने वाला समूह है। इसलिए, यह बेंजीन वलय में इलेक्ट्रॉन घनत्व को बढ़ा देता है जैसा कि फीनॉल के दिए गए अनुरूपजन संरचना में दिखाया गया है।

इस कारण, बेंजीन वलय एलेक्ट्रॉन अभिसरण अभिक्रिया के लिए सक्रिय हो जाता है।
11.17 निम्नलिखित अभिक्रियाओं के समीकरण दीजिए:
- Reaction of phenol with excess bromine water
- Reaction of phenol with sodium hydroxide
- Reaction of phenol with acetic anhydride
- Reaction of phenol with dilute nitric acid
- Reaction of phenol with concentrated nitric acid
- Reaction of phenol with concentrated sulfuric acid
- Reaction of phenol with sodium metal
- Reaction of phenol with acetyl chloride
- Reaction of phenol with formaldehyde
- Reaction of phenol with acetaldehyde
(i) प्रोपेन-1-ऑल के क्षारीय ${KMnO_4}$ विलयन के ऑक्सीकरण से।
(ii) फीनॉल के ${CS_2}$ में ब्रोमीन।
(iii) तनु ${HNO_3}$ के फीनॉल के साथ।
(iv) जलीय ${NaOH}$ की उपस्थिति में फीनॉल के क्लोरोफॉर्म के साथ उपचार।
उत्तर दिखाएं
उत्तर
(i)
$\underset{\text{प्रोपेन-1-ऑल}}{{CH_3} {CH_2} {CH_2} {OH}} \xrightarrow{\text { क्षार } {KMnO_4}} \underset{\text{प्रोपियिक अम्ल}}{{CH_3} {CH_2} {COOH}}$
(ii)

(iii)

(iv)

11.18 उदाहरण के साथ निम्नलिखित की व्याख्या करें।
(i) कोल्बे की अभिक्रिया।
(ii) रीमर-टिमेन अभिक्रिया।
(iii) विलियमसन ईथर संश्लेषण।
(iv) असममित ईथर।
उत्तर दिखाएं
उत्तर
(i) कोल्बे की अभिक्रिया:
जब फीनॉल को सोडियम हाइड्रॉक्साइड के साथ उपचार किया जाता है, तो सोडियम फीनॉक्साइड बनता है। इस सोडियम फीनॉक्साइड को कार्बोन डाइऑक्साइड के साथ उपचार करके, फिर अम्लीय विलयन के साथ उपचार करके, बेंजीन वलय के अंतर्गत ओर्थो-हाइड्रॉक्सीबेंजोइक अम्ल के मुख्य उत्पाद के रूप में इलेक्ट्रोफिलिक प्रतिस्थापन अभिक्रिया होती है। इस अभिक्रिया को कोल्बे की अभिक्रिया कहते हैं।

(ii) रीमर-टिमेन अभिक्रिया:
जब फीनॉल को क्लोरोफॉर्म $\left({CHCl_3}\right)$ के साथ नैत्रिक हाइड्रॉक्साइड की उपस्थिति में उपचार किया जाता है, तो बेंजीन वलय के ओर्थो स्थिति पर - ${CHO}$ समूह जोड़ दिया जाता है। इस अभिक्रिया को रीमर-टिमेन अभिक्रिया कहते हैं। अंतराल अम्लीय विलयन की उपस्थिति में हाइड्रोलाइज़ किया जाता है ताकि साइलिकल्डिहाइड्रोक्सिल बनता है।

(iii) विलियमसन ईथर संश्लेषण:
विलियमसन ईथर संश्लेषण एक प्रयोगशाला विधि है जिसके माध्यम से एल्किल हैलाइड के साथ सोडियम एल्कॉक्साइड के अभिक्रिया के माध्यम से सममित एवं असममित ईथर बनाए जाते हैं।

इस अभिक्रिया में एल्कॉक्साइड आयन एल्किल हैलाइड पर ${S_{N}} 2$ आक्रमण होता है। प्राथमिक एल्किल हैलाइड के मामले में बेहतर परिणाम प्राप्त होते हैं।

यदि एल्किल हैलाइड द्वितीयक या तृतीयक होता है, तो विस्थापन के स्थान पर उद्हरण अधिक बलपूर्वक होता है।

(iv) असममित ईथर:
एक असममित ईथर वह ईथर है जहां ऑक्सीजन परमाणु के दोनों ओर दो समूह अलग-अलग होते हैं (अर्थात, विभिन्न संख्या में कार्बन परमाणु होते हैं)। उदाहरण के लिए: एथिल मेथिल ईथर $\left({CH_3}-{O}-{CH_2} {CH_3}\right)$।
11.19 एथेनॉल के अम्लीय विस्थापन द्वारा एथीन के निर्माण के योगात्मक तंत्र को लिखिए।
उत्तर दिखाएं
उत्तर
एथेनॉल के अम्लीय विस्थापन द्वारा एथीन के निर्माण के योगात्मक तंत्र में निम्नलिखित तीन चरण शामिल होते हैं:
चरण 1: एथेनॉल के प्रोटॉनीकरण से एथिल ऑक्सोनियम आयन का निर्माण:

चरण 2: कार्बोकैटियन के निर्माण (गति निर्धारण चरण):

कदम 3: प्रोटॉन के उत्सर्जन से एथीन के निर्माण:

कदम 1 में उपयोग किए गए अम्ल को कदम 3 में मुक्त कर दिया जाता है। एथीन के निर्माण के बाद, इसे हटा दिया जाता है ताकि संतुलन आगे की दिशा में बदल जाए।
11.20 निम्नलिखित परिवर्तन कैसे किए जाते हैं?
(i) प्रोपीन $\rightarrow$ प्रोपेन-2-ऑल।
(ii) बेंजिल क्लोराइड $\rightarrow$ बेंजिल ऐल्कोहॉल।
(iii) एथिल मैग्नीशियम क्लोराइड $\rightarrow$ प्रोपेन-1-ऑल।
(iv) मेथिल मैग्नीशियम ब्रोमाइड $\rightarrow$ 2-मेथिलप्रोपेन-2-ऑल।
उत्तर दिखाएं
उत्तर
(i) यदि प्रोपीन को एक अम्ल के उपस्थिति में जल के साथ अभिक्रिया कराई जाती है, तो प्रोपेन-2-ऑल प्राप्त होता है।

(ii) यदि बेंजिल क्लोराइड को ${NaOH}$ (अम्लीकरण के बाद) के साथ अभिक्रिया कराई जाती है, तो बेंजिल ऐल्कोहॉल बनता है।

(iii) जब एथिल मैग्नीशियम क्लोराइड को मेथेनल के साथ अभिक्रिया कराई जाती है, तो एक योग के उत्पाद बनता है जिसके हाइड्रोलाइज़ करने पर प्रोपेन-1-ऑल प्राप्त होता है।

(iv) जब मेथिल मैग्नीशियम ब्रोमाइड को प्रोपेन के साथ अभिकृत किया जाता है, तो एक योगज यौगिक बनता है जिसके हाइड्रोलाइज़ेशन से 2-मेथिलप्रोपेन-2-ऑल प्राप्त होता है।

11.21 निम्नलिखित अभिक्रियाओं में प्रयुक्त अभिकर्मकों के नाम बताइए:
(i) प्राथमिक एल्कोहल के ऑक्सीकरण से कार्बॉक्सिलिक अम्ल के निर्माण।
(ii) प्राथमिक एल्कोहल के ऑक्सीकरण से एल्डिहाइड के निर्माण।
(iii) फेनॉल के ब्रोमीनेशन से 2,4,6-ट्राइब्रोमोफेनॉल के निर्माण।
(iv) बेंजिल एल्कोहल से बेंजोइक अम्ल के निर्माण।
(v) प्रोपेन-2-ऑल के डेहाइड्रोएलेशन से प्रोपीन के निर्माण।
(vi) ब्यूटेन-2-ओन से ब्यूटेन-2-ऑल के निर्माण।
उत्तर दिखाएं
Answer
(i) अम्लीय क्षारीय पोटैशियम परमैंगनेट
(ii) पिरिडिनियम क्लोरोक्रोमेट (PCC)
(iii) ब्रोमीन जल
(iv) अम्लीय पोटैशियम परमैंगनेट
(v) $85 \%$ फॉस्फोरिक अम्ल
(vi) ${NaBH_4}$ या ${LiAlH_4}$
11.22 एथेनॉल के तुलना में मेथॉक्सीमेथेन के उच्च क्वथनांक के कारण क्या है?
उत्तर दिखाएं
Answer
एथेनॉल में $-{OH}$ समूह के उपस्थिति के कारण अंतराणुक ${H}$-बंधन बनते हैं, जिसके कारण अणुओं के संगठन होता है। इन हाइड्रोजन बंधों को तोड़ने के लिए अतिरिक्त ऊर्जा की आवश्यकता होती है। दूसरी ओर, मेथॉक्सीमेथेन में ${H}$-बंधन नहीं बनते। इसलिए, एथेनॉल का क्वथनांक मेथॉक्सीमेथेन के तुलना में अधिक होता है।

11.23 निम्नलिखित ईथर्स के IUPAC नाम दीजिए:

उत्तर दिखाएं
Answer
(i) 1-एथॉक्सी-2-मेथिलप्रोपेन
(ii) 2-क्लोरो-1-मेथॉक्सीएथेन
(iii) 4-नाइट्रोएनिसोल
(iv) 1-मेथॉक्सीप्रोपेन
(v) 4-एथॉक्सी-1, 1-डाइमेथिलसाइक्लोहेक्सेन
(vi) एथॉक्सीबेंज़ीन
11.24 विलियमसन संश्लेषण द्वारा निम्नलिखित ईथर्स के निर्माण के लिए रासायनिक अभिकर्मकों के नाम लिखिए तथा अभिक्रिया समीकरण लिखिए:
(i) 1-प्रोपॉक्सीप्रोपेन
(ii) एथॉक्सीबेंज़ीन
(iii) 2-मेथॉक्सी-2-मेथिलप्रोपेन
(iv) 1-मेथॉक्सीएथेन
उत्तर दिखाएं
Answer
(i) $\underset{\text{सोडियम प्रोपॉक्साइड}}{{CH_3} {CH_2} {CH_2ONa}}+\underset{\text{1-ब्रोमोप्रोपेन}}{{CH_3} {CH_2} {CH_2} {Br}} \longrightarrow \underset{\text{1-प्रोपॉक्सीप्रोपेन}}{{C_2} {H_5} {CH_2}-{O}-{CH_2} {C_2} {H_5}}+{NaBr}$
(ii)

(iii)

(iv) $\underset{\text{सोडियम एथॉक्साइड}}{{CH_3} {CH_2}-{ONa}}+\underset{\text{ब्रोमोमेथेन}}{{CH_3}-{Br}} \xrightarrow{heat} \underset{\text{1-मेथॉक्सीएथेन}}{{CH_3} {CH_2}-{O}-{CH_3}}+{NaBr}$
11.25 उदाहरण के साथ विलियमसन संश्लेषण के निश्चित प्रकार के ईथर्स के निर्माण के सीमाएं दर्शाइए।
उत्तर दिखाएं
Answer
विलियमसन संश्लेषण की अभिक्रिया में एक एल्कॉक्साइड आयन एक प्राथमिक एल्किल हैलाइड पर ${S_{N}} 2$ आक्रमण होता है।

लेकिन यदि प्राथमिक एल्किल हैलाइड के स्थान पर द्वितीयक या तृतीयक एल्किल हैलाइड का उपयोग किया जाता है, तो उदासीनीकरण उत्प्रेरण के स्थान पर प्रतिस्थापन के साथ प्रतियोगिता होती है। इसके परिणामस्वरूप एल्कीन उत्पन्न होते हैं। इसका कारण यह है कि एल्कॉक्साइड नाभिक विपरीत रूप से एक मजबूत क्षारक भी होते हैं। अतः, वे एल्किल हैलाइड के साथ अभिक्रिया करते हैं, जिसके परिणामस्वरूप एलिमिनेशन अभिक्रिया होती है।

11.26 1-propoxypropane को propan-1-ol से कैसे संश्लेषित किया जाता है? इस अभिक्रिया के यांत्रिक विधि को लिखिए।
उत्तर दिखाएं
Answer
1-propoxypropane को propan-1-ol से विलयन करके संश्लेषित किया जा सकता है।
Propan-1-ol को ${H_2} {SO_4}, {H_3} {PO_4}$ जैसे प्रोटिक अम्ल की उपस्थिति में विलयन करके 1-propoxypropane बनाया जाता है।
$ \underset{\text { Propane-1-ol }}{2 {CH_3} {CH_2} {CH_2}-{OH}} \xrightarrow{{H}^{+}} \underset{\text { 1-Propoxypropane }}{{CH_3} {CH_2} {CH_2}-{O}-{CH_2} {CH_2} {CH_3}} $
इस अभिक्रिया के यांत्रिक विधि में निम्नलिखित तीन चरण शामिल होते हैं:
चरण 1: प्रोटॉनीकरण

चरण 2: न्यूक्लिओफिलिक हमला

चरण 3: प्रोटॉन के अपसारण

11.27 द्वितीयक या तृतीयक अल्कोहल के अम्लीय विलयन द्वारा ईथर के निर्माण की विधि एक उपयुक्त विधि नहीं है। कारण बताइए।
उत्तर दिखाएं
Answer
अल्कोहल के विलयन द्वारा ईथर के निर्माण एक द्विअणुक अभिक्रिया $\left({S_{N}} 2\right)$ होती है जिसमें एक अल्कोहल अणु एक प्रोटॉनिकृत अल्कोहल अणु पर हमला करता है। इस विधि में ऐल्किल समूह अवरोधित नहीं होना चाहिए। द्वितीयक या तृतीयक अल्कोहल में ऐल्किल समूह अवरोधित होता है। इस कारण, उपस्थिति में उपस्थित अपघटन विस्थापन के स्थान पर अधिक रहता है। अतः ईथर के स्थान पर एल्कीन बनते हैं।
11.28 हाइड्रोजन आयोडाइड के साथ अभिक्रिया के समीकरण लिखिए:
(i) 1-प्रोपॉक्सीप्रोपेन
(ii) मेथॉक्सीबेंजीन
(iii) बेंजिल एथिल ईथर।
उत्तर दिखाएं
उत्तर
(i)
$\underset{\text{1-प्रोपॉक्सीप्रोपेन}}{{C_2} {H_5} {CH_2}-{O}-{CH_2} {C_2} {H_5}}+{HI} \xrightarrow{373 {~K}} \underset{\text{प्रोपेन-1-ऑल}}{{CH_3} {CH_2} {CH_2}-{OH}}+\underset{\text{1-आयोडोप्रोपेन}}{{CH_3} {CH,} {CH_2}-{I}}$
(ii)

(iii)

11.29 ऐरिल ऐल्किल ईथर में यह तथ्य कि
(i) ऐल्कॉक्सी समूह बेंजीन वलय के प्रति इलेक्ट्रॉन अभिकर्मक प्रतिस्थापन के लिए सक्रिय करता है और
(ii) यह आगंतुक प्रतिस्थापकों को बेंजीन वलय के ओर्थो और पैरा स्थानों पर दिशा देता है, की व्याख्या कीजिए।
उत्तर दिखाएं
उत्तर
(i) ऐरिल ऐल्किल ईथर में, ऐल्कॉक्सी समूह के $+{R}$ प्रभाव के कारण बेंजीन वलय में इलेक्ट्रॉन घनत्व बढ़ जाता है, जैसा कि निम्नलिखित संकरण संरचना में दिखाया गया है।

इस प्रकार, ऐल्कॉक्सी समूह बेंजीन वलय के लिए इलेक्ट्रॉन अभिकर्मक प्रतिस्थापन के लिए सक्रिय करता है।
(ii) संकरण संरचनाओं से यह भी देखा जा सकता है कि ओर्थो और पैरा स्थानों पर इलेक्ट्रॉन घनत्व मेटा स्थान की तुलना में अधिक बढ़ जाता है। इस कारण, बेंजीन वलय में आगंतुक प्रतिस्थापकों को ओर्थो और पैरा स्थानों पर दिशा दी जाती है।
11.30 एचआई एवं मेथॉक्सीमेथेन के अभिक्रिया के यांत्रिक विधि को लिखिए।
उत्तर दिखाएं
उत्तर
एचआई एवं मेथॉक्सीमेथेन के बराबर मोल में, निम्नलिखित यांत्रिक विधि द्वारा मेथिल ऐल्कोहॉल एवं मेथिल आयोडाइड के मिश्रण का निर्माण होता है :

हालांकि, यदि अतिरिक्त एचआई का उपयोग किया जाए, तो चरण $\mathbf{2}$ में निर्मित मेथिल ऐल्कोहॉल को निम्नलिखित यांत्रिक विधि द्वारा मेथिल आयोडाइड में परिवर्तित कर दिया जाता है।

11.31 निम्नलिखित अभिक्रियाओं के समीकरण लिखिए:
(i) फ्रेडेल-क्राफ्ट्स अभिक्रिया - एनिसॉल की ऐल्किलीकरण।
(ii) एनिसॉल के नाइट्रेशन।
(iii) एथेनोइक अम्ल माध्यम में एनिसॉल के ब्रोमीनेशन।
(iv) एनिसॉल की फ्रेडेल-क्राफ्ट्स एसीटिलेशन।
उत्तर दिखाएं
उत्तर
(i)

(ii)

(iii)

(iv)

11.32 आप अनुप्रस्थ एल्कीन से निम्नलिखित ऐल्कोहॉल कैसे संश्लेषित करेंगे?

उत्तर दिखाएं
उत्तर
दिए गए एल्कोहल को उचित एल्कीन के अम्ल-कतारित हाइड्रेटेशन के मार्कोवनिकोव के नियम के अनुसार संश्लेषित किया जा सकता है।
(i)

इन दोनों एल्कीन में $\mathrm{H}_2 \mathrm{O}$ के योग द्वारा अभिक्रिया करने पर अभीष्ट एल्कोहल प्राप्त होता है।

(ii)

4-मेथिलहेप्ट-3-ईन के उपस्थिति में अम्ल की उपस्थिति में $\mathrm{H}_2 \mathrm{O}$ के योग द्वारा अभीष्ट एल्कोहल प्राप्त होता है।

(iii)

अब पेंट-1-ईन में $\mathrm{H}_2 \mathrm{O}$ के योग द्वारा अभीष्ट एल्कोहल प्राप्त होता है।

हालांकि, पेंट-2-ईन में $\mathrm{H}_2 \mathrm{O}$ के योग द्वारा दो एल्कोहल के मिश्रण, अर्थात पेंटेन-2-ऑल और पेंटेन-3-ऑल प्राप्त होते हैं।

इसलिए, अभीष्ट एल्कीन पेंट-1-ईन है और नहीं पेंट-2-ईन है।
(iv)

अब तीन एल्कीन में से किसी एक के उपस्थिति में अम्ल की उपस्थिति में $\mathrm{H}_2 \mathrm{O}$ के योग द्वारा अभीष्ट एल्कोहल प्राप्त होता है।

अतः, अभीष्ट एल्कीन 2-साइक्लोहेक्सिलब्यूट-1-ईन या 2-साइक्लोहेक्सिलब्यूट-2-ईन या 2-साइक्लोहेक्सिलिडीनब्यूटेन है।
11.33 जब 3-मेथिलब्यूटन-2-ऑल को HBr के साथ उपचार दिया जाता है, तो निम्नलिखित अभिक्रिया होती है:






