यूनिट 10 हैलोएल्केन एवं हैलोएरीन
हैलोजनित यौगिक भूमि बैक्टीरिया द्वारा विघटित होने के प्रतिरोध के कारण पर्यावरण में लंबे समय तक रहते हैं।
एलिफैटिक या एरोमैटिक हाइड्रोकार्बन में हाइड्रोजन परमाणुओं के स्थान पर हैलोजन परमाणुओं के बदले ले जाने से ऐल्किल हैलाइड (हैलोएल्केन) एवं ऐरिल हैलाइड (हैलोएरीन) के निर्माण होता है। हैलोएल्केन में हैलोजन परमाणु ऐल्किल समूह के $sp^3$ हाइब्रिडाइज्ड कार्बन परमाणु पर जुड़े होते हैं जबकि हैलोएरीन में हैलोजन परम ऐरिल समूह के $sp^2$ हाइब्रिडाइज्ड कार्बन परमाणु पर जुड़े होते हैं। कई हैलोजन युक्त कार्बनिक यौगिक प्रकृति में पाए जाते हैं और इनमें से कुछ चिकित्सीय उपयोग में आते हैं। इन वर्ग के यौगिक प्रत्येक दिन के जीवन एवं उद्योग में व्यापक रूप से उपयोग किए जाते हैं। वे अपेक्षाकृत अधिक ध्रुवीय नहीं वाले यौगिकों के विलायक के रूप में उपयोग किए जाते हैं एवं विस्तृत श्रेणी के कार्बनिक यौगिकों के संश्लेषण के लिए प्रारंभिक सामग्री के रूप में उपयोग किए जाते हैं। क्लोरीन युक्त एंटीबायोटिक, क्लोराम्फेनिकोल, जो माइक्रोऑर्गेनिज्म द्वारा उत्पादित किया जाता है, टाइफॉइड बुखार के उपचार में बहुत प्रभावी होता है। हमारे शरीर में आयोडीन युक्त हार्मोन, थाइरॉक्सिन, की कमी गलगीत नामक बीमारी का कारण बनती है। संश्लेषित हैलोजन यौगिक, जैसे क्लोरोक्वीन, मलेरिया के उपचार के लिए उपयोग किए जाते हैं; हैलोथेन शल्य चिकित्सा के दौरान एनेस्थेटिक के रूप में उपयोग किया जाता है। कुछ पूर्ण रूप से फ्लूओरीनित यौगिक शल्य चिकित्सा में रक्त के स्थान बर्बाद करने वाले उत्पाद के रूप में विचार किए जा रहे हैं।
इस इकाई में, आप अम्लीय यौगिकों के महत्वपूर्ण तैयारी विधियों, भौतिक और रासायनिक गुणों और उपयोगों के अध्ययन करेंगे।
6.1 वर्गीकरण
हैलोएल्केन और हैलोएरीन को निम्नलिखित तरीके से वर्गीकृत किया जा सकता है:
6.1.1 हैलोजन परमाणुओं की संख्या के आधार पर
इन्हें एकल, द्वितीयक या बहु हैलोजन (त्रितीय, चतुर्थ, आदि) यौगिक के रूप में वर्गीकृत किया जा सकता है, जिनमें अपने संरचना में एक, दो या अधिक हैलोजन परमाणु होते हैं। उदाहरण के लिए,

मोनोहैलोकम्पॉउंड्स को आगे बढ़कर उस कार्बन परमाणु के हाइब्रिडाइजेशन के आधार पर भी वर्गीकृत किया जा सकता है, जिस पर हैलोजन बंधा होता है, जैसा कि नीचे चर्चा किया गया है।
6.1.2 ${s p}^{{3}} {~C}-{X}$ बंध वाले कम्पॉउंड (X= F, Cl, Br, I)
इस श्रेणी में शामिल हैं
(a) एल्किल हैलाइड या हैलोएल्केन ( ${R}-{X}$ )
एल्किल हैलाइड में, हैलोजन परमाणु एक एल्किल समूह $({R})$ के साथ बंधा होता है। वे एक होमोलॉजस श्रेणी को निरूपित करते हैं जिसका प्रतिनिधित्व ${C} _{{n}} {H} _{2 {n}+1} {X}$ करता है। वे आगे बढ़कर प्राथमिक, द्वितीयक या तृतीयक के रूप में वर्गीकृत किया जाता है, जिस कार्बन परमाणु पर हैलोजन बंधा होता है। यदि हैलोजन एक एल्किल हैलाइड में प्राथमिक कार्बन परमाणु पर बंधा होता है, तो एल्किल हैलाइड को प्राथमिक एल्किल हैलाइड या $1^{\circ}$ एल्किल हैलाइड कहा जाता है। इसी तरह, यदि हैलोजन द्वितीयक या तृतीयक कार्बन परम णु पर बंधा होता है, तो एल्किल हैलाइड को द्वितीयक एल्किल हैलाइड ($2^{\circ}$) और तृतीयक ($3^{\circ}$) एल्किल हैलाइड कहा जाता है, क्रमशः।

(b) एलीलिक हैलाइड
इन यौगिकों में हैलोजन परमाणु $s p^{3}$-हाइब्रिडाइज्ड कार्बन परमाणु से जुड़ा होता है जो कार्बन-कार्बन डबल बॉंड $({C}={C})$ के समीप होता है अर्थात एलीलिक कार्बन परमाणु से।

(c) बेंजिलिक हैलाइड
ये उन यौगिकों को कहते हैं जिनमें हैलोजन परमाणु एक $s p^{3}$-हाइब्रिडाइज़्ड कार्बन परमाणु पर बंधा होता है जो एक औषधीय वलय के साथ जुड़ा होता है।

6.1.3 $ \boldsymbol{s p}^{2} {C}-{X} $ बंध वाले यौगिक
इस श्रेणी में शामिल हैं:
(a) विनिलिक हैलाइड
ये उन यौगिकों को कहते हैं जिनमें हैलोजन परमाणु एक $s p^{2}$-हाइब्रिडाइज़्ड कार्बन परमाणु पर बंधा होता है जो एक कार्बन-कार्बन द्विबंध $({C}={C})$ के हिस्से के रूप में होता है।

(b) ऐरिल हैलाइड
इन यौगिकों में हैलोजन परमाणु एक औषधीय वलय के $s p^{2}$-हाइब्रिडाइज्ड कार्बन परमाणु के सीधे बंधे होते हैं।

6.2 नामांकन
हैलोजनित यौगिकों के वर्गीकरण के बारे में सीख गए हैं, अब हम इनके नामकरण के बारे में सीखेंगे। एल्किल हैलाइड के सामान्य नाम एल्किल समूह के नाम के बाद हैलाइड के नाम से बनाए जाते हैं। IUPAC नामांकन प्रणाली में, एल्किल हैलाइड को हैलोसब्स्टिट्यूटेड हाइड्रोकार्बन के रूप में नामित किया जाता है। बेंजीन के मोनोहैलोजन व्युत्पन्न के लिए सामान्य और IUPAC नाम समान होते हैं। डाइहैलोजन व्युत्पन्न के लिए सामान्य प्रणाली में $o^{-,}, m^{-}, p^-$ प्रतीकों का उपयोग किया जाता है, लेकिन IUP एन नामांकन प्रणाली में, जैसा कि कक्षा XI में आपने सीखा है, $1,2 $ ; $1,3$ और $1,4$ अंकों का उपयोग किया जाता है।

उन डाइहैलोएल्केन के नाम अल्किलिडीन या अल्किलीन डाइहैलाइड के रूप में दिए जाते हैं जिनमें समान प्रकार के हैलोजन परमाणु होते हैं। डाइहैलो कम्पॉउंड जिनमें दोनों हैलोजन परमाणु उपस्थित होते हैं, उन्हें फिर से गेमिनल हैलाइड या गेम-डाइहैलाइड के रूप में वर्गीकृत किया जाता है जब दोनों हैलोजन परमाणु श्रृंखला के समान अणु के एक ही कार्बन परमाणु पर होते हैं और विसीनल हैलाइड या विस-डाइहैलाइड के रूप में जब हैलोजन परमाणु आसन्न कार्बन परमाणुओं पर होते हैं। सामान्य नाम प्रणाली में, गेम-डाइहैलाइड को अल्किलिडीन हैलाइड के रूप में और विस-डाइहैलाइड को अल्किलीन डाइहैलाइड के रूप में नामित किया जाता है। IUPAC प्रणाली में, उन्हें डाइहैलोएल्केन के रूप में नामित किया जाता है।

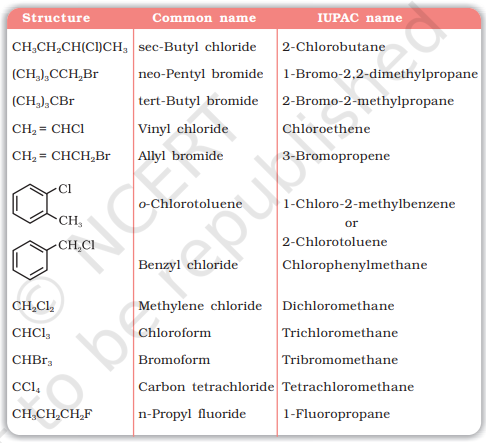
तालिका 6.1 में कुछ आम हैलोकम्पॉउंड के उदाहरण दिए गए हैं।
उदाहरण 6.1
$ {C_5} {H_{11}} {Br} $ के अणुसूत्र के सभी आठ संरचनात्मक समावयवी के संरचना बनाइए। प्रत्येक समावयवी को IUPAC प्रणाली के अनुसार नाम दें और उन्हें प्राथमिक, द्वितीयक या तृतीयक ब्रोमाइड के रूप में वर्गीकृत करें।
हल
| ${CH}_3 {CH}_2 {CH}_2 {CH}_2 {CH}_2 {Br}$ | 1-ब्रोमोपेंटेन (1 $\left.{ }^{\circ}\right)$ |
|---|---|
| ${CH}_3 {CH}_2 {CH}_2 {CH}({Br}) {CH}_3$ | 2-ब्रोमोपेंटेन $\left(2^{\circ}\right)$ |
| ${CH}_3 {CH}_2 {CH}({Br}) {CH}_2 {CH}_3$ | 3-ब्रोमोपेंटेन (2 $\left.{ }^{\circ}\right)$ |
| $\left({CH}_3\right)_2 {CHCH}_2 {CH}_2 {Br}$ | 1-ब्रोमो-3-मेथिलब्यूटेन (1 $\left.{ }^{\circ}\right)$ |
| $\left({CH}_3\right)_2 {CHCHBrCH}_3$ | 2-ब्रोमो-3-मेथिलब्यूटेन(2 $\left.{ }^{\circ}\right)$ |
| $\left({CH}_3\right)_2 {CBrCH}_2 {CH}_3$ | 2-ब्रोमो-2-मेथिलब्यूटेन $\left(3^{\circ}\right)$ | | ${CH}_3 {CH}_2 {CH}\left({CH}_3\right) {CH}_2 {Br}$ | 1-ब्रोमो-2-मेथिलब्यूटेन(1 $\left.{ }^{\circ}\right)$ | | $\left({CH}_3\right)_3 {CCH}_2 {Br}$ | 1-ब्रोमो-2,2-डाइमेथिलप्रोपेन (1 $\left.{ }^{\circ}\right)$ |
उदाहरण 6.2 निम्नलिखित के IUPAC नाम लिखिए:

हल
(i) 4-ब्रोमोपेंट-2-ईन
(ii) 3-ब्रोमो-2-मेथिलब्यूट-1-ईन
(iii) 4-ब्रोमो-3-मेथिलपेंट-2-ईन
(iv) 1-ब्रोमो-2-मेथिलब्यूट-2-ईन
(v) 1-ब्रोमोब्यूट-2-ईन
(vi) 3-ब्रोमो-2-मेथिलप्रोपीन
अंतर्गत प्रश्न
10.1 निम्नलिखित यौगिकों के संरचना सूत्र लिखिए:
(i) $\text{2-क्लोरो-3-मेथिल पेंटेन}$
(ii) $\text{1-क्लोरो-4-एथिल साइक्लोहेक्सेन}$
(iii) $\text{4-tert. ब्यूटिल-3-आयोडोहेप्टेन}$
(iv) $\text{1,4-डाइब्रोमोब्यूट-2-ईन}$
(v) $\text{1-ब्रोमो-4-सेक. ब्यूटिल-2-मेथिल बेंजीन}$
उत्तर दिखाएं
उत्तर
(i)

2-क्लोरो-3-मेथिल पेंटेन
(ii)

1-क्लोरो-4-एथिल साइक्लोहेक्सेन
(iii)

4- tert-ब्यूटिल-3-आयोडोहेप्टेन
(iv) $ \mathrm{Br}-{\mathrm{C}} \mathrm{H_2} \mathrm{C} \mathrm{H}={\mathrm{C}} \mathrm{H}{\mathrm{C}} \mathrm{H_2}-\mathrm{Br} $
1, 4-डाइब्रोमोब्यूट-2-ईन
(v)

1-ब्रोमो-4-सेक-ब्यूटिल-2-मेथिल बेंजीन
6.3 C-X बंध की प्रकृति
हैलोजन परमाणु कार्बन की तुलना में अधिक विद्युत ऋणात्मक होते हैं, इसलिए ऐल्किल हैलाइड के कार्बन-हैलोजन बंध ध्रुवीय होते हैं; कार्बन पर्शियल धनावेश और हैलोजन पर आंशिक ऋणावेश होता है।

प perियोडिक सारणी में समूह के नीचे जाते हुए, हैलोजन परमाणु का आकार बढ़ता जाता है। फ्लूओरीन परमाणु सबसे छोटा होता है और आयोडीन परमाणु सबसे बड़ा होता है। इसलिए, कार्बन-हैलोजन बंध की लंबाई ${C}-{F}$ से ${C}-{I}$ तक बढ़ती जाती है। तालिका 6.2 में कुछ सामान्य बंध लंबाई, बंध py और द्विध्रुवी आघूर्ण दिए गए हैं।
अल्किल हैलाइड सबसे अच्छा एल्कोहल से तैयार किए जाते हैं, जो आसानी से उपलब्ध होते हैं।
तालिका 6.2: कार्बन-हैलोजन (C—X) बंध दूरी, बंध एंथैल्पी और डायपोल क्षेत्र
| बंध | बंध दूरी/pm | C-X बंध एंथैल्पी/kJmol ${ }^{-1}$ | डायपोल क्षेत्र/Debye |
|---|---|---|---|
| ${CH}_3-{F}$ | 139 | 452 | 1.847 |
| ${CH}_3-{Cl}$ | 178 | 351 | 1.860 |
| ${CH}_3-{Br}$ | 193 | 293 | 1.830 |
| ${CH}_3-{I}$ | 214 | 234 | 1.636 |
6.4 हैलोएल्केन के निर्माण के विधियाँ
6.4.1 एल्कोहल से
एल्कोहल के हाइड्रॉक्सिल समूह को अभिकर्मक के रूप में सांद्र एल्कोहल अम्ल, फॉस्फोरस हैलाइड या थियोनाइल क्लोराइड के साथ अभिक्रिया में हैलोजन द्वारा प्रतिस्थापित किया जाता है। थियोनाइल क्लोराइड पसंद किया जाता है क्योंकि इस अभिक्रिया में एल्किल हैलाइड के साथ-साथ ${SO_2}$ और ${HCl}$ गैस बनती है। दो गैसीय उत्पाद उत्सर्जन होते हैं, इसलिए अभिक्रिया शुद्ध एल्किल हैलाइड देती है। प्राथमिक और द्वितीयक एल्कोहल के ${HCl}$ के साथ अभिक्रिया में ${ZnCl_2}$ के उपस्थिति की आवश्यकता होती है। तृतीयक एल्कोहल के लिए, अभिक्रिया को तापमान के अनुसार कमरे के तापमान पर एल्कोहल को सांद्र ${HCl}$ के साथ हिलाकर चलाया जाता है। अभिक्रिया मिश्रण में बने रहने वाले अतिसंतृप्त बॉइलिंग के लिए ${HBr}(48 \%)$ का उपयोग किया जाता है। एल्कोहल को 95% ऑर्थोफॉस्फोरिक अम्ल में सोडियम या पोटेशियम आयोडाइड के साथ गर्म करके R-I के अच्छे उत्पाद बनाए जा सकते हैं। एक दिए गए हैलोएसिड के साथ एल्कोहल की प्रतिक्रिया के क्रम $3^{\circ}>2^{\circ}>1^{\circ}$ होता है। लाल फॉस्फोरस के साथ ब्रोमीन और आयोडीन की क्रिया द्वारा फॉस्फोरस ट्राइब्रोमाइड और ट्राइआयोडाइड आमतौर पर अभिक्रिया मिश्रण में स्थानांतरित किए जाते हैं।
$$ \begin{aligned} & {R}-{OH}+{HCl} \xrightarrow{{ZnCl_2}} {R}-{Cl}+{H_2} {O} \\ & {R}-{OH}+{NaBr}+{H_2} {SO_4} \longrightarrow {R}-{Br}+{NaHSO_4}+{H_2} {O} \\ & 3 {R}-{OH}+{PX_3} \longrightarrow 3 {R}-{X}+{H_3} {PO_3} \quad({X}={Cl}, {Br}) \\ & {R}-{OH}+{PCl_5} \longrightarrow {R}-{Cl}+{POCl_3}+{HCl} \\ & {R}-{OH}\hspace{0.5mm}\frac{\mathrm{red} {~P} / {X_2}}{{X_2}={Br_2}, {I_2}} {R}-{X} \\ & {R}-{OH}+{SOCl_2} \longrightarrow {R}-{Cl}+{SO_2}+{HCl} \end{aligned} $$
अल्किल क्लोराइड के निर्माण के लिए एल्कोहल के घोल में सूखे हाइड्रोजन क्लोराइड गैस को पार कराया जाता है या एल्कोहल और सांद्रित जलीय हैलोजन अम्ल के मिश्रण को गर्म करके।
ऊपर के तरीके ऐरिल हैलाइड के तैयारी के लिए अनुपयुक्त हैं क्योंकि फेनॉल में कार्बन-ऑक्सीजन बंध में आंशिक द्विबंध चरित्र होता है और इसे तोड़ना कठिन होता है क्योंकि यह एकल बंध की तुलना में मजबूत होता है।
6.4.2 हाइड्रोकार्बन से
(I) अल्केन से मुक्त रadical हैलोजनीकरण द्वारा
अल्केन के मुक्त रadical क्लोरीनीकरण या ब्रोमीनीकरण से एक जटिल मिश्रण आइसोमेरिक मोनो- और पॉलीहैलोअल्केन प्राप्त होते हैं, जिन्हें शुद्ध यौगिक के रूप में अलग करना कठिन होता है। इसलिए, किसी भी एक यौगिक के उत्पादन की आउटपुट कम होती है।
${CH_3}{CH_2}{CH_2}{CH_3} \xrightarrow[ \text {or heat}]{{Cl_2} \text {/UV light}} {CH_3}{CH_2}{CH_2}{CH_2}{Cl_2} + {CH_3}{CH}{CHCl}{CH_3} $
(II) एल्कीन से
(i) हाइड्रोजन हैलाइड का योग: एल्कीन को हाइड्रोजन क्लोराइड, हाइड्रोजन ब्रोमाइड या हाइड्रोजन आयोडाइड के साथ अभिक्रिया करके संगत एल्किल हैलाइड में परिवर्तित किया जा सकता है।

प्रोपीन दो उत्पाद देता है, हालांकि मार्कोवनिकोव के नियम के अनुसार केवल एक उत्पाद प्रधान होता है। (यूनिट 13, कक्षा XI)
$$ {CH_3} {CH}={CH_2}+{H}-{I} \longrightarrow \underset {\text{minor}}{{CH_3} {CH_2} {CH_2} {I}} + \underset{ \text{major }}{{CH_3} {CHICH_3}} $$
(ii) हैलोजन के योग: प्रयोगशाला में, ${CCl}_{4}$ में ब्रोमीन के योग एक ऐल्कीन में द्विबंध के उपस्थिति का पता लगाने के लिए महत्वपूर्ण विधि है, जिसमें ब्रोमीन के लाल भूरे रंग के विस्थापन के कारण होता है। योग के परिणामस्वरूप विकिर डाइब्रोमाइड के संश्लेषण होता है, जो रंगहीन होते हैं (एकांक 9, कक्षा XI)।

उदाहरण 6.3 $\left({CH}_3\right)_2 {CHCH}_2 {CH}_3$ के मुक्त रadical मोनोक्लोरीनेशन के द्वारा बनने वाले सभी संभावित मोनोक्लोरो संरचनात्मक समावयवी की पहचान करें।
हल
दिए गए अणु में चार अलग-अलग प्रकार के हाइड्रोजन परमाणु हैं। इन हाइड्रोजन परमाणुओं के स्थान लेने से निम्नलिखित परिणाम होंगे :
$\left({CH} _{3}\right) _{2} {CHCH} _{2} {CH} _{2} {Cl}$,
$\left({CH} _{3}\right) _{2} {CHCH}({Cl}) {CH} _{3}$,
$\left({CH} _{3}\right) _{2} {C}({Cl}) {CH} _{2} {CH} _{3}$,
${CH} _{3} {CH}\left({CH} _{2} {Cl}\right) {CH} _{2} {CH} _{3}$
6.4.3 हैलोजन आदान-प्रदान
अल्किल आयोडाइड अक्सीजन रहित एसिटोन में अल्किल क्लोराइड/ब्रोमाइड के साथ NaI के अभिक्रिया द्वारा बनाए जाते हैं। इस अभिक्रिया को ** ** अभिक्रिया कहते हैं।
$$ \begin{aligned} & {R}-{X}+{NaI} \longrightarrow {R}-{I}+{NaX} \\ & {X}={Cl}, {Br} \end{aligned} $$
अक्सीजन रहित एसिटोन में बने NaCl या NaBr के अवक्षेपण द्वारा आगे की अभिक्रिया को ली चाटलियर के सिद्धांत के अनुसार सुगम बनाए रखा जाता है।
अल्किल फ्लूओराइड के संश्लेषण के लिए अल्किल क्लोराइड/ब्रोमाइड को एक धातु फ्लूओराइड जैसे ${AgF}, {Hg}_2 {F}_2, {CoF}_2$ या ${SbF}_3$ की उपस्थिति में गर्म करना सर्वोत्तम विधि है। इस अभिक्रिया को स्वार्ट्स अभिक्रिया कहते हैं।
$$ {H}_3 {C}-{Br}+{AgF} \longrightarrow {H}_3 {C}-{F}+{AgBr} $$
6.5 हैलोएरीन के तैयार करना
(i) हाइड्रोकार्बन से इलेक्ट्रोफिलिक प्रतिस्थापन द्वारा
एरिल क्लोराइड और ब्रोमाइड को क्लोरीन और ब्रोमीन के साथ एरिन के इलेक्ट्रोफिलिक प्रतिस्थापन द्वारा आसानी से तैयार किया जा सकता है, जिसमें ली अम्ल कैटलिस्ट जैसे लोहा या लोहा (III) क्लोराइड की उपस्थिति में।

ओर्थो एवं पैरा आइसोमर अपने गलनांक में बहुत अधिक अंतर के कारण आसानी से अलग किए जा सकते हैं। आयोडीन के साथ अभिक्रियाएं प्रकृति में उत्क्रमणीय होती हैं और आयोडीनकरण के दौरान उत्पन्न ${HI}$ को ऑक्सीकृत करने के लिए एक ऑक्सीकारक एजेंट $\left({HNO_3}\right.$, ${HIO_4}$ ) की उपस्थिति की आवश्यकता होती है। फ्लूओरो यौगिक इस विधि से तैयार नहीं किए जा सकते क्योंकि फ्लोरीन की उच्च प्रतिक्रियाशीलता होती है।
(ii) एमीन से सैंडमेयर की अभिक्रिया द्वारा
जब एक प्राथमिक औषधीय एमीन, ठंडे जलीय खनिज अम्ल में घुला या तटा हुआ हो, तो सोडियम नाइट्राइट के साथ उपचार करने पर डाइएजोनियम लवण बनता है। नए तैयार डाइएजोनियम लवण के घोल को क्यूप्रस क्लोराइड या क्यूप्रस ब्रोमाइड के साथ मिलाने पर डाइएजोनियम समूह को $-{Cl}$ या $-{Br}$ से प्रतिस्थापित कर दिया जाता है।

डाइएजोनियम समूह के स्थान पर आयोडीन के प्रतिस्थापन के लिए क्यूप्रस हैलाइड की उपस्थिति की आवश्यकता नहीं होती है और इसे सरलता से डाइएजोनियम लवण को पोटैशियम आयोडाइड के साथ हिलाकर किया जाता है।

उदाहरण 6.4 निम्नलिखित अभिक्रियाओं के उत्पाद लिखिए:

हल

अंतर्गत प्रश्न
10.2 ऐल्कोहल के KI के साथ अभिक्रिया के दौरान सल्फ्यूरिक अम्ल क्यों उपयोग नहीं किया जाता?
उत्तर दिखाएं
उत्तर
सल्फ्यूरिक अम्ल की उपस्थिति में, KI, HI उत्पन्न करता है
$ 2 {KI}+{H _2} {SO _4} \longrightarrow 2 {KHSO _4}+2 {HI} $
क्योंकि $ {H _2} {SO _4} $ एक ऑक्सीकारक है, इसलिए इसके द्वारा अभिक्रिया में उत्पन्न HI को $ {I _2} $ में ऑक्सीकृत कर देता है।
$ 2 {HI}+{H _2} {SO _4} \longrightarrow {I _2}+{SO _2}+{H _2} {O} $
इस कारण, ऐल्कोहल एवं HI के बीच अभिक्रिया जिसके माध्यम से ऐल्किल आयोडाइड बनता है, नहीं हो सकती। इसलिए, ऐल्कोहल के KI के साथ अभिक्रिया के दौरान सल्फ्यूरिक अम्ल का उपयोग नहीं किया जाता। बजाए इसके, एक अऑक्सीकारक अम्ल जैसे $ {H _3} {PO _4} $ का उपयोग किया जाता है।
10.3 प्रोपेन के विभिन्न डाइहैलोजन अपशिष्ट उत्पादों के संरचना लिखिए।
उत्तर दिखाएं
उत्तर
प्रोपेन के चार अलग-अलग डाइहैलोजन अपशिष्ट उत्पाद होते हैं। इन अपशिष्ट उत्पादों के संरचना नीचे दिखाए गए हैं।


10.4 अणुसूत्र $ {C _5} {H _12} $ के आइसोमेरिक ऐल्केन में से वह ऐल्केन चुनिए जो प्रकाशरासायनिक क्लोरीनन अभिक्रिया के दौरान निम्नलिखित देता है: (i) एक एकल मोनोक्लोराइड। (ii) तीन आइसोमेरिक मोनोक्लोराइड। (iii) चार आइसोमेरिक मोनोक्लोराइड।
उत्तर दिखाएं
उत्तर
(i) एक एकल मोनोक्लोराइड प्राप्त करने के लिए, $ {C _5} {H _12} $ के ऐल्केन के आइसोमर में केवल एक प्रकार का $ {H} $-परमाणु होना चाहिए। इसके कारण, किसी भी $ {H} $-परमाणु के स्थान पर बदलने से समान उत्पाद बनता है। ऐसा आइसोमर न्यूपेंटेन है।
${CH _3 - \stackrel{\substack{{CH _3} \\ |}}{\underset{\substack{ | \\ {CH _3}}}{C}} -CH _3}$
निपेंटेन
इसलिए, इसमले एन-पेंटेन है। यह देखा जा सकता है कि एन-पेंटेन में तीन प्रकार के ${H}$ परमाणु हैं जिन्हें $a, b$ और $c$ के रूप में चिह्नित किया गया है।

(iii) पाँच अणुक फॉर्मूला ${C _5} {H _12}$ के एल्केन के इसमले के चार विभिन्न प्रकार के ${H}$-परमाणु होने चाहिए ताकि चार आइसोमेरिक मोनोक्लोराइड हों। इसलिए, इसमले 2-मेथिलब्यूटेन है। यह देखा जा सकता है कि 2-मेथिलब्यूटेन में चार प्रकार के ${H}$ परमाणु हैं जिन्हें $a, b, c$, और $d$ के रूप में चिह्नित किया गया है।

10.5 निम्नलिखित प्रतिक्रियाओं में प्रत्येक के मुख्य मोनोहैलो उत्पादों के संरचना बनाइए:

उत्तर दिखाएं
Answer
(i)

(ii)

(iii)

(iv)

(v)

(vi)

6.6 भौतिक गुण
अल्किल हैलाइड शुद्ध रूप में रंगहीन होते हैं। हालांकि, ब्रोमाइड और आयोडाइड प्रकाश के विकिरण के अधीन होने पर रंग विकसित करते हैं। कई वाष्पशील हैलोजन यौगिकों की गंध शर्मर रहती है।
गलन और क्वथनांक
मेथिल क्लोराइड, मेथिल ब्रोमाइड, एथिल क्लोराइड और कुछ क्लोरोफ्लूरोमेथेन तापमान के अनुसार गैस होते हैं। उच्च अणुभार वाले यौगिक तरल या ठोस होते हैं। जैसे हम पहले सीख चुके हैं, ऑर्गैनिक हैलोजन यौगिकों के अणु आमतौर पर ध्रुवीय होते हैं। अपेक्षाकृत अधिक ध्रुवता और अधिक अणुभार के कारण हैलोजन यौगिकों में अणुक के बीच आकर्षण बल (द्विध्रुव-द्विध्रुव और वैन डर वाल्स बल) अधिक होते हैं। इस कारण चलोजन, ब्रोमाइड और आयोडाइड के क्वथनांक उन ईंधन यौगिकों के तुलना में बहुत अधिक होते हैं जिनका अणुभार इतना ही होता है।
मोलेक्यूल के आकार में बढ़ोतरी और इलेक्ट्रॉनों की संख्या में वृद्धि के साथ आकर्षण बढ़ता जाता है। विभिन्न हैलाइडों के क्वथनांक के विचलन के पैटर्न को आकृति 6.1 में दर्शाया गया है। समान ऐल्किल समूह के लिए, ऐल्किल हैलाइडों के क्वथनांक के क्रम इस प्रकार होता है: ${RI}>{RBr}>{RCl}>{RF}$. इसका कारण यह है कि हैलोजन परमाणु के आकार और द्रव्यमान में वृद्धि के साथ वैन डर वाल के बलों के मान में वृद्धि होती है।
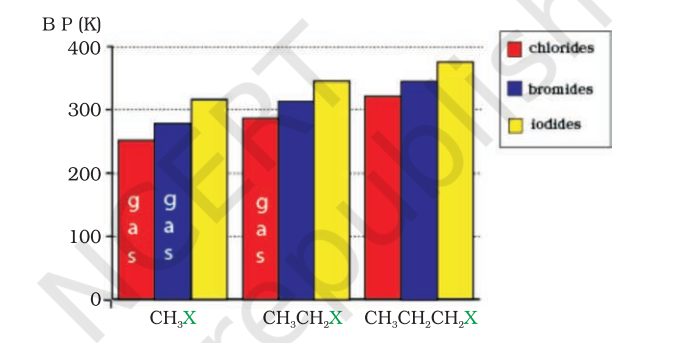

चित्र 6.1: कुछ ऐल्किल हैलाइड के क्वथनांक की तुलना
समावयवी हैलोऐल्केन के क्वथनांक शाखणुकरण के साथ घटते हैं। उदाहरण के लिए, 2-ब्रोमो-2-मेथिलप्रोपेन तीन समावयवी में सबसे कम क्वथनांक वाला है।
समावयवी डाइहैलोबेंज़ीन के क्वथनांक बहुत निकट होते हैं। हालांकि, $para$-समावयवी अपने $ortho$ और $meta$-समावयवी की तुलना में उच्च गलनांक वाले होते हैं। इसका कारण $para$-समावयवी के सममिति के कारण जिसके क्रिस्टल जाली में बेहतर फिट होते हैं, जबकि $ortho$ और $meta$-समावयवी के नहीं।

घनत्व
ब्रोमो, आयोडो एवं पॉलीक्लोरो हाइड्रोकार्बन अवतरण जल से भारी होते हैं। कार्बन परमाणुओं, हैलोजन परमाणुओं एवं हैलोजन परमाणुओं के परमाणु द्रव्यमान की संख्या बढ़ने के साथ-साथ घनत्व बढ़ता है (तालिका 6.3)।
तालिका 6.3: कुछ हैलोएल्केनों का घनत्व
| यौगिक | घनत्व (g/mL) | यौगिक | घनत्व (g/mL) |
|---|
| ${n}-{C}_3 {H}_7 {Cl}$ | 0.89 | ${CH}_2 {Cl}_2$ | 1.336 | | ${n}-{C}_3 {H}_7 {Br}$ | 1.335 | ${CHCl}_3$ | 1.489 | | ${n}-{C}_3 {H}_7 {I}$ | 1.747 | ${CCl}_4$ | 1.595 |
विलेयता
हैलोएल्केन जल में बहुत हल्के रूप से घुलते हैं। हैलोएल्केन को जल में घोलने के लिए, हैलोएल्केन अणुओं के बीच आकर्षण को पार करने और जल अणुओं के बीच हाइड्रोजन बंधों को तोड़ने के लिए ऊर्जा की आवश्यकता होती है। हैलोएल्केन और जल अणुओं के बीच नए आकर्षण बनाने पर कम ऊर्जा उत्सर्जित होती है क्योंकि ये जल में मूल हाइड्रोजन बंधों के तुलना में कमजोर होते हैं। इस कारण, हैलोएल्केन जल में विलेयता कम होती है। हालांकि, हैलोएल्केन अपने विलायक अणुओं के साथ नए अंतराणुक आकर्षण के कारण अधिक विलेय होते हैं क्योंकि ये आकर्षण अलग अलग हैलोएल्केन और विलायक अणुओं के बीच टूट रहे आकर्षण के तुलना में बहुत अधिक शक्ति रखते हैं।
अंतर्गत प्रश्न
10.6 प्रत्येक यौगिक समूह को उबलने के बिंदु के बढ़ते क्रम में व्यवस्थित करें।
(i) ब्रोमोमेथेन, ब्रोमोफॉर्म, क्लोरोमेथेन, डाइब्रोमोमेथेन।
(ii) 1-क्लोरोप्रोपेन, आइसोप्रोपिल क्लोराइड, 1-क्लोरोब्यूटेन।
उत्तर दिखाएं
उत्तर

एक ही ऐल्किल समूह वाले ऐल्किल हैलाइड में, उबलने के बिंदु में हैलोजन परमाणु के परमाणु द्रव्यमान के बढ़ते साथ बढ़ता है।
क्योंकि ${Br}$ के परमाणु द्रव्यमान ${Cl}$ के परमाणु द्रव्यमान से अधिक है, इसलिए ब्रोमोमेथेन का उबलने का बिंदु क्लोरोमेथेन के उबलने के बिंदु से अधिक होता है।
इसके अतिरिक्त, एक ही ऐल्किल समूह वाले ऐल्किल हैलाइड में, हैलाइड की संख्या के बढ़ते साथ उबलने के बिंदु में वृद्धि होती है। इसलिए, डाइब्रोमोमेथेन का उबलने का बिंदु क्लोरोमेथेन और ब्रोमोमेथेन के उबलने के बिंदु से अधिक होता है, लेकिन ब्रोमोफॉर्म के उबलने के बिंदु से कम होता है।
इसलिए, दिए गए यौगिक समूह को उबलने के बिंदु के बढ़ते क्रम में इस तरह व्यवस्थित किया जा सकता है:
$\text {क्लोरोमेथेन < ब्रोमोमेथेन < डाइब्रोमोमेथेन < ब्रोमोफॉर्म}.$

एक ही हैलाइड वाले ऐल्किल हैलाइड में, ऐल्किल समूह के आकार के बढ़ते साथ उबलने के बिंदु में वृद्धि होती है। इसलिए, 1-क्लोरोब्यूटेन का उबलने का बिंदु आइसोप्रोपिल क्लोराइड और 1-क्लोरोप्रोपेन के उबलने के बिंदु से अधिक होता है।
इसके अतिरिक्त, श्रृंखला में शाखन के बढ़ते साथ उबलने के बिंदु में कमी होती है। इसलिए, आइसोप्रोपिल अल्कोहल का उबलने का बिंदु 1-क्लोरोप्रोपेन के उबलने के बिंदु से कम होता है।
इसलिए, दिए गए यौगिकों को उनके क्वथनांक के बढ़ते क्रम में व्यवस्थित करने पर:
$\text{आइसोप्रॉपिल क्लोराइड < 1-क्लोरोप्रोपेन < 1-क्लोरोब्यूटेन}$
6.7 रासायनिक अभिक्रियाएं
6.7.1 हैलोएल्केन की अभिक्रियाएं
हैलोएल्केन की अभिक्रियाएं निम्नलिखित श्रेणियों में वर्गीकृत की जा सकती हैं:
-
न्यूक्लिओफिलिक स्थानांतरण
-
उत्सर्जन अभिक्रियाएं
-
धातुओं के साथ अभिक्रिया।
(1) न्यूक्लिओफिलिक स्थानांतरण अभिक्रियाएं आप कक्षा XI में सीख चुके हैं कि न्यूक्लिओफिल के इलेक्ट्रॉन समृद्ध अणु होते हैं। इसलिए, वे उस भाग पर हमला करते हैं जो इलेक्ट्रॉन अभाव वाला होता है। एक अणु में पहले से मौजूद न्यूक्लिओफिल को एक न्यूक्लिओफिल द्वारा प्रतिस्थापित करने वाली अभिक्रिया को न्यूक्लिओफिलिक स्थानांतरण अभिक्रिया कहा जाता है। हैलोएल्केन इन अभिक्रियाओं में उपस्थित उपचारक होते हैं। इस प्रकार की अभिक्रिया में, एक न्यूक्लिओफिल हैलोएल्केन (उपचारक) के साथ अभिक्रिया करता है जिसमें हैलोजन के संलग्न कार्बन पर आंशिक धनावेश होता है। एक स्थानांतरण अभिक्रिया होती है और हैलोजन परमाणु, जिसे छोड़ने वाला समूह कहा जाता है, हैलाइड आयन के रूप में छोड़ देता है। क्योंकि यह स्थानांतरण अभिक्रिया एक न्यूक्लिओफिल द्वारा प्रारंभ होती है, इसे न्यूक्लिओफिलिक स्थानांतरण अभिक्रिया कहा जाता है।

यह ऐल्किल हैलाइड के अम्लीय अभिक्रियाओं की सबसे उपयोगी श्रेणी में से एक है जहाँ हैलोजन $sp^3$ हाइब्रिडाइज़्ड कार्बन के साथ बंधी होती है। ऐल्किल हैलाइड के कुछ सामान्य न्यूक्लिओफ़ाइल के साथ अभिक्रिया द्वारा उत्पन्न उत्पादों को तालिका 6.4 में दिया गया है।
तालिका 6.4: ऐल्किल हैलाइड के न्यूक्लिओफ़ाइलिक प्रतिस्थापन (R–X)
$$ {R}-{X}+{Nu}^{-} \rightarrow {R}-{Nu}+{X}^{-}
$$
| अभिकर्मक | न्यूक्लिओफाइल $\left({N u}^{-}\right)$ |
प्रतिस्थापन उत्पाद R-Nu |
मुख्य उत्पाद की श्रेणी |
|---|---|---|---|
| ${NaOH}({KOH})$ | ${HO}^{-}$ | ${ROH}$ | अल्कोहल |
| ${H}_2 {O}$ | ${H}_2 {O}$ | ${ROH}$ | अल्कोहल |
| ${NaOR}^{\prime}$ | ${R}^{\prime} {O}^{-}$ | ${ROR}^{\prime}$ | ईथर |
| ${NaI}$ | ${I}^{-}$ | ${R}-{I}$ | ऐल्किल आयोडाइड |
| ${NH}_3$ | ${NH}_3$ | ${RNH}_2$ | प्राथमिक ऐमीन |
| ${R}^{\prime} {NH}_2$ | ${R}^{\prime} {NH}_2$ | ${RNHR}^{\prime}$ | द्वितीयक ऐमीन |
| ${R}^{\prime} {R}^{\prime \prime N H}$ | ${R}^{\prime} {R}^{\prime \prime} {NH}$ | ${RNR}^{\prime} {R}^{\prime \prime}$ | तृतीय एमीन |
| ${KCN}$ | $\overline{{C}} \equiv {N}:$ | ${RCN}$ | नाइट्राइल
(साइएनाइड) |
| ${AgCN}$ | ${Ag}-{CN}$ : | ${RNC}$
(आइसोनाइट्राइल) | आइसोनाइट्राइल |
| ${KNO}_2$ | ${O}={N}-{O}$ | ${R}-{O}-{N}={O}$ | एल्किल नाइट्राइट |
| ${AgNO}_2$ | ${Ag}-\ddot{{O}}-{N}={O}$ | ${R}-{NO}_2$ | नाइट्रोएल्केन |
| ${R}^{\prime} {COOAg}$ | ${R}^{\prime} {COO}^{-}$ | ${R}^{\prime} {COOR}$ | एस्टर |
| ${LiAlH}_4$ | ${H}$ | ${RH}$ | हाइड्रोकार्बन | | ${R}^{\prime-} {M}^{+}$ | ${R}^{\prime-}$ | ${RR}^{\prime}$ | एल्केन |
साइनाइड और नाइट्राइट जैसे समूह दो न्यूक्लिओफिलिक केंद्र रखते हैं और इन्हें अम्बिडेंट न्यूक्लिओफिल कहा जाता है। वास्तव में साइनाइड समूह दो योगदानकार संरचनाओं के मिश्रण होता है और इसलिए इसके दो अलग-अलग तरीकों से न्यूक्लिओफिल के रूप में कार्य कर सकता है $\left[{ }^{\ominus} {C} \equiv {N} \leftrightarrow: {C}={N}^{\ominus}\right]$, अर्थात्, कार्बन परमाणु के माध्यम से जुड़कर एल्किल साइनाइड बनते हैं और नाइट्रोजन परमाणु के माध्यम से जुड़कर आइसोसाइनाइड बनते हैं। इसी तरह नाइट्राइट आयन भी दो अलग-अलग जुड़ने के बिंदुओं के साथ एक अम्बिडेंट न्यूक्लिओफिल के रूप में प्रस्तुत करता है $[{^-}{O}-\overset{..}{N}={O}]$। ऑक्सीजन के माध्यम से जुड़ने से एल्किल नाइट्राइट बनते हैं जबकि नाइट्रोजन परमाणु के माध्यम से जुड़ने से नाइट्रोएल्केन बनते हैं।
उदाहरण 6.5
हैलोएल्केन ${KCN}$ के साथ अभिक्रिया करके मुख्य रूप से एल्किल साइनाइड बनाते हैं जबकि ${AgCN}$ मुख्य रूप से आइसोसाइनाइड बनाता है। समझाइए।
हल
${KCN}$ मुख्य रूप से आयनिक होता है और विलयन में साइनाइड आयन प्रदान करता है। हालांकि, कार्बन और नाइट्रोजन दोनों परमाणु इलेक्ट्रॉन युग्म दान करने के अवसर पर हो सकते हैं, लेकिन अभिक्रिया मुख्य रूप से कार्बन परमाणु के माध्यम से होती है और नाइट्रोजन परमाणु के माध्यम से नहीं, क्योंकि ${C}-{C}$ बंध ${C}-{N}$ बंध की तुलना में अधिक स्थायी होती है। इसके विपरीत, ${AgCN}$ मुख्य रूप से सहसंयोजक प्रकृति का होता है और नाइट्रोजन इलेक्ट्रॉन युग्म दान करके मुख्य रूप से आइसोसाइनाइड बनाता है।
मेकैनिज़्म : इस अभिक्रिया के द्वारा दो अलग-अलग मेकैनिज़्म के माध्यम से चलती है जो नीचे वर्णित हैं:
(a) बिमोलेक्यूलर न्यूक्लियोफिलिक स्थानांतरण ( $\left.{S_N} {2}\right.$ )
${CH_3} {Cl}$ और हाइड्रॉक्साइड आयन के बीच अभिक्रिया जो मेथेनॉल और क्लोराइड आयन उत्पन्न करती है, द्वितीय कोटि की रासायनिक गति का पालन करती है, अर्थात दर दोनों अभिकर्मकों के सांद्रण पर निर्भर करती है

ठोस त्रिकोणीय आकृति बर्तन के बाहर निकलते बंधन को दर्शाती है, दृढ़ रेखा बर्तन के अंदर जाते बंधन को दर्शाती है और बर्तन के तल में बंधन को दर्शाती है।
ऊपर दिया गया अभिक्रिया चित्रात्मक रूप से चित्र 6.2 में दिखाया गया है।

चित्र 6.2: लाल गेंद आगंतुक हाइड्रॉक्साइड आयन को दर्शाती है और हरी गेंद उत्सर्जित हैलाइड आयन को दर्शाती है।
1937 के वर्ष में, एडवर्ड डेविस हुग्स और सर क्रिस्टोफर इंगल एक $S_N 2$ अभिक्रिया के एक योगात्मक योगी विस्थापन $\left({S_{N}} 2\right)$ अभिक्रिया के एक माध्यम का प्रस्ताव दिया। यह एक द्विअणुक न्यूक्लिओफिलिक विस्थापन अभिक्रिया है; आगत न्यूक्लिओफिल एल्किल हैलाइड के साथ अंतर्क्रिया करता है जिसके कारण कार्बन-हैलाइड बंध टूट जाती है और कार्बन और आक्रमण करने वाले न्यूक्लिओफिल के बीच एक नई बंध बनती है। यहां इसके बीच ${C}-{O}$ बंध बनती है जो ${C}$ और $-{OH}$ के बीच होती है। ये दोनों प्रक्रियाएं एक ही चरण में साथ-साथ होती हैं और कोई मध्यवर्ती बनता नहीं है। जैसे-जैसे अभिक्रिया आगे बढ़ती है और आगत न्यूक्लिओफिल और कार्बन परमाणु के बीच बंध बनती है, कार्बन परमाणु और छोड़े जाने वाले समूह के बीच बंध कमजोर हो जाती है। जैसे यह होता है, आधार के तीन कार्बन-हाइड्रोजन बंध आक्रमण करने वाले न्यूक्लिओफिल से दूर चले जाते हैं। संक्रमण अवस्था में सभी तीन ${C}-{H}$ बंध एक ही तल में होते हैं और आक्रमण और छोड़े जाने वाले न्यूक्लिओफिल आंशिक रूप से कार्बन पर बंधे होते हैं। जैसे आक्रमण न्यूक्लिओफिल कार्बन के पास निकट आता है, ${C}-{H}$ बंध अभी भी एक ही दिशा में चलते रहते हैं तक आक्रमण न्यूक्लिओफिल कार्बन पर बंध जाता है और छोड़े जाने वाला समूह कार्बन से छूट जाता है। इस प्रकार विन्यास उलट जाता है, अभिक्रिया के अभिकरक के तहत कार्बन परमाणु के विन्यास के अभिकरक के तहत विन्यास उलट जाता है, जैसे एक छत्ती बहुत मजबूत हवा में उलट जाती है। इस प्रक्रिया को विन्यास के उलटन कहते हैं। संक्रमण अवस्था में, कार्बन परमाणु आगत न्यूक्लिओफिल और छोड़े जाने वाले समूह दोनों के साथ बंधे होते हैं। ऐसे संरचनाएं अस्थायी होती हैं और अलग किए जा सकते हैं। इसलिए, संक्रमण अवस्था में कार्बन परमाणु पांच अणुओं के साथ बंधे होते हैं।
कॉन्फ़िगरेशन
कार्बन के चारों ओर फ़ंक्शनल समूहों की स्पेसियल व्यवस्था को उसकी कॉन्फ़िगरेशन कहते हैं। नीचे दिए गए संरचनाओं (A) और (B) को ध्यान से देखें।

ये एक ही यौगिक की दो संरचनाएं हैं। वे कार्बन पर लगे फ़ंक्शनल समूहों की स्पेसियल व्यवसथा में अलग हैं। संरचना (A) संरचना (B) का दर्पण छवि है। हम कहते हैं कि संरचना (A) में कार्बन की कॉन्फ़िगरेशन संरचना (B) में कार्बन की कॉन्फ़िगरेशन के दर्पण छवि है।
चूंकि इस प्रतिक्रिया में न्यूक्लिफाइल के कार्बन पर छोड़ा गया समूह के बराबर कार्बन पर पहुंचना आवश्यक है, इसलिए कार्बन पर या उसके पास बड़े विस्थापक समूहों की उपस्थिति एक बड़ा बाधा डालती है। सरल एल्किल हैलाइड में, मेथिल हैलाइड ${S_{N}} 2$ प्रतिक्रियाओं में सबसे तेजी से अभिक्रिया करते हैं क्योंकि वे केवल तीन छोटे हाइड्रोजन परमाणुओं के साथ होते हैं। तृतीयक हैलाइड सबसे कम प्रतिक्रियाशील होते हैं क्योंकि बड़े समूह न्यूक्लिफाइल के पहुंचने को बाधा डालते हैं। इसलिए प्रतिक्रिया शक्ति का क्रम इस प्रकार होता है:
प्राथमिक हैलाइड > द्वितीयक हैलाइड > तृतीयक हैलाइड।

चित्र 6.3: ${S_{N}} 2$ अभिक्रिया में स्थानीय प्रभाव। ${S_{N}} 2$ अभिक्रिया की सापेक्ष दर के अंश में दिया गया है
(b) एक अणुक नाभिकस्थानीय प्रतिस्थापन $\left({S_N} {1}\right)$
${S_{N}} 1$ अभिक्रियाएं आमतौर पर ध्रुवीय प्रोटिक विलायकों (जैसे पानी, अल्कोहल, एसिटिक अम्ल आदि) में ले जायी जाती हैं। टेर्ट-ब्यूटिल ब्रोमाइड और हाइड्रॉक्साइड आयन के बीच अभिक्रिया टेर्ट-ब्यूटिल एल्कोहल देती है और पहले कोटि की रासायनिक गति का पालन करती है, अर्थात अभिक्रिया की दर केवल एक अभिकरक के सांद्रण पर निर्भर करती है, जो टेर्ट-ब्यूटिल ब्रोमाइड है।

यह दो चरणों में होता है। चरण I में, ध्रुवीकृत ${C}-{Br}$ बंध धीरे-धीरे टूटकर कार्बोकेटियन और ब्रोमाइड आयन उत्पन्न करती है। इस तरह बने कार्बोकेटियन को चरण II में न्यूक्लिओफ़ाइल द्वारा हमला करके प्रतिस्थापन अभिक्रिया के अंतिम चरण को पूरा किया जाता है।

स्टेप I सबसे धीमा और उत्क्रमणीय होता है। इसमें ${C}-{Br}$ बंध टूटता है, जिसके लिए ऊर्जा प्रोटिक विलायक के प्रोटॉन के साथ हैलाइड आयन के समाधान के माध्यम से प्राप्त की जाती है। क्योंकि अभिक्रिया की दर सबसे धीमे चरण पर निर्भर करती है, अभिक्रिया की दर केवल एल्किल हैलाइड के सांद्रण पर ही निर्भर करती है और हाइड्रॉक्साइड आयन के सांद्रण पर नहीं। इसके अतिरिक्त, कार्बोकेटियन की अधिक स्थायिता इसके एल्किल हैलाइड से आसानी से बनने की अधिक संभावना देती है और अभिक्रिया की दर भी अधिक हो जाती है। एल्किल हैलाइड के मामले में, $3^{0}$ एल्किल हैलाइड $ {S_{N}} 1 $ अभिक्रिया में बहुत तेजी से अभिक्रिया करते हैं क्योंकि $3^{0}$ कार्बोकेटियन की उच्च स्थायिता होती है। हम एल्किल हैलाइड के $ {S_{N}} 1 $ और $ {S_{N}} 2 $ अभिक्रियाओं के प्रति अभिक्रियाशीलता के क्रम को निम्नलिखित तरीके से सारांशित कर सकते हैं:

उतने ही कारणों से, एलिलिक और बेंजिलिक हैलाइड ${S_{N}} 1$ अभिक्रिया के प्रति उच्च प्रतिक्रियाशीलता दिखाते हैं। इस प्रकार बने कार्बोकेशन अनुगामी रूप से स्थायित्म लाभ प्राप्त करते हैं (यूनिट 8, क्लास XI) जैसा कि नीचे दिखाया गया है:

एक दिए गए ऐल्किल समूह के लिए, हैलाइड $\mathrm{R-X}$ की प्रतिक्रियाशीलता दोनों योजनाओं में एक ही क्रम में रहती है: R – I > R – Br > R – Cl » R – F।
उदाहरण 6.6 निम्नलिखित हैलोजन यौगिक के युग्मों में, कौन ${S}_{{N}} 2$ अभिक्रिया तेजी से होगी?

हल

यह प्राथमिक हैलाइड है और अतः ${S}_{{N}} 2$ अभिक्रिया तेजी से होती है।

आयोडीन के बड़े आकार के कारण एक बेहतर छोड़ने वाला समूह होता है, इसलिए आगंतुक नाभिक के उपस्थिति में इसका तेजी से छोड़ा जाएगा।
उदाहरण 6.7 निम्नलिखित यौगिकों के ${S_{N}} 1$ और ${S_{N}} 2$ अभिक्रियाओं में प्रतिक्रियाशीलता के क्रम का अनुमान लगाएं:
(i) चार समावयवी ब्रोमोब्यूटेन
(ii) ${C_6} {H_5} {CH_2} {Br}, {C_6} {H_5} {CH}\left({C_6} {H_5}\right) {Br}, {C_6} {H_5} {CH}\left({CH_3}\right) {Br}, {C_6} {H_5} {C}\left({CH_3}\right)\left({C_6} {H_5}\right) {Br}$
हल
(i)
$ \begin{aligned} & {CH}_3 {CH}_2 {CH}_2 {CH}_2 {Br}<\left({CH}_3\right)_2 {CHCH}_2 {Br}<{CH}_3 {CH}_2 {CH}({Br}) {CH}_3<\left({CH}_3\right)_3 {CBr}\left({S}_N 1\right) \\ & {CH}_3 {CH}_2 {CH}_2 {CH}_2 {Br}>\left({CH}_3\right)_2 {CHCH}_2 {Br}>{CH}_3 {CH}_2 {CH}({Br}) {CH}_3>\left({CH}_3\right)_3 {CBr}\left({S}_N 2\right) \end{aligned} $
${CH_3} {CH_2} {CH_2} {CH_2} {Br}$ के बराबर इलेक्ट्रॉन दाता इंडक्टिव प्रभाव के कारण $\left({CH_3}\right)_2 {CH}$ - समूह के कारण। अतः, $\left({CH_3}\right)2 {CHCH_2} {Br}$, ${CH_3} {CH_2} {CH_2} {CH_2} {Br}$ की तुलना में ${S_N} 1$ अभिक्रियाओं में अधिक प्रतिक्रियाशील होता है। ${CH_3} {CH_2} {CH}(Br) {CH_3}$ एक द्वितीयक ब्रोमाइड है और $\left({CH_3}\right)3 {CBr}$ एक तृतीयक ब्रोमाइड है। अतः, ${S{N}} 1$ में उपरोक्त क्रम अपनाया जाता है। ${S{N}} 2$ अभिक्रियाओं में प्रतिक्रियाशीलता का क्रम उल्टा होता है क्योंकि वह इलेक्ट्रॉन धनात्मक कार्बन के चारों ओर स्टेरिक बाधा के उस क्रम में बढ़ती जाती है।
(ii)
${C_6} {H_5} {C}\left({CH_3}\right)\left({C_6} {H_5}\right) {Br}>{C_6} {H_5} {CH}\left({C_6} {H_5}\right) {Br}>{C_6} {H_5} {CH}\left({CH_3}\right) {Br}>{C_6} {H_5} {CH_2} {Br}\left({S_N} {1}\right)$
${C_6} {H_5} {C}\left({CH_3}\right)\left({C_6} {H_5}\right) {Br}<{C_6} {H_5} {CH}\left({C_6} {H_5}\right) {Br}<{C_6} {H_5} {CH}\left({CH_3}\right) {Br}<{C
${C_6} {H_5} {C}\left({CH_3}\right)\left({C_6} {H_5}\right) {Br}$ के बराबर ${C_6} {H_5} {CH}\left({C_6} {H_5}\right) {Br}$ से प्राप्त कार्बोकेशन अंतराल अधिक स्थायी होता है क्योंकि यह दो फेनिल समूहों द्वारा संरंगन के कारण स्थायी होता है। अतः, पहले ब्रोमाइड की ${S_{N}} 1$ अभिक्रिया में अधिक प्रतिक्रियाशीलता होती है। एक फेनिल समूह एक मेथिल समूह से बड़ा होता है। अतः, ${C_6} {H_5} {CH}\left({C_6} {H_5}\right) {Br}$ की ${S_{N}} 2$ अभिक्रिया में ${C_6} {H_5} {CH}\left({CH_3}\right) {Br}$ की तुलना में कम प्रतिक्रियाशीलता होती है।
(c) न्यूक्लियोफिल विस्थापन अभिक्रियाओं के स्थानीय अनुमान
न्यूक्लियोफिल विस्थापन अभिक्रियाओं के स्थानीय अनुमान को समझने के लिए हमें कुछ मूलभूत स्थानीय अनुमान सिद्धांत और नोटेशन के बारे में जानना होगा (प्रकाश गतिशीलता, विपरीतता, संरक्षण, विपरीतता, रेसमीकरण, आदि).
विलियम निकोल (1768 - 1851) ने पहला प्रिज्म विकसित किया जो समतल प्रकाश को उत्पन्न करता था।
(i) प्रकाश गतिशीलता: सामान्य प्रकाश को निकोल प्रिज्म के माध्यम से गुजारने पर उत्पन्न समतल प्रकाश के तल को जब कुछ यौगिकों के घोलों के माध्यम से गुजारा जाता है तो इसका घूर्णन हो जाता है। ऐसे यौगिकों को प्रकाश गतिशील यौगिक कहा जाता है। इस घूर्णन के कोण को एक उपकरण के द्वारा मापा जाता है जिसे पोलारिमीटर कहा जाता है। यदि यौगिक समतल प्रकाश के तल को दाहिने ओर, अर्थात घड़ी के चक्कर की दिशा में घुमाता है, तो इसे दक्षिणावर्ती (ग्रीक में दाहिने घुमाने वाला) या d-रूप कहा जाता है और घूर्णन के मापदंड के साथ एक धनात्मक (+) चिह्न रखा जाता है। यदि प्रकाश बाईं ओर (वृत्ताकार घूर्णन की दिशा में) घुमता है, तो यौगिक को वामावर्ती या l-रूप कहा जाता है और घूर्णन के मापदंड के साथ एक ऋणात्मक (–) चिह्न रखा जाता है। ऐसे (+) और (–) आइसोमर एक यौगिक के लिए प्रकाश आइसोमर कहलाते हैं और इस घटना को प्रकाश आइसोमरी कहा जाता है।
जैकबस हेंड्रिकस वैंट हॉफ (1852-1911) को 1901 में रसायन विज्ञान में पहला नोबेल पुरस्कार दिया गया था जिसके लिए उन्होंने विलयनों पर कार्य किया था।
(ii) अणु सममिति, चिरलिटी और एनैंटिओमर्स: लुई पेस्टर (1848) के अवलोकन कि कुछ यौगिकों के क्रिस्टल दर्पण छवि के रूप में मौजूद होते हैं, आधुनिक स्टीरियोकेमिस्ट्री की आधारशिला रखी। उन्होंने दिखाया कि दोनों प्रकार के क्रिस्टल के जलीय घोल विवर्तन दिखाते हैं, जो समान मात्रा (समान सांद्रता के घोल के लिए) के बराबर होते हैं लेकिन दिशा में विपरीत होते हैं। उन्होंने यह विश्वास रखा कि इस विभिन्न विवर्तन गति के अंतर को अणुओं में परमाणुओं के तीन आयामी व्यवस्था (कॉन्फ़िगरेशन) से संबंधित माना जाता है। वही वर्ष (1874) डच वैज्ञानिक, जे. वैंट हॉफ और फ्रांसीसी वैज्ञानिक, सी. ले बेल ने स्वतंत्र रूप से तर्क दिया कि केंद्रीय कार्बन के चार समूह (मूल्यांकन) के अंतर्गत अंतरिक्ष में चतुष्कोणीय व्यवस्था होती है और यदि उस कार्बन के सभी उपस्थित विस्थापक अलग-अलग हों, तो अणु के दर्पण छवि अणु पर अधिरोपित नहीं हो सकती है; ऐसे कार्बन को असममित कार्बन या स्टीरियोसेंटर कहा जाता है। इस परिणाम वाले अणु के सममिति की कमी होती है और इसे असममित अणु कहा जाता है। अणु की असममिति और दर्पण छवि के अधिरोपित न होने के कारण ऐसे कार्बोहाइड्रेट यौगिकों में प्रकाश गतिशीलता होती है।

चित्र 6.4: कुछ आम चिरल और अचिरल वस्तुओं के उदाहरण
सममिति और असममिति कई दैनिक वस्तुओं में भी देखी जाती है: एक गोला, एक घन, एक शंकु, अपने दर्पण प्रतिबिम्ब के समान होते हैं और उन्हें एक दूसरे पर ठीक कर सकते हैं। हालांकि, कई वस्तुएं अपने दर्पण प्रतिबिम्ब पर ठीक नहीं की जा सकतीं। उदाहरण के लिए, आपके बाईं और दाईं तरफ के हाथ आपस में बहुत समान दिखते हैं, लेकिन अगर आप उन्हें एक ही तल में एक दूसरे पर रखते हैं, तो वे एक दूसरे के समान नहीं होते। वे वस्तुएं जो अपने दर्पण प्रतिबिम्ब पर ठीक नहीं की जा सकतीं (जैसे कि हाथ के जोड़े) चिरल कहलाती हैं और इस गुण को चिरलता कहते हैं। चिरल अणु प्रकाश के अधिकारी होते हैं, जबकि वे वस्तुएं जो अपने दर्पण प्रतिबिम्ब पर ठीक की जा सकतीं हैं अचिरल कहलाती हैं। इन अणुओं के प्रकाश अधिकार नहीं होते।
ऊपर के अणु के चरमता के परीक्षण को आगे बढ़ाया जा सकता है आगे बढ़ाया जा सकता है आगे बढ़ाया जा सकता है आगे बढ़ाया जा सकता है आगे बढ़ाया जा सकता है आगे बढ़ाया जा सकता है आगे बढ़ाया जा सकता है आगे बढ़ाया जा सकता है आगे बढ़ाया जा सकता है आगे बढ़ाया जा सकता है आगे बढ़ाया जा सकता है आगे बढ़ाया जा सकता है आगे बढ़ाया जा सकता है आगे बढ़ाया जा सकता है आगे बढ़ाया जा सकता है आगे बढ़ाया जा सकता है आगे बढ़ाया जा सकता है आगे बढ़, अणुओं के मॉडल बनाकर और उनके दर्पण छवियों के बनाकर या तीन आयामी संरचनाओं के बनाकर उन्हें हमारे मन में अपने ऊपर रखने की कोशिश करके। हालांकि, कई अन्य सहायता उपलब्ध हैं जो हमें चरमता अणुओं की पहचान में सहायता कर सकते हैं। एक ऐसी सहायता एक असममित कार्बन परमाणु की उपस्थिति है। चलो हम दो सरल अणुओं प्रोपेन-2-ऑल (चित्र 6.5) और ब्यूटेन-2-ऑल (चित्र 6.6) और उनके दर्पण छवियों को विचार करें।

चित्र 6.5: B, A का दर्पण प्रतिबिम्ब है; B को 180° घुमाकर C प्राप्त किया जाता है; C, A पर अधिकृत किया जा सकता है।
आप बहुत स्पष्ट रूप से देख सकते हैं कि प्रोपेन-2-ऑल (A) में एक असममित कार्बन नहीं होता, क्योंकि चतुष्फलकीय कार्बन पर लगे चारों समूह सभी अलग नहीं होते। हम अणु के दर्पण प्रतिबिम्ब (B) को $180^{\circ}$ घुमाकर (संरचना C) बनाते हैं और फिर संरचना (C) को संरचना (A) के साथ अधिकृत करने की कोशिश करते हैं, इन संरचनाओं के बीच पूरी तरह से अधिकृत हो जाता है। इसलिए प्रोपेन-2-ऑल एक असममित अणु है।
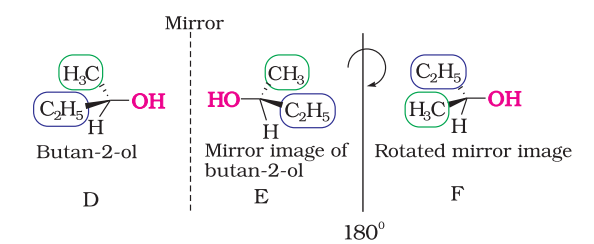
चित्र 6.6: E, D के दर्पण प्रतिबिम्ब है; E को 18 डिग्री घुमाकर F प्राप्त किया जाता है और F, अपने दर्पण प्रतिबिम्ब D के समान नहीं हो सकता।
ब्यूटेन-2-ऑल के टेट्राहेड्रल कार्बन पर चार अलग-अलग समूह जुड़े हुए हैं और अपेक्षित रूप से यह हैज़िरल है। कुछ सामान्य चिरल अणुओं के उदाहरण जैसे 2-क्लोरोब्यूटेन, 2, 3-डाइहाइड्रॉक्सीप्रोपेनल, $\left({OHC}-{CHOH}-{CH_2} {OH}\right)$, ब्रोमोक्लोरोआयोडोमेथेन $({BrClCHI}), 2$-ब्रोमोप्रोपेनोइक अम्ल $\left({H_3} {C}-{CHBr}-{COOH}\right)$, आदि।


एक दूसरे के असुमेलनीय दर्पण छवि के रूप में संबंधित स्टीरियोइसोमर एनैंटिओमर कहलाते हैं (चित्र 6.7)। चित्र 6.5 में ${A}$ और ${B}$ तथा चित्र 6.6 में ${D}$ और ${E}$ एनैंटिओमर हैं।
एनैंटिओमर गलनांक, उबलना बिंदु, अपवर्तनांक आदि भौतिक गुणों में समान होते हैं। वे केवल तलीय ध्रुवीय प्रकाश के घूर्णन के संदर्भ में अलग होते हैं। यदि एक एनैंटिओमर दक्षिणावर्त घूर्णन देता है, तो दूसरा वामावर्त घूर्णन देता है।
हालांकि, प्रकाश घूर्णन के चिह्न के साथ-साथ अणु के अंतर्निहित (वास्तविक) विन्यास के संबंध आवश्यक नहीं होता
एक मिश्रण जिसमें दो एनैंटियोमर बराबर अनुपात में मिले होंगे, तो शून्य प्रकाश घूर्णन देगा, क्योंकि एक इसोमर के कारण घूर्णन दूसरे इसोमर के कारण घूर्णन द्वारा रद्द कर दिया जाएगा। ऐसे मिश्रण को racemic mixture या racemic modification कहा जाता है। एक racemic mixture को नाम के सामने $d l$ या $( \pm)$ के प्रतीक लगाकर दर्शाया जाता है, उदाहरण के लिए $( \pm)$ butan-2-ol। एनैंटियोमर के एक racemic mixture में परिवर्तन की प्रक्रिया को racemisation कहा जाता है।
उदाहरण 6.8
निम्नलिखित प्रत्येक युग्म में चिरल और अचिरल अणुओं की पहचान करें। (कक्षा 11 के अनुसार तीक्ष्ण और डॉट प्रतिनिधित्व के अनुसार)।
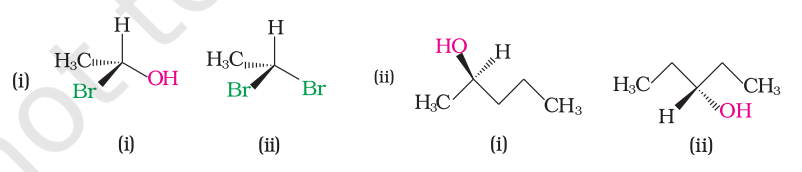

हल

(iii) संरक्षण: संरक्षण के अनुपात में एक रासायनिक प्रतिक्रिया या परिवर्तन के दौरान एक असममित केंद्र के बंधन के अंतराल को संरक्षित रखना।
सामान्य रूप से, यदि किसी प्रतिक्रिया के दौरान स्थायी केंद्र के कोई भी बंधन टूट नहीं जाता, तो उत्पाद के स्थायी केंद्र के आसपास समूहों के सामान्य संरचना अनुपात अभिकरक के समान होता है। ऐसी प्रतिक्रिया को संरचना के संरक्षण के साथ चलने वाली प्रतिक्रिया कहा जाता है। उदाहरण के रूप में, जब (–)-2-मेथिलब्यूटेन-1-ऑल को सांद्र हाइड्रोक्लोरिक अम्ल के साथ गरम किया जाता है तो जो प्रतिक्रिया होती है।

ध्यान देने योग्य है कि प्रतिक्रियक और उत्पाद में सममिति केंद्र पर विन्यास समान होता है लेकिन उत्पाद में प्रकाश घूर्णन के चिह्न में परिवर्तन हो जाता है। इसका कारण यह है कि दो अलग-अलग यौगिकों में सममिति केंद्र पर समान विन्यास हो सकता है लेकिन उनके प्रकाश घूर्णन अलग-अलग हो सकते हैं। एक यौगिक दक्षिणावर्त (प्रकाश घूर्णन के धनात्मक चिह्न) हो सकता है जबकि दूसरा वामावर्त (प्रकाश घूरन के ऋणात्मक चिह्न) हो सकता है।
(iv) व्युत्क्रमण, संरक्षण एवं रेसेमीकरण: एक असममित कार्बन परमाणु पर एक अभिक्रिया के तीन परिणाम हो सकते हैं, जब कोई बंधन असममित कार्बन परमाणु से सीधे जुड़ा हो और इस बंधन को तोड़ दिया जाए। निम्नलिखित अभिक्रिया में ${X}$ के स्थान पर ${Y}$ के बदले लेने की दृष्टि से विचार करें;

यदि (A) केवल एक यौगिक प्राप्त होता है, तो इस प्रक्रिया को संरक्षण व्यवस्था कहा जाता है। ध्यान दें कि व्यवस्था A में घुमायी गई है।
अगर $({B})$ एकमात्र यौगिक है जो प्राप्त होता है, तो प्रक्रिया अनुवर्तन अवस्था (inversion of configuration) कहलाती है। अवस्था ${B}$ में उलट गई है।
अगर ${A}$ और ${B}$ के 50:50 मिश्रण प्राप्त होता है, तो प्रक्रिया रेसेमीकरण (racemisation) कहलाती है और उत्पाद उपस्थित रहते हुए प्रकाश के तलीय ध्रुवीकृत प्रकाश के घुमाव के विपरीत दिशा में घुमाव देने वाले एक अभिकारक के लिए अप्रकाशिक रहता है।
अब हम $S_{N} 1$ और $S_{N} 2$ योजनाओं को एक उपस्थित अप्रकाशिक ऐल्किल हैलाइड के उदाहरण लेकर एक नए दृष्टिकोण से देखेंगे।
उपस्थित अप्रकाशिक ऐल्किल हैलाइड के मामले में, ${S_{N}} 2$ योजना के परिणामस्वरूप उत्पाद अभिकारक के तुलना में उलट अवस्था वाला होता है। इसका कारण यह है कि न्यूक्लिओफाइल वह ओर जुड़ता है जहां हैलोजन परमाणु के विपरीत ओर है। जब (-)-2-ब्रोमोऑक्टेन सोडियम हाइड्रॉक्साइड के साथ अभिक्रिया करता है, तो $(+)$-ऑक्टेन-2-ऑल बनता है जहां $-{OH}$ समूह ब्रोमाइड के जगह लेने वाले स्थान के विपरीत स्थित होता है।

इसलिए, प्रकाश एक्टिव हैलाइड के ${S_{N}} 2$ अभिक्रियाएं अनुसूची के परिवर्तन के साथ होती हैं।
प्रकाश एक्टिव ऐल्किल हैलाइड के मामले में, ${S_{N}} 1$ अभिक्रियाएं रेसेमीकरण के साथ होती हैं। आप इसके कारण के बारे में सोच सकते हैं? वास्तव में, धीमी चरण में बने कार्बोकेटियन $s p^{2}$ हाइब्रिडाइज्ड होता है जो तल के चारों ओर विस्तारित होता है (अप्रकाश एक्टिव)। न्यूक्लिओफ़ाइल के हमला तल के दोनों ओर से हो सकता है जिसके परिणामस्वरूप उत्पादों के मिश्रण बनता है, जिसमें एक उत्पाद एक ही अनुसूची के साथ होता है (जहां –OH आयन के समान स्थान पर जुड़ता है) और दूसरा उत्पाद विपरीत अनुसूची के साथ होता है (जहां –OH आयन के विपरीत ओर जुड़ता है)।
ईन). इसका उदाहरण अपचयन योग्य 2-ब्रोमोब्यूटेन के हाइड्रोलिज़ेशन द्वारा दिया जा सकता है, जिसके परिणामस्वरूप ( $\pm$ )-ब्यूटेन-2-ऑल के निर्माण होता है।

एक अणु में a और b कार्बन के स्थान
जिस कार्बन पर हैलोजन परमाणु की सीधे जुड़वाई होती है उसे $\alpha$-कार्बन कहते हैं और इस कार्बन के समीपस्थ कार्बन को $\beta$-कार्बन कहते हैं।
2. उत्प्रेरक अभिक्रियाएं
जब एक हैलोएल्केन को $\beta$-हाइड्रोजन परमाणु वाले एल्कोहलिक कांचीय हाइड्रोक्साइड विलयन के साथ गरम किया जाता है, तो $\beta$-कार्बन से हाइड्रोजन परमाणु और $\alpha$-कार्बन परमाणु से हैलोजन परमाणु के उत्सर्जन होता है।

अत: एक एल्कीन उत्पाद के रूप में बनता है। क्योंकि $\beta$-हाइड्रोजन परमाणु उद्ह्वस्त करने में शामिल होता है, इसे अक्सर $\beta$-उद्ह्वस्त कहा जाता है।
यदि एक से अधिक $\beta$-हाइड्रोजन परमाणु की उपलब्धता के कारण एक से अधिक एल्कीन के निर्माण की संभावना हो, तो आमतौर पर एक एल्कीन मुख्य उत्पाद के रूप में बनता है। ये एक पैटर्न के हिस्सा हैं, जिसे पहले रूसी रसायन विज्ञानी, एलेक्ज़ैंडर ज़ाइट्सेव (जिसे भी साइट्सेफ के रूप में प्रचलित कहा जाता है) द्वारा देखा गया था, जो 1875 में एक नियम के रूप में सारांशित कर सकते थे, जिसे “देहाइड्रोहैलोजनेशन अभिक्रियाओं में, जो एल्कीन उत्पाद अधिकतम ऐल्किल समूहों के संलग्न द्विबंधित कार्बन परमाणुओं के साथ होता है वह मुख्य उत्पाद होता है” कहा जाता है। इसलिए, 2-ब्रोमोपेंटेन पेंट-2-ईन के रूप में मुख्य उत्पाद बनता है।

उपस्थिति और प्रतिस्थापन के बीच अंतर
एक रासायनिक अभिक्रिया प्रतियोगिता के परिणाम होती है; यह एक दौड़ होती है जिसे तेज दौड़ते व्यक्ति जीतता है। अणुओं के एक संग्रह आम तौर पर उनके लिए सबसे आसान कार्य करते हैं। एक ऐल्किल हैलाइड जिसमें $\beta$-हाइड्रोजन परमाणु होते हैं, एक बेस या न्यूक्लिओफ़ाइल के साथ अभिक्रिया करते समय दो प्रतियोगिता पथ होते हैं: प्रतिस्थापन $\left({S_{N}} 1\right.$ और $\left.{S_{N}} 2\right)$ और उपस्थिति। अभिक्रिया के रूप में कौन सा पथ लिया जाएगा अल्किल हैलाइड की प्रकृति, बेस/न्यूक्लिओफ़ाइल की शक्ति और आकार तथा अभिक्रिया की स्थितियों पर निर्भर करता है। इसलिए, एक बड़े आकार के न्यूक्लिओफ़ाइल के लिए बेस के रूप में कार्य करना आसान होगा और वह एक प्रोटॉन को अपसारित करेगा बल्कि एक चतुर्विभाजित कार्बन परमाणु के निकट जाना आसान नहीं होगा (स्थानीय कारणों से) और विपरीत। इसी तरह, एक प्राथमिक ऐल्किल हैलाइड ${S_{N}} 2$ अभिक्रिया की प्राथमिकता रखेगा, द्वितीयक हैलाइड- ${S_{N}} 2$ या उपस्थिति अभिक्रिया बेस/न्यूक्लिओफ़ाइल की शक्ति पर निर्भर करती है और तृतीयक हैलाइड- ${S_{N}} 1$ या उपस्थिति अभिक्रिया कार्बोकेटियन के स्थायित्व या अधिक प्रतिस्थापित ऐल्कीन के आधार पर निर्भर करती है।

3. धातुओं के साथ अभिक्रिया
अधिकांश कार्बनिक क्लोराइड, ब्रोमाइड और आयोडाइड विशिष्ट धातुओं के साथ अभिक्रिया करके कार्बन-धातु बंध वाले यौगिक बनाते हैं। ऐसे यौगिकों को कार्बन-धातु यौगिक कहा जाता है। विक्टर ग्रिगनार्ड द्वारा 1900 में खोजे गए एक महत्वपूर्ण कार्बन-धातु यौगिक के रूप में एल्किल मैग्नीशियम हैलाइड, RMgX, को ग्रिगनार्ड अभिकरक कहा जाता है। ये अभिकरक एल्कोहल अभिकरकों के साथ मैग्नीशियम धातु के अभिक्रिया के माध्यम से शुष्क ईथर में प्राप्त किए जाते हैं।
$${CH}_3 {CH}_2 {Br}+{Mg} \xrightarrow{\text { dry ether }} \underset{\text { Grignard reagent }}{{CH}_3 {CH}_2 {MgBr}}$$

विक्टर ग्रिग्नार्ड के एक रसायन विज्ञानी के रूप में शैक्षिक जीवन के शुरुआती चरण अद्वितीय थे - उन्होंने गणित की डिग्री ली। जब वे अंततः रसायन विज्ञान में बदल गए, तो वे गणितीय भौतिक रसायन के क्षेत्र में नहीं, बल्कि आगन रसायन के क्षेत्र में बदल गए। विधि के प्रक्रम में एक कुशल कारक की खोज करते समय उन्होंने ज्ञात किया कि डाइएथिल ईथर में Zn का उपयोग इस उद्देश्य के लिए किया गया था और वे सोच रहे थे कि Mg/ईथर संयोजन के उपयोग के लिए भी सफलता हो सकती है। ग्रिग्नार्ड रासायनिक अभिकर्मक पहली बार 1900 में रिपोर्ट किए गए थे और ग्रिग्नार्ड ने इस कार्य का उपयोग 1901 में अपने डॉक्टरेट थेसिस के लिए किया। 1910 में, ग्रिग्नार्ड ने
एक प्रोफेसरशिप यूनिवर्सिटी ऑफ नैंस में और 1912 में, उन्हें रसायन विज्ञान में नोबेल पुरस्कार से सम्मानित किया गया जिसके साथ पॉल साबाटियर के साथ शेयर किया गया जिन्होंने निकल के उत्प्रेरक एसिड हाइड्रोजनेशन में उन्नति की थी।
ग्रिग्नार्ड अभिकर्मक में, कार्बन-मैग्नीशियम बंध आबंधी होती है लेकिन उच्च ध्रुवीय होती है, जहां कार्बन धनात्मक धारित मैग्नीशियम से इलेक्ट्रॉन खींचता है; मैग्नीशियम हैलोजन बंध आधुनिक रूप से आयनिक होती है।

ग्रिग्नार्ड अभिकर्मक बहुत अभिक्रियाशील होते हैं और किसी भी प्रोटॉन के स्रोत के साथ अभिक्रिया करते हैं जिससे हाइड्रोकार्बन बनते हैं। भले ही पानी, एल्कोहल, ऐमीन आदि अपर्याप्त एसिड होते हैं जो उन्हें संगत हाइड्रोकार्बन में परिवर्तित कर देते हैं।
$$ {RMgX}+{H_2} {O} \longrightarrow {RH}+{Mg}({OH}) {X} $$
इसलिए ग्रिग्नार्ड अभिकर्मक से भी नमता के कोई भी ट्रेस बचाना आवश्यक है। इस कारण अभिक्रिया शुष्क ईथर में की जाती है। दूसरी ओर, यह एक विधि के रूप में भी विचार किया जा सकता है जिसके माध्यम से हैलाइड को हाइड्रोकार्बन में परिवर्तित किया जाता है।
वर्ट्ज अभिक्रिया
एल्किल हैलाइड शुष्क ईथर में सोडियम के साथ अभिक्रिया करके उपस्थित हैलाइड में उपस्थित कार्बन परमाणुओं की दुगुनी संख्या वाले हाइड्रोकार्बन देते हैं। यह अभिक्रिया वर्ट्ज अभिक्रिया के रूप में जानी जाती है।
$$2 {RX}+2 {Na} \longrightarrow {RR}+2 {NaX}$$
6.7.2 हैलोएरीन्स के अभिक्रियाएँ
1. न्यूक्लिओफिलिक प्रतिस्थापन
अरिल हैलाइड न्यूक्लिओफिलिक प्रतिस्थापन अभिक्रियाओं के प्रति बहुत कम अभिक्रियाशील होते हैं क्योंकि निम्नलिखित कारणों से:
(i) संकरण प्रभाव : हैलोएरीन्स में हैलोजन परमाणु के इलेक्ट्रॉन युग्म वलय के p-इलेक्ट्रॉनों के साथ संकरण में होते हैं और निम्नलिखित संकरण संरचनाएँ संभव हैं।

${C}-{Cl}$ बंध अपचायक अनुगामी अभिक्रिया में हैलोएरीन में बंध तोड़ना हैलोएल्केन की तुलना में कठिन होता है और इसलिए वे नाभिक विस्थापन अभिक्रिया के प्रति कम प्रतिक्रियाशील होते हैं।
(ii) $C-X$ बंध में कार्बन परमाणु के हाइब्रिडाइजेशन में अंतर: हैलोएल्केन में, हैलोजन के संलग्न कार्बन परमाणु $s p^{3}$ हाइब्रिडाइज़्ड होता है जबकि हैलोएरीन में, हैलोजन के संलग्न कार्बन परम णु $s p^{2}$-हाइब्रिडाइज़्ड होता है।

$sp^{2}$ हाइब्रिडाइज़्ड कार्बन जिसमें अधिक $s$-भाग होता है, अधिक विद्युत ऋणात्मक होता है और इसलिए ${C}-{X}$ बंध के इलेक्ट्रॉन युग्म को $sp^{3}$-हाइब्रिडाइज़्ड कार्बन की तुलना में अधिक तीव्रता से धारण कर सकता है जो कि हैलोएल्केन में कम $s$-भाग वाला होता है। अतः, हैलोएल्केन में ${C}-{Cl}$ बंध की लंबाई $177 \hspace{0.5mm} {pm}$ होती है जबकि हैलोएरीन में $169\hspace{0.5mm} {pm}$ होती है। चूंकि छोटे बंध को तोड़ना लंबे बंध के तुलना में कठिन होता है, इसलिए हैलोएरीन हैलोएल्केन की तुलना में न्यूक्लियोफिलिक स्थानांतरण अभिक्रिया के प्रति कम प्रतिक्रियाशील होते हैं।
(iii) फ़ीनिल कैटियन की अनिश्चितता: हैलोएरीन के मामले में, स्व-आयनीकरण के परिणामस्वरूप बने फ़ीनिल कैटियन को अनुनाद द्वारा स्थायित्म नहीं हो सकता है और इसलिए, ${S_{N}} 1$ योग के लिए अवसर नहीं होता।
(iv) इलेक्ट्रॉन समृद्ध न्यूक्लिओफ़ाइल के इलेक्ट्रॉन समृद्ध एरीन के प्रति आकर्षण के लिए संभावित प्रतिकर्षण के कारण यह कम संभावना है।
हाइड्रॉक्सिल समूह द्वारा प्रतिस्थापन
क्लोरोबेंज़ीन को 623 K तापमान और 300 वायुमंडलीय दबाव पर जलीय सोडियम हाइड्रॉक्साइड विलयन में गरम करके फ़ेनॉल में परिवर्तित किया जा सकता है।

$ortho-$ और $para-$ स्थिति पर इलेक्ट्रॉन अवसादक समूह $\left(-{NO_2}\right)$ की उपस्थिति हैलोएरीन की प्रतिक्रियाशीलता को बढ़ाती है।


प्रभाव तब स्पष्ट रूप से दिखाई देता है जब $\left(-{NO_2}\right)$ समूह अपशिष्ट और $para$- स्थिति पर प्रवेश करता है। हालांकि, मेटा-स्थिति पर इलेक्ट्रॉन अवसादक समूह की उपस्थिति द्वारा हैलोएरीन के प्रतिक्रियाशीलता पर कोई प्रभाव नहीं पड़ता। प्रतिक्रिया के योजना नीचे चित्र में दर्शाई गई है:

आप बता सकते हैं कि क्यों $-{NO}_2$ समूह केवल ओर्थो और पेरा स्थिति पर ही प्रभाव दिखाता है और मेटा स्थिति पर नहीं?
जैसा कि दिखाया गया है, नाइट्रो समूह के ओर्थो और पेरा स्थिति पर उपस्थिति बेंजीन वलय से इलेक्ट्रॉन घनत्व को निकालती है और इस प्रकार हैलोएरीन पर न्यूक्लियोफिल के आक्रमण को सुगम बनाती है। इस प्रकार बने कार्बानियन को उसके अनुरूप रूप में स्थायित्म देता है। नाइट्रो समूह द्वारा ओर्थो और पेरा स्थिति पर नाइट्रो समूह के संबंध में हैलोजन प्रतिस्थापक के संबंध में नकारात्मक आवेश के वितरण के द्वारा स्थायित्म दिया जाता है। जबकि मेटा-नाइट्रोबेंजीन के मामले में, कोई भी अनुरूप संरचना नाइट्रो समूह वाले कार्बन पर नकारात्मक आवेश को वहन नहीं करती है। अतः, मेटा स्थिति पर नाइट्रो समूह की उपस्थिति नकारात्मक आवेश के स्थायित्म को नहीं बढ़ाती है और इसलिए मेटा स्थिति पर नाइट्रो समूह की उपस्थिति रासायनिक प्रतिक्रियाशीलता पर कोई प्रभाव नहीं डालती है।
2. विद्युत-धनात्मक प्रतिस्थापन अभिक्रियाएं
हैलोएरीन बेंजीन वलय के सामान्य विद्युत-धनात्मक अभिक्रियाओं जैसे हैलोजनन, नाइट्रेशन, सल्फोनेशन और फ्रेडेल-क्राफ्ट्स अभिक्रियाएं अनुभव करते हैं। हैलोजन परमाणु अपेक्षाकृत अक्रियकरण देता है लेकिन o, p-निर्देशक होता है; इसलिए, हैलोजन परमाणु के संबंध में ओर्थो और पैरा स्थितियों पर आगे के प्रतिस्थापन होता है। हैलोजन परमाणु के o, p-निर्देशक प्रभाव को आसानी से समझा जा सकता है यदि हम हैलोबेंजीन के विस्थापन संरचनाओं को ध्यान में रखें जैसा कि नीचे दिखाया गया है:
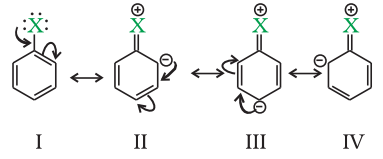
अनुनाद के कारण, ओर्थो और पेरा स्थितियों पर इलेक्ट्रॉन घनत्व में वृद्धि एमेटा स्थितियों की तुलना में अधिक होती है। इसके अतिरिक्त, हैलोजन परमाणु के कारण इसका -I प्रभाव बेंजीन वलय से इलेक्ट्रॉन अपसार करने की कुछ प्रवृत्ति होती है। इस प्रकार, वलय की क्रियाशीलता बेंजीन की तुलना में कम हो जाती है और इसलिए हैलोएरीन में विद्युत धनात्मक प्रतिस्थापन अभिक्रियाएं धीमी गति से होती हैं और बेंजीन में अभिक्रियाएं की तुलना में अधिक तीव्र शर्तों की आवश्यकता होती है।

(iv) Friedel-Crafts अभिक्रिया

उदाहरण 6.9 यद्यपि क्लोरीन एक इलेक्ट्रॉन अपस्वीकृत करने वाला समूह है, लेकिन इसके अतिरिक्त, परारैंग दिशा देता है इलेक्ट्रॉन अपस्वीकृत करने वाली एरोमैटिक विस्थापन अभिक्रिया में। क्यों?
हल
क्लोरीन इंडक्टिव प्रभाव के माध्यम से इलेक्ट्रॉन खींचता है और रेजोनेंस के माध्यम से इलेक्ट्रॉन छोड़ता है। इंडक्टिव प्रभाव के माध्यम से क्लोरीन विद्युत अपसारी प्रतिस्थापन के दौरान बने मध्यवर्ती कार्बोकेटियन को अस्थिर बनाता है।

रेजोनेंस के माध्यम से हैलोजन कार्बोकेटियन को स्थायी बनाने की कोशिश करता है और इस प्रभाव का अधिक प्रभाव ओर्थो और पेरा स्थितियों पर दिखाई देता है। इंडक्टिव प्रभाव रेजोनेंस की तुलना में अधिक मजबूत होता है और इसके कारण नेट इलेक्ट्रॉन खींचने का प्रभाव होता है जिसके कारण नेट अक्रियकरण होता है। रेजोनेंस प्रभाव ओर्थो और पेरा स्थितियों पर हमले के विरोध में आता है और इस प्रकार ओर्थो और पेरा हमले के लिए अक्रियकरण कम हो जाता है। इसलिए अक्रियकरण के लिए इंडक्टिव प्रभाव के अधिक मजबूत प्रभाव द्वारा अभिक्रिया क्षमता नियंत्रित होती है और ओर्थो और पेरा हमले के लिए रेजोनेंस प्रभाव द्वारा दिशा नियंत्रित होती है।
3. धातुओं के साथ अभिक्रिया
वर्ट्ज-फिटिग अभिक्रिया
एक एल्किल हैलाइड और एरिल हैलाइड के मिश्रण को शुष्क ईथर में सोडियम के साथ उपचार देने पर एल्किलएरिल बनता है और इस अभिक्रिया को वर्ट्ज-फिटिग अभिक्रिया कहते हैं।

फिटिग अभिक्रिया
एरिल हैलाइड भी शुष्क ईथर में सोडियम के साथ उपचार देने पर दो एरिल समूहों के मिलने वाले समान यौगिक देते हैं। इस अभिक्रिया को फिटिग अभिक्रिया कहते हैं।

अंतर्गत प्रश्न
10.7 निम्नलिखित युग्मों में से कौन सा ऐल्किल हैलाइड ${S_{N}} 2$ योगात्मक योग के द्वारा अधिक तेजी से अभिक्रिया करेगा? अपने उत्तर की व्याख्या करें।

उत्तर दिखाएं
उत्तर
(i)

2-ब्रोमोब्यूटेन एक $2 ^{\circ}$ (द्वितीयक) ऐल्किल हैलाइड है जबकि 1-ब्रोमोब्यूटेन एक $1 ^{\circ}$ (प्राथमिक) ऐल्किल हैलाइड है। नाभिक अभिकरक के आगंतुक अधिक अवरोधित होता है 2-ब्रोमोब्यूटेन में जबकि 1-ब्रोमोब्यूटेन में नहीं। अतः 1-ब्रोमोब्यूटेन, 2-ब्रोमोब्यूटेन की तुलना में ${S_{N}} 2$ योगात्मक योग द्वारा अधिक तेजी से अभिक्रिया करता है।
(ii)

2-ब्रोमोब्यूटेन एक $2 ^{\circ}$ ऐल्किल हैलाइड है जबकि 2-ब्रोमो-2-मेथिलप्रोपेन एक $3 ^{\circ}$ ऐल्किल हैलाइड है। अतः $3 ^{\circ}$ ऐल्किल हैलाइड में $2 ^{\circ}$ ऐल्किल हैलाइड की तुलना में अधिक संख्या में प्रतिस्थापक उपस्थित होते हैं जो नाभिक अभिकरक के आगंतुक को अवरोधित करते हैं। अतः 2-ब्रोमोब्यूटेन, 2-ब्रोमो-2-मेथिलप्रोपेन की तुलना में ${S_{N}} 2$ योगात्मक योग द्वारा अधिक तेजी से अभिक्रिया करता है।
(iii)

दोनों ऐल्किल हैलाइड प्राथमिक हैं। हालांकि, 1-ब्रोमो-3-मेथिलब्यूटेन में $-{CH_3}$ प्रतिस्थापक, 1-ब्रोमो-2-मेथिलब्यूटेन में $-{CH_3}$ प्रतिस्थापक के तुलना में ब्रोमीन के संलग्न कार्बन पर अधिक दूरी पर है। अतः पहले के मामले में नाभिक अभिकरक के आगंतुक कम अवरोधित होता है जबकि दूसरे मामले में अधिक अवरोधित होता है। अतः पहले के मामले में अभिक्रिया दूसरे मामले की तुलना में ${S_{N}} 2$ योगात्मक योग द्वारा तेजी से होती है।
10.8 निम्नलिखित जालक यौगिकों के युग्म में, कौन सा यौगिक ${S_{N}} 1$ अभिक्रिया में तेजी से अग्रगति करता है?

उत्तर दिखाएं
उत्तर
(i)

${S_{N}} 1$ अभिक्रिया कार्बोकेटियन के निर्माण के माध्यम से होती है। ऐल्किल हैलाइड (I) $3 ^{\circ}$ है जबकि (II) $2 ^{\circ}$ है। अतः, (I) $3 ^{\circ}$ कार्बोकेटियन बनाता है जबकि (II) $2 ^{\circ}$ कार्बोकेटियन बनाता है। कार्बोकेटियन की अधिक स्थायित्व, ${S_{N}} 1$ अभिक्रिया की दर के अधिक तेज होती है। चूंकि $3 ^{\circ}$ कार्बोकेटियन $2 ^{\circ}$ कार्बोकेटियन की तुलना में अधिक स्थायी होता है, अतः (I), अर्थात 2-क्लोरो-2-मेथिलप्रोपेन, (II) अर्थात 3-क्लोरोपेंटेन की तुलना में ${S_{N}} 1$ अभिक्रिया में तेजी से अग्रगति करता है।

ऐल्किल हैलाइड (I) $2 ^{\circ}$ है जबकि (II) $1 ^{\circ}$ है। $2 ^{\circ}$ कार्बोकेटियन $1 ^{\circ}$ कार्बोकेटियन की तुलना में अधिक स्थायी होता है। अतः, (I), 2-क्लोरोहेप्टेन, (II), 1-क्लोरोहेक्सेन की तुलना में ${S_{N}} 1$ अभिक्रिया में तेजी से अग्रगति करता है।
10.9 निम्नलिखित में A, B, C, D, E, R और $R ^1$ की पहचान करें:

उत्तर दिखाएं
उत्तर

6.8 बहुहैलोजन यौगिक
वे कार्बन यौगिक जिनमें एक से अधिक हैलोजन परमाणु होते हैं, आमतौर पर बहुहैलोजन यौगिक कहलाते हैं। इन यौगिकों में से कई औद्योगिक एवं कृषि में उपयोगी होते हैं। इस अनुच्छेद में कुछ बहुहैलोजन यौगिकों का वर्णन किया गया है।
6.8.1 डाइक्लोरोमेथेन (मेथिलीन क्लोराइड)
डाइक्लोरोमेथेन का उपयोग रंग निकालने के रूप में, एयरोसोल में एक प्रोपेल्लेंट के रूप में और दवाओं के निर्माण में एक प्रक्रिया विलायक के रूप में व्यापक रूप से किया जाता है। यह धातु साफ़ करने और अंतिम उपचार के रूप में भी उपयोग किया जाता है। मेथिलीन क्लोराइड मानव केंद्री तंत्रिका प्रणाली को नुकसान पहुंचाता है। हवा में निम्न स्तर के मेथिलीन क्लोराइड के अतिरिक्त अवलोकन के कारण सुनने और देखने की थोड़ी सी कमजोरी हो सकती है। हवा में उच्च स्तर के मेथिलीन क्लोराइड के कारण घबराहट, खांसी, अंगों के अंगों में तंगी और अक्षमता के लक्षण हो सकते हैं। मानव शरीर में मेथिलीन क्लोराइड के सीधे त्वचा संपर्क से त्वचा पर तीव्र जलन और हल्की लाली हो सकती है। आंखों के सीधे संपर्क से कोर्निया के जलन के कारण हो सकता है।
6.8.2 ट्राइक्लोरोमेथेन (क्लोरोफॉर्म)
रासायनिक रूप से, क्लोरोफॉर्म वसा, अम्लकर यौगिक, आयोडीन और अन्य पदार्थों के विलायक के रूप में प्रयोग किया जाता है। आज क्लोरोफॉर्म का मुख्य उपयोग रेफ्रिजरेंट एआर-22 के उत्पादन में है। इसके अतिरिक्त, यह पहले सर्जनी में सामान्य अनाजनन के रूप में प्रयोग किया जाता था, लेकिन अब इसके स्थान पर कम विषैले, सुरक्षित अनाजनन जैसे ईथर का प्रयोग किया जाता है। अनाजनन के रूप में इसके उपयोग से अपेक्षित रूप से, क्लोरोफॉर्म के वाष्पों के सांस लेने के बाद केंद्रीय तंत्रिका प्रणाली के अवसाद के लक्षण हो सकते हैं। वायु के लगभग 900 भाग क्लोरोफॉर्म प्रति मिलियन भाग (900 भाग प्रति मिलियन) के लिए एक छोटे समय में घबराहट, थकान और सिरदर्द के कारण हो सकते हैं। लंबे समय तक क्लोरोफॉर्म के अनुभव के कारण यकृत (जहां क्लोरोफॉर्म फॉस्गीन में परिवर्तित होता है) और किडनी के नुकसान हो सकते हैं, और कुछ लोगों के त्वचा के जब उसमें डूबे होते हैं तो उनमें चोट लग सकती है। क्लोरोफॉर्म आंतरिक ताप और वायु की उपस्थिति में धीरे-धीरे एक बहुत विषैले गैस, कार्बोनिल क्लोराइड, जिसे फॉस्गीन के रूप में भी जाना जाता है, में ऑक्सीकृत हो जाता है। इसलिए इसे बंद काले रंग के बरतन में पूरी तरह से भरकर भंडारित किया जाता है ताकि हवा के बाहर रहे।
$$2 {CHCl}_3+{O}_2 \xrightarrow{\text { light }} \underset{\text { Phosgene }}{2 {COCl}_2}+2 {HCl}$$
6.8.3 ट्राइआयोडोमेथेन (आयोडोफॉर्म)
इसे पहले एंटीसेप्टिक के रूप में उपयोग किया गया लेकिन एंटीसेप्टिक गुण आयोडीन के मुक्त रूप के विमुक्ति के कारण हैं और आयोडोफॉर्म के कारण नहीं हैं। इसके कारण अपस्वाद वाली गंध के कारण, इसके स्थान पर आयोडीन वाले अन्य सूत्रों का उपयोग कर दिया गया है।
6.8.4 टेट्राक्लोरोमेथेन (कार्बन टेट्राक्लोराइड)
इसका बड़े पैमाने पर उत्पादन रेफ्रिजरेंट और एयरोसॉल कैन के प्रोपेल्लेंट के निर्माण के लिए किया जाता है। यह च्लोरोफ्लूरोकार्बन और अन्य रसायनों, औषधि निर्माण और सामान्य विलायक के संश्लेषण में भी उपयोग किया जाता है। मध्य 1960 के दशक तक, यह उद्योग में, एक डिग्रेजिंग एजेंट के रूप में और घर में, एक धब्बा हटाने के एजेंट के रूप में और आग बुझाने के एजेंट के रूप में एक साफ्ट के रूप में भी व्यापक रूप से उपयोग किया जाता था। कार्बन टेट्राक्लोराइड के अनुभव के कुछ सबूत हैं कि यह मानव में लीवर कैंसर के कारण हो सकता है। सबसे आम प्रभाव घबराहट, चक्कर आना, खांसी और उल्टी हो सकते हैं, जो तंत्रिका कोशिकाओं में अस्थायी क्षति का कारण बन सकते हैं। गंभीर मामलों में, इन प्रभावों के कारण तेजी से अवस्थिति, अलस्वास, अचेतनता या मृत्यु हो सकती है। कार्बन टेट्राक्लोराइड के अनुभव के कारण दिल के धड़कन के अस्थायी या बंद हो सकते हैं। रसायन आंखों के संपर्क में आने पर आंखों को नुकसान पहुंचा सकता है। जब कार्बन टेट्राक्लोराइड हवा में छोड़ दिया जाता है, तो यह वातावरण में उठकर ओजोन परत को कम कर देता है। ओजोन परत के कम होने के कारण मानव उपचार के लिए अतिरिक्त अल्ट्रावॉल्टा रेडियों के विरुद्ध अतिरिक्त त्वचा कैंसर, आंख के रोग और विकार, और संभावित इम्यून प्रणाली के विघटन के कारण बढ़ सकते हैं।
6.8.6 प,प’-डाइक्लोरोडीफेनिलट्राइक्लोरोएथेन (डीडीटी)
डीडीटी, पहला क्लोरीनिकरण अनॉर्गेनिक कीटनाशक, 1873 में पहली बार तैयार किया गया था, लेकिन तकनीकी रूप से इसके कीटनाशक गुण की खोज 1939 में स्विट्जरलैंड के जीईई फार्मास्यूटिकल कंपनी के पॉल मुलर द्वारा की गई थी। पॉल मुलर को 1948 में चिकित्सा और शारीरिक विज्ञान के नोबेल पुरस्कार के लिए इस खोज के लिए चुना गया था। द्वितीय विश्व युद्ध के बाद डीडीटी के उपयोग का वैश्विक स्तर पर बहुत बड़ा वृद्धि हुई, जिसके मुख्य कारण इसके मलेरिया फैलाने वाले मच्छर और टाइफस फैलाने वाले कीड़ों के खिलाफ अप्रतिरोधी गुण थे। हालांकि, डीडीटी के व्यापक उपयोग से संबंधित समस्याएं 1940 के दूसरे दशक के अंत में शुरू हो गई। कई कीटों ने डीडीटी के प्रति प्रतिरोध विकसित कर लिया, और इसके अतिरिक्त इसके मछलियों के प्रति उच्च जहरीलापन के बारे में भी पता चला। डीडीटी की रासायनिक स्थायिता और वसा में घुलनशीलता इस समस्या को और भी गंभीर बना दिया। डीडीटी के जानवरों द्वारा बहुत तेजी से बचाव नहीं होता, बजाए इसके यह वसा ऊतक में जमा और संग्रहीत हो जाता है। यदि खाद्य ग्रहणन एक स्थिर दर पर जारी रहता है, तो डीडीटी जानवर में समय के साथ जमा हो जाता है। डीडीटी के उपयोग को 1973 में संयुक्त राज्य अमेरिका में बैन कर दिया गया था, लेकिन यह कुछ अन्य भागों में अभी भी उपयोग में है।

सारांश
अल्किल/एरिल हैलाइड एक, दो या अधिक हैलोजन परमाणु उनके संरचना में उपस्थित होने पर एकल, द्विहैलोजन (त्रिहैलोजन, चतुरहैलोजन, आदि) यौगिक के रूप में वर्गीकृत किए जा सकते हैं। कारण हैलोजन परमाणु कार्बन की तुलना में अधिक विद्युत ऋणात्मक होते हैं, अल्किल हैलाइड के कार्बन-हैलोजन बंध ध्रुवीकृत होते हैं; कार्बन परमाणु पर आंशिक धनावेश और हैलोजन परमाणु पर आंशिक ऋणावेश होता है।
अल्किल हैलाइड एल्केन के मुक्त अपघटन जलना द्वारा, एल्कीन के साथ हैलोजन अम्ल के योग, एल्कोहल के $-{OH}$ समूह को हैलोजन से प्रतिस्थापित करके फॉस्फोरस हैलाइड, थियोनिल क्लोराइड या हैलोजन अम्ल का उपयोग करके तैयार किए जाते हैं। ऐरिल हैलाइड ऐरीन के इलेक्ट्रोफिलिक प्रतिस्थापन द्वारा तैयार किए जाते हैं। फ्लूओराइड और आयोडाइड को हैलोजन आदान-प्रदान विधि द्वारा सबसे अच्छा तैयार किया जाता है।
ऑर्गैनोहैलोजन यौगिकों के क्वथनांक संगत हाइड्रोकार्बन के तुलना में अधिक होते हैं क्योंकि उनमें मजबूत डाइपोल-डाइपोल और वैन डर वाल्स आकर्षण बल होते हैं। ये पानी में थोड़ा घुलनशील होते हैं लेकिन ऑर्गैनिक विलायक में पूर्ण रूप से घुलनशील होते हैं।
कार्बन-हैलोजन बंध की ध्रुवता एल्किल हैलाइड के न्यूक्लिओफिलिक स्थानांतरण, उत्सर्जन एवं धातु परमाणुओं के साथ अभिक्रिया के माध्यम से ऑर्गैनोमेटलिक यौगिकों के निर्माण के लिए उत्तरदायी है। न्यूक्लिओफिलिक स्थानांतरण अभिक्रियाओं को उनके विपुत गुणों के आधार पर ${S_{N}} 1$ और ${S_{N}} 2$ में वर्गीकृत किया जाता है। अनुमति ${S_{N}} 1$ और ${S_{N}} 2$ अभिक्रियाओं के अभिक्रिया यांत्रिकी को समझने में गहरा योगदान देती है। ${S_{N}} 2$ अभिक्रियाओं में चिरल एल्किल हैलाइड के लिए अभिक्रिया की विनिमय अभिक्रिया विन्यास के विपरीत होता है जबकि ${S_{N}} 1$ अभिक्रियाओं में रेसेमीकरण विशेषता होती है।
कई पॉलीहैलोजन यौगिक, जैसे कि डाइक्लोरोमेथेन, क्लोरोफॉर्म, आयोडोफॉर्म, कार्बन टेट्राक्लोराइड, फ्रीऑन और डीडीटी के कई औद्योगिक उपयोग हैं। हालांकि, इन यौगिकों में से कुछ आसानी से विघटित नहीं हो सकते और वातावरण के लिए खतरनाक हो सकते हैं, जैसे कि ओजोन परत के नुकसान का कारण बन सकते हैं।






