अध्याय 08 रेडॉक्स अभिक्रियाएं
“जहां ऑक्सीकरण होता है, वहां हमेशा अपचयन भी होता है। रसायन विज्ञान मूल रूप से रेडॉक्स प्रणालियों के अध्ययन का अध्ययन है।”
रसायन विज्ञान विभिन्न पदार्थों और एक पदार्थ के दूसरे पदार्थ में परिवर्तन के अध्ययन के बारे में है। एक पदार्थ से दूसरे पदार्थ में पदार्थ के परिवर्तन विभिन्न प्रकार की अभिक्रियाओं के माध्यम से होता है। इस प्रकार की अभिक्रियाओं की एक महत्वपूर्ण श्रेणी रेडॉक्स अभिक्रियाएं हैं। रेडॉक्स अभिक्रियाओं के साथ-साथ भौतिक और जैविक घटनाएं भी संबंधित होती हैं। ये अभिक्रियाएं औषधीय, जैविक, औद्योगिक, खनिज और कृषि क्षेत्रों में व्यापक रूप से उपयोग में लाई जाती हैं। इन अभिक्रियाओं की महत्वता इस तथ्य से स्पष्ट होती है कि घरेलू, परिवहन और अन्य व्यापारिक उद्देश्यों के लिए ऊर्जा प्राप्त करने के लिए विभिन्न प्रकार के ईंधन के जलने, उच्च प्रतिस्पर्धी धातु और अधातुओं के निस्पत्ति के लिए विद्युत रासायनिक प्रक्रम, कास्टिक सोडा जैसे रासायनिक यौगिकों के निर्माण, सूखे और नम बैटरी के संचालन और धातुओं के विरोधाभास के अंतर्गत रेडॉक्स प्रक्रमों के अंतर्गत आते हैं। हाल के वर्षों में, हाइड्रोजन अर्थव्यवस्था (तरल हाइड्रोजन के रूप में ईंधन का उपयोग) और ‘ओजोन छेद’ के विकास जैसे पर्यावरण संबंधी मुद्दे रेडॉक्स घटनाओं के अंतर्गत आने लगे हैं।
8.1 रेडॉक्स अभिक्रियाओं की क्लासिकल धारणा - ऑक्सीकरण और अपचायन अभिक्रियाएं
प्रारंभ में, “ऑक्सीकरण” शब्द का उपयोग एक तत्व या यौगिक में ऑक्सीजन के योग के वर्णन के लिए किया जाता था। वातावरण में डाइऑक्सीजन की उपस्थिति के कारण (20%) कई तत्व इसके साथ संयोजित हो जाते हैं और इसी कारण वे पृथ्वी पर अपने ऑक्साइड के रूप में आमतौर पर पाए जाते हैं। नीचे दिए गए अभिक्रियाएं ऑक्सीकरण की सीमित परिभाषा के अनुसार ऑक्सीकरण प्रक्रियाओं को प्रस्तुत करती हैं:
$$2 \mathrm{Mg}(\mathrm{s})+\mathrm{O_2}(\mathrm{~g}) \rightarrow 2 \mathrm{MgO}(\mathrm{s}) \tag{8.1}$$
$$\mathrm{S}(\mathrm{s})+\mathrm{O_2}(\mathrm{~g}) \rightarrow \mathrm{SO_2}(\mathrm{~g}) \tag{8.2}$$
अभिक्रिया (8.1) और (8.2) में, मैग्नीशियम और सल्फर तत्वों में ऑक्सीजन के योग से ऑक्सीकृत होते हैं। इसी तरह, मेथेन ऑक्सीजन के योग के कारण ऑक्सीकृत होता है।
$$\mathrm{CH} _{4}(\mathrm{~g})+2 \mathrm{O} _{2}(\mathrm{~g}) \rightarrow \mathrm{CO} _{2}(\mathrm{~g})+2 \mathrm{H} _{2} \mathrm{O}(\mathrm{l}) \tag{7.3}$$
अभिक्रिया (8.3) के ध्यानपूर्वक अध्ययन से, जहाँ हाइड्रोजन के स्थान पर ऑक्सीजन है, रसायनशास्त्रियों को ऑक्सीकरण के अर्थ को हाइड्रोजन के अपसारण के रूप में परिभाषित करने के लिए प्रेरित किया गया। इसलिए, ऑक्सीकरण शब्द के विस्तार के लिए एक वस्तु से हाइड्रोजन के अपसारण को शामिल कर लिया गया। नीचे दिया गया उदाहरण एक अभिक्रिया है जहाँ हाइड्रोजन के अपसारण को ऑक्सीकरण अभिक्रिया के रूप में भी देखा जा सकता है।
$$ \begin{equation*} 2 \mathrm{H_2} \mathrm{~S}(\mathrm{~g})+\mathrm{O_2}(\mathrm{~g}) \rightarrow 2 \mathrm{~S}(\mathrm{~s})+2 \mathrm{H_2} \mathrm{O}(\mathrm{l}) \tag{8.4} \end{equation*} $$
जैसे-जैसे रसायनज्ञों के ज्ञान में वृद्धि हुई, इसके लिए आसानी से अभिक्रियाओं (7.1 से 7.4) के लिए ऑक्सीकरण शब्द को विस्तारित करना प्राकृतिक था, जो ऑक्सीजन के बिना अन्य विद्युत ऋणात्मक तत्वों के साथ अभिक्रिया करती हैं। मैग्नीशियम के फ्लूओरीन, क्लोरीन और सल्फर आदि के साथ ऑक्सीकरण निम्नलिखित अभिक्रियाओं के अनुसार होता है :
$$\operatorname{Mg}(\mathrm{s})+\mathrm{F_2} (\mathrm{~g}) \rightarrow \operatorname{MgF_2} (s) \tag{8.5}$$
$$\mathrm{Mg}(\mathrm{s})+\mathrm{Cl_2} (g) \rightarrow \mathrm{MgCl_2} (s) \tag{8.6}$$
$$\mathrm{Mg}(\mathrm{s})+\mathrm{S} (s) \rightarrow \operatorname{MgS}(\mathrm{s}) \tag{8.7}$$
अभिक्रिया 7.5 से 7.7 के अंतर्गत ऑक्सीकरण अभिक्रियाओं के ढांचे में शामिल करने से रसायन विशेषज्ञों को अब न केवल हाइड्रोजन के अपसारण को ऑक्सीकरण मानने के अलावा, धनात्मक विद्युत धारित तत्वों के अपसारण को भी ऑक्सीकरण मानने के लिए प्रेरित किया गया। इस प्रकार अभिक्रिया :
$$ 2 \mathrm{~K_4} \left[ \mathrm{Fe} ( \mathrm{CN})_{6} \right] ( \mathrm{aq}) + \mathrm{H_2} \mathrm{O_2} ( \mathrm{aq}) \rightarrow 2 \mathrm{~K_3} \left[\mathrm{Fe}( \mathrm{CN})_6 \right] ( \mathrm{aq}) + 2 \mathrm{KOH} ( \mathrm{aq}) $$
$$
कार्बनेट फेरोसाइएनाइड से पोटेशियम फेर्रिसाइएनाइड में बदलने से पहले पोटेशियम के अपसार के कारण यह ऑक्सीकरण के रूप में व्याख्यान किया जाता है। सारांश के रूप में, “ऑक्सीकरण” शब्द को एक पदार्थ में ऑक्सीजन/इलेक्ट्रोनेगेटिव तत्व के जोड़ के रूप में परिभाषित किया जाता है या एक पदार्थ में हाइड्रोजन/इलेक्ट्रोपॉजिटिव तत्व के अपसार के रूप में।
आरंभ में, अपचयन को एक यौगिक से ऑक्सीजन के अपसार के रूप में विचार किया जाता था। हालांकि, आजकल “अपचयन” शब्द को विस्तारित कर दिया गया है ताकि एक पदार्थ में ऑक्सीजन/इलेक्ट्रोनेगेटिव तत्व के अपसार या हाइड्रोजन/इलेक्ट्रोपॉजिटिव तत्व के जोड़ के रूप में शामिल किया जा सके।
ऊपर दिए गए परिभाषा के आधार पर, निम्नलिखित अपचायक प्रक्रियाओं के उदाहरण हैं:
$$2 \mathrm{HgO}(\mathrm{s}) \xrightarrow{\Delta} 2 \mathrm{Hg}(\mathrm{l})+\mathrm{O_2}(\mathrm{~g}) \tag{8.8}$$
(सीसा ऑक्साइड से ऑक्सीजन के अपसारण)
$$2 \mathrm{FeCl_3}(\mathrm{aq})+\mathrm{H_2}(\mathrm{~g}) \rightarrow 2 \mathrm{FeCl_2}(\mathrm{aq})+2 \mathrm{HCl}(\mathrm{aq}) \tag{8.9}$$
(फेरिक क्लोराइड से विद्युत ऋणात्मक तत्व, क्लोरीन के अपसारण)
$$\mathrm{CH_2}=\mathrm{CH_2}(\mathrm{~g})+\mathrm{H_2}(\mathrm{~g}) \rightarrow \mathrm{H_3} \mathrm{C}-\mathrm{CH_3}(\mathrm{~g})\tag{8.10}$$
(हाइड्रोजन के योग)
$$2 \mathrm{HgCl_2}(\mathrm{aq})+\mathrm{SnCl_2}(\mathrm{aq}) \rightarrow \mathrm{Hg_2} \mathrm{Cl_2}(\mathrm{~s})+\mathrm{SnCl_4}(\mathrm{aq})\tag{8.11}$$
(मर्करी के अतिरिक्त एक मर्करिक क्लोराइड में)
अभिक्रिया (8.11) में साथ ही स्टैनोस क्लोराइड के ऑक्सीकरण करके स्टैनिक क्लोराइड के निर्माण की घटना भी हो रही है क्योंकि इसमें विद्युत ऋणात्मक तत्व क्लोरीन के योग हो रहा है। इसके तुरंत पहले ही यह देखा गया कि ऑक्सीकरण और अपचयन हमेशा एक साथ होते हैं (ऊपर दिए गए सभी समीकरणों को फिर से देखकर यह स्पष्ट हो जाएगा), इसलिए इस प्रकार की रासायनिक अभिक्रियाओं के लिए “रेडॉक्स” शब्द बनाया गया।
समस्या 8.1
नीचे दिए गए अभिक्रियाओं में, ऑक्सीकरण और अपचयन कर रहे अपवर्जी अणुओं की पहचान करें:
(i) $\mathrm{H_2} \mathrm{~S}$ (g) $+\mathrm{Cl_2}$ (g) $\rightarrow 2 \mathrm{HCl}$ (g) $+\mathrm{S}$ (s)
(ii) $3 \mathrm{Fe_3} \mathrm{O_4}$ (s) $+8 \mathrm{Al}$ (s) $\rightarrow 9 \mathrm{Fe}$ (s) $+4 \mathrm{Al_2} \mathrm{O_3}(\mathrm{~s})$
(iii) $2 \mathrm{Na}$ (s) $+\mathrm{H_2}$ (g) $\rightarrow 2 \mathrm{NaH}$ (s)
हल
(i) $\mathrm{H_2} \mathrm{~S}$ ऑक्सीकृत होता है क्योंकि हाइड्रोजन के लिए अधिक विद्युत ऋणात्मक तत्व, क्लोरीन, हाइड्रोजन के साथ जुड़ गया है (या सल्फर के लिए अधिक विद्युत धनात्मक तत्व, हाइड्रोजन, सल्फर से हट गया है)। क्लोरीन अपचयित होता है क्योंकि इसमें हाइड्रोजन के जुड़े होने के कारण।
(ii) एल्यूमीनियम ऑक्सीकृत होता है क्योंकि ऑक्सीजन इसमें मिल जाती है। लौह लौह ऑक्साइड $\left(\mathrm{Fe_3} \mathrm{O_4}\right)$ अपचयित होता है क्योंकि इसमें ऑक्सीजन को निकाल लिया गया है।
(iii) इलेक्ट्रोनगेटिवता के अवधारणा के साथ ध्यानपूर्वक अनुप्रयोग करके ही हम यह निष्कर्ष निकाल सकते हैं कि सोडियम ऑक्सीकृत होता है और हाइड्रोजन अपचयित होता है।
इस अभिक्रिया (iii) के चयन से हमें रेडॉक्स अभिक्रियाओं को एक अन्य तरीके से परिभाषित करने के लिए सोचने के लिए प्रेरित किया जाता है।
8.2 इलेक्ट्रॉन परिवहन अभिक्रियाओं के अनुसार रेडॉक्स अभिक्रियाएँ
हम पहले से ही सीख चुके हैं कि अभिक्रियाएँ रेडॉक्स अभिक्रियाएँ हैं क्योंकि इन अभिक्रियाओं में से प्रत्येक में सोडियम के ऑक्सीकरण के कारण ऑक्सीजन या अधिक इलेक्ट्रोनगेटिव तत्व के जोड़ने से सोडियम ऑक्सीकृत होता है।
$$2 \mathrm{Na}(\mathrm{s})+\mathrm{Cl_2}(\mathrm{~g}) \rightarrow 2 \mathrm{NaCl}(\mathrm{s})\tag{8.12}$$
$$4 \mathrm{Na}(\mathrm{s})+\mathrm{O_2}(\mathrm{~g}) \rightarrow 2 \mathrm{Na_2} \mathrm{O}(\mathrm{s})\tag{8.13}$$
$$2 \mathrm{Na}(\mathrm{s})+\mathrm{S}(\mathrm{s}) \rightarrow \mathrm{Na_2} \mathrm{~S}(\mathrm{~s}) \tag{8.14}$$
साथ ही, क्लोरीन, ऑक्सीजन और सल्फर कम हो जाते हैं क्योंकि इनमें से प्रत्येक में विद्युत धनात्मक तत्व सोडियम को जोड़ दिया गया है। हमारे रासायनिक बंधन के ज्ञान से हम भी जानते हैं कि सोडियम क्लोराइड, सोडियम ऑक्साइड और सोडियम सल्फाइड आयनिक यौगिक हैं और शायद बेहतर रूप से लिखे जा सकते हैं के रूप में $\mathrm{Na}^{+} \mathrm{Cl}^{-}( \mathrm{s}),\left(\mathrm{Na}^{+} \right)_2 \mathrm{O}^{2-}( \mathrm{s})$, और $ \left(\mathrm{Na}^{+} \right)_2$ $\mathrm{S}^{2-}( \mathrm{s})$. उत्पादित विशिष्टताओं पर आवेश के विकास से हमें अनुमान लगाने के लिए अभिक्रियाओं (8.12 से 8 तक 8.14) को निम्नलिखित रूप में लिखने के लिए प्रेरित करता है:
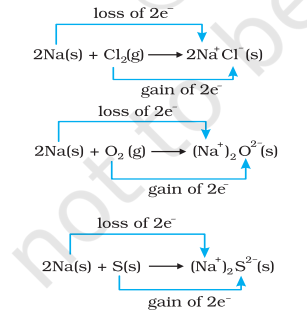
आसानी के लिए, उपरोक्त प्रक्रियाओं में से प्रत्येक को दो अलग-अलग चरणों के रूप में विचार किया जा सकता है, एक में इलेक्ट्रॉनों के नुकसान और दूसरे में इलेक्ट्रॉनों के लाभ। उदाहरण के लिए, हम इनमें से एक को और विस्तार से समझ सकते हैं, जैसे कि सोडियम क्लोराइड के निर्माण।
$2 \mathrm{Na}(\mathrm{s}) \rightarrow 2 \mathrm{Na}^{+}(\mathrm{g})+2 \mathrm{e}^{-}$
$\mathrm{Cl_2}(\mathrm{~g})+2 \mathrm{e}^{-} \rightarrow 2 \mathrm{Cl}^{-}(\mathrm{g})$
ऊपर के प्रत्येक कदम को आधा अभिक्रिया कहा जाता है, जो इलेक्ट्रॉन के भाग लेने को विशिष्ट रूप से दर्शाता है। आधा अभिक्रिया के योग से समग्र अभिक्रिया प्राप्त होती है :
$2 \mathrm{Na}(\mathrm{s})+\mathrm{Cl_2}(\mathrm{~g}) \rightarrow 2 \mathrm{Na}^{+} \mathrm{Cl}^{-}(\mathrm{s})$ या $2 \mathrm{NaCl}(\mathrm{s})$
अभिक्रिया 8.12 से 8.14 तक से स्पष्ट होता है कि इलेक्ट्रॉन के नुकसान वाली आधा अभिक्रियाओं को ऑक्सीकरण अभिक्रिया कहा जाता है। इसी तरह, इलेक्ट्रॉन के लाभ वाली आधा अभिक्रियाओं को अपचयन अभिक्रिया कहा जाता है। यहां यह भी बताना उचित नहीं होगा कि ऑक्सीकरण और अपचयन के नए तरीके की परिभाषा केवल क्लासिक विचार के अनुसार विविध प्रकार के विस्तार के बीच संबंध की स्थापना के बाद ही संभव हुई है। अभिक्रिया (8.12 से 8.14) में, जो ऑक्सीकृत होता है, सोडियम, इलेक्ट्रॉन देकर अपने साथ अंतरक्रिया करने वाले प्रत्येक तत्व को अपचयित करने में सहायता करता है इसलिए एक अपचायक एजेंट के रूप में कार्य करता है। क्लोरीन, ऑक्सीजन और सल्फर अपचयित होते हैं और ऑक्सीकारक एजेंट के रूप में कार्य करते हैं क्योंकि ये सोडियम से इलेक्ट्रॉन ग्रहण करते हैं। संक्षेप में, हम बता सकते हैं कि
उपचयन : किसी भी पदार्थ द्वारा इलेक्ट्रॉन (इलेक्ट्रॉनों) के नुकसान के कारण।
अपचयन : किसी भी पदार्थ द्वारा इलेक्ट्रॉन (इलेक्ट्रॉनों) के लाभ के कारण।
उपचयक : इलेक्ट्रॉन (इलेक्ट्रॉनों) के स्वीकारक।
अपचयक : इलेकट्रॉन (इलेक्ट्रॉनों) के दाता।
समस्या 8.2
समझाइए कि अभिक्रिया: $2 \mathrm{Na}(\mathrm{s})+\mathrm{H_2}(\mathrm{~g}) \rightarrow 2 \mathrm{NaH}$ (s) एक रेडॉक्स परिवर्तन है।
हल
ऊपर दी गई अभिक्रिया में बना यौगिक आयनिक यौगिक है, जिसे भी $\mathrm{Na}^{+} \mathrm{H}^{-}$(s) के रूप में दर्शाया जा सकता है, इससे इस प्रक्रिया में एक आधा अभिक्रिया इस प्रकार हो सकती है:
$2 \mathrm{Na}(\mathrm{s}) \quad \rightarrow 2 \mathrm{Na}^{+}(\mathrm{g})+2 \mathrm{e}^{-}$
और दूसरा आधा अभिक्रिया यह है:
$\mathrm{H_2}(\mathrm{~g})+2 \mathrm{e}^{-} \rightarrow 2 \mathrm{H}^{-}(\mathrm{g})$
इस अभिक्रिया को दो आधी अभिक्रियाओं में विभाजित करने से स्पष्ट हो जाता है कि यहाँ सोडियम ऑक्सीकृत हो रहा है और हाइड्रोजन अपचयित हो रहा है, इसलिए पूर्ण अभिक्रिया एक रेडॉक्स परिवर्तन है।
8.2.1 प्रतिस्पर्धात्मक इलेक्ट्रॉन स्थानांतरण अभिक्रियाएँ
चित्र 8.1 में दिखाए गए अनुसार एक धातु जिंक की बैंड को कॉपर नाइट्रेट के जलीय घोल में रखें और लगभग एक घंटा तक छोड़ दें। आप ध्यान दें सकते हैं कि बैंड लाल धातु कॉपर के साथ ढक जाता है और घोल के नीले रंग का अपसर चल जाता है। घोल में $\mathrm{Cu}^{2+}$ के कारण नीला रंग चल जाने पर $\mathrm{Zn}^{2+}$ आयनों के निर्माण के बारे में आसानी से निर्णय लिया जा सकता है। यदि हाइड्रोजन सल्फाइड गैस को रंगहीन घोल में $\mathrm{Zn}^{2+}$ आयनों के साथ प्रवाहित किया जाए तो अमोनिया के साथ घोल को क्षारीय बनाने पर श्वेत जिंक सल्फाइड, $\mathrm{ZnS}$ के उत्पादन को देखा जा सकता है।
स्थायी जिंक और कॉपर नाइट्रेट के जलीय घोल के बीच अभिक्रिया निम्नलिखित है :
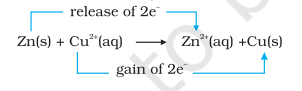
$$\mathrm{Zn}(\mathrm{s})+\mathrm{Cu}^{2+}(\mathrm{aq}) \rightarrow \mathrm{Zn}^{2+}(\mathrm{aq})+\mathrm{Cu}(\mathrm{s}) \tag{8.15}$$
अभिक्रिया (8.15) में, जिंक इलेक्ट्रॉन खोकर $Zn^{2+}$ के रूप में बन गया है और इसलिए जिंक ऑक्सीकृत हो गया है। स्पष्ट रूप से, अब यदि जिंक ऑक्सीकृत हो रहा है और इलेक्ट्रॉन छोड़ रहा है, तो कुछ चीज इलेक्ट्रॉन ग्रहण करके अपचयित हो रही होनी चाहिए। कॉपर आयन जिंक से इलेक्ट्रॉन प्राप्त करके अपचयित हो जाते हैं।
अभिक्रिया (8.15) को इस प्रकार भी लिखा जा सकता है:
इस स्तर पर हम अभिक्रिया (8.15) के लिए साम्यावस्था की अवस्था की जांच कर सकते हैं। इसके लिए हम एक धातु कॉपर की एक छड़ को जिंक सल्फेट विलयन में रखते हैं। कोई दृश्य अभिक्रिया नहीं दिखाई देती और हम विलयन में $\mathrm{Cu}^{2+}$ आयनों की उपस्थिति को पता लगाने के लिए विलयन में $\mathrm{H_2} \mathrm{~S}$ गैस प्रवाहित करते हैं जिससे कॉपर सल्फाइड, CuS के काले रंग के उत्पाद के निर्माण के लिए प्रयास करते हैं लेकिन यह असफल रहता है। कॉपर सल्फाइड इतना कम विलेय होता है कि यह एक बहुत संवेदनशील परीक्षण होता है; फिर भी $\mathrm{Cu}^{2+}$ के उत्पादित अंश का पता लगाया नहीं जा सकता। इसलिए हम निष्कर्ष निकालते हैं कि अभिक्रिया (8.15) के लिए साम्यावस्था उत्पादों के प्रति अभिकर्मकों की तुलना में बहुत अधिक पक्षपाती होती है।
अब हम इलेक्ट्रॉन परिवहन अभिक्रिया को तांबा धातु और जल में सिल्वर नाइट्रेट विलयन तक विस्तारित करते हैं और चित्र 8.2 में दिखाए गए सेट-अप को व्यवस्थित करते हैं। अभिक्रिया के कारण $\mathrm{Cu}^{2+}$ आयनों के निर्माण के कारण विलयन नीला रंग ले लेता है:
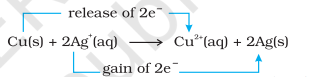
यहाँ, $\mathrm{Cu}(\mathrm{s})$ को $\mathrm{Cu}^{2+}(\mathrm{aq})$ में ऑक्सीकृत किया जाता है और $\mathrm{Ag}^{+}(\mathrm{aq})$ को $\mathrm{Ag}(\mathrm{s})$ में अपचयित किया जाता है। साम्य उत्पाद $\mathrm{Cu}^{2+}(\mathrm{aq})$ और $\mathrm{Ag}(\mathrm{s})$ के अनुकूल है।
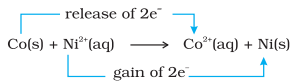
किसी अन्य तुलना के रूप में, चालक एक और तुलना करते हैं जहां धात्विक कोबाल्ट निकल सल्फेट विलयन में रखा जाता है। यहां होने वाली अभिक्रिया निम्नलिखित है :

चित्र 8.1 एक बीकर में जिंक और सिल्वर नाइट्रेट के जलीय घोल के बीच रेडॉक्स अभिक्रिया।
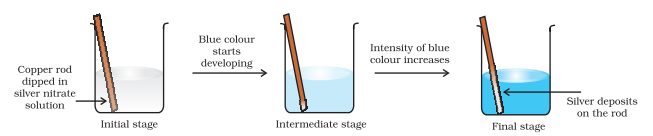
चित्र 8.2 एक बीकर में कॉपर और सिल्वर नाइट्रेट के जलीय घोल के बीच रेडॉक्स अभिक्रिया
संतुलन पर, रासायनिक परीक्षण दर्शाते हैं कि दोनों $\mathrm{Ni}^{2+}(\mathrm{aq})$ और $\mathrm{Co}^{2+}(\mathrm{aq})$ मध्यम सांद्रता में उपस्थित हैं। इस स्थिति में, अभिकर्मक $\left[\mathrm{Co}(\mathrm{s})\right.$ और $\left.\mathrm{Ni}^{2+}(\mathrm{aq})\right]$ या उत्पाद $\left[\mathrm{Co}^{3+}(\mathrm{aq})\right.$ और $\left.\mathrm{Ni}(\mathrm{s})\right]$ दोनों बहुत अधिक प्रभावित नहीं हैं।
इलेक्ट्रॉन विमुक्ति के विस्तार के लिए प्रतियोगिता अम्लों के बीच प्रोटॉन विमुक्ति के लिए प्रतियोगिता के साथ तुलना करती है। इस समानता से हम यह अनुमान लगा सकते हैं कि हम एक ऐसे तालिका के विकास के लिए तैयार हैं जिसमें धातुएँ और उनके आयन अपनी इलेक्ट्रॉन विमुक्ति की प्रवृत्ति के आधार पर सूचीबद्ध होंगे, जैसे कि हम अम्लों के मामले में करते हैं ताकि अम्ल की क्षमता को दर्शाया जा सके। वास्तव में हमने इसकी कुछ तुलना कर चुके हैं। तुलना के माध्यम से हम जान गए हैं कि जिंक कॉपर को इलेक्ट्रॉन देता है और कॉपर सिल्वर को इलेकट्रॉन देता है और इसलिए धातुओं की इलेक्ट्रॉन विमुक्ति की प्रवृत्ति क्रम में होती है: $\mathrm{Zn}>\mathrm{Cu}>\mathrm{Ag}$. हम अपनी सूची को और विस्तारित करना चाहेंगे और धातु गतिशीलता श्रेणी या विद्युतरसायनिक श्रेणी बनाना चाहेंगे। विभिन्न धातुओं के बीच इलेक्ट्रॉन के लिए प्रतियोगिता हमें गैल्वैनिक सेल के एक श्रेणी के डिज़ाइन में सहायता करती है जिसमें रासायनिक अभिक्रियाएँ विद्युत ऊर्जा के स्रोत बन जाती हैं। हम कक्षा XII में इन सेलों के बारे में अधिक अध्ययन करेंगे।
8.3 ऑक्सीकरण संख्या
इलेक्ट्रॉन परिवहन का एक कम ज्ञात उदाहरण जब हाइड्रोजन ऑक्सीजन के साथ संयोजित होकर जल बनाता है, तब होता है:
$$2 \mathrm{H_2}(\mathrm{~g})+\mathrm{O_2}(\mathrm{~g}) \rightarrow 2 \mathrm{H_2} \mathrm{O}(\mathrm{l})\tag{8.18}$$
हालांकि इसकी विधि सरल नहीं है, लेकिन हम $\mathrm{H}$ परमाणु को $\mathrm{H_2}$ में उदासीन (शून्य) अवस्था से $\mathrm{H_2} \mathrm{O}$ में धनात्मक अवस्था में बदले जाने के रूप में कल्पना कर सकते हैं, जबकि $\mathrm{O}$ परमाणु $\mathrm{O_2}$ में शून्य अवस्था से $\mathrm{H_2} \mathrm{O}$ में दुनिया ऋणात्मक अवस्था में बदल जाता है। मान लीजिए कि $\mathrm{H}$ से $\mathrm{O}$ में इलेक्ट्रॉन परिवहन होता है और इसलिए $\mathrm{H_2}$ ऑक्सीकृत हो जाता है और $\mathrm{O_2}$ अपचयित हो जाता है।
हालांकि, बाद में हम देखेंगे कि आवेश परिवहन केवल आंशिक होता है और यह शायद एक इलेक्ट्रॉन विस्थापन के रूप में बेहतर वर्णित किया जा सकता है, जबकि $\mathrm{H}$ द्वारा इलेक्ट्रॉन का पूर्ण खोना और O द्वारा इलेक्ट्रॉन का प्राप्त करना नहीं होता। इस बात के संदर्भ में विवरण (8.18) के संबंध में कहा गया है कि यह एक अच्छी संख्या में अन्य अभिक्रियाओं के लिए भी सत्य हो सकता है, जिनमें सहसंयोजक यौगिकों की शामिल होती है। इस श्रेणी की दो ऐसी उदाहरण हैं:
$$\mathrm{H_2}(\mathrm{~s})+\mathrm{Cl_2}(\mathrm{~g}) \rightarrow 2 \mathrm{HCl}(\mathrm{g})\tag{8.19}$$
और,
$$\mathrm{CH_4}(\mathrm{~g})+4 \mathrm{Cl_2}(\mathrm{~g}) \rightarrow \mathrm{CCl_4}(\mathrm{l})+4 \mathrm{HCl}(\mathrm{g})\tag{8.20}$$
अतिरिक्त इलेक्ट्रॉन विस्थापन के लेखन के लिए एक अधिक प्रायोगिक विधि विकसित की गई है। इस विधि में, हमेशा यह माना जाता है कि कम विद्युत ऋणात्मक अणु से अधिक विद्युत ऋणात्मक अणु में इलेक्ट्रॉन का पूर्ण अंतरण होता है। उदाहरण के लिए, हम समीकरण (8.18 से 8.20) को लिखते हैं ताकि प्रत्येक अणु के आवेश को दिखाया जा सके :
$$ \begin{array}{cccc} 2 \stackrel{0}{\mathrm{H_2}}(\mathrm{~g}) + \stackrel{0}{\mathrm{O_2}}(\mathrm{~g}) & \rightarrow & 2 \stackrel{+1}{\mathrm{H_2}} \stackrel{-2}{\mathrm{O}}(\mathrm{l}) \tag{8.21}
\end{array} $$
$$ \begin{array}{llll} \stackrel {0}{\mathrm{H_2}}(\mathrm{~s}) + \stackrel{0}{\mathrm{Cl_2}}(\mathrm{~g}) & \rightarrow & 2 \stackrel{+1-1}{\mathrm{HCl}}(\mathrm{g}) \tag{8.22} \end{array} $$
$$ \begin{array}{cccc} \stackrel{-4 +1}{\mathrm{CH_4}}(\mathrm{~g}) + & 4 \stackrel{0}{\mathrm{Cl_2}}(\mathrm{~g}) \rightarrow & \stack \stackrel{+4 -1}{\mathrm{C}\mathrm{Cl_4}} (\mathrm{l})+4 \stackrel{+1 -1 }{\mathrm{H } \mathrm{Cl}} (\mathrm{g})\tag{8.23} \end{array} $$
उल्लेखनीय है कि इलेक्ट्रॉन परिवहन के अनुमान केवल बुक कीपिंग के उद्देश्य के लिए किया जाता है और इकाई के बाद चरण में यह स्पष्ट हो जाएगा कि यह रेडॉक्स अभिक्रियाओं के सरल वर्णन के लिए जाता है।
ऑक्सीकरण संख्या एक यौगिक में एक तत्व के ऑक्सीकरण अवस्था को बताती है, जो एक नियमों के आधार पर निर्धारित की जाती है, जो यह मानते हुए बनाए गए हैं कि सहसंयोजक बंध में इलेक्ट्रॉन युग्म अधिक विद्युत ऋणात्मक तत्व के पूरी तरह से स्वामी होता है।
एक यौगिक/आयन में आसानी से यह याद रखना या निर्धारित करना कि कौन सा तत्व दूसरे तत्व की तुलना में अधिक विद्युत ऋणात्मक है, हमेशा संभव नहीं होता। इसलिए, एक सेट नियमों के निर्माण के लिए एक यौगिक/आयन में एक तत्व की ऑक्सीकरण संख्या निर्धारित करने के लिए नियम बनाए गए हैं। यदि एक यौगिक/आयन में एक तत्व के दो या दो से अधिक परमाणु उपस्थित हों, जैसे $\mathrm{Na_2} \mathrm{~S_2} \mathrm{O_3} / \mathrm{Cr_2} \mathrm{O_7}^{2-}$, तो उस तत्व के परमाणु की ऑक्सीकरण संख्या उस तत्व के सभी परमाणुओं की ऑक्सीकरण संख्या के औसत के बराबर होगी। इस चरण में हम ऑक्सीकरण संख्या की गणना के लिए नियम बता सकते हैं। ये नियम हैं:
1. तत्वों में, मुक्त या संयोजन अवस्था में, प्रत्येक परमाणु के ऑक्सीकरण संख्या शून्य होती है। स्पष्ट रूप से $\mathrm{H_2}, \mathrm{O_2}, \mathrm{Cl_2}, \mathrm{O_3}, \mathrm{P_4}, \mathrm{~S_8}, \mathrm{Na}, \mathrm{Mg}, \mathrm{Al}$ में प्रत्येक परमाणु के ऑक्सीकरण संख्या शून्य होती है।
2. एक एकल परमाणु से बने आयनों के लिए, ऑक्सीकरण संख्या आयन पर आवेश के बराबर होती है। इसलिए $\mathrm{Na}^{+}$ आयन के ऑक्सीकरण संख्या $+1$, $\mathrm{Mg}^{2+}$ आयन के ऑक्सीकरण संख्या $+2$, $\mathrm{Fe}^{3+}$ आयन के ऑक्सीकरण संख्या +3, $\mathrm{Cl}^{-}$ आयन के ऑक्सीकरण संख्या $-1$, $\mathrm{O}^{2-}$ आयन के ऑक्सीकरण संख्या -2 होती है आदि। अपने यौगिकों में सभी क्षार धातुएं +1 के ऑक्सीकरण संख्या के साथ होती हैं, और सभी क्षारीय भूमि धातुएं +2 के ऑक्सीकरण संख्या के साथ होती हैं। एल्यूमिनियम के सभी यौगिकों में इसे +3 के ऑक्सीकरण संख्या के रूप में देखा जाता है।
3. अधिकांश यौगिकों में ऑक्सीजन की ऑक्सीकरण संख्या -2 होती है। हालांकि, यहां दो प्रकार के अपवाद होते हैं। एक विशेषता परॉक्साइड और सुपरऑक्साइड के मामले में होती है, जहां ऑक्सीजन के परमाणु एक दूसरे के सीधे जुड़े होते हैं। परॉक्साइड में (जैसे, $\mathrm{H_2} \mathrm{O_2}$, $\mathrm{Na_2} \mathrm{O_2}$), प्रत्येक ऑक्सीजन परमाणु की ऑक्सीकरण संख्या -1 होती है, जबकि सुपरऑक्साइड में (जैसे, $\mathrm{KO_2}$, $\mathrm{RbO_2}$) प्रत्येक ऑक्सीजन परमाणु की ऑक्सीकरण संख्या $-(1/2)$ होती है। दूसरा अपवाद बहुत घट घट आता है, अर्थात जब ऑक्सीजन फ्लुओरीन के साथ बंधे होते हैं। ऐसे यौगिकों में, जैसे, ऑक्सीजन डाइफ्लुओराइड $\left(\mathrm{OF_2}\right)$ और डाइऑक्सीजन डाइफ्लुओराइड $\left(\mathrm{O_2} \mathrm{~F_2}\right)$, ऑक्सीजन की ऑक्सीकरण संख्या क्रमशः +2 और +1 होती है। ऑक्सीजन की ऑक्सीकरण संख्या ऑक्सीजन के बंधन के अवस्था पर निर्भर करेगी, लेकिन अब यह संख्या धनात्मक होगी।
4. हाइड्रोजन की ऑक्सीकरण संख्या +1 होती है, बिना धातुओं के साथ द्वितीयक यौगिकों में जुड़े होने के अतिरिक्त। उदाहरण के लिए, $\mathrm{LiH}, \mathrm{NaH}$ और $\mathrm{CaH_2}$ में इसकी ऑक्सीकरण संख्या -1 होती है।
5. सभी अपने यौगिकों में फ्लूओरीन की ऑक्सीकरण संख्या -1 होती है। अन्य हैलोजन $(\mathrm{Cl}$, $\mathrm{Br}$ और I) भी अपने यौगिकों में हैलाइड आयन के रूप में उपस्थित होने पर ऑक्सीकरण संख्या -1 होती है। क्लोरीन, ब्रोमीन और आयोडीन जब ऑक्सीजन के साथ संयोजित होते हैं, उदाहरण के लिए ऑक्सोएसिड और ऑक्सोएनियन में, उनकी ऑक्सीकरण संख्या धनात्मक होती है।
6. किसी यौगिक में सभी परमाणुओं के ऑक्सीकरण संख्या का बीजगणितीय योग शून्य होना चाहिए। एक बहुपरमाणुक आयन में सभी परमाणुओं के ऑक्सीकरण संख्या का बीजगणितीय योग आयन के आवेश के बराबर होना चाहिए। इसलिए, कार्बोनेट आयन, $\left(\mathrm{CO_3}\right)^{2-}$ में तीन ऑक्सीजन परमाणु और एक कार्बन परमाणु के ऑक्सीकरण संख्या का योग -2 होना चाहिए।
उपरोक्त नियमों के अनुप्रयोग से हम किसी अणु या आयन में चाहे गए तत्व की ऑक्सीकरण संख्या ज्ञात कर सकते हैं। स्पष्ट है कि धातु तत्वों के ऑक्सीकरण संख्या धनात्मक होती है और अधातु तत्वों के ऑक्सीकरण संख्या धनात्मक या ऋणात्मक हो सकती है। संक्रमण तत्वों के परमाणु आमतौर पर कई धनात्मक ऑक्सीकरण संख्या दर्शाते हैं। प्रतिनिधि तत्व के उच्चतम ऑक्सीकरण संख्या पहले दो समूहों के लिए समूह संख्या होती है और अन्य समूहों के लिए लंबे रूप के आवर्त सारणी के अनुसार समूह संख्या कम 10 होती है। इसलिए, यह बताता है कि आवर्त सारणी में एक तत्व के परमाणु के द्वारा दिखाए गए उच्चतम ऑक्सीकरण संख्या का मान आवर्त में बढ़ते हुए बदलता रहता है। तीसरे आवर्त में, तत्वों के यौगिकों में उच्चतम ऑक्सीकरण संख्या 1 से 7 तक बदलती है, जैसा कि नीचे दिखाया गया है।
एक शब्द जो ऑक्सीकरण संख्या के साथ अक्सर बदल बैठकर प्रयोग किया जाता है, वह ऑक्सीकरण अवस्था है। इसलिए $\mathrm{CO_2}$ में कार्बन की ऑक्सीकरण अवस्था +4 है, जो इसकी ऑक्सीकरण संख्या भी है और इसी तरह ऑक्सीजन की ऑक्सीकरण अवस्था और ऑक्सीकरण संख्या दोनों -2 है। इसका अर्थ है कि ऑक्सीकरण संख्या एक यौगिक में एक तत्व की ऑक्सीकरण अवस्था को दर्शाती है।
| समूह | $\mathbf{1}$ | $\mathbf{2}$ | $\mathbf{1 3}$ | $\mathbf{1 4}$ | $\mathbf{1 5}$ | $\mathbf{1 6}$ | $\mathbf{1 7}$ |
|---|
| तत्व | $\mathrm{Na}$ | $\mathrm{Mg}$ | $\mathrm{Al}$ | $\mathrm{Si}$ | $\mathrm{P}$ | $\mathrm{S}$ | $\mathrm{Cl}$ | | यौगिक | $\mathrm{NaCl}$ | $\mathrm{MgSO_4}$ | $\mathrm{AlF_3}$ | $$\mathrm{SiCl_4}$ | $\mathrm{P_4} \mathrm{O_{10}}$ | $\mathrm{SF_6}$ | $\mathrm{HClO}$ | | समूह तत्व के उच्चतम ऑक्सीकरण संख्या अवस्था | +1 | +2 | +3 | +4 | +5 | +6 | +7 |
एक धातु के यौगिक में ऑक्सीकरण संख्या/अवस्था को कभी-कभी जर्मन रसायनज्ञ अल्फ्रेड स्टॉक द्वारा दी गई नोटेशन के अनुसार प्रस्तुत किया जाता है। इसे लोकप्रिय रूप से स्टॉक नोटेशन के रूप में जाना जाता है। इसके अनुसार, ऑक्सीकरण संख्या को अणुसूत्र में धातु के चिह्न के पीछे ऑक्सीकरण संख्या को प्रकट करने वाला रोमन संख्या के रूप में व्यक्त किया जाता है। इस प्रकार, एवरस ब्रोमाइड और एवरिक ब्रोमाइड को $\mathrm{Au}(\mathrm{I}) \mathrm{Cl}$ और $\mathrm{Au}(\mathrm{III}) \mathrm{Cl_3}$ के रूप में लिखा जाता है। इसी तरह, स्टैनस ब्रोमाइड और स्टैनिक ब्रोमाइड को $\mathrm{Sn}$ (II) $\mathrm{Cl_2}$ और $\mathrm{Sn}(\mathrm{IV}) \mathrm{Cl_4}$ के रूप में लिखा जाता है। ऑक्सीकरण संख्या में परिवर्तन ऑक्सीकरण अवस्था में परिवर्तन को दर्शाता है, जो इसके अवस्था के आधार पर विशेषता के बारे में बताता है कि यह ऑक्सीकृत रूप या अपचयित रूप में है। इसलिए, $\mathrm{Hg_2}(\mathrm{I}) \mathrm{Cl_2}$, $\mathrm{Hg}$ (II) $\mathrm{Cl_2}$ के अपचयित रूप है।
समस्या 8.3
स्टॉक नोटेशन का उपयोग करके निम्नलिखित यौगिकों का प्रतिनिधित्व करें: $\mathrm{HAuCl_4}, \mathrm{Tl_2} \mathrm{O}, \mathrm{FeO}$, $\mathrm{Fe_2} \mathrm{O_3}$, CuI, $\mathrm{CuO}, \mathrm{MnO}$ और $\mathrm{MnO_2}$।
हल
एक यौगिक में चाहे तत्व के ऑक्सीकरण संख्या की गणना करने के विभिन्न नियमों के अनुसार, इस यौगिक में प्रत्येक धातु तत्व के ऑक्सीकरण संख्या निम्नलिखित हैं:
$ \begin{array}{ccc} \mathrm{HAuCl_4} & \rightarrow & \mathrm{Au} \text{ has } 3 \\
इसलिए, ये यौगिक निम्नलिखित रूप में प्रस्तुत किए जा सकते हैं:
$\mathrm{HAu}(\mathrm{III}) \mathrm{Cl_4}, \mathrm{Tl_2}$ (I)O, $\mathrm{Fe}(\mathrm{II}) \mathrm{O}, \mathrm{Fe_2}(\mathrm{III}) \mathrm{O_3}$, $\mathrm{Cu}(\mathrm{I}) \mathrm{I}, \mathrm{Cu}(\mathrm{II}) \mathrm{O}, \mathrm{Mn}(\mathrm{II}) \mathrm{O}, \mathrm{Mn}(\mathrm{IV}) \mathrm{O_2}$। oxidation number के अवधारण का एक अक्षुत रूप से ऑक्सीकरण, अपचयन, ऑक्सीकारक (ऑक्सीडेंट), अपचायक (रेडक्टेंट) और रेडॉक्स अभिक्रिया को परिभाषित करने में उपयोग किया गया है। सारांशित करते हुए, हम कह सकते हैं कि:
-
ऑक्सीकरण: दिए गए पदार्थ में तत्व के ऑक्सीकरण संख्या में वृद्धि।
-
कमी : दिए गए पदार्थ में तत्व के ऑक्सीकरण संख्या में कमी।
-
ऑक्सीकरण एजेंट : एक रासायनिक अभिकर्मक जो किसी दिए गए पदार्थ में तत्व के ऑक्सीकरण संख्या को बढ़ा सकता है। इन अभिकर्मकों को ऑक्सीकारक भी कहा जाता है।
-
अपचायक एजेंट : एक रासायनिक अभिकर्मक जो किसी दिए गए पदार्थ में तत्व के ऑक्सीकरण संख्या को कम कर सकता है। इन अभिकर्मकों को अपचायक भी कहा जाता है।
-
रेडॉक्स अभिक्रियाएं : वे अभिक्रियाएं जिनमें अंतरक्रिया कर रहे अणुओं के ऑक्सीकरण संख्या में परिवर्तन होता है।
समस्या 8.4
उपयोग करके बताइए कि अभिक्रिया: $2 \mathrm{Cu_2} \mathrm{O}(\mathrm{s})+\mathrm{Cu_2} \mathrm{~S}(\mathrm{~s}) \rightarrow 6 \mathrm{Cu}(\mathrm{s})+\mathrm{SO_2}(\mathrm{~g})$ एक अपचायक-उपचायक अभिक्रिया है। अपचायक एवं उपचायक के रूप में कौन कार्य करता है और अपचित एवं उपचित विषम कौन हैं?
हल
हम अभिक्रिया में प्रत्येक अवयव के ऑक्सीकरण संख्या का निर्धारण करते हैं। इसके परिणामस्वरूप हमें निम्नलिखित प्राप्त होता है:
$$ \begin{aligned} & 2 \stackrel{+1}{\mathrm{Cu_2}} \stackrel{-2}{\mathrm{O}}(\mathrm{s})+\stackrel{+1}{\mathrm{Cu_2}} \stack
\end{aligned} $$
हम इसलिए निष्कर्ष निकालते हैं कि इस अभिक्रिया में कॉपर +1 अवस्था से शून्य ऑक्सीकरण अवस्था में अवाप्त हो जाता है और सल्फर -2 अवस्था से +4 अवस्था में ऑक्सीकृत हो जाता है। इसलिए उपरोक्त अभिक्रिया एक रेडॉक्स अभिक्रिया है।
अतः, $\mathrm{Cu_2} \mathrm{O}$, $\mathrm{Cu_2} \mathrm{~S}$ में सल्फर के ऑक्सीकरण संख्या को बढ़ाने में सहायता करता है, इसलिए $\mathrm{Cu}(\mathrm{I})$ एक ऑक्सीकारक है; और $\mathrm{Cu_2} \mathrm{~S}$ के सल्फर, $\mathrm{Cu_2} \mathrm{~S}$ में अपने स्वयं के कॉपर और $\mathrm{Cu_2} \mathrm{O}$ में कॉपर के ऑक्सीकरण संख्या को कम करने में सहायता करता है, इसलिए $\mathrm{Cu_2} \mathrm{~S}$ के सल्फर एक अपचायक है।
8.3.1 रेडॉक्स अभिक्रियाओं के प्रकार
1. संयोजन अभिक्रियाएं
एक संयोजन अभिक्रिया को इस प्रकार दर्शाया जा सकता है:
$$ \mathrm{A}+\mathrm{B} \rightarrow \mathrm{C} $$
ऐसी अभिक्रिया के लिए या तो A और B में से कोई एक तत्वात्मक रूप में होना चाहिए या दोनों A और B तत्वात्मक रूप में होना चाहिए। सभी ज्वलन अभिक्रियाएं, जिनमें तत्वात्मक डाइऑक्सीजन का उपयोग किया जाता है, तथा अन्य अभिक्रियाएं, जिनमें डाइऑक्सीजन के अतिरिक्त अन्य तत्वों का उपयोग किया जाता है, रेडॉक्स अभिक्रियाएं होती हैं। इस श्रेणी के कुछ महत्वपूर्ण उदाहरण हैं:
$$\stackrel{0}{\mathrm{C}}(\mathrm{s}) + \stackrel{0}{\mathrm{O_2}}(\mathrm{~g}) \xrightarrow{\Delta} \stackrel{+4-2}{\mathrm{CO_2}} (\mathrm{~g}) \tag{8.24} $$
$$3 \stackrel{0}{\mathrm{Mg}}(\mathrm{s})+ \stackrel{0}{\mathrm{N_2}}(\mathrm{~g}) \xrightarrow{\Delta} \stackrel{+2}{\mathrm{Mg_3}} \stackrel{-3}{\mathrm{~N_2}}(\mathrm{~s}) \tag{8.25}$$
$$\stackrel{-4+1}{\mathrm{CH_4}}(\mathrm{~g})+2 \stackrel{0}{\mathrm{O_2}}(\mathrm{~g}) \xrightarrow{\Delta} \stackrel{+4-2}{\mathrm{CO_2}}(\mathrm{~g})+2 \stackrel{+1}{\mathrm{H_2}} \stackrel{-2}{\mathrm{O}}(\mathrm{l})$$
2. अपघटन अभिक्रियाएं
अपघटन अभिक्रियाएं संयोजन अभिक्रियाओं के विपरीत होती हैं। ठीक ही, एक अपघटन अभिक्रिया एक यौगिक के दो या अधिक घटकों में विघटन करती है जिसमें कम से कम एक घटक तत्वीय अवस्था में होता है। इस श्रेणी के उदाहरण निम्नलिखित हैं:
$$2 \stackrel{+1}{\mathrm{H_2}} \stackrel{-2}{\mathrm{O}}(\mathrm{l}) \xrightarrow{\Delta} 2 \stackrel{0}{\mathrm{H_2}}(\mathrm{~g}) + \stackrel{0}{\mathrm{O_2}}(\mathrm{~g})\tag{8.26}$$
$$\stackrel{+1-1}{\mathrm{NaH}}(\mathrm{s}) \xrightarrow{\Delta} 2 \stackrel{0}{\mathrm{Na}}(\mathrm{s})+ \stackrel{0}{\mathrm{H_2}} (\mathrm{~g}) \tag{8.27}$$
$$ 2 \stackrel{+1+5}{\mathrm{KCl}}\stackrel{-2}{\mathrm{O_3}}(\mathrm{~s}) \xrightarrow{\Delta} 2 \stackrel{+1-1}{\mathrm{KCl}}(\mathrm{s})+3 \stackrel{0}{\mathrm{O_2}}(\mathrm{~g}) \tag{8.28}$$
ध्यान देने योग्य है कि मिश्रण अभिक्रियाओं में मेथेन में हाइड्रोजन के ऑक्सीकरण संख्या में कोई परिवर्तन नहीं होता और पोटैशियम क्लोरेट में पोटैशियम के ऑक्सीकरण संख्या में अभिक्रिया (7.28) में कोई परिवर्तन नहीं होता। यहाँ ध्यान देने योग्य है कि सभी अपघटन अभिक्रियाएँ रेडॉक्स अभिक्रियाएँ नहीं होती हैं। उदाहरण के लिए, कैल्शियम कार्बोनेट के अपघटन एक रेडॉक्स अभिक्रिया नहीं होता।
$$\stackrel{+2}{\mathrm{Ca}}\stackrel{+4}{\mathrm{C}}\stackrel{-2}{\mathrm{O_3}} \mathrm{(s)} \xrightarrow{\Delta} \stackrel{+2-2}{\mathrm{CaO}} + \stackrel{+4-2}{\mathrm{CO_2}}\mathrm{(g)}$$
3. विस्थापन अभिक्रियाएं
एक विस्थापन अभिक्रिया में, एक यौगिक में एक आयन (या एक परमाणु) दूसरे तत्व के आयन (या परमाणु) द्वारा प्रतिस्थापित हो जाता है। इसे इस प्रकार दर्शाया जा सकता है:
$$ \mathrm{X}+\mathrm{YZ} \rightarrow \mathrm{XZ}+\mathrm{Y} $$
विस्थापन अभिक्रियाएं दो श्रेणियों में वर्गीकृत होती हैं: धातु विस्थापन और अधातु विस्थापन।
(a) धातु विस्थापन: एक यौगिक में धातु अपररूप में दूसरी धातु द्वारा प्रतिस्थापित हो सकती है। हम पहले अनुच्छेद 7.2.1 में इस अभिक्रिया के वर्ग के बारे में चर्चा कर चुके हैं। धातु विस्थापन अभिक्रियाएं धातु के खनिजों से शुद्ध धातुओं के निष्कर्षण में उपयोग होती हैं। कुछ उदाहरण नीचे दिए गए हैं:
$$\stackrel{+2+6-2}{\mathrm{CuSO_4}}(\mathrm{aq})+ \stackrel{0}{\mathrm{Zn}}(\mathrm{s}) \rightarrow \stackrel{0}{\mathrm{Cu}}(\mathrm{s})+\stackrel{+2+6-3}{\mathrm{ZnSO_4}}(\mathrm{aq}) \tag{8.29}$$
$$\stackrel{+5-2}{\mathrm{V_2O_5}}\mathrm{(s)} + 5 \stackrel{0}{\mathrm{Ca}}\mathrm{(s)} \xrightarrow{\Delta} 2 \stackrel{0}{\mathrm{V}} \mathrm{(s)} + 5 \stackrel{+2-2}{\mathrm{CaO}}\mathrm{(s)} \tag{8.30}$$
$$\stackrel{+4-1}{\mathrm{TiCl_4}}\mathrm{(l)} + 2 \stackrel{0}{\mathrm{Mg}}\mathrm{(s)} \xrightarrow{\Delta} \stackrel{0}{\mathrm{Ti}} \mathrm{(s)} + 2\stackrel{+2-1}{\mathrm{MgCl_2}}\mathrm{(s)} \tag{8.31}$$
$$\stackrel{+3-2}{\mathrm{Cr_2O_3}}\mathrm{(l)} + 2 \stackrel{0}{\mathrm{Al}}\mathrm{(s)} \xrightarrow{\Delta} \stackrel{+3-2}{\mathrm{Al_2O_3}} \mathrm{(s)} + 2\stackrel{0}{\mathrm{Cr}}\mathrm{(s)} \tag{8.32}$$
प्रत्येक मामले में, अपचायक धातु उस धातु की तुलना में बेहतर अपचायक होती है जो कि अपचयित हो रही है, जो आसानी से इलेक्ट्रॉन खोने की क्षमता के लिए स्पष्ट रूप से अधिक उपलब्ध होती है जो कि अपचयित हो रही है।
(b) अधातु विस्थापन: अधातु विस्थापन रेडॉक्स अभिक्रियाएं जल विस्थापन और बहुत कम घटनाओं में ऑक्सीजन विस्थापन शामिल होती है।
सभी अल्कली धातुएँ और कुछ अल्कली भूमि धातुएँ $(\mathrm{Ca}, \mathrm{Sr}$, और $\mathrm{Ba})$ जो बहुत अच्छे अपचायक होते हैं, ठंडे पानी से हाइड्रोजन विस्थापित करते हैं।
$$2 \stackrel{0}{\mathrm{Na}}\mathrm{(s)} + 2 \stackrel{+1-2}{\mathrm{H_2O}}\mathrm{(l)} \rightarrow 2 \stackrel{+1-2+1}{\mathrm{NaOH}} \mathrm{(aq)} + \stackrel{0}{\mathrm{Hg}}\mathrm{(g)} \tag{8.33}$$
$$ \stackrel{0}{\mathrm{2Ca}}\mathrm{(s)} + 2 \stackrel{+1-2}{\mathrm{H_2O}}\mathrm{(l)} \rightarrow 2 \stackrel{+2-2+1}{\mathrm{Ca(OH)_2}} \mathrm{(aq)} + \stackrel{0}{\mathrm{Hg}}\mathrm{(g)} \tag{8.34}$$
कम सक्रिय धातुओं जैसे मैग्नीशियम और लोहा, भाप के साथ अभिक्रिया करके डाइहाइड्रोजन गैस उत्पन्न करते हैं:
$$ \stackrel{0}{\mathrm{Mg}}\mathrm{(s)} + \stackrel{+1-2}{2\mathrm{H_2O}}\mathrm{(l)} \xrightarrow{\Delta} \stackrel{+2-2+1}{\mathrm{Mg(OH)_2}} \mathrm{(s)} + \stackrel{0}{\mathrm{Hg}}\mathrm{(g)} \tag{8.35}$$
$$ \stackrel{0}{2\mathrm{Fe}}\mathrm{(s)} + \stackrel{+1-2}{3\mathrm{H_2O}}\mathrm{(l)} \xrightarrow{\Delta} \stackrel{+3-2}{\mathrm{Fe_2O_3}} \mathrm{(s)} + \stackrel{0}{3\mathrm{Hg}}\mathrm{(g)} \tag{8.36}$$
कई धातुएँ, जिनमें से कुछ ठंडे पानी के साथ अभिक्रिया नहीं करती, अम्लों से हाइड्रोजन को विस्थापित करने में सक्षम होती हैं। ऐसी धातुएँ तकनीकी रूप से भी हाइड्रोजन के उत्पादन में भाग ले सकती हैं जो भाप के साथ अभिक्रिया नहीं करती। कadmium और tin ऐसी धातुओं के उदाहरण हैं। अम्लों से हाइड्रोजन के विस्थापन के कुछ उदाहरण नीचे दिए गए हैं:
$$ \stackrel{0}{\mathrm{Zn}}\mathrm{(s)} + \stackrel{+1-1}{2\mathrm{HCl}}\mathrm{(aq)} \rightarrow \stackrel{+2-1}{\mathrm{ZnCl_2}} \mathrm{(aq)} + \stackrel{0}{\mathrm{H_2}}\mathrm{(g)} \tag{8.37}$$
$$ \stackrel{0}{\mathrm{Mg}}\mathrm{(s)} + \stackrel{+1-1}{2\mathrm{HCl}}\mathrm{(aq)} \rightarrow \stackrel{+2-1}{\mathrm{MgCl_2}} \mathrm{(aq)} + {\mathrm{H_2}}\mathrm{(g)} \tag{8.38}$$
$$ \stackrel{0}{\mathrm{Fe}}\mathrm{(s)} + \stackrel{+1-1}{2\mathrm{HCl}}\mathrm{(aq)} \rightarrow \stackrel{+2-1}{\mathrm{FeCl_2}} \mathrm{(aq)} + {\mathrm{H_2}}\mathrm{(g)} \tag{8.39}$$
प्रतिक्रियाएँ (8.37 से 8.39) लैब में डाइहाइड्रोजन गैस के तैयार करने के लिए उपयोग की जाती हैं। यहाँ, धातुओं की प्रतिक्रियाशीलता हाइड्रोजन गैस के उत्पादन की दर में प्रतिबिंबित होती है, जो सबसे कम प्रतिक्रियाशील धातु $\mathrm{Fe}$ के लिए सबसे धीमी होती है, और सबसे अधिक प्रतिक्रियाशील धातु, Mg के लिए सबसे तेज होती है। बहुत कम प्रतिक्रियाशील धातुएँ, जो अपने स्वतंत्र अवस्था में उपस्थित हो सकती हैं, जैसे कि चांदी (Ag), और स्वर्ण (Au), ताकत वाले हाइड्रोक्लोरिक अम्ल के साथ भी प्रतिक्रिया नहीं करती हैं।
अनुच्छेद (8.2.1) में हमने पहले ही चर्चा की है कि धातुएँ - जिंक $(\mathrm{Zn})$, तांबा $(\mathrm{Cu})$ और चांदी (Ag) इलेक्ट्रॉन खोने की प्रवृत्ति के कारण अपनी अपचायक गतिविधि के क्रम में $\mathrm{Zn} >$ $\mathrm{Cu} > \mathrm{Ag}$ के क्रम में होती हैं। धातुओं के समान, हैलोजन के लिए भी गतिविधि श्रेणी का अस्तित्व होता है। आवर्त सारणी के 17वें समूह में फ्लूओरीन से आयोडीन तक नीचे जाने पर इन तत्वों के ऑक्सीकारक क्षमता कम होती जाती है। इसका अर्थ है कि फ्लूओरीन इतना अभिक्रियाशील है कि यह विलयन में क्लोराइड, ब्रोमाइड और आयोडाइड आयनों को बदल सकता है। वास्तव में, फ्लूओरीन इतना अभिक्रियाशील है कि यह पानी के साथ अभिक्रिया करता है और पानी के ऑक्सीजन को विस्थापित कर देता है :
$$ \stackrel{+1-2}{2\mathrm{H_2O}}\mathrm{(l)} + \stackrel{0}{2\mathrm{F_2}}\mathrm{(g)} \rightarrow \stackrel{+1-1}{4\mathrm{HF}} \mathrm{(aq)} + \stackrel{0}{\mathrm{O_2}}\mathrm{(g)} \tag{8.40}$$
इस कारण फ्लूओरीन के प्रयोग से क्लोरीन, ब्रोमीन और आयोडीन के विस्थापन अभिक्रियाएं आमतौर पर जलीय विलयन में नहीं की जाती हैं। दूसरी ओर, क्लोरीन जलीय विलयन में ब्रोमाइड और आयोडाइड आयनों को विस्थापित कर सकती है, जैसा कि नीचे दिखाया गया है:
$$ \stackrel{0}{\mathrm{Cl_2}}\mathrm{(g)} + \stackrel{+1-1}{2\mathrm{KBr}}\mathrm{(aq)} \rightarrow \stackrel{+1-1}{2\mathrm{KCl}} \stackrel{0} {\mathrm{(aq)}} + {\mathrm{Br_2}}\mathrm{(l)} \tag{8.41}$$
$$ \stackrel{0}{\mathrm{Cl_2}}\mathrm{(g)} + \stackrel{+1-1}{2\mathrm{KI}}\mathrm{(aq)} \rightarrow \stackrel{+1-1}{2\mathrm{KCl}} \stackrel{0} {\mathrm{(aq)}} + {\mathrm{I_2}}\mathrm{(s)} \tag{8.42}$$
जैसे $\mathrm{Br_2}$ और $\mathrm{I_2}$ रंग वाले होते हैं और $\mathrm{CCl_4}$ में घुलते हैं, इन्हें विलयन के रंग से आसानी से पहचाना जा सकता है। उपरोक्त अभिक्रियाओं को आयनिक रूप में लिखा जा सकता है जैसे:
$$ \stackrel{0}{\mathrm{Cl_2}}\mathrm{(g)} + \stackrel{-1}{2\mathrm{Br^-}}\mathrm{(aq)} \rightarrow \stackrel{-1}{2\mathrm{Cl^-}} \mathrm{(aq)} + \stackrel{0}{\mathrm{Br_2}}\mathrm{(s)} \tag{8.41a}$$
$$ \stackrel{0}{\mathrm{Cl_2}}\mathrm{(g)} + \stackrel{-1}{2\mathrm{I^-}}\mathrm{(aq)} \rightarrow \stackrel{-1}{2\mathrm{Cl^-}} \mathrm{(aq)} + \stackrel{0}{\mathrm{I_2}}\mathrm{(s)} \tag{8.42a}$$
अभिक्रियाएँ (8.41) और (8.42) प्रयोगशाला में $\mathrm{Br}^{-}$ और $\mathrm{I}^{-}$ की पहचान के लिए प्रसिद्ध ‘स्तर परीक्षण’ नामक परीक्षण के आधार के रूप में हैं। यहाँ यह उल्लेख करना उचित नहीं होगा कि ब्रोमीन भी विलयन में आयोडाइड आयन को विस्थापित कर सकती है:
$$ \stackrel{0}{\mathrm{Br_2}(\mathrm{l})}+\stackrel{-1}{2 \mathrm{I}^{-}}(\mathrm{aq}) \rightarrow \stackrel{-1}{2 \mathrm{Br}^{-}} (\mathrm{aq})+ \stackrel{0}{\mathrm{I_2}} (\mathrm{~s}) \tag{8.43} $$
$$
हैलोजन प्रतिस्थापन अभिक्रियाएं एक सीधे औद्योगिक अनुप्रयोग के रूप में हैं। अपने हैलाइड से हैलोजन के पुनः प्राप्ति के लिए एक ऑक्सीकरण प्रक्रिया की आवश्यकता होती है, जिसे निम्नलिखित द्वारा प्रस्तुत किया गया है:
$$2 \mathrm{X}^{-} \rightarrow \mathrm{X_2}+2 \mathrm{e}^{-} \tag{8.44}$$
यहाँ $\mathrm{X}$ एक हैलोजन तत्व को दर्शाता है। जबकि रासायनिक तरीकों के माध्यम से $\mathrm{Cl}^{-}$, $\mathrm{Br}^{-}$ और $\mathrm{I}^{-}$ के ऑक्सीकरण के लिए साधन उपलब्ध हैं, फ्लूओरीन सबसे मजबूत ऑक्सीकरण एजेंट है; इसलिए रासायनिक तरीकों के माध्यम से $\mathrm{F}^{-}$ आयनों को $\mathrm{F_2}$ में परिवर्तित करना संभव नहीं है। $\mathrm{F}^{-}$ से $\mathrm{F_2}$ प्राप्त करने का एकमात्र तरीका विद्युत अपघटन द्वारा ऑक्सीकरण है, जिसके विस्तारित विवरण आप बाद में अध्ययन करेंगे।
4. असमानुपाती अभिक्रियाएं
असमानुपाती अभिक्रियाएं एक विशेष प्रकार की रूपांतरण अभिक्रियाएं होती हैं। एक असमानुपाती अभिक्रिया में, एक ऑक्सीकरण अवस्था में उपस्थित एक तत्व एक साथ ऑक्सीकृत और अपचयित होता है। एक असमानुपाती अभिक्रिया में एक अभिकर्मक पदार्थ में हमेशा एक तत्व होता है जो कम से कम तीन ऑक्सीकरण अवस्थाओं में विद्यमान हो सकता है। अभिकर्मक पदार्थ के रूप में उपस्थित तत्व की मध्यम ऑक्सीकरण अवस्था होती है; और इस तत्व की उच्च और निम्न ऑक्सीकरण अवस्थाएं अभिक्रिया में बनती हैं। हाइड्रोजन परॉक्साइड के अपघटन असमानुपाती अभिक्रिया का एक परिचित उदाहरण है, जहां ऑक्सीजन असमानुपाती अभिक्रिया का अनुभव करता है।
$$\stackrel{+1-1}{2\mathrm{H_2O_2}}\mathrm{(aq)} \rightarrow \stackrel{+1-2}{2\mathrm{H_2O}} \mathrm{(l)} + \stackrel{0}{\mathrm{O_2}}\mathrm{(g)} \tag{8.45}$$
यहाँ परऑक्साइड में उपस्थित ऑक्सीजन, जो -1 ऑक्सीकरण अवस्था में होती है, $\mathrm{O_2}$ में शून्य ऑक्सीकरण अवस्था में और $\mathrm{H_2O}$ में -2 ऑक्सीकरण अवस्था में परिवर्तित हो जाती है।
फॉस्फोरस, सल्फर और क्लोरीन के अल्कली माध्यम में अपनी ऑक्सीकरण अवस्था में विभेदन (disproportionation) होता है, जैसा कि नीचे दिखाया गया है :
$$\stackrel{0}{\mathrm{P_4}}\mathrm{(s)}+ \stackrel{}{3\mathrm{OH^-}}\mathrm{(aq)} + \stackrel{}{3\mathrm{H_2O}}\mathrm{(l)} \rightarrow \stackrel{-3}{2\mathrm{P}} \mathrm{H_3} \mathrm{(g)} + 3\mathrm{H_2P}\stackrel{+1}{\mathrm{O_2^-}}\mathrm{(aq)} \tag{8.46}$$
$$\stackrel{0}{\mathrm{S_8}}\mathrm{(s)}+ \stackrel{}{12\mathrm{OH^-}}\mathrm{(aq)} \rightarrow \stackrel{-2}{4\mathrm{S}^{2-}}\mathrm{(aq)} + \stackrel{+2}{2\mathrm{S_2O_3}^{2-}} \mathrm{(aq)} + 6\mathrm{H_2O}\mathrm{(l)} \tag{8.47}$$
$$\stackrel{0}{\mathrm{Cl_2}}\mathrm{(g)}+ \stackrel{}{2\mathrm{OH^-}}\mathrm{(aq)} \rightarrow \stackrel{+1}{4\mathrm{ClO^-}}\mathrm{(aq)} + \stackrel{-1}{2\mathrm{Cl^-}} \mathrm{(aq)} + \mathrm{H_2O}\mathrm{(l)} \tag{8.48}$$
अभिक्रिया (8.48) घरेलू ब्लीचिंग एजेंट के निर्माण का वर्णन करती है। अभिक्रिया में उत्पन्न होने वाले हाइपोक्लोराइट आयन $\left(\mathrm{ClO}^{-}\right)$ वस्तुओं के रंग वाले धब्बों को रंगहीन यौगिकों में ऑक्सीकृत करता है।
यहाँ उल्लेख करना रोचक होगा कि ब्रोमीन और आयोडीन, अभिक्रिया (8.48) में क्लोरीन के द्वारा दिखाए गए प्रवृत्ति के समान प्रवृत्ति का पालन करते हैं, लेकिन फ्लूओरीन जब एल्कली के साथ अभिक्रिया करता है तो इस व्यवहार से विचलन दिखाता है। फ्लूओरीन के मामले में होने वाली अभिक्रिया निम्नलिखित है:
$$2 \mathrm{~F_2}(\mathrm{~g})+2 \mathrm{OH}^{-}(\mathrm{aq}) \rightarrow 2 \mathrm{~F}^{-}(\mathrm{aq})+\mathrm{OF_2}(\mathrm{~g})+\mathrm{H_2} \mathrm{O}(\mathrm{l}) \tag{8.49}$$
(ध्यान देने योग्य है कि अभिक्रिया (8.49) में फ्लूओरीन पानी के साथ निश्चित रूप से अभिक्रिया करेगा और थोड़ा ऑक्सीजन भी उत्पन्न करेगा।) फ्लूओरीन द्वारा दिखाए गए विचलन के लिए हमें आश्चर्य नहीं होना चाहिए क्योंकि हम जानते हैं कि फ्लूओरीन की सीमा यह है कि यह सबसे इलेक्ट्रोनेगेटिव तत्व होने के कारण कोई धनात्मक ऑक्सीकरण अवस्था नहीं दिखा सकता। इसका अर्थ है कि हैलोजन में, फ्लूओरीन अपचयन और ऑक्सीकरण दोनों के लिए असमान व्यवहार नहीं दिखाता।
समस्या 8.5
निम्नलिखित अनुपातिक अनियमित अभिक्रिया दिखाते नहीं हैं और कारण बताइए?
$\mathrm{ClO}^{-}, \mathrm{ClO_2}^{-}, \mathrm{ClO_3}^{-}$ और $\mathrm{ClO_4}^{-}$
साथ ही, विघटन अभिक्रिया के लिए प्रत्येक अनुपातिक अनियमित अभिक्रिया के लिए अभिक्रिया लिखिए।
हल
ऊपर सूचित क्लोरीन के ऑक्सोआयन में, $\mathrm{ClO_4}^{-}$ अनुपातिक अनियमित अभिक्रिया नहीं दिखाता क्योंकि इस ऑक्सोआयन में क्लोरीन के उच्चतम ऑक्सीकरण अवस्था में उपस्थित होता है, अर्थात +7। अन्य तीन ऑक्सोआयन के लिए विघटन अभिक्रिया निम्नलिखित हैं:
$\stackrel{+1}{2\mathrm{ClO^-}} \longrightarrow \stackrel{-1}{2\mathrm{Cl^-}}+ \stackrel{+5}{\mathrm{ClO_3^-}}$
$\stackrel{+}{6\mathrm{Cl}} \mathrm{O_2}^- \xrightarrow{hv} \stackrel{+5}{4\mathrm{Cl}} \mathrm{C_3}^- + \stackrel{-1}{2\mathrm{Cl^-}}$
$\stackrel{+5}{4\mathrm{Cl}} \mathrm{O_3}^- \longrightarrow \stackrel{-1}{\mathrm{Cl^-}} + 3\stackrel{+7}{\mathrm{Cl}}\mathrm{O_4}^-$
समस्या 8.6
निम्नलिखित अपचयन-उपचय अभिक्रियाओं के वर्गीकरण के एक योजना सुझाएं
(a) $\mathrm{N_2}$ (g) $+\mathrm{O_2}$ (g) $\rightarrow 2 \mathrm{NO}$ (g)
(b) $2 \mathrm{~Pb}\left(\mathrm{NO_3}\right)_{2}$ (s) $\rightarrow 2 \mathrm{PbO}$ (s) $+4 \mathrm{NO_2}$ (g) + $\mathrm{O_2}(\mathrm{~g})$
(c) $\mathrm{NaH}$ (s) $+\mathrm{H_2} \mathrm{O}$ (l) $\rightarrow \mathrm{NaOH}\left(\right.$ aq) $+\mathrm{H_2}$ (g)
(d) $2 \mathrm{NO_2}$ (g) $+2 \mathrm{OH}^{-}$(aq) $\rightarrow \mathrm{NO_2}^{-}(\mathrm{aq})+$ $\mathrm{NO_3}^{-}(\mathrm{aq})+\mathrm{H_2} \mathrm{O}(\mathrm{l})$
हल
अभिक्रिया (a) में, तत्वों नाइट्रोजन और ऑक्सीजन के संयोजन से नाइट्रिक ऑक्साइड बनता है; इसलिए, यह संयोजन रेडॉक्स अभिक्रिया का उदाहरण है। अभिक्रिया (b) में, सीसा नाइट्रेट तीन घटकों में विघटित हो जाता है; इसलिए, यह विघटन रेडॉक्स अभिक्रिया के अंतर्गत आती है। अभिक्रिया (c) में, जल के हाइड्रोजन को हाइड्राइड आयन द्वारा डाइहाइड्रोजन गैस में विस्थापित कर दिया गया है। इसलिए, इसे विस्थापन रेडॉक्स अभिक्रिया कहा जा सकता है। अभिक्रिया (d) में, $\mathrm{NO_2}$ (+4 अवस्था) के $\mathrm{NO_2}^{-}$ (+3 अवस्था) और $\mathrm{NO_3}^{-}$ (+5 अवस्था) में अपचयन एवं ऑक्सीकरण के माध्यम से अपने आप बदल देता है। इसलिए, अभिक्रिया (d) अपने आप बदलने वाली रेडॉक्स अभिक्रिया का उदाहरण है।
अंशात्मक ऑक्सीकरण संख्या का विरोधाभास
कभी-कभी हम ऐसे यौगिकों के साथ सामना करते हैं जिनमें यौगिक में एक विशिष्ट तत्व की ऑक्सीकरण संख्या अंशात्मक होती है। उदाहरण के लिए:
$\mathrm{C_3} \mathrm{O_2}$ [जहाँ कार्बन की ऑक्सीकरण संख्या (4/3) होती है],
$\mathrm{Br_3} \mathrm{O_8}$ [जहाँ ब्रोमीन की ऑक्सीकरण संख्या (16/3) होती है]
और $\mathrm{Na_2} \mathrm{~S_4} \mathrm{O_6}$ (जहाँ सल्फर की ऑक्सीकरण संख्या 2.5 होती है)।
हम जानते हैं कि अंशात्मक ऑक्सीकरण संख्या के विचार के लिए हमें अस्पष्टता महसूस होती है, क्योंकि इलेक्ट्रॉन कभी भी अंशात्मक रूप से साझा या परिवहन नहीं किए जाते। वास्तव में, यह अंशात्मक ऑक्सीकरण अवस्था विचार के तत्व की औसत ऑक्सीकरण अवस्था होती है और संरचनात्मक पैरामीटर बताते हैं कि जिस तत्व के लिए अंशात्मक ऑक्सीकरण अवस्था विचार किया जाता है, वह विभिन्न ऑक्सीकरण अवस्थाओं में उपस्थित होता है। $\mathrm{C_3} \mathrm{O_2}, \mathrm{Br_3} \mathrm{O_8}$ और $\mathrm{S_4} \mathrm{O_6}^{2-}$ के अणु की संरचना निम्नलिखित बंधन स्थितियों को दर्शाती है:

प्रत्येक अणु में तारांकित तत्व अपने समान तत्व के अन्य परमाणुओं से भिन्न ऑक्सीकरण अवस्था (ऑक्सीकरण संख्या) दिखाई दे रहा है। इससे पता चलता है कि $\mathrm{C_3} \mathrm{O_2}$ में दो कार्बन परमाणु +2 ऑक्सीकरण अवस्था में हैं, जबकि तीसरा कार्बन शून्य ऑक्सीकरण अवस्था में है और औसत ऑक्सीकरण संख्या $4 / 3$ है। हालांकि, वास्तविक चित्र यह है कि दो सिरे वाले कार्बन परमाणु +2 ऑक्सीकरण अवस्था में हैं और मध्य कार्बन शून्य ऑक्सीकरण अवस्था में है। इसी तरह $\mathrm{Br_3} \mathrm{O_8}$ में दो सिरे वाले ब्रोमीन परमाणु +6 ऑक्सीकरण अवस्था में हैं और मध्य ब्रोमीन परमाणु +4 ऑक्सीकरण अवस्था में है। फिर से औसत, जो वास्तविकता से भिन्न है, $16 / 3$ है। इसी तरह, $\mathrm{S_4} \mathrm{O_6}^{2-}$ विशिष्टता में, दो अत्यधिक सल्फर परमाणु +5 ऑक्सीकरण अवस्था में हैं और दो मध्य सल्फर परमाणु शून्य ऑक्सीकरण अवस्था में हैं। $\mathrm{S_4} \mathrm{O_6}^{2-}$ के सल्फर के चार ऑक्सीकरण संख्या का औसत 2.5 है, जबकि वास्तविक ऑक्सीकरण संख्या क्रमशः प्रत्येक सल्फर के लिए +5, 0, 0 और +5 है।
हम इस प्रकार, सामान्य रूप से निष्कर्ष ले सकते हैं कि भिन्न ऑक्सीकरण अवस्था के विचार के साथ सावधानी से ले जाया जाना चाहिए और वास्तविकता केवल संरचनाओं द्वारा खोली जाती है। इसके अतिरिक्त, जब भी हम किसी विशिष्ट तत्व के किसी भी अपवाहक में भिन्न ऑक्सीकरण अवस्था के साथ मिलते हैं, तो हमें समझना चाहिए कि यह केवल औसत ऑक्सीकरण संख्या है। वास्तविकता (केवल संरचनाओं द्वारा खोली जाती है), उस विशिष्ट अपवाहक में तत्व केवल एक से अधिक पूर्ण संख्या ऑक्सीकरण अवस्था में उपस्थित होता है। $\mathrm{Fe_3} \mathrm{O_4}, \mathrm{Mn_3} \mathrm{O_4}$, $\mathrm{Pb_3} \mathrm{O_4}$ जैसे कुछ अन्य यौगिकों के उदाहरण हैं, जो मिश्रित ऑक्साइड होते हैं, जहां हम धातु परमाणु के भिन्न ऑक्सीकरण अवस्था के साथ मिलते हैं। हालांकि, ऑक्सीकरण अवस्था भिन्न रूप में हो सकती है, जैसे $\mathrm{O_2}^{+}$ और $\mathrm{O_2}^{-}$ में यह क्रमशः $+1 / 2$ और $-1 / 2$ होती है।
समस्या 8.7
निम्नलिखित अभिक्रियाएँ अलग-अलग क्यों चलती हैं?
$$ \begin{array}{r} \mathrm{Pb_3} \mathrm{O_4}+8 \mathrm{HCl} \rightarrow 3 \mathrm{PbCl_2}+\mathrm{Cl_2}+4 \mathrm{H_2} \mathrm{O} \text { और } \\ \mathrm{Pb_3} \mathrm{O_4}+4 \mathrm{HNO_3} \rightarrow 2 \mathrm{~Pb}\left(\mathrm{NO_3}\right)_{2}+\mathrm{PbO_2}+ 2 \mathrm{H_2} \mathrm{O}\\ \end{array} $$
हल
$\mathrm{Pb_3} \mathrm{O_4}$ वास्तव में $2 \mathrm{~mol}$ के $\mathrm{PbO}$ और $1 \mathrm{~mol}$ के $\mathrm{PbO_2}$ के स्थैतिक मिश्रण होता है। $\mathrm{PbO_2}$ में लेड की ऑक्सीकरण अवस्था +4 होती है, जबकि $\mathrm{PbO}$ में लेड की स्थायी ऑक्सीकरण अवस्था +2 होती है। अतः $\mathrm{PbO_2}$ एक ऑक्सीकारक (ऑक्सीकरण एजेंट) के रूप में कार्य कर सकता है और इसलिए इसके माध्यम से $\mathrm{HCl}$ के $\mathrm{Cl}^{-}$ आयन को क्लोरीन में ऑक्सीकृत किया जा सकता है। हम यह भी ध्यान रख सकते हैं कि $\mathrm{PbO}$ एक क्षारीय ऑक्साइड होता है। अतः अभिक्रिया
$\mathrm{Pb_3} \mathrm{O_4}+8 \mathrm{HCl} \rightarrow 3 \mathrm{PbCl_2}+\mathrm{Cl_2}+4 \mathrm{H_2} \mathrm{O}$ को दो अभिक्रियाओं में विभाजित किया जा सकता है:
$$ \begin{aligned} & 2 \mathrm{PbO}+4 \mathrm{HCl} \rightarrow 2 \mathrm{PbCl_2}+2 \mathrm{H_2} \mathrm{O} \\ & \text { (अम्ल-क्षार अभिक्रिया) } \\ \end{aligned} $$
$$ \begin{aligned} & & \stackrel{+4}{\mathrm{Pb}} \mathrm{O_2} +4 \stackrel{-1}{\mathrm{HCl}} \rightarrow \stackrel{+2}{\mathrm{PbCl_2}} + \stackrel{0}{\mathrm{Cl_2}}+2 \mathrm{H_2} \mathrm{O} \\
$$ & &\text { (अपचायक-उपचायक अभिक्रिया) } \end{aligned} $$
क्योंकि $\mathrm{HNO_3}$ स्वयं एक उपचायक एजेंट है, इसलिए $\mathrm{PbO_2}$ और $\mathrm{HNO_3}$ के बीच अभिक्रिया होने की संभावना कम है। हालांकि, $\mathrm{PbO}$ और $\mathrm{HNO_3}$ के बीच अम्ल-क्षार अभिक्रिया होती है जैसे:
$$ 2 \mathrm{PbO}+4 \mathrm{HNO_3} \rightarrow 2 \mathrm{~Pb}\left(\mathrm{NO_3}\right)_{2}+2 \mathrm{H_2} \mathrm{O} $$
$\mathrm{PbO_2}$ के $\mathrm{HNO_3}$ के विरुद्ध पासिव गुण ही उस अभिक्रिया को $\mathrm{HCl}$ के साथ अलग बनाए रखते हैं।
8.3.2 रेडॉक्स अभिक्रियाओं के संतुलन
रेडॉक्स प्रक्रियाओं के रासायनिक समीकरणों के संतुलन के लिए दो विधियों का उपयोग किया जाता है। इन विधियों में से एक विधि अपचायक एजेंट और ऑक्सीकारक एजेंट के ऑक्सीकरण संख्या में परिवर्तन पर आधारित होती है, जबकि दूसरी विधि रेडॉक्स अभिक्रिया को दो आधा अभिक्रियाओं में विभाजित करके आधारित होती है - एक ऑक्सीकरण और दूसरी अपचायन के आधार पर। ये दोनों विधियाँ उपयोग में हैं और इनके उपयोग के चयन उपयोगकर्ता के अनुसार होता है।
(a) ऑक्सीकरण संख्या विधि: ऑक्सीकरण-अपचायन अभिक्रियाओं के लिखने में, अन्य अभिक्रियाओं के लिए जैसे, अभिकर्मक और उत्पाद के अणु संरचना और सूत्र जानना आवश्यक होता है। ऑक्सीकरण संख्या विधि निम्नलिखित चरणों के माध्यम से अब सबसे बेहतर रूप से दिखाई देती है:
चरण 1: प्रत्येक अभिकर्मक और उत्पाद के लिए सही सूत्र लिखें।
चरण 2: अभिक्रिया में ऑक्सीकरण संख्या में परिवर्तन करने वाले परमाणुओं की पहचान करें। इसके लिए अभिक्रिया में सभी तत्वों की ऑक्सीकरण संख्या निर्धारित करें।
चर नंबर 3: प्रति परमाणु और उस परमाणु के अणु/आयन में ऑक्सीकरण संख्या में वृद्धि या कमी की गणना करें। यदि ये समान नहीं हैं, तो उपयुक्त संख्या से गुणा करें ताकि ये समान हो जाएं। (अगर आप देखते हैं कि दो पदार्थ अपचयित हो रहे हैं और कुछ ऑक्सीकृत नहीं हो रहा है या विपरीत, तो कुछ गलत है। या तो अभिकर्मक या उत्पाद के सूत्र गलत हैं या ऑक्सीकरण संख्या का सही तरीके से निर्धारण नहीं किया गया है।)
चरण 4: यदि अभिक्रिया पानी में हो रही है, तो आयनों की भाग लेने की पुष्टि करें, तथा उचित ओर अभिक्रिया के समीकरण में $\mathrm{H}^{+}$ या $\mathrm{OH}^{-}$ आयनों को जोड़ें ताकि अभिकर्मक और उत्पाद के कुल आयनिक आवेश समान हों। यदि अभिक्रिया अम्लीय विलयन में की जा रही है, तो समीकरण में $\mathrm{H}^{+}$ आयनों का उपयोग करें; यदि क्षारीय विलयन में, तो $\mathrm{OH}^{-}$ आयनों का उपयोग करें।
चरण 5: अभिक्रिया के दोनों ओर हाइड्रोजन अणुओं की संख्या समान बनाने के लिए पानी $\left(\mathrm{H_2} \mathrm{O}\right)$ अणुओं को अभिकर्मक या उत्पाद में जोड़ें। अब, ऑक्सीजन अणुओं की संख्या की भी जांच करें। यदि अभिकर्मक और उत्पाद में ऑक्सीजन अणुओं की संख्या समान है, तो तब समीकरण संतुलित रेडॉक्स अभिक्रिया को प्रस्तुत करता है।
अब हम नीचे दिए गए कुछ समस्याओं की सहायता से विधि में शामिल कदमों की व्याख्या करेंगे:
समस्या 8.8
पोटेशियम डाइक्रोमेट(VI), $\mathrm{K_2} \mathrm{Cr_2} \mathrm{O_7}$ के सोडियम सल्फाइट, $\mathrm{Na_2} \mathrm{SO_3}$ के साथ अम्लीय विलयन में अभिक्रिया के लिए आयनिक समीकरण लिखें, जो क्रोमियम(III) आयन और सल्फेट आयन देती है।
हल
कदम 1: असंगठित आयनिक समीकरण है:
$$ \mathrm{Cr_2} \mathrm{O_7}^{2-}(\mathrm{aq})+\mathrm{SO_3}^{2-}(\mathrm{aq}) \rightarrow \mathrm{Cr}^{3+}(\mathrm{aq}) +\mathrm{SO_4}^{2-}(\mathrm{aq}) $$
$$
चरण 2: $\mathrm{Cr}$ और $\mathrm{S}$ के ऑक्सीकरण संख्या निर्धारित करें
$\stackrel{+6}{\mathrm{Cr_2}} \stackrel{-2}{\mathrm{O_7}^{2-}}(\mathrm{aq})+\stackrel{+4-2}{\mathrm{SO_3}^{2-}}(\mathrm{aq}) \rightarrow \stackrel{+3}{\mathrm{Cr}}(\mathrm{aq})+ \stackrel{+6-2}{\mathrm{SO_4}{ }^{2-}}(\mathrm{aq})$
इससे ज्ञात होता है कि डाइक्रोमेट आयन ऑक्सीकारक है और सल्फाइट आयन अपचायक है।
चरण 3: ऑक्सीकरण संख्या में वृद्धि और कमी की गणना करें और उन्हें समान करें: चरण-2 से हम देख सकते हैं कि क्रोमियम और सल्फर के ऑक्सीकरण संख्या में परिवर्तन हो रहा है। क्रोमियम के ऑक्सीकरण संख्या +6 से +3 में घट जाती है। समीकरण के दाहिने तरफ क्रोमियम के ऑक्सीकरण संख्या में +3 की कमी होती है। सल्फर के ऑक्सीकरण संख्या +4 से +6 में बढ़ जाती है। समीकरण के दाहिने तरफ सल्फर के ऑक्सीकरण संख्या में +2 की वृद्धि होती है। ऑक्सीकरण संख्या में वृद्धि और कमी को समान बनाने के लिए, समीकरण के दाहिने तरफ क्रोमियम आयन के सामने संख्या 2 लगाएं और सल्फेट आयन के सामने संख्या 3 लगाएं और समीकरण के दोनों तरफ क्रोमियम और सल्फर के परमाणुओं को संतुलित करें। इस प्रकार हमें प्राप्त होता है
$\stackrel{+6}{\mathrm{Cr_2}} \stackrel{-2}{\mathrm{O_7}^{2-}}(\mathrm{aq})+3\stackrel{+4-2}{\mathrm{SO_3}^{2-}}(\mathrm{aq}) \rightarrow \stackrel{+3}{\mathrm{Cr^{3+}}}(\mathrm{aq})+ 3\stackrel{+6-2}{\mathrm{SO_4}{ }^{2-}}(\mathrm{aq})$
चरण 4: चूंकि अभिक्रिया अम्लीय माध्यम में हो रही है, और इसके अतिरिक्त दोनों ओर आयनिक आवेश बराबर नहीं है, तो बाईं ओर $8 \mathrm{H}^{+}$ जोड़ें ताकि आयनिक आवेश बराबर हो जाए
$$ \mathrm{Cr_2} \mathrm{O_7}^{2-}(\mathrm{aq})+3\mathrm{SO_3}^{2-}(\mathrm{aq}) + 8\mathrm{H^+} \rightarrow 2\mathrm{Cr}^{3+}(\mathrm{aq}) + 3\mathrm{SO_4}^{2-}(\mathrm{aq})
$$
स्टेप 5: अंत में, हाइड्रोजन परमाणुओं की संख्या गिनें, और बाईं ओर उचित संख्या में जल अणु (अर्थात, $4 \mathrm{H_2} \mathrm{O}$ ) जोड़ें ताकि ऑक्सीकरण अपचयन परिवर्तन संतुलित हो जाए।
$$ \begin{aligned} & \mathrm{Cr_2} \mathrm{O_7}^{2-}(\mathrm{aq})+3 \mathrm{SO_3}{ }^{2-}(\mathrm{aq})+8 \mathrm{H}^{+}(\mathrm{aq}) \rightarrow 2 \mathrm{Cr}^{3+}(\mathrm{aq})+3 \mathrm{SO_4}{ }^{2-}(\mathrm{aq})+4 \mathrm{H_2} \mathrm{O}(\mathrm{l}) \end{aligned} $$
समस्या 8.9
परमैंगनेट आयन, क्षारीय माध्यम में ब्रोमाइड आयन के साथ अभिक्रिया करके मैंगनीज डाइऑक्साइड और ब्रोमेट आयन देता है। अभिक्रिया के संतुलित आयनिक समीकरण को लिखिए।
हल
कदम 1: नाभिकीय आयनिक समीकरण है:
$\mathrm{MnO_4}^{-}(\mathrm{aq})+\mathrm{Br}^{-}(\mathrm{aq}) \rightarrow \mathrm{MnO_2}(\mathrm{~s})+\mathrm{BrO_3}^{-}(\mathrm{aq})$
कदम 2: $\mathrm{Mn}$ और $\mathrm{Br}$ के ऑक्सीकरण संख्या का निर्धारण करें
$\stackrel{+7}{\mathrm{Mn}} \mathrm{O_4}^{-} (\mathrm{aq})+\stackrel{-1}{\mathrm{Br^-}}(\mathrm{aq}) \longrightarrow \stackrel{+4}{\mathrm{Mn}} \mathrm{O_2}(\mathrm{s})+\stackrel{+5}{\mathrm{BrO_3}^{-}}(\mathrm{aq})$
इससे पता चलता है कि परमैंगनेट आयन ऑक्सीकारक है और ब्रोमाइड आयन अपचायक है।
चरण 3: ऑक्सीकरण संख्या में वृद्धि और कमी की गणना करें और वृद्धि को कमी के बराबर कर दें।
$\stackrel{+7}{2 \mathrm{Mn}} \mathrm{O_4}^{-} (\mathrm{aq})+\stackrel{-1}{\mathrm{Br}}(\mathrm{aq}) \rightarrow 2 \stackrel{+4}{\mathrm{Mn}} \mathrm{O_2}(\mathrm{~s})+ \stackrel{+5}{\mathrm{Br}} \mathrm{O_3}^{-}(\mathrm{aq})$
चरण 4: चूंकि अभिक्रिया कार्बोहाइड्रेट माध्यम में हो रही है और दोनों तरफ आयनिक आवेश बराबर नहीं है, तो दाहिने तरफ $2 \mathrm{OH}^{-}$ आयन जोड़ें ताकि आयनिक आवेश बराबर हो जाए।
$2 \mathrm{MnO_4}^{-}(\mathrm{aq})+\mathrm{Br}^{-}(\mathrm{aq}) \rightarrow 2 \mathrm{MnO_2}(\mathrm{~s})+ \mathrm{BrO_3}^{-}(\mathrm{aq})+2 \mathrm{OH}^{-}(\mathrm{aq})$
स्टेप 5: अंत में, हाइड्रोजन परमाणुओं की संख्या गिनें और उचित संख्या में जल अणु (अर्थात एक $\mathrm{H_2} \mathrm{O}$ अणु) को बाईं ओर जोड़ें ताकि ऑक्सीकरण अपचयन परिवर्तन संतुलित हो जाए।
$$ 2 \mathrm{MnO_4}^{-}(\mathrm{aq})+\mathrm{Br}^{-}(\mathrm{aq})+\mathrm{H_2} \mathrm{O}(\mathrm{l}) \rightarrow 2 \mathrm{MnO_2}(\mathrm{~s}) +\mathrm{BrO_3}^{-}(\mathrm{aq})+2 \mathrm{OH}^{-}(\mathrm{aq})
$$
(ब) आधा अभिक्रिया विधि: इस विधि में, दो आधा अभिक्रिया अलग-अलग संतुलित किए जाते हैं और फिर एक संतुलित अभिक्रिया के रूप में एक साथ जोड़ दिए जाते हैं।
मान लीजिए हम एक अभिक्रिया के समीकरण को संतुलित कर रहे हैं जो $\mathrm{Fe}^{2+}$ आयनों के $\mathrm{Fe}^{3+}$ आयनों में ऑक्सीकरण को दिखाती है, जो एसिडिक माध्यम में डाइक्रोमेट आयन $\left(\mathrm{Cr_2} \mathrm{O_7}\right)^{2-}$ द्वारा होता है, जहां $\mathrm{Cr_2} \mathrm{O_7}^{2-}$ आयन $\mathrm{Cr}^{3+}$ आयन में अवांछित हो जाते हैं। इस कार्य में शामिल निम्नलिखित कदम हैं।
कदम 1: अभिक्रिया के लिए असंतुलित समीकरण को आयनिक रूप में बनाएँ :
Step 2: Balance the atoms other than oxygen and hydrogen in each half-reaction. For the oxidation half-reaction, the iron atoms are already balanced. For the reduction half-reaction, balance the chromium atoms :
$$\mathrm{Fe}^{2+}(\mathrm{aq})+\mathrm{Cr_2} \mathrm{O_7}^{2-}(\mathrm{aq}) \rightarrow \mathrm{Fe}^{3+}(\mathrm{aq})+\mathrm{Cr}^{3+}(\mathrm{aq}) \tag{8.50}$$
चरण 2: समीकरण को आधा अभिक्रिया में विभाजित करें:
ऑक्सीकरण आधा अभिक्रिया :
$$\mathrm{Fe}^{2+}(\mathrm{aq}) \rightarrow \mathrm{Fe}^{3+}(\mathrm{aq})$$
अपचयन आधा अभिक्रिया :
$$\mathrm{Cr}^{+6}{ } _{2} \mathrm{O} _{7}^{2-}(\mathrm{aq}) \rightarrow \mathrm{Cr}^{+3}(\mathrm{aq})$$
चरण 3: प्रत्येक आधा अभिक्रिया में $O$ और $\mathrm{H}$ के अलावा अन्य परमाणुओं को संतुलित करें। यहाँ ऑक्सीकरण आधा अभिक्रिया $\mathrm{Fe}$ परमाणुओं के संतुलन के लिहाज से पहले से ही संतुलित है। अपचयन आधा अभिक्रिया में, $\mathrm{Cr}^{3+}$ को 2 से गुणा करके $\mathrm{Cr}$ परमाणुओं को संतुलित कर लिया जाता है।
$$\mathrm{Cr_2} \mathrm{O_7}^{2-}(\mathrm{aq}) \rightarrow 2 \mathrm{Cr}^{3+}(\mathrm{aq}) \tag{8.53}$$
चरण 4: अम्लीय माध्यम में होने वाली अभिक्रियाओं के लिए, $\mathrm{O}$ परमाणुओं के संतुलन के लिए $\mathrm{H_2} \mathrm{O}$ और $\mathrm{H}^{+}$ के उपयोग करें।
इस प्रकार हमें प्राप्त होता है :
$$\mathrm{Cr_2} \mathrm{O_7}^{2-}(\mathrm{aq})+14 \mathrm{H}^{+}(\mathrm{aq}) \rightarrow 2 \mathrm{Cr}^{3+}(\mathrm{aq})+7 \mathrm{H_2} \mathrm{O}(\mathrm{l})\tag{8.54}$$
चरण 5: आधा अभिक्रिया के एक तरफ इलेक्ट्रॉन जोड़ें ताकि आवेश का संतुलन हो जाए। आवश्यकता पड़े तो दोनों आधा अभिक्रियाओं में इलेक्ट्रॉन की संख्या बराबर करें, इसके लिए एक या दोनों आधा अभिक्रियाओं को उपयुक्त संख्या से गुणा करें।
ऑक्सीकरण अर्ध-अभिक्रिया को आवेश के संतुलन के लिए इस प्रकार लिखा जाता है:
$$\mathrm{Fe}^{2+}(\mathrm{aq}) \rightarrow \mathrm{Fe}^{3+}(\mathrm{aq})+\mathrm{e}^{-} \tag{8.55}$$
अब अपचयन अर्ध-अभिक्रिया में बाईं ओर आठ से अधिक सकारात्मक आवेश हैं और दाईं ओर केवल छह सकारात्मक आवेश हैं। इसलिए, हम बाईं ओर छह इलेक्ट्रॉन जोड़ते हैं।
$$ \begin{equation*} \mathrm{Cr_2} \mathrm{O_7}^{2-}(\mathrm{aq})+14 \mathrm{H}^{+}(\mathrm{aq})+6 \mathrm{e}^{-} \rightarrow 2 \mathrm{Cr}^{3+}(\mathrm{aq})+ 7\mathrm{H_2O} \tag{8.56}
\end{equation*} $$
दोनों हाफ अभिक्रियाओं में इलेक्ट्रॉन की संख्या को समान बनाने के लिए, हम ऑक्सीकरण हाफ अभिक्रिया को 6 से गुणा करते हैं और इस प्रकार लिखते हैं :
$$6 \mathrm{Fe}^{2+}(\mathrm{aq}) \rightarrow 6 \mathrm{Fe}^{3+}(\mathrm{aq})+6 \mathrm{e}^{-} \tag{8.57}$$
चरण 6: हम दोनों हाफ अभिक्रियाओं को जोड़ते हैं ताकि समग्र अभिक्रिया प्राप्त की जा सके और प्रत्येक तरफ इलेक्ट्रॉन को खत्म कर दें। इससे नेट आयनिक समीकरण निम्नलिखित हो जाता है :
$$6 \mathrm{Fe}^{2+}(\mathrm{aq})+\mathrm{Cr_2} \mathrm{O_7}^{2-}(\mathrm{aq})+14 \mathrm{H}^{+}(\mathrm{aq}) \rightarrow 6 \mathrm{Fe}^{3+}(\mathrm{aq})+ 2 \mathrm{Cr}^{3+}(\mathrm{aq})+7 \mathrm{H_2} \mathrm{O}(\mathrm{l})$$
चरण 7: जांच करें कि समीकरण में दोनों तरफ समान प्रकार और संख्या में परमाणु तथा आवेश हों। इस अंतिम जांच से पता चलता है कि समीकरण परमाणुओं की संख्या और आवेशों के संदर्भ में पूर्ण रूप से संतुलित है।
किसी क्षारीय माध्यम में अभिक्रिया के लिए, सबसे पहले अम्लीय माध्यम में जैसे तरीके से परमाणुओं को संतुलित करें। फिर प्रत्येक $\mathrm{H}^{+}$ आयन के लिए समीकरण के दोनों तरफ समान संख्या में $\mathrm{OH}^{-}$ आयन जोड़ें। जहाँ $\mathrm{H}^{+}$ और $\mathrm{OH}^{-}$ समीकरण के एक ही तरफ उपस्थित हों, उन्हें $\mathrm{H_2} \mathrm{O}$ में संयोजित कर दें।
समस्या 8.10
बेसिक विलयन में परमैंगनेट(VII) आयन, $\mathrm{MnO_4}^{-}$ आयोडाइड आयन, $\mathrm{I}^{-}$ को अणुकृत आयोडीन $\left(\mathrm{I_2}\right)$ और मैंगनेज (IV) ऑक्साइड $\left(\mathrm{MnO_2}\right)$ बनाने में ऑक्सीकृत करता है। इस रेडॉक्स अभिक्रिया को प्रकट करने वाला संतुलित आयनिक समीकरण लिखिए।
हल
चरण 1: सबसे पहले हम आंतरिक आयनिक समीकरण लिखते हैं, जो इस प्रकार है:
$\mathrm{MnO_4}^{-}(\mathrm{aq})+\mathrm{I}^{-}(\mathrm{aq}) \rightarrow \mathrm{MnO_2}(\mathrm{~s})+\mathrm{I_2}(\mathrm{~s})$
स्टेप 2: दो आधी अभिक्रियाएं हैं:
$$ \begin{aligned} & \text { ऑक्सीकरण आधी अभिक्रिया : } \stackrel{-1}{\mathrm{I^-}} \mathrm{(aq)} \rightarrow \stackrel{0}{\mathrm{I_3}}(\mathrm{s}) \end{aligned} $$
$$ \begin{aligned} & \text { अपचयन आधी अभिक्रिया : } \stackrel{+7}{\mathrm{Mn}} \mathrm{O_4}^{-}\mathrm{(aq)} \rightarrow \stackrel{+4}{\mathrm{Mn}} \mathrm{O_2}(\mathrm{s}) \end{aligned} $$
स्टेप 3: ऑक्सीकरण आधी अभिक्रिया में I परमाणुओं के संतुलन के लिए, हम इसे इस तरह लिखते हैं:
$$ 2 \mathrm{I}^{-}(\mathrm{aq}) \rightarrow \mathrm{I_2}(\mathrm{~s})
$$
चरण 4: अपचयन अर्ध-अभिक्रिया में $O$ परमाणुओं के संतुलन के लिए, हम दाएं ओर दो जल अणु जोड़ते हैं:
$\mathrm{MnO_4}^{-}(\mathrm{aq}) \rightarrow \mathrm{MnO_2}$ (s) $+2 \mathrm{H_2} \mathrm{O}$ (l)
$\mathrm{H}$ परमाणुओं के संतुलन के लिए, हम बाएं ओर चार $\mathrm{H}^{+}$ आयन जोड़ते हैं:
$\mathrm{MnO_4}^{-}(\mathrm{aq})+4 \mathrm{H}^{+}(\mathrm{aq}) \rightarrow \mathrm{MnO_2}(\mathrm{~s})+2 \mathrm{H_2} \mathrm{O} \mathrm{(l)}$
क्योंकि अभिक्रिया एक क्षारीय विलयन में होती है, इसलिए चार $\mathrm{H}^{+}$ आयन के लिए, हम समीकरण के दोनों ओर चार $\mathrm{OH}^{-}$ आयन जोड़ते हैं:
$\mathrm{MnO_4}^{-}(\mathrm{aq})+4 \mathrm{H}^{+}(\mathrm{aq})+4 \mathrm{OH}^{-}(\mathrm{aq}) \rightarrow\mathrm{MnO_2}(\mathrm{~s})+2 \mathrm{H_2} \mathrm{O}(\mathrm{l})+4 \mathrm{OH}^{-}(\mathrm{aq})$
$\mathrm{H}^{+}$ और $\mathrm{OH}^{-}$ आयनों को पानी के साथ बदलने पर, परिणामी समीकरण निम्नलिखित होता है:
$\mathrm{MnO_4}^{-}(\mathrm{aq})+2 \mathrm{H_2} \mathrm{O}(\mathrm{l}) \rightarrow \mathrm{MnO_2}(\mathrm{~s})+4 \mathrm{OH}^{-}(\mathrm{aq})$
स्टेप 5 : इस स्टेप में हम दोनों अर्ध-समीकरणों के आवेश को उस प्रकार संतुलित करते हैं जैसा कि नीचे दिखाया गया है:
$$ \begin{gathered} 2 \mathrm{I}^{-}(\mathrm{aq}) \rightarrow \mathrm{I_2}(\mathrm{~s})+2 \mathrm{e}^{-} \\ \mathrm{MnO_4}^{-}(\mathrm{aq})+2 \mathrm{H_2} \mathrm{O}(\mathrm{l})+3 \mathrm{e}^{-} \rightarrow \mathrm{MnO_2}(\mathrm{~s}) +4 \mathrm{OH}^{-}(\mathrm{aq}) \end{gathered} $$
अब इलेक्ट्रॉन की संख्या को समान करने के लिए, हम ऑक्सीकरण अर्ध-अभिक्रिया को 3 से और अपचयन अर्ध-अभिक्रिया को 2 से गुणा करते हैं।
$6 \mathrm{I}^{-}(\mathrm{aq}) \rightarrow 3 \mathrm{I_2}$ (s) $+6 \mathrm{e}^{-}$
$2 \mathrm{MnO_4}^{-}(\mathrm{aq})+4 \mathrm{H_2} \mathrm{O}$ (l) $+6 \mathrm{e}^{-} \rightarrow 2 \mathrm{MnO_2}(\mathrm{~s})+8 \mathrm{OH}^{-}(\mathrm{aq})$
स्टेप 6: दो आधे अभिक्रियाएं जोड़ें ताकि इलेक्ट्रॉनों को दोनों ओर से खत्म करके शुद्ध अभिक्रिया प्राप्त की जा सके।
$6 \mathrm{I}^{-}(\mathrm{aq})+2 \mathrm{MnO_4}^{-}(\mathrm{aq})+4 \mathrm{H_2} \mathrm{O}(\mathrm{l}) \rightarrow 3 \mathrm{I_2}(\mathrm{~s})+ 2 \mathrm{MnO_2}(\mathrm{~s})+8 \mathrm{OH}^{-}(\mathrm{aq})$
स्टेप 7: अंतिम जांच दिखाती है कि समीकरण दोनों ओर परमाणुओं और आवेशों की संख्या के संदर्भ में संतुलित है।
8.3.3 रेडॉक्स अभिक्रियाएं टिट्रेशन के आधार के रूप में
अम्ल-क्षार प्रणालियों में हम एक विधि के साथ सामना करते हैं जिसे टिट्रेशन कहते हैं, जिसके माध्यम से एक विलयन की शक्ति दूसरे विलयन के विस्थापन के आधार पर निर्धारित की जाती है। इसी तरह, रेडॉक्स प्रणालियों में टिट्रेशन विधि का उपयोग किया जा सकता है ताकि एक अपचायक/ऑक्सीकारक की शक्ति का निर्धारण किया जा सके, जिसके लिए एक रेडॉक्स संवेदी सूचक का उपयोग किया जाता है। रेडॉक्स टिट्रेशन में सूचक के उपयोग को नीचे दिखाया गया है:
(i) एक स्थिति में, अपचायक या ऑक्सीकारक खुद गहरा रंग रखता है, जैसे कि परमैंगनेट आयन, $\mathrm{MnO_4}^{-}$. यहाँ $\mathrm{MnO_4}^{-}$ स्वयं एक सूचक के रूप में कार्य करता है। इस स्थिति में दृश्य अंत बिंदु तब प्राप्त होता है जब अपचायक $\left(\mathrm{Fe}^{2+}\right.$ या $\left.\mathrm{C_2} \mathrm{O_4}{ }^{2-}\right)$ के अंतिम अंश का ऑक्सीकरण हो जाता है और $\mathrm{MnO_4}^{-}$ के सांद्रण के नीचे $10^{-6} \mathrm{~mol} \quad \mathrm{dm}^{-3}$ $\left(10^{-6} \mathrm{~mol} \mathrm{~L}^{-1}\right)$ के बराबर एक पहली बार लंबे समय तक लाल रंग के झांकी के रूप में दिखाई देता है। यह तुलना बिंदु के बाद रंग के अतिरिक्त अंश को न्यूनतम बनाता है, जहाँ अपचायक और ऑक्सीकारक के मोल अनुपात में समानता होती है।
(ii) यदि कोई ड्रामैटिक स्वतः रंग परिवर्तन नहीं होता (जैसे कि $\mathrm{MnO_4}^{-}$ के तिर्यकन के साथ), तो इंडिकेटर उसके अंतिम बिट के उपयोग के बाद तुरंत ऑक्सीकृत हो जाते हैं, जिससे ड्रामैटिक रंग परिवर्तन होता है। सर्वोत्तम उदाहरण $\mathrm{Cr_2} \mathrm{O_7}^{2-}$ द्वारा दिया जाता है, जो स्वयं इंडिकेटर नहीं होता, लेकिन तुल्यांक बिंदु के ठीक बाद इंडिकेटर पदार्थ डाइफेनिलएमीन को ऑक्सीकृत करता है और एक तीव्र नीला रंग उत्पन्न करता है, जिससे अंतिम बिंदु के अंत को संकेत देता है।
(iii) अब एक और विधि है जो दिलचस्प और बहुत सामान्य है। इसका उपयोग केवल उन रासायनिक पदार्थों के लिए सीमित है जो $\mathrm{I}^{-}$ आयनों को ऑक्सीकृत कर सकते हैं, जैसे कि, उदाहरण के लिए,
$$\mathrm{Cu}(\mathrm{II}) : 2 \mathrm{Cu}^{2+}(\mathrm{aq})+4 \mathrm{I}^{-}(\mathrm{aq}) \rightarrow \mathrm{Cu_2} \mathrm{I_2}(\mathrm{~s})+\mathrm{I_2}(\mathrm{aq}) \tag{8.59}$$
इस विधि के आधार इस तथ्य पर है कि आयोडीन आयोडीन एवं स्टार्च के साथ गहरा नीला रंग देती है तथा इसके थायोसल्फेट आयन $\left(\mathrm{S_2} \mathrm{O_3}{ }^{2-}\right)$ के साथ बहुत विशिष्ट प्रतिक्रिया होती है, जो भी एक रेडॉक्स प्रतिक्रिया है:
$$\mathrm{I_2}(\mathrm{aq})+2 \mathrm{~S_2} \mathrm{O_3}^{2-}(\mathrm{aq}) \rightarrow 2 \mathrm{I}^{-}(\mathrm{aq})+\mathrm{S_4} \mathrm{O_6}{ }^{2-}(\mathrm{aq}) \tag{8.60}$$
$\mathrm{I_2}$, हालांकि पानी में अघुलनशील है, लेकिन $\mathrm{KI}$ वाले विलयन में $\mathrm{KI_3}$ के रूप में उपस्थित रहता है।
$\mathrm{Cu}^{2+}$ आयनों के आयोडाइड आयनों पर क्रिया के दौरान आयोडीन के विमुक्त होने के बाद स्टार्च के योग करने पर एक तीव्र नीला रंग दिखाई देता है। जैसे ही आयोडीन थायोसल्फेट आयनों द्वारा उपयोग कर लिया जाता है, यह रंग चले जाते हैं। इस प्रकार, समापन बिंदु को आसानी से ट्रैक किया जा सकता है और शेष भाग केवल आस्टोइकियोमेट्रिक गणना ही है।
8.3.4 ऑक्सीकरण संख्या के अवधारणा की सीमाएं
जैसा कि आप उपरोक्त चर्चा में देख चुके हैं, रेडॉक्स प्रक्रियाओं के अवधारणा के साथ समय के साथ विकास हो रहा है। यह विकास प्रक्रिया जारी रहती है। वास्तव में, हाल के दिनों में, ऑक्सीकरण प्रक्रिया को परमाणुओं के आसपास इलेक्ट्रॉन घनत्व में कमी के रूप में और अपचयन प्रक्रिया को इलेक्ट्रॉन घनत्व में वृद्धि के रूप में देखा जाता है।
8.4 रेडॉक्स अभिक्रियाएँ एवं इलेक्ट्रोड प्रक्रियाएँ
अभिक्रिया (8.15) के संगत प्रयोग को यदि जिंक छड़ को कॉपर सल्फेट विलयन में डुबोया जाए तो इसे भी देखा जा सकता है। रेडॉक्स अभिक्रिया होती है और अभिक्रिया के दौरान जिंक जिंक आयन में ऑक्सीकृत हो जाता है और कॉपर आयन कॉपर के धातु के रूप में अपचयित हो जाते हैं क्योंकि इलेक्ट्रॉन जिंक से कॉपर आयन में सीधे स्थानांतरित होते हैं। इस अभिक्रिया के दौरान ऊष्मा भी उत्सर्जित होती है। अब हम इस प्रयोग को इस प्रकार बदल देते हैं कि एक ही रेडॉक्स अभिक्रिया के लिए इलेक्ट्रॉन के स्थानांतरण के लिए अप्रत्यक्ष रूप से आवश्यकता होती है। इसके लिए जिंक धातु को कॉपर सल्फेट विलयन से अलग कर देना आवश्यक होता है। हम एक बीकर में कॉपर सल्फेट विलयन लेते हैं और इसमें एक कॉपर छड़ या छटी रखते हैं। हम दूसरे बीकर में जिंक सल्फेट विलयन लेते हैं और इसमें एक जिंक छड़ या छटी रखते हैं। अब दोनों बीकरों में अभिक्रिया होती है और प्रत्येक बीकर में धातु और उसके लवण विलयन के संपर्क बिंदु पर एक ही वस्तु के अपचयित एवं ऑक्सीकृत रूप उपस्थित होते हैं। ये वस्तुएँ अपचयन एवं ऑक्सीकरण अर्ध-अभिक्रियाओं में वस्तु के रूप को प्रतिनिधित्व करती हैं। रेडॉक्स युग्म को एक वस्तु के ऑक्सीकृत एवं अपचयित रूप के साथ एक साथ विद्यमान होने के रूप में परिभाषित किया जाता है जो एक ऑक्सीकरण या अपचयन अर्ध-अभिक्रिया में भाग ले रही हो।
यह एक लंबवत रेखा या एक विभाजक चिह्न (जैसे स्थैतिक/समाधान) द्वारा ऑक्सीकृत रूप और अपचयित रूप के बीच अलग करके दर्शाया जाता है। उदाहरण के लिए, इस प्रयोग में दो रेडॉक्स युग्म $\mathrm{Zn}^{2+} / \mathrm{Zn}$ और $\mathrm{Cu}^{2+} / \mathrm{Cu}$ के रूप में दर्शाए गए हैं। दोनों मामलों में, ऑक्सीकृत रूप को अपचयित रूप के पहले लिखा जाता है।

चित्र 8.3 डानियल सेल के सेट-अप। जिंक के ऑक्सीकरण के कारण एनोड पर उत्पन्न इलेक्ट्रॉन बाहरी परिपथ के माध्यम से कैथोड तक जाते हैं, जहां ये कॉपर आयनों को अपचयित करते हैं। सेल के भीतर परिपथ को लवण पुली के माध्यम से आयनों के प्रवाह द्वारा पूरा किया जाता है। ध्यान देने योग्य है कि विद्युत धारा की दिशा इलेक्ट्रॉन प्रवाह की दिशा के विपरीत होती है।
अब हम तांबा सल्फेट विलयन वाले बीकर और जिंक सल्फेट विलयन वाले बीकर को एक दूसरे के ओर रखते हैं (चित्र 7.3)। हम दोनों बीकरों के विलयन को एक लवण पुली (एक U-नली जिसमें पोटेशियम क्लोराइड या एमोनियम नाइट्रेट के घोल आमतौर पर आग लगाकर ठोस हो जाते हैं और बाद में ठंडा होकर जेल जैसे पदार्थ बन जाते हैं) के माध्यम से जोड़ते हैं। यह दोनों विलयनों के बीच विद्युत संपर्क प्रदान करता है लेकिन उनके बीच मिश्रण करने की अनुमति नहीं देता। जिंक और कॉपर के छड़ों को एक धातु तार के माध्यम से जोड़ा जाता है जिसमें एमीटर और स्विच के लिए सुविधा होती है। चित्र 7.3 में दिखाए गए सेट-अप को डानियल सेल कहा जाता है। जब स्विच बंद नहीं होता है, तो दोनों बीकरों में कोई अभिक्रिया नहीं होती और धातु तार में कोई विद्युत धारा प्रवाह नहीं होती। जैसे ही स्वि चालू हो जाता है, हम निम्नलिखित अवलोकन करते हैं:
1. इलेक्ट्रॉनों के स्थानांतरण अब $\mathrm{Zn}$ से $\mathrm{Cu}^{2+}$ के सीधे नहीं हो रहा है बल्कि दो छड़ों को जोड़ने वाले धातु के तार के माध्यम से हो रहा है, जैसा कि तीर से स्पष्ट है जो धारा के प्रवाह को दर्शाता है।
2. एक बीकर में घोल से दूसरे बीकर में घोल तक बिजली के प्रवाह के लिए आयनों के अपवाह द्वारा नमक के पुल के माध्यम से होता है। हम जानते हैं कि धारा के प्रवाह के लिए केवल ताम्बा और जस्ता छड़ों के बीच विभवांतर की आवश्यकता होती है, जिसे यहाँ इलेक्ट्रोड के रूप में जाना जाता है।
प्रत्येक इलेक्ट्रोड के साथ संबंधित संभावना को इलेक्ट्रोड विभव के रूप में जाना जाता है। यदि इलेक्ट्रोड अभिक्रिया में भाग लेने वाले प्रत्येक अणु की सांद्रता एक (यदि इलेक्ट्रोड अभिक्रिया में कोई गैस उपस्थित हो, तो इसे 1 वायुमंडलीय दबाव पर सीमित कर दिया जाता है) और इसके अलावा अभिक्रिया $298 \mathrm{~K}$ पर की जाती है, तो प्रत्येक इलेक्ट्रोड के विभव को मानक इलेक्ट्रोड विभव कहा जाता है। परंपरा के अनुसार, हाइड्रोजन इलेक्ट्रोड का मानक इलेक्ट्रोड विभव $\left(\mathrm{E}^{\ominus}\right)$ 0.00 वोल्ट होता है। प्रत्येक इलेक्ट्रोड प्रक्रिया के इलेक्ट्रोड विभव मान उस प्रक्रिया में सक्रिय अणु के ऑक्सीकृत/अपचयित रूप में रहने की संभावना के संबंध में मापदंड होता है। एक नकारात्मक $\mathrm{E}^{\ominus}$ यह दर्शाता है कि रेडॉक्स युग्म $\mathrm{H}^{+} / \mathrm{H_2}$ युग्म की तुलना में एक शक्तिशाली अपचायक एजेंट है। एक धनात्मक $\mathrm{E}^{\ominus}$ यह दर्शाता है कि रेडॉक्स युग्म $\mathrm{H}^{+} / \mathrm{H_2}$ युग्म की तुलना में एक कम शक्तिशाली अपचायक एजेंट है। मानक इलेक्ट्रोड विभव बहुत महत्वपूर्ण होते हैं और हम उनसे बहुत सारी उपयोगी जानकारी प्राप्त कर सकते हैं। कुछ चयनित इलेक्ट्रोड प्रक्रियाओं (अपचयन अभिक्रियाओं) के मानक इलेक्ट्रोड विभव के मान तालिका 8.1 में दिए गए हैं। आप कक्षा XII में इलेक्ट्रोड अभिक्रियाओं और सेलों के बारे में अधिक जानेंगे।
सारणी 7.1 298 K पर मानक इलेक्ट्रोड विभव
आयन जलीय विषम रूप में उपस्थित होते हैं और $H_2O$ तरल रूप में होता है; गैस और ठोस क्रमशः g और s द्वारा दर्शाए जाते हैं।

-
एक नकारात्मक E यह दर्शाता है कि रेडॉक्स युग्म $ H^{+} / H_2 $ युग्म की तुलना में एक शक्तिशाली अपचायक एजेंट है।
-
एक धनात्मक E यह दर्शाता है कि रेडॉक्स युग्म $ H^{+} / H_2 $ युग्म की तुलना में एक कम शक्तिशाली अपचायक एजेंट है।
सारांश
रेडॉक्स अभिक्रियाएं एक महत्वपूर्ण श्रेणी की अभिक्रियाएं होती हैं जहां ऑक्सीकरण और अपचयन एक साथ होते हैं। तीन स्तरीय अवधारणाएं, जैसे कि क्लासिकल, इलेक्ट्रॉनिक और ऑक्सीकरण संख्या, जो कि पाठ्यपुस्तकों में आमतौर पर उपलब्ध होती हैं, विस्तार से प्रस्तुत की गई हैं। ऑक्सीकरण, अपचयन, ऑक्सीकरण एजेंट (ऑक्सीडेंट) और अपचयन एजेंट (रेडक्टेंट) को प्रत्येक अवधारणा के अनुसार देखा गया है। ऑक्सीकरण संख्या को एक सांतर नियमों के अनुसार निर्धारित किया जाता है। ऑक्सीकरण संख्या और आयन-इलेक्ट्रॉन विधि दोनों ही रेडॉक्स अभिक्रियाओं के समीकरण लिखने में उपयोगी तरीके हैं। रेडॉक्स अभिक्रियाएं चार श्रेणियों में वर्गीकृत होती हैं: संयोजन, विघटन, विस्थापन और अपचयन अभिक्रियाएं। यहां रेडॉक्स जोड़े और इलेक्ट्रोड प्रक्रियाओं की अवधारणा को परिचय दिया गया है। रेडॉक्स अभिक्रियाएं इलेक्ट्रोड प्रक्रियाओं और सेलों के अध्ययन में व्यापक रूप से उपयोग की जाती हैं।
अभ्यास
8.1 निम्नलिखित प्रतियोगियों में अंतर्गत तत्वों के ऑक्सीकरण संख्या का निर्धारण कीजिए:
(a) $\mathrm{NaH_2} \mathrm{PO_4}$
(b) $\mathrm{NaHSO_4}$
(c) $\mathrm{H_4} \mathrm{P_2} \mathrm{O_7}$
(d) $\mathrm{K_2} \mathrm{MnO_4}$
(e) $\mathrm{CaO_2}$
(f) $\mathrm{NaBH_4}$
(g) $\mathrm{H_2} \underline {\mathrm{S}_2} \mathrm{O_7}$
(h) $\mathrm{KAl}\left(\mathrm{SO_4}\right)_{2} \cdot 12 \mathrm{H_2} \mathrm{O}$
उत्तर दिखाएँ
उत्तर
(a) $NaH_2 \underline PO_4$
मान लीजिए $P$ के ऑक्सीकरण संख्या $x$ है।
हम जानते हैं कि,
$Na$ के ऑक्सीकरण संख्या $+1$ है
$H$ के ऑक्सीकरण संख्या $+1$ है
$O$ के ऑक्सीकरण संख्या $-2$ है
$\Rightarrow \stackrel{+1}{Na} \stackrel{+1}{H} \stackrel{x}{P} \stackrel{-2}{O_4}$
तब हमें प्राप्त होता है
$1(+1)+2(+1)+1(x)+4(-2)=0$
$\Rightarrow 1+2+x-8=0$
$\Rightarrow x=+5$
अतः $P$ के ऑक्सीकरण संख्या +5 है।
(b) $NaHSO_4$
$\stackrel{+1}{Na} \stackrel{+1}{H} \stackrel{x}{S} O_4$
तब हमें प्राप्त होता है
$1(+1)+1(+1)+x+4(-2)=0$
$\Rightarrow 1+1+x-8=0$
$\Rightarrow x=+6$
अतः $S$ के ऑक्सीकरण संख्या +6 है।
(c) $H_4 \underline P_2 O_7$ $\stackrel{+1}{H_4} \stackrel{x}{P} \stackrel{-2}O_7$
तब हमें प्राप्त होता है
$4(+1)+2(x)+7(-2)=0$
$\Rightarrow 4+2 x-14=0$
$\Rightarrow 2 x=+10$
$\Rightarrow x=+5$
अतः $P$ के ऑक्सीकरण संख्या +5 है।
(d) $K_2 \underline {MnO_4}$
$ \stackrel{+1}{K_2} \stackrel{x}{Mn} \stackrel{-2}{O_4} $
तब हमें प्राप्त होता है
$2(+1)+x+4(-2)=0$
$\Rightarrow 2+x-8=0$
$\Rightarrow x=+6$
अतः $Mn$ के ऑक्सीकरण संख्या +6 है।
(e) $CaO \underline O_2$
$\stackrel{+2}{Ca} \stackrel{x_O^{2}}{ }$
तब हमें प्राप्त होता है
$(+2)+2(x)=0$
$\Rightarrow 2+2 x=0$
$\Rightarrow x=-1$
अतः $O$ के ऑक्सीकरण संख्या - 1 है।
(f) $NaBH_4$
$\stackrel{+1}{Na} \stackrel{x}B^{-1} H_4$
तब हमें प्राप्त होता है
$1(+1)+1(x)+4(-1)=0$
$\Rightarrow 1+x-4=0$
$\Rightarrow x=+3$
अतः $B$ के ऑक्सीकरण संख्या +3 है।
(g) $H_2 \underline S_2 O_7$
$\stackrel{+1}{H_2} S_2 \stackrel{-2}{O}$
तब, हमें यह प्राप्त होता है
$2(+1)+2(x)+7(-2)=0$
$\Rightarrow 2+2 x-14=0$
$\Rightarrow 2 x=12$
$\Rightarrow x=+6$
इसलिए, $S$ के ऑक्सीकरण संख्या +6 है ।
(ह) $KAl(\underline SO_4)_2 \cdot 12 H_2 O$
$\stackrel{+1}{KAl}(\stackrel{x^{2}-SO_4}{ })_2 .12 \stackrel{+1}{H_2} \stackrel{-2}{O}$
तब, हमें यह प्राप्त होता है
$1(+1)+1(+3)+2(x)+8(-2)+24(+1)+12(-2)=0$
$\Rightarrow 1+3+2 x-16+24-24=0$
$\Rightarrow 2 x=12$
$\Rightarrow x=+6$
या,
हम पानी के अणु को नगण्य मान सकते हैं क्योंकि यह एक उदासीन अणु है। तब, पानी के अणु के सभी परमाणुओं के ऑक्सीकरण संख्या को शून्य मान लिया जा सकता है। इसलिए, पानी के अणु को नगण्य कर देने के बाद हमें यह प्राप्त होता है
$1(+1)+1(+3)+2(x)+8(-2)=0$
$\Rightarrow 1+3+2 x-16=0$
$\Rightarrow 2 x=12$
$\Rightarrow x=+6$
इसलिए, $S$ के ऑक्सीकरण संख्या +6 है ।
8.2 प्रत्येक निम्नलिखित में अंतर्रिक तत्वों के ऑक्सीकरण संख्या क्या है और आप अपने परिणाम को कैसे तर्क देंगे?
(a) $\mathrm{KI_3}$
(b) $\mathrm{H_2} \underline {\mathrm{S}_4} \mathrm{O_6}$
(c) $\mathrm{Fe_3} \mathrm{O_4}$
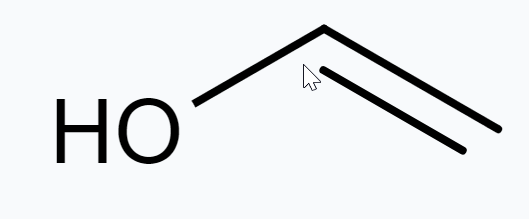
(d) $\mathrm{CH_3} \mathrm{CH_2} \mathrm{OH}$
(e) $\mathrm{CH_3} \mathrm{COOH}$
उत्तर दिखाएं
उत्तर
(a) $KI_3$
$KI_3$ में $K$ के ऑक्सीकरण संख्या (O.N.) +1 है। इसलिए, $I$ के औसत ऑक्सीकरण संख्या $-\frac{1}{3}$ है। हालांकि, ऑक्सीकरण संख्या भिन्न नहीं हो सकती। इसलिए, हमें $KI_3$ के संरचना को ध्यान में रखते हुए ऑक्सीकरण अवस्था ज्ञात करनी होगी।
एक $KI_3$ अणु में, आयोडीन के एक परमाणु आयोडीन अणु के साथ सहसंयोजक संयोजक आबंध बनाता है।
$ \stackrel{+1}{K^+}[\stackrel{0}{I-}\stackrel{0}{I} \longleftarrow \stackrel{-1}{I} ]^{-} $
इसलिए, $KI_3$ अणु में, $I_2$ अणु बनाने वाले दो I परमाणुओं के ऑक्सीकरण संख्या 0 है, जबकि सहसंयोजक आबंध बनाने वाले I परमाणु के ऑक्सीकरण संख्या -1 है।
(b) $H_2 \underline S_4 O_6$
$ \stackrel{+1}{H_2} \stackrel{\stackrel{x}{S} O_4 \stackrel{-2}{O}}{6} $
अब, $2(+1)+4(x)+6(-2)=0$
$\Rightarrow 2+4 x-12=0$
$\Rightarrow 4 x=10$
$\Rightarrow x=+2 \frac{1}{2}$
हालांकि, O.N. भिन्न भिन्न ऑक्सीकरण अवस्था में उपस्थित हो सकता है। अतः, अणु में S के अलग-अलग ऑक्सीकरण अवस्था में उपस्थित होना आवश्यक है।
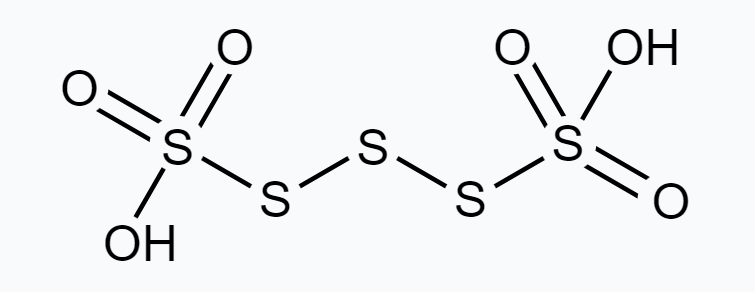
चार $S$ परमाणुओं में से दो के O.N. +5 है और बाकी दो के O.N. 0 है।
(c) $\underline Fe_3 O_4$
ऑक्सीजन के O.N. को -2 मानकर, लोहा के O.N. को ${ }^{+2 \frac{2}{3}}$ पाया जाता है। हालांकि, O.N. भिन्न भिन्न ऑक्सीकरण अवस्था में उपस्थित हो सकता है। यहां, तीन लोहा परमाणुओं में से एक के O.N. +2 है और बाकी दो के O.N. +3 है।
$\stackrel{+2}{FeO}, \stackrel{+3}{F} e_2 O_3$
(d) $CH_3 \underline CH_2 OH$
$2(x)+6(+1)+1(-2)=0$
या, $2 x+4=0$
या, $x=-2$
अतः, C के O.N. -2 है।
(e)
$CH_3 \underline {COOH}$
$2(x)+4(+1)+2(-2)=0$
या, $2 x=0$
या, $x=0$
हालांकि, 0 C के औसत O.N. है। इस अणु में उपस्थित दो कार्बन परमाणु अलग-अलग वातावरण में उपस्थित हैं। अतः, वे एक ही ऑक्सीकरण अवस्था में नहीं हो सकते। अतः, $C$ अणु $CH_3 COOH$ में +2 और -2 ऑक्सीकरण अवस्था में उपस्थित है।
8.3 निम्नलिखित अभिक्रियाओं के लिए बताइए कि ये रेडॉक्स अभिक्रियाएं क्यों हैं:
(a) $\mathrm{CuO}$ (s) $+\mathrm{H_2}$ (g) $\rightarrow \mathrm{Cu}$ (s) $+\mathrm{H_2} \mathrm{O}$ (g)
(b) $\mathrm{Fe_2} \mathrm{O_3}$ (s) $+3 \mathrm{CO}$ (g) $\rightarrow 2 \mathrm{Fe}(\mathrm{s})+3 \mathrm{CO_2}$ (g)
(c) $4 \mathrm{BCl_3}(\mathrm{~g})+3 \mathrm{LiAlH_4}(\mathrm{~s}) \rightarrow 2 \mathrm{~B_2} \mathrm{H_6}(\mathrm{~g})+3 \mathrm{LiCl}(\mathrm{s})+3 \mathrm{AlCl_3}$ (s)
(d) $2 \mathrm{~K}(\mathrm{~s})+\mathrm{F_2}(\mathrm{~g}) \rightarrow 2 \mathrm{~K}^{+} \mathrm{F}^{-}(\mathrm{s})$
(e) $4 \mathrm{NH_3}(\mathrm{~g})+5 \mathrm{O_2}(\mathrm{~g}) \rightarrow 4 \mathrm{NO}(\mathrm{g})+6 \mathrm{H_2} \mathrm{O}(\mathrm{g})$
उत्तर दिखाएं
Answer
(a)
$ CuO _{(s)}+H _{2(g)} \longrightarrow Cu _{(s)}+H_2 O _{(g)} $
हम दिए गए अभिक्रिया में शामिल प्रत्येक तत्व के ऑक्सीकरण संख्या को लिखें:
$\stackrel{+2}{Cu} \stackrel{-2}{O}(s)+\stackrel{0}{H}(g) \longrightarrow \stackrel{0}{C} u _{(s)}+\stackrel{+1}H_2 \stackrel{-2}O _{(g)}$
यहाँ, $Cu$ की ऑक्सीकरण संख्या $CuO$ में +2 से $Cu$ में 0 तक घट जाती है, अर्थात $CuO$ $Cu$ में अपचयित हो जाता है। एक ओर, $H$ की ऑक्सीकरण संख्या $H_2$ में 0 से $H_2 O$ में +1 तक बढ़ जाती है, अर्थात $H_2$ $H_2 O$ में ऑक्सीकृत हो जाता है। अतः यह अभिक्रिया एक रेडॉक्स अभिक्रिया है।
(b)
$ Fe_2 O _{3(s)}+3 CO _{(g)} \longrightarrow 2 Fe _{(s)}+3 CO _{2(g)} $
हम दिए गए अभिक्रिया में शामिल प्रत्येक तत्व के ऑक्सीकरण संख्या को लिखें:
$ \stackrel{+3}{Fe_2} \stackrel{-2}{O_3} + \stackrel{+2 -2}{3CO_{(g)}} \longrightarrow 2\stackrel{0}{Fe_{(s)}} + 3\stackrel{+4-2}{CO_{2(g)}} $
यहाँ, $Fe$ की ऑक्सीकरण संख्या $Fe_2 O_3$ में +3 से $Fe$ में 0 तक घट जाती है, अर्थात $Fe_2 O_3$ $Fe$ में अपचयित हो जाता है। दूसरी ओर, $C$ की ऑक्सीकरण संख्या $CO$ में +2 से $CO_2$ में +4 तक बढ़ जाती है, अर्थात $CO$ $CO_2$ में ऑक्सीकृत हो जाता है। अतः दी गई अभिक्रिया एक रेडॉक्स अभिक्रिया है।
(c)
$ 4 BCl _{3(g)}+3 LiAlH _{4(s)} \longrightarrow 2 B_2 H _{6(g)}+3 LiCl _{(s)}+3 AlCl _{3(s)} $
दी गई अभिक्रिया में शामिल प्रत्येक तत्व की ऑक्सीकरण संख्या को इस प्रकार दर्शाया जा सकता है:
$ 4 \stackrel{+3}{B} \stackrel{-1}{Cl_{3(g)}} + \stackrel{+1+3-1}{\quad 3LiAlH_{4(s)}} \longrightarrow \stackrel{-3 \quad +1}{\quad 2B_2 H_{6(g)}} + \stackrel{+1-1}{3LiCl_{(s)}} + \stackrel{+3 -1}{\quad 3AlCl_{3(s)}} $
इस अभिक्रिया में, $B$ की ऑक्सीकरण संख्या $BCl_3$ में +3 से $B_2 H_6$ में -3 तक घट जाती है, अर्थात $BCl_3$ $B_2 H_6$ में अपचयित हो जाता है। एक ओर, $H$ की ऑक्सीकरण संख्या $LiAlH_4$ में -1 से $B_2 H_6$ में +1 तक बढ़ जाती है, अर्थात $LiAlH_4$ $B_2 H_6$ में ऑक्सीकृत हो जाता है। अतः दी गई अभिक्रिया एक रेडॉक्स अभिक्रिया है।
(d) $2 K _{(s)}+F _{2(g)} \longrightarrow 2 K^{+} F^{-} _{(s)}$
दिए गए अभिक्रिया में प्रत्येक तत्व के ऑक्सीकरण संख्या को निम्नलिखित रूप में प्रस्तुत किया जा सकता है:
$2 \stackrel{0}K _{(s)}+\stackrel{0}F _{2(g)}^{\longrightarrow} 2 \stackrel{+1}K^{+} \stackrel{-1}F _{(s)}^{-}$
इस अभिक्रिया में, $K$ के ऑक्सीकरण संख्या $K$ में 0 से $KF$ में +1 तक बढ़ जाती है, अर्थात $K$ के $KF$ में ऑक्सीकरण हो जाता है। दूसरी ओर, $F$ के ऑक्सीकरण संख्या $F_2$ में 0 से $KF$ में -1 तक घट जाती है, अर्थात $F_2$ के $KF$ में अपचयन हो जाता है।
इसलिए, उपरोक्त अभिक्रिया एक रेडॉक्स अभिक्रिया है।
(e)
$ 4NH_{3(g)} + 5O_{2(g)} \longrightarrow 4NO_{(g)} + 6H_2O_{(g)} $
दिए गए अभिक्रिया में प्रत्येक तत्व के ऑक्सीकरण संख्या को निम्नलिखित रूप में प्रस्तुत किया जा सकता है:
$4 \stackrel{-3}N _{3(g)}+5 \stackrel{0}O _{2(g)}^{\longrightarrow} 4 \stackrel{+2}{N} \stackrel{-2}O _{(g)}+6 \stackrel{+1}H_2 \stackrel{-2}O _{(g)}$
यहाँ, $N$ के ऑक्सीकरण संख्या $NH_3$ में -3 से $NO$ में +2 तक बढ़ जाती है। दूसरी ओर, $O_2$ के ऑक्सीकरण संख्या $O_2$ में 0 से $NO$ और $H_2 O$ में -2 तक घट जाती है, अर्थात $O_2$ के $NO$ और $H_2 O$ में अपचयन हो जाता है। इसलिए, दिए गए अभिक्रिया एक रेडॉक्स अभिक्रिया है।
8.4 फ्लूओरीन बर्फ के साथ अभिक्रिया करता है और निम्नलिखित परिवर्तन होता है:
$\mathrm{H_2} \mathrm{O}(\mathrm{s})+\mathrm{F_2}(\mathrm{~g}) \rightarrow \mathrm{HF}(\mathrm{g})+\mathrm{HOF}(\mathrm{g})$
इस अभिक्रिया को रेडॉक्स अभिक्रिया के रूप में बताइए।
उत्तर दिखाएं
Answer
दिए गए अभिक्रिया में शामिल प्रत्येक परमाणु के ऑक्सीकरण संख्या को उसके प्रतीक के ऊपर लिखा जा सकता है:
$ \stackrel{+1 -2}{H_2O} + \stackrel{0}{F} \longrightarrow \stackrel{+1-1}{HF} + \stackrel{+1-2+1}{HOF} $
यहाँ, हम देखते हैं कि $F$ के ऑक्सीकरण संख्या $F_2$ में 0 से $HOF$ में +1 तक बढ़ जाती है। इसके अलावा, $F$ के ऑक्सीकरण संख्या $F_2$ में 0 से $HF$ में -1 तक घट जाती है। इसलिए, उपरोक्त अभिक्रिया में $F$ एक साथ ऑक्सीकृत और अपचयित होता है। इसलिए, दिए गए अभिक्रिया एक रेडॉक्स अभिक्रिया है।
8.5 $\mathrm{H_2} \mathrm{SO_5}, \mathrm{Cr_2} \mathrm{O_7}^{2-}$ और $\mathrm{NO_3}^{-}$ में सल्फर, क्रोमियम और नाइट्रोजन के ऑक्सीकरण संख्या की गणना कीजिए। इन यौगिकों की संरचना के बारे में सुझाव दीजिए। त्रुटि की गणना कीजिए।
उत्तर दिखाएँ
उत्तर
(i)
$\stackrel{+1}{H_2} \stackrel{x}{S^{-2}} S_5$
$2(+1)+1(x)+5(-2)=0$
$\Rightarrow 2+x-10=0$
$\Rightarrow x=+8$
हालाँकि, $S$ के ऑक्सीकरण अवस्था +8 नहीं हो सकती। $S$ में छह बाह्य इलेक्ट्रॉन होते हैं। इसलिए, $S$ के ऑक्सीकरण अवस्था +6 से अधिक नहीं हो सकती। $H_2 SO_5$ की संरचना निम्नलिखित है:
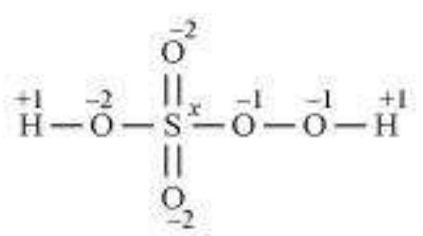
अब, $2(+1)+1(x)+3(-2)+2(-1)=0$
$\Rightarrow 2+x-6-2=0$
$\Rightarrow x=+6$
इसलिए, $S$ के ऑक्सीकरण अवस्था +6 है।
(ii)
${ }^{Cr} r_2 O_7^{2-}$
$2(x)+7(-2)=-2$
$\Rightarrow 2 x-14=-2$
$\Rightarrow x=+6$
यहाँ, $Cr_2 O_7^{2-}$ में $Cr$ के ऑक्सीकरण अवस्था के बारे में कोई त्रुटि नहीं है।
$Cr_2 O_7^{2-}$ की संरचना निम्नलिखित है:
यहाँ, दोनों $Cr$ परमाणुओं के ऑक्सीकरण अवस्था +6 है।
(iii) $\stackrel{x}{N} \stackrel{2-}{O_3^{-}}$
$1(x)+3(-2)=-1$
$\Rightarrow x-6=-1$
$\Rightarrow x=+5$
यहाँ, $NO_3^{-}$ में $N$ के ऑक्सीकरण अवस्था के बारे में कोई त्रुटि नहीं है।
$NO_3^{-}$ की संरचना निम्नलिखित है:
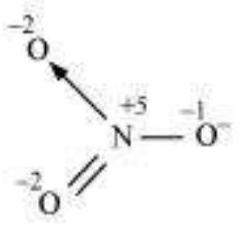
$N$ परमाणु के ऑक्सीकरण अवस्था +5 है।
8.6 निम्नलिखित यौगिकों के सूत्र लिखिए:
(a) रту क्लोराइड (II)
(b) निकल (II) सल्फेट
(c) टिन (IV) ऑक्साइड
(d) थैलियम (I) सल्फेट
(e) लोहा (III) सल्फेट
(f) क्रोमियम (III) ऑक्साइड
उत्तर दिखाएँ
उत्तर
(a) रту (II) क्लोराइड:
$HgCl_2$
(b) निकल (II) सल्फेट:
$NiSO_4$
(c) टिन (IV) ऑक्साइड:
$SnO_2$
(d) थैलियम (I) सल्फेट:
$TI_2 SO_4$
(e) लोहा (III) सल्फेट:
$Fe_2(SO_4)_3$
(f) क्रोमियम (III) ऑक्साइड:
$Cr_2 O_3$
8.7 कार्बन के ऑक्सीकरण अवस्था -4 से +4 तक और नाइट्रोजन के ऑक्सीकरण अवस्था -3 से +5 तक दिखाने वाले यौगिकों की सूची सुझाएँ।
उत्तर दिखाएँ
उत्तर
कार्बन के ऑक्सीकरण अवस्था (-4 से +4) के बीच परिवर्तन कर सकने वाले पदार्थों की सूची निम्नलिखित तालिका में दी गई है।
| पदार्थ | कार्बन की ऑक्सीकरण अवस्था (O.N.) |
|---|---|
| $CH_2 Cl_2$ | 0 |
| $ClC \equiv CCl$ | +1 |
| $HCA \equiv CH$ | $- 1$ |
| $CHCl_3, CO$ | +2 |
| $CH_3 Cl$ | $- 2$ |
| $Cl_3 C - CCl_3$ | +3 |
| $H_3 C - CH_3$ | -3 |
| $CCl_4- CO_2$ | +4 |
| $CH_4$ | -4 |
नाइट्रोजन के ऑक्सीकरण अवस्था (-3 से +5) के बीच परिवर्तन कर सकने वाले पदार्थों की सूची निम्नलिखित तालिका में दी गई है।
| पदार्थ | नाइट्रोजन की ऑक्सीकरण अवस्था (O.N.) |
|---|---|
| $N_2$ | 0 |
| $N_2 O$ | +1 |
| $N_2 H_2$ | $- 1$ |
| $NO$ | +2 |
| $N_2 H_4$ | $-2$ |
| $N_2 O_3$ | +3 |
| $NH_3$ | $- 3$ |
| $NO_2$ | +4 |
| $N_2 O_5$ | +5 |
8.8 सल्फर डाइऑक्साइड और हाइड्रोजन पेरॉक्साइड अपने प्रतिक्रियाओं में ऑक्सीकारक और अपचायक दोनों के रूप में कार्य कर सकते हैं, जबकि ओजोन और नाइट्रिक अम्ल केवल ऑक्सीकारक के रूप में कार्य करते हैं। क्यों?
उत्तर दिखाएं
उत्तर
सल्फर डाइऑक्साइड $(SO_2)$ में, सल्फर $(S)$ की ऑक्सीकरण अवस्था (O.N.) +4 है और सल्फर की ऑक्सीकरण अवस्था की संभावित श्रेणी +6 से -2 है।
इसलिए, $SO_2$ एक ऑक्सीकारक और अपचायक दोनों के रूप में कार्य कर सकता है।
हाइड्रोजन पेरॉक्साइड $(H_2 O_2)$ में, ऑक्सीजन $(O)$ की ऑक्सीकरण अवस्था -1 है और ऑक्सीजन की ऑक्सीकरण अवस्था की संभावित श्रेणी 0 से -2 है। ऑक्सीजन कभी-कभी +1 और +2 के ऑक्सीकरण अवस्था भी प्राप्त कर सकती है। इसलिए, $H_2 O_2$ एक ऑक्सीकारक और अपचायक दोनों के रूप में कार्य कर सकता है।
ओजोन $(O_3)$ में, ऑक्सीजन $(O)$ की ऑक्सीकरण अवस्था शून्य है और ऑक्सीजन की ऑक्सीकरण अवस्था की संभावित श्रेणी $O$ से -2 है। इसलिए, ऑक्सीजन की ऑक्सीकरण अवस्था इस मामले में केवल कम हो सकती है। इसलिए, $O_3$ केवल ऑक्सीकारक के रूप में कार्य करता है।
नाइट्रिक अम्ल $(HNO_3)$ में, नाइट्रोजन $(N)$ की ऑक्सीकरण अवस्था +5 है और नाइट्रोजन की ऑक्सीकरण अवस्था की संभावित श्रेणी +5 से -3 है। इसलिए, नाइट्रोजन की ऑक्सीकरण अवस्था इस मामले में केवल कम हो सकती है। इसलिए, $HNO_3$ केवल ऑक्सीकारक के रूप में कार्य करता है।
8.9 निम्नलिखित प्रतिक्रियाओं को ध्यान में रखें:
(a) $6 \mathrm{CO_2}(\mathrm{~g})+6 \mathrm{H_2} \mathrm{O}(\mathrm{l}) \rightarrow \mathrm{C_6} \mathrm{H_12} \mathrm{O_6}(\mathrm{aq})+6 \mathrm{O_2}(\mathrm{~g})$
(b) $\mathrm{O_3}(\mathrm{~g})+\mathrm{H_2} \mathrm{O_2}(\mathrm{l}) \rightarrow \mathrm{H_2} \mathrm{O}(\mathrm{l})+2 \mathrm{O_2}(\mathrm{~g})$
क्यों इन अभिक्रियाओं को इस तरह लिखना अधिक उपयुक्त है :
(a) $6 \mathrm{CO_2}(\mathrm{~g})+12 \mathrm{H_2} \mathrm{O}(\mathrm{l}) \rightarrow \mathrm{C_6} \mathrm{H_12} \mathrm{O_6}(\mathrm{aq})+6 \mathrm{H_2} \mathrm{O}(\mathrm{l})+6 \mathrm{O_2}(\mathrm{~g})$
(b) $\mathrm{O_3}$ (g) $+\mathrm{H_2} \mathrm{O_2}$ (l) $\rightarrow \mathrm{H_2} \mathrm{O}(\mathrm{l})+\mathrm{O_2}(\mathrm{~g})+\mathrm{O_2}$ (g)
इन (a) और (b) रेडॉक्स अभिक्रियाओं के पथ की जांच करने की एक तकनीक का सुझाव भी दें।
उत्तर दिखाएं
Answer
(a) प्रकाश संश्लेषण की प्रक्रिया में दो चरण होते हैं।
चरण 1:
$H_2 O$ के अपघटन से $H_2$ और $O_2$ प्राप्त होते हैं।
$ 2 H_2 O _{(l)} \longrightarrow 2 H _{2(g)}+O _{2(g)} $
चरण 2:
चरण 1 में उत्पन्न $H_2$ कार्बन डाइऑक्साइड को अपचयित करता है, जिससे ग्लूकोज $(C_6 H _{12} O_6)$ और $H_2 O$ बनते हैं।
$ 6 CO _{2(g)}+12 H _{2(g)} \longrightarrow C_6 H _{12} O _{6(s)}+6 H_2 O _{(l)} $
अब, प्रक्रिया की सामग्री अभिक्रिया निम्नलिखित रूप में दी गई है:
$ \begin{aligned} 2 H_2 O _{(i)} & .\longrightarrow 2 H _{2(g)}+O _{2(g)}] \times 6 \\ 6 CO _{2(g)}+12 H _{2(g)} & \longrightarrow C_6 H _{12} O _{6(g)}+6 H_2 O _{(l)} \\ 6 CO _{2(g)}+12 H_2 O _{(l)} & \longrightarrow C_6 H _{12} O _{6(g)}+6 H_2 O _{(l)}+6 O _{2(g)} \end{aligned} $
इस अभिक्रिया को ऊपर दिए गए रूप में लिखना अधिक उपयुक्त है क्योंकि प्रकाश संश्लेषण की प्रक्रिया में पानी के अणु भी उत्पन्न होते हैं।
इस अभिक्रिया के पथ की जांच करने के लिए $H_2 O^{18}$ के रेडियोधर्मी अणु के स्थान पर $H_2 O$ का उपयोग किया जा सकता है।
(b) $O_3$ और $H_2 O_2$ दोनों अभिकर्मकों से $O_2$ उत्पन्न होता है। इस कारण, $O_2$ दो बार लिखा गया है।
दी गई अभिक्रिया में दो चरण होते हैं। पहले, $O_3$ के अपघटन से $O_2$ और $O$ बनते हैं। दूसरे चरण में, $H_2 O_2$ पहले चरण में उत्पन्न $O$ के साथ अभिक्रिया करता है, जिससे $H_2 O$ और $O_2$ बनते हैं।
$ \begin{aligned} & O _{3(g)} \longrightarrow O _{2(g)}+O _{(g)} \\
& H_2 O _{2(l)}+O _{(g)} \longrightarrow H_2 O _{(l)}+O _{2(g)} \\ & H_2 O _{2(l)}+O _{3(g)} \longrightarrow H_2 O _{(l)}+O _{2(g)}+O _{2(g)} \end{aligned} $
इस अभिक्रिया के पथ का अध्ययन $H_2 O_2{ }^{18}$ या $O_3^{18}$ का उपयोग करके किया जा सकता है।
8.10 यौगिक $\mathrm{AgF_2}$ अनावश्यक यौगिक है। हालांकि, यदि इसका निर्माण होता है, तो यह एक बहुत मजबूत ऑक्सीकारक के रूप में कार्य करता है। क्यों?
उत्तर दिखाएं
Answer
$\mathrm{AgF_2}$ में $Ag$ की ऑक्सीकरण अवस्था +2 है। लेकिन, +2 $Ag$ की अनावश्यक ऑक्सीकरण अवस्था है। अतः, जब $\mathrm{AgF_2}$ का निर्माण होता है, तो सिल्वर तेजी से एक इलेक्ट्रॉन ग्रहण करता है ताकि $Ag^{+}$ का निर्माण हो सके। इससे $Ag$ की ऑक्सीकरण अवस्था +2 से एक अधिक स्थायी अवस्था +1 में घट जाती है। इस कारण $\mathrm{AgF_2}$ एक बहुत मजबूत ऑक्सीकारक के रूप में कार्य करता है।
8.11 जब एक ऑक्सीकारक एवं एक अपचायक एजेंट के बीच अभिक्रिया होती है, तो अपचायक एजेंट अधिक मात्रा में होता है तो एक निम्न ऑक्सीकरण अवस्था वाला यौगिक बनता है और ऑक्सीकारक एजेंट अधिक मात्रा में होता है तो एक उच्च ऑक्सीकरण अवस्था वाला यौगिक बनता है। इस कथन की पुष्टि करें तीन उदाहरणों के माध्यम से।
उत्तर दिखाएं
Answer
जब एक ऑक्सीकारक एवं एक अपचायक एजेंट के बीच अभिक्रिया होती है, तो अपचायक एजेंट अधिक मात्रा में होता है तो एक निम्न ऑक्सीकरण अवस्था वाला यौगिक बनता है और ऑक्सीकारक एजेंट अधिक मात्रा में होता है तो एक उच्च ऑक्सीकरण अवस्था वाला यौगिक बनता है। इस कथन की पुष्टि निम्नलिखित तीन उदाहरणों के माध्यम से की जा सकती है:
(i) $P_4$ एक अपचायक एजेंट है और $F_2$ एक ऑक्सीकारक एजेंट है।
यदि $P_4$ की अधिक मात्रा $F_2$ के साथ अभिक्रिया करती है, तो $PF_3$ बनता है, जहां $P$ की ऑक्सीकरण अवस्था +3 है।
P_4 \text{ (excess) }+F_2 \longrightarrow \stackrel{+3}{P_3}
हालांकि, यदि $P_4$ को अधिक मात्रा में $F_2$ के साथ अभिक्रिया कराई जाती है, तो $PF_5$ बनता है, जहां $P$ की ऑक्सीकरण अवस्था +5 है।
P_4+F_2$ (excess) $\longrightarrow \stackrel{+5}{P_5}
(ii) $K$ एक अपचायक एजेंट है, जबकि $O_2$ एक ऑक्सीकारक एजेंट है।
यदि $K$ की अधिक मात्रा $O_2$ के साथ अभिक्रिया करती है, तो $K_2 O$ बनता है, जहां $O$ की ऑक्सीकरण अवस्था $-2$ है।
$ 4 K \text{ (अतिरिक्त) }+O_2 \longrightarrow 2 K_2{ }^{-2} $
हालांकि, यदि $K$ अतिरिक्त $O_2$ के साथ अभिक्रिया करे, तो $K_2 O_2$ बनेगा, जहां $O$ का ऑक्सीकरण संख्या $\hat{a} E^{\text{" }} 1$ होता है।
$ 2 K+O_2 \text{ (अतिरिक्त) } \longrightarrow K_2{\stackrel{-1}{O_2}}^{-1} $
(iii) C एक अपचायक एजेंट है, जबकि $O_2$ एक ऑक्सीकरण एजेंट के रूप में कार्य करता है।
यदि $C$ को अपर्याप्त मात्रा में $O_2$ की उपस्थिति में जलाया जाए, तो $CO$ उत्पन्न होगा, जहां $C$ का ऑक्सीकरण संख्या +2 होता है।
$ C(\text{ अतिरिक्त })+O_2 \longrightarrow \stackrel{+2}{C} O $
दूसरी ओर, यदि $C$ को अतिरिक्त $O_2$ के साथ जलाया जाए, तो $CO_2$ उत्पन्न होगा, जहां $C$ का ऑक्सीकरण संख्या +4 होता है।
$ C+O_2 \text{ (अतिरिक्त) } \longrightarrow \stackrel{+4}{CO_2} $
8.12 आप निम्नलिखित अवलोकनों के लिए कैसे गणना करेंगे?
(a) अतिरिक्त जिंक अम्लीय पोटैशियम परमैंगनेट और क्षारीय पोटैशियम परमैंगनेट दोनों ऑक्सीकरण एजेंट के रूप में उपयोग किए जाते हैं, लेकिन टॉलूईन से बेंजोइक अम्ल के निर्माण में हम एल्कोहॉलिक पोटैशियम परमैंगनेट का उपयोग करते हैं। क्यों? अभिक्रिया के लिए संतुलित रेडॉक्स समीकरण लिखें।
(b) जब अतिसांद्रित सल्फ्यूरिक अम्ल एक अकार्बनिक मिश्रण में क्लोराइड के साथ मिलाया जाता है, तो हमें रंगहीन, तीखा गंध वाली गैस $\mathrm{HCl}$ प्राप्त होती है, लेकिन यदि मिश्रण में ब्रोमाइड होता है तो हमें लाल वाष्प ब्रोमीन प्राप्त होती है। क्यों?
उत्तर दिखाएं
Answer
(a) टॉलूईन से बेंजोइक अम्ल के निर्माण में एल्कोहॉलिक पोटैशियम परमैंगनेट का उपयोग ऑक्सीकरण एजेंट के रूप में किया जाता है क्योंकि निम्नलिखित कारणों के कारण:
(i) उदासीन माध्यम में, अभिक्रिया के दौरान $OH^{-}$ आयन उत्पन्न होते हैं। इस कारण, अम्ल या क्षार के उत्पादन की लागत को कम कर सकते हैं।
(ii) $KMnO_4$ और एल्कोहॉल एक दूसरे के समान होते हैं क्योंकि दोनों ध्रुवीय होते हैं। टॉलूईन और एल्कोहॉल भी एक दूसरे के समान होते हैं क्योंकि दोनों कार्बनिक यौगिक होते हैं। एक समान माध्यम में अभिक्रियाएं एक विषम माध्यम की तुलना में तेजी से चल सकती हैं। इसलिए, एल्कोहॉल में $KMnO_4$ और टॉलूईन तेजी से अभिक्रिया कर सकते हैं।
उदासीन माध्यम में अभिक्रिया के लिए संतुलित रेडॉक्स समीकरण नीचे दिया गया है:
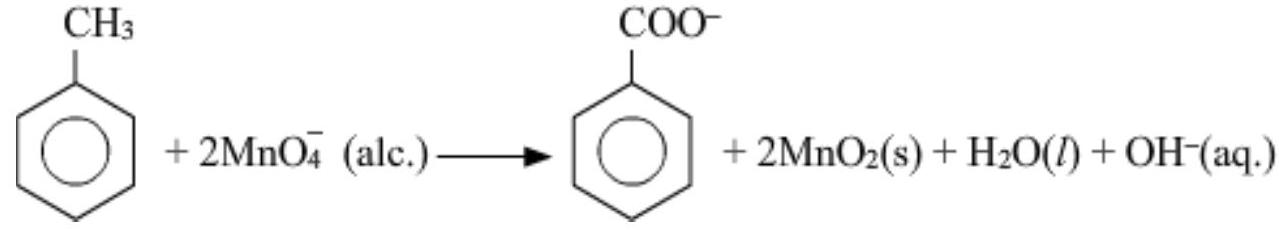
(b) जब सांद्र $H_2 SO_4$ एक अकार्बनिक मिश्रण में ब्रोमाइड के साथ मिलाया जाता है, तो शुरू में $HBr$ उत्पन्न होता है। $HBr$, एक मजबूत अपचायक एजेंट होता है जो $H_2 SO_4$ को $SO_2$ में घटाता है और लाल वाष्प ब्रोमीन के उत्पादन के साथ।
$ \begin{aligned} & 2 NaBr+2 H_2 SO_4 \longrightarrow 2 NaHSO_4+2 HBr \\ & 2 HBr+H_2 SO_4 \longrightarrow Br_2+SO_2+2 H_2 O \\ & \text{ (लाल वाष्प) } \end{aligned} $
लेकिन, जब सांद्र $H_2 SO_4$ एक अकार्बनिक मिश्रण में क्लोराइड के साथ मिलाया जाता है, तो एक तीखी गंध वाली गैस $(HCl)$ उत्पन्न होती है। $HCl$, एक कम अपचायक एजेंट होता है, जो $H_2 SO_4$ को $SO_2$ में घटाने में असमर्थ होता है
$2 NaCl+2 H_2 SO_4 \longrightarrow 2 NaHSO_4+2 HCl$
8.13 निम्नलिखित प्रतिक्रियाओं में प्रत्येक के लिए ऑक्सीकृत वस्तु, अपचायक वस्तु, ऑक्सीकारक एजेंट और अपचायक एजेंट की पहचान करें:
(a) $2 \mathrm{AgBr}$ (s) $+\mathrm{C_6} \mathrm{H_6} \mathrm{O_2}$ (aq) $2 \mathrm{Ag}(\mathrm{s})+2 \mathrm{HBr}$ (aq) $+\mathrm{C_6} \mathrm{H_4} \mathrm{O_2}$ (aq)
(b) $\mathrm{HCHO}(\mathrm{l})+2 \left[\mathrm{Ag} \left(\mathrm{NH_3} \right)_{2} \right]^{+}(\mathrm{aq})+3 \mathrm{OH}^{-}(\mathrm{aq}) + 2 \mathrm{Ag}(\mathrm{s})+\mathrm{HCOO}^{-}(\mathrm{aq})+4 \mathrm{NH_3}(\mathrm{aq})+ 2 \mathrm{H2O}\mathrm{(l)}$
(c) $\mathrm{HCHO} \mathrm{(l)}+2 \mathrm{Cu}^{2+}(\mathrm{aq})+5 \mathrm{OH}^{-}(\mathrm{aq}) \quad \mathrm{Cu} 2 \mathrm{O}(\mathrm{s})+\mathrm{HCOO}^{-}(\mathrm{aq})+3 \mathrm{H_2} \mathrm{O}(\mathrm{l})$
(d) $\mathrm{N_2} \mathrm{H_4}(\mathrm{l})+2 \mathrm{H_2} \mathrm{O_2}(\mathrm{l}) \rightarrow \mathrm{N_2}(\mathrm{~g})+4 \mathrm{H_2} \mathrm{O}(\mathrm{l})$
(e) $\mathrm{Pb}(\mathrm{s})+\mathrm{PbO_2}(\mathrm{~s})+2 \mathrm{H_2} \mathrm{SO_4}(\mathrm{aq}) \rightarrow 2 \mathrm{PbSO_4}(\mathrm{~s})+2 \mathrm{H_2} \mathrm{O}(\mathrm{l})$
उत्तर दिखाएँ
उत्तर
(a) ऑक्सीकृत पदार्थ $ \longrightarrow C_6H_6O_2 $
अपचयित पदार्थ $ \longrightarrow $ AgBr
ऑक्सीकारक $ \longrightarrow A g B r$
अपचायक $ \longrightarrow $ $C_6 H_6 O_2$
(b)ऑक्सीकृत पदार्थ $\longrightarrow $ HCHO
अपचयित पदार्थ $ \longrightarrow ,[Ag(NH_3)_2]^{+}$
ऑक्सीकारक $ \longrightarrow ,[Ag(NH_3)_2]^{+}$
अपचायक $ \longrightarrow $ HCHO
(c) ऑक्सीकृत पदार्थ $ \longrightarrow $ HCHO
अपचयित पदार्थ $ \longrightarrow Cu^{2+}$
ऑक्सीकारक $ \longrightarrow $ $Cu^{2+}$
अपचायक $ \longrightarrow $ $HCHO$
(d) ऑक्सीकृत पदार्थ $ \longrightarrow N_2 H_4$
अपचयित पदार्थ $ \longrightarrow $ $H_2 O_2$
ऑक्सीकारक $ \longrightarrow H_2 O_2$
अपचायक $\longrightarrow N_2H_4 $
(e) ऑक्सीकृत पदार्थ $ \longrightarrow $ Pb
अपचयित पदार्थ $ \longrightarrow PbO_2$
ऑक्सीकारक $ \longrightarrow $ $PbO_2$
अपचायक $\longrightarrow Pb $
8.14 अभिक्रियाएँ विचार करें :
$2 \mathrm{~S_2} \mathrm{O_3}^{2-}(\mathrm{aq})+\mathrm{I_2}(\mathrm{~s}) \rightarrow \mathrm{S_4} \mathrm{O_6}^{2-}(\mathrm{aq})+2 \mathrm{I}^{-}(\mathrm{aq})$
$\mathrm{S_2} \mathrm{O_3}^{2-}(\mathrm{aq})+2 \mathrm{Br_2}(\mathrm{l})+5 \mathrm{H_2} \mathrm{O}(\mathrm{l}) \rightarrow 2 \mathrm{SO_4}^{2-(\mathrm{aq})}+4 \mathrm{Br}^{-}(\mathrm{aq})+10 \mathrm{H}^{+}(\mathrm{aq})$
क्यों एक ही अपचायक, थायोसल्फेट, आयोडीन और ब्रोमीन के साथ अलग-अलग रूप से प्रतिक्रिया करता है?
उत्तर दिखाएँ
उत्तर
$S_2 O_3^{2-}$ में $S$ की औसत ऑक्सीकरण संख्या (O.N.) +2 है। ब्रोमीन ($Br_2$) आयोडीन ($I_2$) की तुलना में एक शक्तिशाली ऑक्सीकारक है, इसलिए यह $S_2 O_3^{2-}$ को $SO_4^{2-}$ में ऑक्सीकृत करता है, जहाँ $S$ की ऑक्सीकरण संख्या +6 है। हालाँकि, आयोडीन एक कमजोर ऑक्सीकारक है। इसलिए, यह $S_2 O_3^{2-}$ को $S_4 O_6^{2-}$ में ऑक्सीकृत करता है, जहाँ $S$ की औसत ऑक्सीकरण संख्या केवल +2.5 है। इस कारण, $S_2 O_3^{2-}$ आयोडीन और ब्रोमीन के साथ अलग-अलग प्रतिक्रिया करता है।
8.15 फ्लूरीन के ऑक्सीकारक और हाइड्रोहैलिक यौगिकों में से हाइड्रोआयोडिक अम्ल के अपचायक के रूप में सबसे अच्छा क्यों है, इसकी व्याख्या करें।
उत्तर दिखाएं
उत्तर
$F_2$ के $Cl^{-}$ को $Cl_2$ में ऑक्सीकृत करने, $Br^{-}$ को $Br_2$ में ऑक्सीकृत करने और $I^{-}$ को $I_2$ में ऑक्सीकृत करने के लिए निम्नलिखित अभिक्रिया होती है:
$ \begin{aligned} & F _{2(a q)}+2 Cl _{(s)}^{-} \longrightarrow 2 F _{(a q)}^{-}+Cl _{(g)} \\ & F _{2(a q)}+2 Br _{(a q)}^{-} \longrightarrow 2 F _{(a q)}^{-}+Br _{2(l)} \\ & F _{2(a q)}+2 I _{(a q)}^{-} \longrightarrow 2 F _{(a q)}^{-}+I _{2(s)} \end{aligned} $
दूसरी ओर, $Cl_2, Br_2$ और $I_2$ $F^{-}$ को $F_2$ में ऑक्सीकृत नहीं कर सकते। हैलोजन के ऑक्सीकारक शक्ति क्रम $I_2<Br_2<Cl_2<F_2$ होती है। इसलिए, फ्लूरीन हैलोजन में सबसे अच्छा ऑक्सीकारक है।
$HI$ और $HBr$ $H_2 SO_4$ को $SO_2$ में अपचायक कर सकते हैं, लेकिन $HCl$ और $HF$ नहीं कर सकते। इसलिए, $HI$ और $HBr$ $HCl$ और $HF$ से अधिक अपचायक होते हैं।
$2 HI+H_2 SO_4 \longrightarrow I_2+SO_2+2 H_2 O$
$2 HBr+H_2 SO_4 \longrightarrow Br_2+SO_2+2 H_2 O$
पुनः, $I^{-}$ $Cu^{2+}$ को $Cu^{+}$ में अपचायक कर सकता है, लेकिन $Br^{-}$ नहीं कर सकता।
$4 I _{(a q)}^{-}+2 Cu _{(a q)}^{2+} \longrightarrow Cu_2 I _{2(s)}+I _{2(a q)}$
इसलिए, हाइड्रोहैलिक यौगिकों में हाइड्रोआयोडिक अम्ल सबसे अच्छा अपचायक है।
इसलिए, हाइड्रोहैलिक अम्लों की अपचायक शक्ति क्रम $HF<HCl<HBr<HI$ होती है।
8.16 निम्नलिखित अभिक्रिया क्यों होती है?
$\mathrm{XeO_6}{ }^{4-}(\mathrm{aq})+2 \mathrm{~F}^{-}(\mathrm{aq})+6 \mathrm{H}^{+}(\mathrm{aq}) \rightarrow \mathrm{XeO_3}(\mathrm{~g})+\mathrm{F_2}(\mathrm{~g})+3 \mathrm{H_2} \mathrm{O}(\mathrm{l})$
इस अभिक्रिया से निष्कर्ष लें कि $\mathrm{Na_4} \mathrm{XeO_6}$ (जिसमें $\mathrm{XeO_6}^{4-}$ एक हिस्सा है) के बारे में क्या कहा जा सकता है।
उत्तर दिखाएं
उत्तर
दी गई अभिक्रिया $XeO_6^{4-}$ द्वारा $F^{-}$ के ऑक्सीकरण और $F^{-}$ द्वारा $XeO_6^{4-}$ के अपचयन के कारण होती है।
$\mathrm{XeO} _{6(\mathrm{aq})}^{4-}+2 \mathrm{~F}^{-1}{ } _{(\mathrm{aq})}+6 \mathrm{H} _{(\mathrm{aq})}^{+} \rightarrow \mathrm{XeO} _{3(\mathrm{~g})}^{+6}+\mathrm{F} _{2(\mathrm{~g})}^0+3 \mathrm{H} _2 \mathrm{O} _{(\mathrm{l})}$
इस अभिक्रिया में, Xe के ऑक्सीकरण संख्या (O.N.) $XeO_6^{4-}$ में +8 से $XeO_3$ में +6 तक घटती है और F के ऑक्सीकरण संख्या $F^{a \hat{e}}$ में -1 से $F_2$ में O में बढ़ जाती है।
इसलिए, हम निष्कर्ष निकाल सकते हैं कि $Na_4 XeO_6$ $F^{a \epsilon}$ से एक शक्तिशाली ऑक्सीकरण एजेंट है।
8.17 निम्नलिखित अभिक्रियाओं को ध्यान से देखें:
(a) $\mathrm{H_3} \mathrm{PO_2}(\mathrm{aq})+4 \mathrm{AgNO_3}(\mathrm{aq})+2 \mathrm{H_2} \mathrm{O}(\mathrm{l}) \rightarrow \mathrm{H_3} \mathrm{PO_4}(\mathrm{aq})+4 \mathrm{Ag}(\mathrm{s})+4 \mathrm{HNO_3}(\mathrm{aq})$
(b) $\mathrm{H_3} \mathrm{PO_2}$ (aq) $+2 \mathrm{CuSO_4}(\mathrm{aq})+2 \mathrm{H_2} \mathrm{O}$ (l) $\rightarrow \mathrm{H_3} \mathrm{PO_4}$ (aq) $+2 \mathrm{Cu}$ (s) $+\mathrm{H_2} \mathrm{SO_4}(\mathrm{aq})$
(c) $\mathrm{C_6} \mathrm{H_5} \mathrm{CHO}(\mathrm{l})+2\left[\mathrm{Ag}\left(\mathrm{NH_3}\right)_{2}\right]^{+}(\mathrm{aq})+3 \mathrm{OH}^{-}(\mathrm{aq}) \rightarrow \mathrm{C_6} \mathrm{H_5} \mathrm{COO}^{-}(\mathrm{aq})+2 \mathrm{Ag}(\mathrm{s})+ 4 \mathrm{NH_3}(\mathrm{aq})+2 \mathrm{H_2} \mathrm{O}(\mathrm{l})$
(d) $\mathrm{C_6} \mathrm{H_5} \mathrm{CHO}(\mathrm{l})+2 \mathrm{Cu}^{2+}(\mathrm{aq})+5 \mathrm{OH}^{-}(\mathrm{aq}) \rightarrow$ कोई परिवर्तन नहीं देखा गया।
इन अभिक्रियाओं से आप $Ag^{+}$ और $Cu^{2+}$ के व्यवहार के बारे में क्या निष्कर्ष निकाल सकते हैं?
उत्तर दिखाएं
उत्तर
$Ag^{+}$ और $Cu^{2+}$ क्रमशः अभिक्रिया (a) और (b) में ऑक्सीकरण एजेंट के रूप में कार्य करते हैं।
अभिक्रिया (c) में, $Ag^{+}$ $C_6 H_5 CHO$ को $C_6 H_5 COO$ में ऑक्सीकृत करता है, लेकिन अभिक्रिया (d) में, $Cu^{2+}$ $C_6 H_5 CHO$ को ऑक्सीकृत नहीं कर सकता।
इसलिए, हम कह सकते हैं कि $Ag^{+}$ $Cu^{2+}$ से एक शक्तिशाली ऑक्सीकरण एजेंट है।
8.18 आयन-इलेक्ट्रॉन विधि के माध्यम से निम्नलिखित रेडॉक्स अभिक्रियाओं को संतुलित करें:
(a) $\mathrm{MnO_4}^{-}$(aq) $+\mathrm{I}^{-}$(aq) $\rightarrow \mathrm{MnO_2}$ (s) $+\mathrm{I_2}$ (s) (क्षारीय माध्यम में)
(b) $\mathrm{MnO_4}^{-}(\mathrm{aq})+\mathrm{SO_2}$ (g) $\rightarrow \mathrm{Mn}^{2+}(\mathrm{aq})+\mathrm{HSO_4}^{-}$(aq) (अम्लीय विलयन में)
(c) $\mathrm{H_2} \mathrm{O_2}(\mathrm{aq})+\mathrm{Fe}^{2+}(\mathrm{aq}) \rightarrow \mathrm{Fe}^{3+}(\mathrm{aq})+\mathrm{H_2} \mathrm{O}$ (l) (अम्लीय विलयन में)
(d) $\mathrm{Cr_2} \mathrm{O_7}^{2-}+\mathrm{SO_2}(\mathrm{~g}) \rightarrow \mathrm{Cr}^{3+}(\mathrm{aq})+\mathrm{SO_4}{ }^{2-}$ (aq) (अम्लीय विलयन में)
उत्तर दिखाएं
उत्तर
(a) कदम 1: दिए गए अभिक्रिया में शामिल दो अर्ध-अभिक्रियाएं निम्नलिखित हैं:
ऑक्सीकरण अर्ध-अभिक्रिया: $\stackrel{-1}{I}(aq) \longrightarrow 0^{0}$
अपचयन अर्ध-अभिक्रिया:
$ \stackrel{+7}{MnO} H _{4(a q)}^{-} \longrightarrow \stackrel{+4}{M} nO _{2(a q)} $
कदम 2:
ऑक्सीकरण अर्ध-अभिक्रिया में I के संतुलन के लिए, हमें निम्नलिखित प्राप्त होता है:
$ 2 I _{(a q)}^{-} \longrightarrow I _{2(s)} $
अब, आवेश के संतुलन के लिए, हम अभिक्रिया के दाएं ओर $2 e^{-}$ जोड़ते हैं।
$ 2 I _{(a q)}^{-} \longrightarrow I _{2(s)}+2 e^{-} $
कदम 3:
अपचयन अर्ध-अभिक्रिया में, $Mn$ के ऑक्सीकरण अवस्था +7 से +4 में घट गई है। इसलिए, अभिक्रिया के बाएं ओर 3 इलेक्ट्रॉन जोड़े जाते हैं।
$ MnO _{4(a q)}^{-}+3 e^{-} \longrightarrow MnO _{2(a q)} $
अब, आवेश के संतुलन के लिए, हम अभिक्रिया के दाएं ओर $4 OH^{-}$ आयन जोड़ते हैं क्योंकि अभिक्रिया एक क्षारीय माध्यम में हो रही है।
$ MnO _{4(a q)}^{-}+3 e^{-} \longrightarrow MnO _{2(a q)}+4 OH^{-} $
कदम 4:
इस समीकरण में, दाएं ओर 6 O अणु और बाएं ओर 4 O अणु हैं। इसलिए, बाएं ओर दो जल अणु जोड़े जाते हैं।
$ MnO _{4(a q)}^{-}+2 H_2 O+3 e^{-} \longrightarrow MnO _{2(a q)}+4 OH^{-} $
कदम 5:
इलेक्ट्रॉन की संख्या के संतुलन के लिए, ऑक्सीकरण अर्ध-अभिक्रिया को 3 से गुणा कर देते हैं और अपचयन अर्ध-अभिक्रिया को 2 से गुणा कर देते हैं, तो हमें निम्नलिखित प्राप्त होता है:
$6 I _{(a q)}^{-} \longrightarrow 3 I _{2(s)}+6 e^{-}$
$2 MnO _{4(a q)}^{-}+4 H_2 O+6 e^{-} \longrightarrow 2 MnO _{2(s)}+8 OH _{(a q)}^{-}$
कदम 6:
दोनों अर्ध-अभिक्रियाओं को जोड़कर, हमें निम्नलिखित संतुलित रेडॉक्स अभिक्रिया प्राप्त होती है:
$ 6 I _{(a q)}^{-}+2 MnO _{4(a q)}^{-}+4 H_2 O _{(l)} \longrightarrow 3 I _{2(s)}+2 MnO _{2(s)}+8 OH _{(a q)}^{-} `
$
(b) भाग (a) में चरण अपनाते हुए, हमें ऑक्सीकरण अर्ध-अभिक्रिया के रूप में निम्नलिखित प्राप्त होती है:
$ SO _{2(g)}+2 H_2 O _{(j)} \longrightarrow HSO _{4(a q)}^{-}+3 H _{(a q)}^{+}+2 e _{(a q)}^{-} $
और अपचयन अर्ध-अभिक्रिया के रूप में:
$ MnO _{4(a q)}^{-}+8 H _{(a q)}^{+}+5 e^{-} \longrightarrow Mn _{(a q)}^{2+}+4 H_2 O _{(l)} $
ऑक्सीकरण अर्ध-अभिक्रिया को 5 से गुणा करके और अपचयन अर्ध-अभिक्रिया को 2 से गुणा करके, फिर उन्हें जोड़कर हमें शुद्ध संतुलित रेडॉक्स अभिक्रिया के रूप में निम्नलिखित प्राप्त होती है:
$ 2 MnO _{4(a q)}^{-}+5 SO _{2(g)}+2 H_2 O _{(i)}+H _{(a q)}^{+} \longrightarrow 2 Mn _{(a q)}^{2+}+5 HSO _{4(a q)}^{-} $
(c) भाग (a) में चरण अपनाते हुए, हमें ऑक्सीकरण अर्ध-अभिक्रिया के रूप में निम्नलिखित प्राप्त होती है:
$ Fe _{(a q)}^{2+} \longrightarrow Fe^{3+} _{(a q)}+e^{-} $
और अपचयन अर्ध-अभिक्रिया के रूप में:
$ H_2 O _{2(a q)}+2 H _{(a q)}^{+}+2 e^{-} \longrightarrow 2 H_2 O _{(l)} $
ऑक्सीकरण अर्ध-अभिक्रिया को 2 से गुणा करके फिर उसे अपचयन अर्ध-अभिक्रिया में जोड़कर हमें शुद्ध संतुलित रेडॉक्स अभिक्रिया के रूप में निम्नलिखित प्राप्त होती है:
$ H_2 O _{2(a q)}+2 Fe^{2+} _{(a q)}+2 H _{(a q)}^{+} \longrightarrow 2 Fe^{3+} _{(a q)}+2 H_2 O _{(l)} $
(d) भाग (a) में चरण अपनाते हुए, हमें ऑक्सीकरण अर्ध-अभिक्रिया के रूप में निम्नलिखित प्राप्त होती है:
$ SO _{2(g)}+2 H_2 O _{(i)} \longrightarrow SO _{4(a q)}^{2-}+4 H _{(a q)}^{+}+2 e^{-} $
और अपचयन अर्ध-अभिक्रिया के रूप में:
$ Cr_2 O _{7(a q)}^{2-}+14 H _{(a q)}^{+}+6 e^{-} \longrightarrow 2 Cr^{3+} _{(a q)}+7 H_2 O _{(l)} $
ऑक्सीकरण अर्ध-अभिक्रिया को 3 से गुणा करके फिर उसे अपचयन अर्ध-अभिक्रिया में जोड़कर हमें शुद्ध संतुलित रेडॉक्स अभिक्रिया के रूप में निम्नलिखित प्राप्त होती है:
$ Cr_2 O _{7(a q)}^{2-}+3 SO _{2(g)}+2 H _{(a q)}^{+} \longrightarrow 2 Cr _{(a q)}^{3+}+3 SO _{4(a q)}^{2-}+H_2 O _{(l)} $
8.19 आयन-इलेक्ट्रॉन विधि और ऑक्सीकरण संख्या विधि के द्वारा निम्नलिखित समीकरणों को क्षारीय माध्यम में संतुलित करें और ऑक्सीकारक एवं अपचायक की पहचान करें।
(a) $\mathrm{P_4}(\mathrm{~s})+\mathrm{OH}^{-}(\mathrm{aq}) \rightarrow \mathrm{PH_3}(\mathrm{~g})+\mathrm{HPO_2}^{-}(\mathrm{aq})$
(b) $\mathrm{N_2} \mathrm{H_4}(\mathrm{l})+\mathrm{ClO_3}^{-}(\mathrm{aq}) \rightarrow \mathrm{NO}(\mathrm{g})+\mathrm{Cl}^{-}(\mathrm{g})$
(c) $\mathrm{Cl_2} \mathrm{O_7}$ (g) $+\mathrm{H_2} \mathrm{O_2}$ (aq) $\rightarrow \mathrm{ClO_2}^{-}$(aq) $+\mathrm{O_2}$ (g) $+\mathrm{H}^{+}$
उत्तर दिखाएं
Answer
(a)
$P$ के O.N. (ऑक्सीकरण संख्या) $P_4$ में 0 से $PH_3$ में -3 तक घटती है और $HPO_2^{-}$ में +2 तक बढ़ जाती है। अतः इस अभिक्रिया में $P_4$ ऑक्सीकरक एजेंट और अपचायक एजेंट दोनों के रूप में कार्य करता है।
आयन-इलेक्ट्रॉन विधि:
ऑक्सीकरण अर्ध-समीकरण है:
$P _{4(s)} \to H_2 PO_2{ }^{-}(aq)$
$P$ परमाणु के संतुलन के लिए:
$\stackrel{0}P _{4(s)} \to 4 H_2 \stackrel{+1}{P} O_2^{-}(aq)$
ऑक्सीकरण संख्या के संतुलन के लिए 4 इलेक्ट्रॉन जोड़े जाते हैं:
$P _{4(s)} \to 4 H_2 PO_2{ }^{-} _{(a q)}+4 e^{-}$
आवेश के संतुलन के लिए $8 OH^{-}$ जोड़े जाते हैं:
$ P_{4(s)} +8OH^-_{(aq)} \to 4 H_2 PO _{2(aq)} + 4e^-$
$O$ और $H$ परमाणु पहले से संतुलित हैं।
अपचायक अर्ध-समीकरण है:
$P _{4(s)} \longrightarrow PH _{3(g)}$
$P$ परमाणु के संतुलन के लिए:
$\stackrel{0}{P _{4(s)}} \longrightarrow 4 \stackrel{-3}{P^{H _{3(g)}}}$
ऑक्सीकरण संख्या के संतुलन के लिए 12 इलेक्ट्रॉन जोड़े जाते हैं:
$ P _{4(s)}+12 e^{-} \longrightarrow 4 PH _{3(g)} $
आवेश के संतुलन के लिए $12 OH^{-}$ जोड़े जाते हैं:
$ P_{4(s)}+12 e^- \longrightarrow 4 PH_{3(g)}+12 OH_{(a q)} $
$O$ और $H$ परमाणु के संतुलन के लिए $12 H_2 O$ जोड़े जाते हैं:
$ P_{4_(s)} + 12H_2O_{(i)} + 12e^- \longrightarrow 4PH_{3_{(g)}}+ 12HO^1_{aq} $
समीकरण (i) को 3 से गुणा करके और समीकरण (ii) को 2 से गुणा करके और फिर उन्हें जोड़कर संतुलित रासायनिक समीकरण प्राप्त किया जा सकता है:
$P _{4(s)}+3 OH^{-} _{(a q)}+3 H_2 O \to PH_3+3 H_2 PO_2{ }^{-} _{(a q)}$
(b)

$N_2 H_4$ में $N$ की ऑक्सीकरण संख्या $-2$ से $NO$ में +2 तक बढ़ जाती है और $Cl$ की ऑक्सीकरण संख्या
+5 $ClO_3^{-}$ में से -1 $Cl^{\hat{\epsilon} \epsilon^{e}}$ में। इसलिए, इस अभिक्रिया में $N_2 H_4$ अपचायक एजेंट और $ClO_3^{-}$ ऑक्सीकारक एजेंट है।
एकल इलेक्ट्रॉन विधि:
ऑक्सीकरण अर्ध-समीकरण है:
$ \stackrel{-2}N_2 H_4(l) \longrightarrow \stackrel{+2}{N} O_{(g)} $
$N$ परमाणु संतुलित किए गए हैं जैसे:
$N_2 H_4(l) \longrightarrow 2 NO_{(g)}$
ऑक्सीकरण संख्या को संतुलित करने के लिए 8 इलेक्ट्रॉन जोड़े गए हैं जैसे:
$N_2 H_4(l) \longrightarrow 2 NO_{(g)}+8 e^{-}$
आवेश को संतुलित करने के लिए $8 OH^{\circledR \epsilon}$ आयन जोड़े गए हैं जैसे:
$N_2 H_4(l)+8 OH_{(aq)}^{-} \longrightarrow 2 NO_{(g)}+8 e^{-}$
$O$ परमाणु को संतुलित करने के लिए $6 H_2 O$ जोड़े गए हैं जैसे:
$ N_2H_4(i) +8OH^{-}_{aq} \longrightarrow 2NO(g) + 6H_2O(i) + 8e^{-} $
अपचायक अर्ध-समीकरण है:
ऑक्सीकरण संख्या को संतुलित करने के लिए 6 इलेक्ट्रॉन जोड़े गए हैं जैसे:
$ClO_{3(aq)}^{-}+6 e^{-} \longrightarrow Cl_{(aq)}^{-}$
आवेश को संतुलित करने के लिए $6 OH^{-}$ आयन जोड़े गए हैं जैसे:
$ ClO_{3(aq)}^{-}+6 e^{-} \longrightarrow Cl_{(aq)}^{-}+6 OH_{(aq)}^{-} $
$O$ परमाणु को संतुलित करने के लिए $3 H_2 O$ जोड़े गए हैं जैसे:
$ ClO^-_3aq + 3H_2O_i + 6e^- \longrightarrow Cl^-_aq + 6OH^-_aq $
संतुलित समीकरण को प्राप्त करने के लिए समीकरण (i) को 3 से गुणा करें और समीकरण (ii) को 4 से गुणा करें फिर उन्हें जोड़ें:
$ 3 N_2 H_4(l)+4 ClO_{3(aq)}^{-} \longrightarrow 6 NO_{(g)}+4 Cl_{(aq)}^{-}+6 H_2 O_{(l)} $
ऑक्सीकरण संख्या विधि:
$N$ के ऑक्सीकरण संख्या में कमी $2 \times 4=8$ है
$Cl$ के ऑक्सीकरण संख्या में वृद्धि $1 \times 6=6$ है
$N_2 H_4$ को 3 से गुणा करें और $ClO_3^{-}$ को 4 से गुणा करें ताकि ऑक्सीकरण संख्या में वृद्धि और कमी को संतुलित कर सकें, तो हमें प्राप्त होता है:
$ 3 N_2 H_4(f)+4 ClO_{3(aq)}^{-} \longrightarrow NO_{(g)}^{-}+Cl_{(aq)}^{-} $
$N$ और $Cl$ परमाणु संतुलित हैं जैसे:
$ 3 N_2 H _{4(l)}+4 ClO _{3(a q)}^{-} \longrightarrow 6 NO _{(g)}+4 Cl _{(a q)}^{-} $
$O$ अणुओं को संतुलित करने के लिए $6 H_2 O$ जोड़ा गया है:
$ 3 N_2 H _{4(l)}+4 ClO _{3(a q)}^{-} \longrightarrow 6 NO _{(g)}+4 Cl _{(a q)}^{-}+6 H_2 O _{(l)} $
यह संतुलित समीकरण है।
(c)
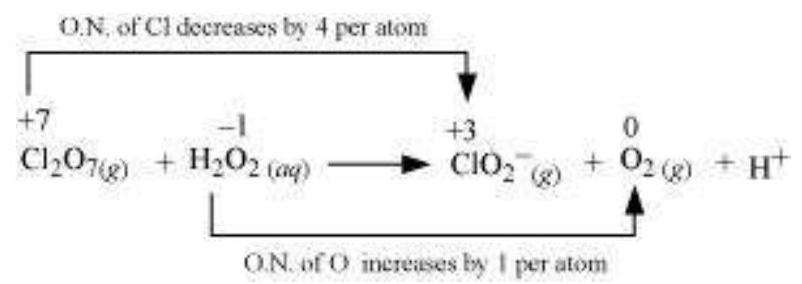
$Cl_2 O_7$ में $Cl$ की ऑक्सीकरण संख्या +7 से $ClO_2^{-}$ में +3 तक घट जाती है और $H_2 O_2$ में $O$ की ऑक्सीकरण संख्या -1 से $O_2$ में शून्य हो जाती है। इसलिए, इस अभिक्रिया में $Cl_2 O_7$ ऑक्सीकरण एजेंट और $H_2 O_2$ अपचायक एजेंट है।
आयन-इलेक्ट्रॉन विधि:
ऑक्सीकरण अर्ध-समीकरण है:
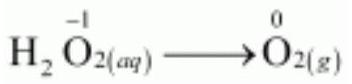
$H_2 O _{2(a q)} \longrightarrow O _{2(g)}+2 e^{-}$
ऑक्सीकरण संख्या को संतुलित करने के लिए 2 इलेक्ट्रॉन जोड़े गए हैं:
$ H_2 O _{2(a q)} \longrightarrow O _{2(g)}+2 e^{-} $
आवेश को संतुलित करने के लिए $2 OH^{a \epsilon}$ आयन जोड़े गए हैं:
$ H_2 O _{2(a q)}+2 OH _{(a q)}^{-} \longrightarrow O _{2(g)}+2 e^{-} $
ऑक्सीजन अणुओं को संतुलित करने के लिए $2 H_2 O$ जोड़े गए हैं:
$$ \begin{equation*} H_2O_{2(a q)}+2 OH_{(a q)}^{-} \longrightarrow O_{2(g)}+2 H_2 O _{(J)}+2 e^{-} \tag{i} \end{equation*} $$
अपचायक अर्ध-समीकरण है:
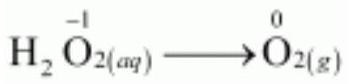
$Cl$ अणुओं को संतुलित करने के लिए:
$ Cl_2 O_{7(g)} \longrightarrow 2 ClO_{2(a q)}^{-} $
ऑक्सीकरण संख्या को संतुलित करने के लिए 8 इलेक्ट्रॉन जोड़े गए हैं:
$ Cl_2O_{7(g)}+8 e^{-} \longrightarrow 2 ClO_{2(a q)}^{-} $
आवेश को संतुलित करने के लिए $6 OH^{-}$ जोड़े गए हैं:
$ Cl_2 O _{7(g)}+8 e^{-} \longrightarrow 2 ClO _{2(a q)}^{-}+6 OH _{(a q)}^{-}
$
ऑक्सीजन परमाणुओं को संतुलित करने के लिए $3 H_2 O$ जोड़ा जाता है जैसे:
$$ \begin{equation*} Cl_2 O _{7(g)}+3 H_2 O _{(l)} 8 e^{-} \longrightarrow 2 ClO _{2(a q)}^{-}+6 OH _{(a q)}^{-} \tag{ii} \end{equation*} $$
संतुलित समीकरण को प्राप्त करने के लिए समीकरण (i) को 4 से गुणा करके और इसमें समीकरण (ii) को जोड़ा जाता है:
जैसे: $Cl_2 O _{7(g)}+4 H_2 O _{2(a q)}+2 OH _{(a q)}^{-} \longrightarrow 2 ClO _{2(a q)}^{-}+4 O _{2(g)}+5 H_2 O _{(l)}$
ऑक्सीकरण संख्या विधि:
$Cl_2 O_7$ में कार्बन की ऑक्सीकरण संख्या में कमी $4 \times 2=8$ है।
$H_2 O_2$ में कार्बन की ऑक्सीकरण संख्या में वृद्धि $2 \times 1=2$ है।
ऑक्सीकरण संख्या में वृद्धि और कमी को संतुलित करने के लिए $H_2 O_2$ और $O_2$ को 4 से गुणा करके हम प्राप्त करते हैं:
$ Cl_2 O _{7(g)}+4 H_2 O _{2(a q)} \longrightarrow ClO _{2(a q)}^{-}+4 O _{2(g)} $
कार्बन परमाणुओं को संतुलित करने के लिए:
$ Cl_2 O _{7(g)}+4 H_2 O _{2(a q)} \longrightarrow 2 ClO _{2(a q)}^{-}+4 O _{2(g)} $
ऑक्सीजन परमाणुओं को संतुलित करने के लिए $3 H_2 O$ जोड़ा जाता है जैसे:
$ Cl_2 O _{7(g)}+4 H_2 O _{2(a q)} \longrightarrow 2 ClO _{2(a q)}^{-}+4 O _{2(g)}+3 H_2 O _{(\delta)} $
हाइड्रोजन परमाणुओं को संतुलित करने के लिए $2 OH^{-}$ और $2 H_2 O$ जोड़े जाते हैं जैसे:
$ Cl_2 O _{7(g)}+4 H_2 O _{2(a q)}+2 OH _{(a q)}^{-} \longrightarrow 2 ClO _{2(a q)}^{-}+4 O _{2(g)}+5 H_2 O _{(l)} $
यह आवश्यक संतुलित समीकरण है।
8.20 निम्नलिखित अभिक्रिया से आप किस प्रकार की जानकारी ले सकते हैं?
$\left(\mathrm{CN_2}(\mathrm{~g})+2 \mathrm{OH}^{-}(\mathrm{aq}) \rightarrow \mathrm{CN}^{-}(\mathrm{aq})+\mathrm{CNO}^{-}(\mathrm{aq})+\mathrm{H_2} \mathrm{O}(\mathrm{l})\right.$
उत्तर दिखाएं
Answer
$(CN)^{2}, CN^{-}$ और $CNO^{\hat{A}}{ }^{-1}$ में कार्बन की ऑक्सीकरण संख्या क्रमशः $+3,+2$ और +4 है। ये नीचे दिए गए तरीके से प्राप्त किए जाते हैं:
मान लीजिए कि $C$ की ऑक्सीकरण संख्या $x$ है।
$(CN)_2$
$2(x$-3 $)=0$
$\therefore x=3$
$CN^{-}$
$x$ - $3= - 1$
$\therefore x=2$
$CNO^{-}$
$x - 2$ = -1
$\therefore x=4$
विभिन्न अणुओं में कार्बन की ऑक्सीकरण संख्या है:
$ (\stackrel{+3}{C} N) _{2(g)}+2 OH _{(a q)}^{-} \longrightarrow \stackrel{+2}{C} N _{(a q)}^{-}+\stackrel{+4}{C} NO _{(a q)}^{-}+H_2 O _{(l)}
$
यह आसानी से देखा जा सकता है कि दी गई समीकरण में एक ही यौगिक एक साथ अपचयित और ऑक्सीकृत हो रहा है। ऐसी अभिक्रियाएँ जिनमें एक ही यौगिक अपचयित और ऑक्सीकृत होता है, अपचयन-ऑक्सीकरण अभिक्रियाएँ कहलाती हैं। इसलिए, कहा जा सकता है कि सांत्वन अपघटन के क्षारीय अपघटन का एक अपचयन-ऑक्सीकरण अभिक्रिया का उदाहरण है।
8.21 $\mathrm{Mn}^{3+}$ आयन विलयन में अनिश्चित होता है और अपचयन-ऑक्सीकरण के माध्यम से $\mathrm{Mn}^{2+}$, $\mathrm{MnO_2}$ और $\mathrm{H}^{+}$ आयन देता है। अभिक्रिया के संतुलित आयनिक समीकरण को लिखिए।
उत्तर दिखाएं
उत्तर
दी गई अभिक्रिया को इस प्रकार दर्शाया जा सकता है:
$ Mn _{(a q)}^{3+} \longrightarrow Mn _{(a q)}^{2+}+MnO _{2(s)}+H _{(a q)}^{+} $
ऑक्सीकरण अर्ध-समीकरण है:

$ \stackrel{+3}{\quad Mn^{3+}} _{(aq)} \longrightarrow \stackrel{+4}{\quad \quad MnO _{2(s)}}$
ऑक्सीकरण संख्या को संतुलित करने के लिए एक इलेक्ट्रॉन जोड़ा जाता है:
$ Mn _{(a q)}^{3+} \longrightarrow MnO _{2(s)}+e^{-} $
आवेश को संतुलित करने के लिए $4 H^{+}$ आयन जोड़े जाते हैं:
$ Mn _{(a q)}^{3+} \longrightarrow MnO _{2(s)}+4 H _{(a q)}^{+}+e^{-} $
$O$ अणु और $H^{+}$ आयन को संतुलित करने के लिए $2 H_2 O$ अणु जोड़े जाते हैं:
$$ \begin{equation*} Mn _{(a q)}^{3+}+2 H_2 O _{(f)} \longrightarrow MnO _{2(s)}+4 H _{(a q)}^{+}+e^{-} \tag{i} \end{equation*} $$
अपचयन अर्ध-समीकरण है:
$ Mn _{(a q)}^{3+} \longrightarrow Mn _{(a q)}^{2+} $
ऑक्सीकरण संख्या को संतुलित करने के लिए एक इलेक्ट्रॉन जोड़ा जाता है:
$$ \begin{equation*} Mn _{(a q)}^{3+}+e^{-} \longrightarrow Mn _{(a q)}^{2+} \tag{ii} \end{equation*} $$
संतुलित रासायनिक समीकरण को समीकरण (i) और (ii) को जोड़कर प्राप्त किया जा सकता है:
$ 2 Mn _{(a q)}^{3+}+2 H_2 O _{(l)} \longrightarrow MnO _{2(s)}+2 Mn _{(a q)}^{2+}+4 H _{(a q)}^{+} $
8.22 निम्नलिखित तत्वों को ध्यान में रखें :
$\mathrm{Cs}, \mathrm{Ne}, \mathrm{I}$ और $\mathrm{F}$
(a) वह तत्व कौन-सा है जो केवल नकारात्मक ऑक्सीकरण अवस्था दर्शाता है।
(b) वह तत्व कौन-सा है जो केवल धनात्मक ऑक्सीकरण अवस्था दर्शाता है।
(c) वह तत्व कौन-सा है जो दोनों धनात्मक और नकारात्मक ऑक्सीकरण अवस्था दर्शाता है।
(d) वह तत्व कौन-सा है जो न तो नकारात्मक न ही धनात्मक ऑक्सीकरण अवस्था दर्शाता है।
उत्तर दिखाएं
उत्तर
(a) F केवल -1 के नकारात्मक ऑक्सीकरण अवस्था दर्शाता है। (b) Cs केवल +1 के धनात्मक ऑक्सीकरण अवस्था दर्शाता है।
(c) I दोनों धनात्मक और नकारात्मक ऑक्सीकरण अवस्था दर्शाता है। यह -1, +1, +3, +5 और +7 ऑक्सीकरण अवस्था दर्शाता है।
(d) Ne की ऑक्सीकरण अवस्था शून्य है। यह न तो नकारात्मक न ही धनात्मक ऑक्सीकरण अवस्था दर्शाता है।
8.23 क्लोरीन पीने के पानी को स्वच्छ करने में प्रयोग किया जाता है। क्लोरीन की अत्यधिक मात्रा हानिकारक हो सकती है। अत्यधिक क्लोरीन को जल में सल्फर डाइऑक्साइड के साथ उपचार करके हटाया जाता है। इस रेडॉक्स परिवर्तन के लिए एक संतुलित समीकरण प्रस्तुत करें जो जल में होता है।
उत्तर दिखाएं
उत्तर
दी गई रेडॉक्स अभिक्रिया को इस प्रकार दर्शाया जा सकता है:
$ Cl _{2(s)}+SO _{2(a q)}+H_2 O _{(l)} \longrightarrow Cl _{(a q)}^{-}+SO _{4(a q)}^{2-} $
ऑक्सीकरण अर्ध-अभिक्रिया है:
$ \stackrel{+4}{S O _{2(a q)}} \longrightarrow \stackrel{+6}{S O^{2-} _{4(a q)} }$
ऑक्सीकरण संख्या को संतुलित करने के लिए दो इलेक्ट्रॉन जोड़े जाते हैं:
$ SO _{2(a q)} \longrightarrow SO_4^{2-}(a q)+2 e^{-} $
आवेश को संतुलित करने के लिए $4 H^{+}$ आयन जोड़े जाते हैं:
$ SO _{2(a q)} \longrightarrow SO _{4(a q)}^{2-}+4 H _{(a q)}^{+}+2 e^{-} $
$O$ अणु और $H^{+}$ आयन को संतुलित करने के लिए $2 H_2 O$ अणु जोड़े जाते हैं:
$$ \begin{equation*} SO _{2(a q)}+2 H_2 O _{(j)} \longrightarrow SO _{4(a q)}^{2-}+4 H _{(a q)}^{+}+2 e^{-} \tag{i} \end{equation*} $$
अपचयन अर्ध-अभिक्रिया है:
$ Cl _{2(s)} \longrightarrow Cl _{(a q)}^{-} $
क्लोरीन अणु को संतुलित करने के लिए:
$ \stackrel{0}C _{2(s)} \longrightarrow \stackrel{-1}C _{(a q)}^{-} $
ऑक्सीकरण संख्या को संतुलित करने के लिए इलेक्ट्रॉन जोड़े जाते हैं
$$ \begin{equation*} Cl _{2(s)}+2 e^{-} \longrightarrow 2 Cl _{(a q)}^{-} \tag{ii} \end{equation*} $$
संतुलित रासायनिक समीकरण को समीकरण (i) और (ii) को जोड़कर प्राप्त किया जा सकता है:
$ Cl _{2(s)}+SO _{2(a q)}+2 H_2 O _{(f)} \longrightarrow 2 Cl _{(a q)}^{-}+SO _{4(a q)}^{2-}+4 H _{(a q)}^{+} $
8.24 अपनी किताब में दिए गए आवर्त सारणी का संदर्भ लें और अब निम्नलिखित प्रश्नों के उत्तर दें:
(a) अपचयन अपचयन अभिक्रिया दिखा सकने वाले संभावित अधातुओं का चयन करें।
(b) तीन धातुओं का चयन करें जो अपचयन अपचयन अभिक्रिया दिखा सकें।
उत्तर दिखाएं
उत्तर
अपचयन अपचयन अभिक्रिया में, एक अभिकारक पदार्थ में हमेशा एक तत्व होता है जो कम से कम तीन ऑक्सीकरण अवस्थाओं में विद्यमान हो सकता है।
(a) $P, Cl$, और $S$ अपचयन अपचयन अभिक्रिया दिखा सकते हैं क्योंकि इन तत्वों को तीन या अधिक ऑक्सीकरण अवस्थाओं में विद्यमान हो सकता है।
(b) $Mn, Cu$, और $Ga$ अपचयन अपचयन अभिक्रिया दिखा सकते हैं क्योंकि इन तत्वों को तीन या अधिक ऑक्सीकरण अवस्थाओं में विद्यमान हो सकता है।
8.25 नाइट्रिक अम्ल के निर्माण में ओस्टवाल्ड प्रक्रम के पहले चरण में अमोनिया गैस के ऑक्सीकरण ऑक्सीजन गैस द्वारा नाइट्रिक ऑक्साइड गैस और भाप देता है। 10.00 ग्राम अमोनिया और 20.00 ग्राम ऑक्सीजन केवल से अधिकतम वजन कितना नाइट्रिक ऑक्साइड प्राप्त किया जा सकता है?
उत्तर दिखाएं
उत्तर
दिए गए अभिक्रिया के लिए संतुलित रासायनिक समीकरण नीचे दिया गया है:
$$ \begin{matrix} 4 NH _{3(g)}+5 O _{2(g)} & 4 NO _{(g)} & +6 H_2 O _{(g)} \\ 4 \times 17 g & 5 \times 32 g & 4 \times 30 g \quad 6 \times 18 g \\ =68 g \quad=160 g & =120 g \quad=108 g \end{matrix} $$
इसलिए, $68 g$ के $NH_3$ $160 g$ के $O_2$ के साथ अभिक्रिया करता है।
इसलिए, $10 g$ के $NH_3$ $ \frac{160 \times 10}{68} g $ के $O_2$ के साथ अभिक्रिया करता है, या $23.53 g$ के $O_2$ के साथ अभिक्रिया करता है।
लेकिन उपलब्ध $O_2$ की मात्रा $20 g$ है।
इसलिए, $O_2$ अभिकारक है (हमने $O_2$ की मात्रा को अभिक्रिया में प्राप्त नाइट्रिक ऑक्साइड के वजन की गणना करने के लिए लिया है)।
अब, $160 g$ के $O_2$ से $120 g$ के $NO$ प्राप्त होते हैं।
इसलिए, $20 g$ के $O_2$ से $\frac{120 \times 20}{160} g$ के $N$ प्राप्त होते हैं, या $15 g$ के $NO$ प्राप्त होते हैं।
इसलिए, नाइट्रिक ऑक्साइड के अधिकतम $15 g$ प्राप्त किए जा सकते हैं।
8.26 सारणी 8.1 में दिए गए मानक इलेक्ट्रोड विभव का उपयोग करते हुए, निम्नलिखित के बीच अभिक्रिया के अभिकल्पन की भविषेद करें:
(a) $\mathrm{Fe}^{3+}(\mathrm{aq})$ और $\mathrm{I}^{-}(\mathrm{aq})$
(b) $\mathrm{Ag}^{+}(\mathrm{aq})$ और $\mathrm{Cu}(\mathrm{s})$
(c) $\mathrm{Fe}^{3+}$ (aq) और $\mathrm{Cu}(\mathrm{s})$
(d) $\mathrm{Ag}(\mathrm{s})$ और $\mathrm{Fe}^{3+}(\mathrm{aq})$
(e) $\mathrm{Br_2}$ (aq) और $\mathrm{Fe}^{2+}(\mathrm{aq})$.
उत्तर दिखाएं
उत्तर
(a) $Fe _{(a q)}^{3+}+I _{(a q)}^{-}$ के बीच संभावित अभिक्रिया निम्नलिखित है,
$2 Fe _{(a q)}^{3+}+2 I _{(a q)}^{-} \longrightarrow 2 Fe _{(a q)}^{2+}+I _{2(s)}$
ऑक्सीकरण अर्ध-समीकरण : $\quad 2 I _{(x q)}^{-} \longrightarrow I _{2(s)}+2 e^{-} ; \quad E^{\circ}=-0.54 V$
अपचयन अर्ध-समीकरण : $[Fe _{(cq)}^{3+}+e^{-} \longrightarrow Fe _{(cq)}^{2+}] \times 2 ; \quad E^{\circ}=+0.77 V$
$ 2 Fe _{(a q)}^{3+}+2 I _{(a q)}^{-} \longrightarrow 2 Fe _{(a q)}^{2+}+I _{2(s)} ; E^{\circ}=+0.23 V $
अभिक्रिया के लिए $E^{\circ}$ धनात्मक है। इसलिए, $Fe _{(a q)}^{3+}$ और $I _{(a q)}^{-}$ के बीच अभिक्रिया संभव है।
(b) $Ag _{(a q)}^{+}+Cu _{(s)}$ के बीच संभावित अभिक्रिया निम्नलिखित है,
$ 2 Ag _{(a q)}^{+}+Cu _{(s)} \longrightarrow 2 Ag _{(s)}+Cu _{(a q)}^{2+} $
ऑक्सीकरण अर्ध-समीकरण : $\quad Cu _{(s)} \longrightarrow Cu _{(\text{aq })}^{2+}+2 e^{-} \quad ; E^{\circ}=-0.34 V$
$ \frac{\text{ अपचयन अर्ध-समीकरण : }[Ag _{(a q)}^{+}+e^{-} \longrightarrow Ag _{(s)}] \times 2 \quad ; E^{\circ}=+0.80 V}{2 Ag _{(a q)}^{+}+Cu _{(s)} \longrightarrow 2 Ag _{(s)}+Cu^{2+} ; E^{\circ}=+0.46 V} $
अभिक्रिया के लिए $E^{\circ}$ धनात्मक है। इसलिए, $Ag _{(a q)}^{+}$ और $Cu _{(s)}$ के बीच अभिक्रिया संभव है।
(c) $Fe _{(a q)}^{3+}$ और $Cu _{(s)}$ के बीच संभावित प्रतिक्रिया निम्नलिखित है,
$ 2 Fe _{(a q)}^{3+}+Cu _{(s)} \longrightarrow 2 Fe _{(x)}^{2+}+Cu _{(a q)}^{2+} $
ऑक्सीकरण अर्ध-समीकरण: $\quad Cu _{(s)} \longrightarrow Cu _{(a q)}^{2+}+2 e^{-} \quad ; E^{\circ}=-0.34 V$
अपचयन अर्ध-समीकरण : $[Fe _{(\alpha q)}^{3+}+e^{-} \longrightarrow Fe _{(s)}^{2+}] \times 2 \quad ; E^{\circ}=+0.77 V$
$ 2 Fe _{(a q)}^{3+}+Cu _{(s)} \longrightarrow 2 Fe _{(s)}^{2+}+Cu _{(a q)}^{2+} ; E^{\circ}=+0.43 V $
सम्पूर्ण प्रतिक्रिया के लिए $E^{\circ}$ धनात्मक है। अतः, $Fe _{(a q)}^{3+}$ और $Cu _{(s)}$ के बीच प्रतिक्रिया संभव है।
(d) $Ag _{(s)}$ और $Fe _{(a q)}^{3+}$ के बीच संभावित प्रतिक्रिया निम्नलिखित है, $Ag _{(s)}+2 Fe _{(a q)}^{3+} \longrightarrow Ag _{(a q)}^{+}+Fe _{(a q)}^{2+}$
ऑक्सीकरण अर्ध-समीकरण: $\quad Ag _{(x)} \longrightarrow Ag _{(a g)}^{+}+e^{-} \quad ; E^{\circ}=-0.80 V$
अपचयन अर्ध-समीकरण : $Fe _{(a q)}^{3+}+e^{-} \longrightarrow Fe _{(a q)}^{2+} \quad ; E^{\circ}=+0.77 V$ $Ag _{(s)}+Fe _{(a q)}^{3+} \longrightarrow Ag _{(a q)}^{+}+Fe _{(a q)}^{2+} ; E^{\circ}=-0.03 V$
यहाँ, सम्पूर्ण प्रतिक्रिया के लिए $E^{\circ}$ नकारात्मक है। अतः, $Ag _{(s)}$ और $Fe _{(a q)}^{3+}$ के बीच प्रतिक्रिया संभव नहीं है।
(e) $Br _{2(a q)}$ और $Fe _{(a q)}^{2+}$ के बीच संभावित प्रतिक्रिया निम्नलिखित है,
$Br _{2(s)}+2 Fe _{(a q)}^{2+} \longrightarrow 2 Br _{(a q)}^{-}+2 Fe _{(a q)}^{3+}$
ऑक्सीकरण अर्ध-समीकरण : $.\quad Fe _{(a q)}^{2+} \longrightarrow Fe _{(a q)}^{3+}+e^{-}] \times 2 \quad ; E^{\circ}=-0.77 V$
अपचयन अर्ध-समीकरण: $Br _{2(a q)}+2 e^{-} \longrightarrow 2 Br _{(a q)}^{-} \quad ; E^{\circ}=+1.09 V$
$ Br _{2(a q)}+2 Fe _{(a q)}^{2+} \longrightarrow 2 Br _{(a q)}^{-}+2 Fe _{(a q)}^{3+} ; E^{\circ}=-0.32 V $
यहाँ, सम्पूर्ण प्रतिक्रिया के लिए $E^{\circ}$ धनात्मक है। अतः, $Br _{2(a q)}$ और $Fe _{(a q)}^{2+}$ के बीच प्रतिक्रिया संभव है।
8.27 प्रत्येक निम्नलिखित में विद्युत अपघटन के उत्पादों की भविषेद करें:
(i) $\mathrm{AgNO_3}$ के जलीय विलयन में सिल्वर इलेक्ट्रोड
(ii) $\mathrm{AgNO_3}$ के जलीय विलयन में प्लेटिनम इलेक्ट्रोड
(iii) $\mathrm{H_2} \mathrm{SO_4}$ के तनु विलयन में प्लेटिनम इलेक्ट्रोड
(iv) $\mathrm{CuCl_2}$ के जलीय विलयन में प्लेटिनम इलेक्ट्रोड।
उत्तर दिखाएं
उत्तर
(i) $AgNO_3$ जलीय विलयन में आयनित होकर $Ag^{+}$ और $NO_3^{-}$ आयन बनाता है।
विद्युत अपघटन के दौरान, कैथोड पर $Ag^{+}$ आयन या $H_2 O$ अणु कम्पन कर सकते हैं। लेकिन $Ag^{+}$ आयन के अपचयन विभव के मूल्य $H_2 O$ के अपचयन विभव के मूल्य से अधिक होता है।
$$ \begin{aligned} & Ag _{(o q)}^{+}+e^{-} \longrightarrow Ag _{(s)} ; E^{\circ}=+0.80 V \\ & 2 H_2 O _{(t)}+2 e^{-} \longrightarrow H _{2(g)}+2 OH _{(a q)}^{-} ; E^{\circ}=-0.83 V \end{aligned} $$
इसलिए, कैथोड पर $Ag^{+}$ आयन अपचयित होते हैं। इसी तरह, कैथोड पर $Ag$ धातु या $H_2 O$ अणु के ऑक्सीकरण हो सकते हैं। लेकिन $Ag$ के ऑक्सीकरण विभव के मूल्य $H_2 O$ अणु के ऑक्सीकरण विभव के मूल्य से अधिक होता है।
$$ \begin{aligned} Ag _{(s)} & \longrightarrow Ag _{(a q)}^{+}+e^{-} \quad ; E^{\circ}=-0.80 V \\ 2 H_2 O _{(l)} & \longrightarrow O _{2(g)}+4 H _{(a q)}^{+}+4 e^{-} ; E^{\circ}=-1.23 V \end{aligned} $$
इसलिए, एनोड पर $Ag$ धातु ऑक्सीकृत होती है।
(ii) प्लेटिनम को आसानी से ऑक्सीकृत नहीं किया जा सकता। इसलिए, एनोड पर पानी के ऑक्सीकरण होता है ताकि $O_2$ गैस मुक्त की जा सके। कैथोड पर $Ag^{+}$ आयन अपचयित होते हैं और उपस्थित होते हैं।
(iii) $H_2 SO_4$ जलीय विलयन में आयनित होकर $H^{+}$ और $SO_4^{2-}$ आयन बनाता है।
$ H_2 SO _{4(a q)} \longrightarrow 2 H _{(a q)}^{+}+SO_4^{2-} _{(a q)} $
विद्युत अपघटन के दौरान, कैथोड पर $H^{+}$ आयन या $H_2 O$ अणु कम्पन कर सकते हैं। लेकिन $H^{+}$ आयन के अपचयन विभव के मूल्य $H_2 O$ अणु के अपचयन विभव के मूल्य से अधिक होता है।
$$ \begin{aligned} & 2 H _{(x q)}^{+}+2 e^{-} \longrightarrow H _{2(g)} ; E^{\circ}=0.0 V \\ & 2 H_2 O _{(a q)}+2 e^{-} \longrightarrow H _{2(g)}+2 OH _{(a q)}^{-} ; E^{\circ}=-0.83 V \end{aligned} $$
इसलिए, कैथोड पर $H^{+}$ आयन अपचयित होते हैं ताकि $H_2$ गैस मुक्त की जा सके।
दूसरी ओर, एनोड पर, $SO_4^{2-}$ आयन या $H_2 O$ अणु के ऑक्सीकरण हो सकते हैं। लेकिन $SO_4^{2-}$ के ऑक्सीकरण में $H_2 O$ अणु के तुलना में अधिक बंध टूटते हैं। इसलिए, $SO_4^{2-}$ आयन की ऑक्सीकरण विभव नीचे होता है। इसलिए, एनोड पर $H_2 O$ के ऑक्सीकरण होता है ताकि $O_2$ अणु मुक्त किए जा सकें।
(iv) जलीय विलयन में, $CuCl_2$ आयनित होकर $Cu^{2+}$ और $Cl^{-}$ आयन देता है जैसे कि:
$ CuCl _{2(a q)} \longrightarrow Cu _{(a q)}^{2+}+2 Cl _{(a q)}^{-} $
इलेक्ट्रोलिसिस के दौरान, कैथोड पर $Cu^{2+}$ आयन या $H_2 O$ अणु के अपचयन हो सकते हैं। लेकिन $Cu^{2+}$ का अपचयन विभव $H_2 O$ अणु के अपचयन विभव से अधिक होता है।
$$ \begin{aligned} & Cu _{(a q)}^{2+}+2 e^{-} \longrightarrow Cu _{(a q)} ; E^{\circ}=+0.34 V \\ & H_2 O _{(l)}+2 e^{-} \longrightarrow H _{2(g)}+2 OH^{-} ; E^{\circ}=-0.83 V \end{aligned} $$
इसलिए, कैथोड पर $Cu^{2+}$ आयन अपचयित होते हैं और उपस्थित होते हैं।
समान रूप से, एनोड पर $Cl^{-}$ या $H_2 O$ के ऑक्सीकरण हो सकते हैं। $H_2 O$ का ऑक्सीकरण विभव $Cl^{-}$ के ऑक्सीकरण विभव से अधिक होता है।
$$ \begin{aligned} & 2 Cl _{(a q)}^{-} \longrightarrow Cl _{2(g)}+2 e^{-} \quad ; E^{\circ}=-1.36 V \\ & 2 H_2 O _{(l)} \longrightarrow O _{2(g)}+4 H _{(a q)}^{+}+4 e^{-} ; E^{\circ}=-1.23 V \end{aligned} $$
लेकिन $H_2 O$ अणु के ऑक्सीकरण के लिए विभव कम होता है क्योंकि विद्युत विभव (गैस को मुक्त करने के लिए अतिरिक्त विभव) के कारण। इसलिए, एनोड पर $Cl^{-}$ आयन ऑक्सीकरण होते हैं ताकि $Cl_2$ गैस मुक्त किए जा सकें।
8.28 निम्नलिखित धातुओं को उनके लवण के विलयन से एक दूसरे को विस्थापित करने के क्रम में व्यवस्थित करें।
$\mathrm{Al}, \mathrm{Cu}, \mathrm{Fe}, \mathrm{Mg}$ और $\mathrm{Zn}$।
उत्तर दिखाएं
उत्तर
एक धातु जो दूसरी धातु की तुलना में अधिक रूपांतरण शक्ति रखती है, अपने लवण के विलयन से दूसरी धातु को विस्थापित कर सकती है।
दिए गए धातुओं की बढ़ती रूपांतरण शक्ति के क्रम $Cu<Fe<Zn<Al<Mg$ है।
इसलिए, हम कह सकते हैं कि $Mg$ $Al$ के अपने लवण के विलयन से विस्थापित कर सकता है, लेकिन $Al$ $Mg$ को विस्थापित नहीं कर सकता।
इसलिए, दिए गए धातुओं के अपने लवण के विलयन से एक दूसरे को विस्थापित करने के क्रम के नीचे दिया गया है:
$Mg>Al>Zn>Fe,>Cu$
8.29 दिए गए मानक इलेक्ट्रोड विभव,
$\mathrm{K}^{+} / \mathrm{K}=-2.93 \mathrm{~V}, \mathrm{Ag}^{+} / \mathrm{Ag}=0.80 \mathrm{~V}$,
$\mathrm{Hg}^{2+} / \mathrm{Hg}=0.79 \mathrm{~V}$
$\mathrm{Mg}^{2+} / \mathrm{Mg}=-2.37 \mathrm{~V} . \mathrm{Cr}^{3+} / \mathrm{Cr}=-0.74 \mathrm{~V}$
दिए गए धातुओं के बढ़ते क्रम में अपचायक शक्ति के अनुसार व्यवस्थित करें।
उत्तर दिखाएं
उत्तर
इलेक्ट्रोड विभव जितना कम होगा, उतना ही अपचायक एजेंट मजबूत होगा। इसलिए, दिए गए धातुओं के बढ़ते क्रम में अपचायक शक्ति के अनुसार व्यवस्थित करें $Ag<Hg<Cr<Mg<K$.
8.30 विद्युत रासायनिक सेल का चित्र बनाएं जिसमें अभिक्रिया $\mathrm{Zn}(\mathrm{s})+2 \mathrm{Ag}^{+}(\mathrm{aq}) \rightarrow \mathrm{Zn}^{2+}(\mathrm{aq})+2 \mathrm{Ag}(\mathrm{s})$ होती है, आगे दिखाएं:
(i) कौन सा इलेक्ट्रोड नकारात्मक चार्जित होता है,
(ii) सेल में विद्युत के वाहक क्या होते हैं, और
(iii) प्रत्येक इलेक्ट्रोड पर अलग-अलग अभिक्रिया।
उत्तर दिखाएं
उत्तर
दिए गए रेडॉक्स अभिक्रिया के संगत विद्युत रासायनिक सेल को नीचे दिए गए रूप में दर्शाया जा सकता है:
$Zn|Zn _{(a q)}^{2+} | Ag _{(a q)}^{+}| Ag$
(i) $Zn$ इलेक्ट्रोड नकारात्मक चार्जित होता है क्योंकि इस इलेक्ट्रोड पर $Zn$ का ऑक्सीकरण $Zn^{2+}$ में होता है और इस इलेक्ट्रोड पर छोड़े गए इलेक्ट्रॉन इकट्ठा हो जाते हैं।
(ii) सेल में विद्युत के वाहक आयन होते हैं।
(iii) $Zn$ इलेक्ट्रोड पर होने वाली अभिक्रिया नीचे दिए गए रूप में दर्शाई जा सकती है:
$ Zn _{(s)} \longrightarrow Zn _{(a q)}^{2+}+2 e^{-} $
और $Ag$ इलेक्ट्रोड पर होने वाली अभिक्रिया नीचे दिए गए रूप में दर्शाई जा सकती है:
$Ag _{(a q)}^{+}+e^{-} \longrightarrow Ag _{(s)}$





