अध्याय 04 रासायनिक आबंधन एवं अणु संरचना
“वैज्ञानिक नए-नए यौगिकों की खोज करते रहते हैं, उनके बारे में तथ्यों को क्रमबद्ध रूप से व्यवस्थित करते हैं, वर्तमान ज्ञान के आधार पर उत्पन्न तथ्यों की व्याख्या करने की कोशिश करते हैं, पहले के दृष्टिकोण को संशोधित करने या नए तथ्यों की व्याख्या के लिए सिद्धांतों के विकास के लिए व्यवस्थित करते हैं।”
पदार्थ एक या अलग-अलग प्रकार के तत्वों से बना होता है। सामान्य अवस्था में कोई अन्य तत्व प्रकृति में स्वतंत्र अणु के रूप में नहीं मौजूद होता, बर्फी गैस के अतिरिक्त। हालांकि, कई अणु एक विशिष्ट विशेषताओं वाले एक वस्तु के रूप में एक साथ मौजूद होते हैं। ऐसे अणुओं के समूह को अणु कहा जाता है। आवश्यकता होती है कि कुछ बल अणुओं में घटक अणुओं को बांधे रखे हों। विभिन्न रासायनिक वस्तुओं में विभिन्न घटकों (अणु, आयन आदि) को आकर्षित करने वाला बल रासायनिक आबंधन कहलाता है। क्योंकि रासायनिक यौगिकों के निर्माण के लिए विभिन्न तत्वों के अणुओं के विभिन्न तरीकों से संयोजन के कारण अनेक प्रश्न उठते हैं। क्यों अणु संयोजन करते हैं? क्यों केवल कुछ संयोजन संभव होते हैं? क्यों कुछ अणु संयोजन करते हैं जबकि कुछ अणु नहीं? क्यों अणु निश्चित आकार रखते हैं? इस प्रकार के प्रश्नों के उत्तर देने के लिए अलग-अलग सिद्धांत एवं अवधारणाएं समय-समय पर प्रस्तुत की गई हैं। ये सिद्धांत एवं अवधारणाएं कोसेल-ल्यूस दृष्टिकोण, मूल बाह्य इलेक्ट्रॉन युग्म प्रतिकर्षण (VSEPR) सिद्धांत, मूल बांध (VB) सिद्धांत एवं अणु कक्षक (MO) सिद्धांत हैं। वैलेंस सिद्धांत के विभिन्न सिद्धांतों के विकास एवं रासायनिक बांध की प्रकृति के विवेचन के संबंध में परमाणु संरचना के बारे में ज्ञान के विकास, तत्वों की इलेक्ट्रॉनिक विन्यास एवं आवर्त सारणी के विकास गहरी रूप से संबंधित है। प्रत्येक प्रणाली अधिक स्थायी होने की ओर अपनी ओर से बढ़ती है और बंधन रचना के माध्यम से प्रकृति एक प्रणाली की ऊर्जा को कम करके स्थायित्व प्राप्त करने के लिए अपनी ओर से बढ़ती है।
4.1 रसायनिक बंधन के लिए कॉसेल-लेविस अनुपात
इलेक्ट्रॉन के आधार पर रसायनिक बंधन के गठन की व्याख्या के लिए कई प्रयास किए गए, लेकिन यह केवल 1916 में कॉसेल और लेविस ने स्वतंत्र रूप से संतोषजनक व्याख्या देने में सफल रहे। वे पहले थे जिन्होंने वैलेंस की कुछ तर्कसंगत व्याख्या प्रदान की, जो नोबल गैसों के अप्रतिस्थापनी गुण पर आधारित थी।
लेविस ने परमाणु को एक धनात्मक चार्ज वाले ‘कर्नल’ (नाभिक और आंतरिक इलेक्ट्रॉनों के संयोजन) और बाहरी कोश के रूप में चित्रित किया, जो अधिकतम आठ इलेक्ट्रॉनों के स्थान ले सकता है। उन्होंने आगे अनुमान लगाया कि ये आठ इलेक्ट्रॉन एक घन के कोनों पर बैठे होते हैं जो ‘कर्नल’ के चारों ओर घेरे होते हैं। इस प्रकार सोडियम के एकल बाहरी कोश इलेक्ट्रॉन घन के एक कोने पर होता है, जबकि नोबल गैस के मामले में सभी आठ कोने भरे होते हैं। इन आठ इलेक्ट्रॉनों के अष्टक, एक विशेष रूप से स्थायी इलेक्ट्रॉनिक व्यवस्ता का प्रतिनिधित्व करते हैं। लेविस ने अनुमान लगाया कि जब परमाणु रसायनिक बंधन द्वारा जुड़े होते हैं तो वे स्थायी अष्टक प्राप्त करते हैं। सोडियम और क्लोरीन के मामले में, यह एक इलेक्ट्रॉन के सोडियम से क्लोरीन के स्थानांतरण के माध्यम से हो सकता है, जिससे $\mathrm{Na}^+$ और $\mathrm{Cl}^{-}$ आयन बनते हैं। अन्य अणुओं के मामले में, जैसे $ \mathrm{Cl}_2, \mathrm{H}_2, \mathrm{~F}_2 $, आदि, बंधन अणुओं के बीच एक इलेक्ट्रॉन युग्म के साझेदारी के माध्यम से बनता है। इस प्रक्रिया में प्रत्येक अणु एक स्थायी बाहरी अष्टक इलेक्ट्रॉन के साथ पहुंचता है।
ल्यूईस प्रतीक: अणु के निर्माण में केवल बाहरी कोश के इलेक्ट्रॉन रासायनिक संयोजन में भाग लेते हैं और इन्हें मूल्युकता इलेक्ट्रॉन कहते हैं। आंतरिक कोश के इलेक्ट्रॉन अच्छी तरह से सुरक्षित होते हैं और सामान्यतः संयोजन प्रक्रिया में शामिल नहीं होते हैं। अमेरिकी रसायन विज्ञानी जी. एन. ल्यूईस ने एक अणु में मूल्युकता इलेक्ट्रॉन को प्रतिनिधित्व करने के लिए सरल चिह्नों की शुरुआत की। इन चिह्नों को ल्यूईस प्रतीक कहते हैं। उदाहरण के लिए, दूसरे आवर्त के तत्वों के ल्यूईस प्रतीक नीचे दिए गए हैं:

महत्व लेविस चिह्नों का : चिह्न के आसपास बिंदुओं की संख्या मूल इलेक्ट्रॉनों की संख्या को प्रदर्शित करती है। इस मूल इलेक्ट्रॉन की संख्या के आधार पर तत्व के सामान्य या समूह वैलेंस की गणना की जा सकती है। तत्वों के समूह वैलेंस आमतौर पर लेविस चिह्नों में बिंदुओं की संख्या के बराबर होता है या 8 में से बिंदुओं की संख्या घटाकर निकाला जाता है।
कॉसल, रासायनिक बंधन के संदर्भ में, निम्नलिखित तथ्यों पर ध्यान आकर्षित करते हैं:
-
आवर्त सारणी में, उच्च विद्युत ऋणात्मकता वाले हैलोजन और उच्च विद्युत धनात्मकता वाले अलॉई धातुएं नोबल गैसों द्वारा अलग की गई हैं;
-
एक हैलोजन परमाणु से नकारात्मक आयन के निर्माण और एक अल्कली मैटल परमाणु से धनात्मक आयन के निर्माण में संबंधित है, क्रमशः उन परमाणुओं के इलेक्ट्रॉन के लाभ और नुकसान से;
-
इस प्रकार बने नकारात्मक और धनात्मक आयन स्थायी नोबल गैस इलेक्ट्रॉनिक विन्यास प्राप्त करते हैं। नोबल गैस (हीलियम के अतिरिक्त, जो द्विपुट इलेक्ट्रॉन के साथ है) के बाहरी कोश में आठ (ऑक्टेट) इलेक्ट्रॉन के स्थायी विन्यास के कारण वे विशेष रूप से स्थायी होते हैं, $n s^{2} n p^{6}$।
-
नकारात्मक और धनात्मक आयन विद्युत स्थैतिक आकर्षण द्वारा स्थायी हो जाते हैं।
उदाहरण के रूप में, सोडियम और क्लोरीन से $\mathrm{NaCl}$ के निर्माण को ऊपर के योजना के अनुसार इस प्रकार समझा जा सकता है:
| $\mathrm{Na}$ | $\rightarrow$ | $\mathrm{Na}^{+}+\mathrm{e}^{-}$ |
| $[\mathrm{Ne}] 3 \mathrm{~s}^{1}$ | $[\mathrm{Ne}]$ | |
| $\mathrm{Cl}+\mathrm{e}^{-}$ | $\rightarrow$ | $\mathrm{Cl}^{-}$ |
| $[\mathrm{Ne}] 3 s^{2} 3 p^{5}$ | $[\mathrm{Ne}] 3 s^{2} 3 p^{6}$ या $[\mathrm{Ar}]$ | |
| $\mathrm{Na}^{+}+\mathrm{Cl}^{-}$ | $\rightarrow$ | $\mathrm{NaCl}$ या $\mathrm{Na}^{+} \mathrm{Cl}^{-}$ |
उतना ही $\mathrm{CaF}_{2}$ के गठन को दिखाया जा सकता है:
| $\mathrm{Ca}$ | $\rightarrow$ | $\mathrm{Ca}^{2+}+2 \mathrm{e}^{-}$ |
| $[\mathrm{Ar}] 4 s^{2}$ | $[\mathrm{Ar}]$ | |
| $\mathrm{F}+\mathrm{e}^{-}$ | $\rightarrow$ | $\mathrm{F}^{-}$ |
| $[\mathrm{He}] 2 s^{2} 2 p^{5}$ | $[\mathrm{He}] 2 s^{2} 2 p^{6}$ या $[\mathrm{Ne}]$ | |
| $\mathrm{Ca}^{2+}+2 \mathrm{~F}^{-}$ | $\rightarrow$ | $\mathrm{CaF}_2$ या $\mathrm{Ca}^{2+}\left(\mathrm{F}^{-}\right)_2$ |
The bond formed, as a result of the electrostatic attraction between the positive and negative ions was termed as the electrovalent bond. The electrovalence is thus equal to the number of unit charge(s) on the ion. Thus, calcium is assigned a positive electrovalence of two, while chlorine a negative electrovalence of one.
Kössel’s postulations provide the basis for the modern concepts regarding ion-formation by electron transfer and the formation of ionic crystalline compounds. His views have proved to be of great value in the understanding and systematisation of the ionic compounds. At the same time he did recognise the fact that a large number of compounds did not fit into these concepts.
4.1.1 ओक्टेट नियम
कॉसल और ली ने 1916 में परमाणुओं के बीच रासायनिक संयोजन के एक महत्वपूर्ण सिद्धांत का विकास किया, जिसे रासायनिक बंधन के इलेक्ट्रॉनिक सिद्धांत के रूप में जाना जाता है। इस सिद्धांत के अनुसार, परमाणु एक दूसरे के तौर पर अपने वैलेंस इलेक्ट्रॉनों के स्थानांतरण द्वारा (गैन या खोने के तौर पर) या वैलेंस इलेक्ट्रॉनों के साझा करके संयोजन कर सकते हैं, ताकि उनके वैलेंस शेल में ओक्टेट हो। इसे ओक्टेट नियम के रूप में जाना जाता है।
4.1.2 सहसंयोजक बंध
लैंगमुअर (1919) ने ली के प्रस्तावना को बेहतर बनाया, जिसमें ओक्टेट के स्थायी घनाकार व्यवस्था के विचार को छोड़ दिया गया और “सहसंयोजक बंध” शब्द को परिचय दिया गया। ली-लैंगमुअर सिद्धांत को समझने के लिए क्लोरीन अणु, $\mathrm{Cl}_2$ के निर्माण को ध्यान में रखा जा सकता है। $\mathrm{Cl}$ परमाणु, जिसकी इलेक्ट्रॉनिक विन्यास $[\mathrm{Ne}] 3 s^2 3 p^5$ होती है, आर्गन के विन्यास से एक इलेक्ट्रॉन कम होता है। $\mathrm{Cl}_2$ अणु के निर्माण को दो क्लोरीन परमाणुओं के बीच एक इलेक्ट्रॉन युग्म के साझा करने के तौर पर समझा जा सकता है, जहां प्रत्येक क्लोरीन परमाणु साझा युग्म में एक इलेक्ट्रॉन योगदान देता है। इस प्रक्रिया में दोनों क्लोरीन परमाणु निकटतम नोबल गैस (अर्थात आर्गन) के बाहरी शेल के ओक्टेट के समान बन जाते हैं।

दो Cl परमाणुओं के बीच सहसंयोजक बंध
डॉट्स इलेक्ट्रॉन को दर्शाते हैं। ऐसे संरचनाएं लेविस डॉट संरचनाएं कहलाती हैं।
लेविस डॉट संरचनाएं अन्य अणुओं के लिए भी लिखी जा सकती हैं, जिनमें संयोजन करने वाले परमाणु समान या अलग हो सकते हैं। महत्वपूर्ण शर्तों के रूप में है:
-
प्रत्येक बंध परमाणुओं के बीच एक इलेक्ट्रॉन युग्म के साझा करने के परिणामस्वरूप बनता है।
-
प्रत्येक संयोजन परमाणु कम से कम एक इलेक्ट्रॉन साझा युग्म में योगदान देता है।
-
संयोजन परमाणुओं के इलेक्ट्रॉन के साझा करने के कारण बाहरी कोश के नोबल गैस विन्यास प्राप्त कर लेते हैं।
-
इसलिए, पानी और कार्बन टेट्राक्लोराइड अणुओं में सहसंयोजक बंधन के निर्माण को इस प्रकार दर्शाया जा सकता है:

इसलिए, जब दो परमाणु एक इलेक्ट्रॉन युग्म साझा करते हैं तो उन्हें एकल सहसंयोजक बंधन द्वारा जुड़े कहा जाता है। कई यौगिकों में परमाणुओं के बीच बहुल बंधन होते हैं। दो परमाणुओं के बीच बहुल बंधन के निर्माण के दृष्टिकोण में दो से अधिक इलेक्ट्रॉन युग्मों के साझा करने की आवश्यकता होती है। यदि दो परमाणु दो इलेक्ट्रॉन युग्मों के साझा करते हैं, तो उनके बीच सहसंयोजक बंधन को द्विबंध कहा जाता है। उदाहरण के लिए, कार्बन डाइऑक्साइड अणु में कार्बन और ऑक्सीजन परमाणुओं के बीच दो द्विबंध होते हैं। इसी तरह, एथीन अणु में दो कार्बन परमाणु एक द्विबंध द्वारा जुड़े होते हैं।

$\mathrm{C} _{2} \mathrm{H} _{4}$ अणु
जब संयोजन करते हुए परमाणु तीन इलेक्ट्रॉन युग्म साझा करते हैं, जैसे कि दो नाइट्रोजन परमाणु $N_{2}$ अणु में और एथाइन अणु में दो कार्बन परमाणु, तब एक त्रिपरमाणुक बंधन बनता है।
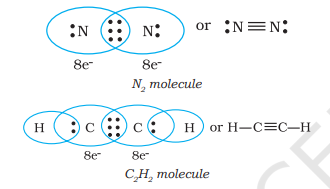
4.1.3 सरल अणुओं का लुईस प्रतिनिधित्व (लुईस संरचना)
लुईस डॉट संरचना अणुओं और आयनों में बंधन के चित्र को इलेक्ट्रॉन के साझा युग्म और अष्टक नियम के रूप में प्रस्तुत करती है। ऐसा चित्र एक अणु के बंधन और व्यवहार को पूरी तरह समझाने में सक्षम नहीं हो सकता, लेकिन इसके माध्यम से अणु के निर्माण और गुणों के बारे में बहुत अधिक समझ में आ सकता है। अतः अणुओं के लुईस डॉट संरचना के लेखन बहुत उपयोगी होता है। अणुओं के लुईस डॉट संरचना को निम्नलिखित चरणों के अनुसार लिखा जा सकता है:
-
संरचना लिखने के लिए आवश्यक संतृप्त इलेक्ट्रॉन की कुल संख्या को संयोजन करने वाले परमाणुओं के संतृप्त इलेक्ट्रॉन के योग द्वारा प्राप्त किया जाता है। उदाहरण के लिए, $\mathrm{CH}_{4}$ अणु में बंधन के लिए आठ संतृप्त इलेक्ट्रॉन उपलब्ध हैं (4 कार्बन से और 4 हाइड्रोजन परमाणुओं से)।
-
ऋणावेशित आयनों के लिए, प्रत्येक नकारात्मक आवेश के अर्थ में एक इलेक्ट्रॉन के जोड़ का अंतर होता है। धनावेशित आयनों के लिए, प्रत्येक धनावेश के अर्थ में कुल संतृप्त इलेक्ट्रॉन की संख्या में एक इलेक्ट्रॉन के घटाव का अंतर होता है। उदाहरण के लिए, $CO_3^{2-}$ आयन के लिए, दो नकारात्मक आवेश यह दर्शाते हैं कि उनके द्वारा उपलब्ध उदासीन परमाणुओं के बराबर इलेक्ट्रॉनों के अतिरिक्त दो इलेक्ट्रॉन होते हैं। $\mathrm{NH}_{4}^{+}$ आयन के लिए, एक धनावेश यह दर्शाता है कि उदासीन परमाणुओं के समूह से एक इलेक्ट्रॉन का नुकसान होता है।
-
संयोजन अणुओं के परमाणुओं के रासायनिक चिह्नों को जानना और यौगिक के कंकाल संरचना के बारे में जानकारी रखना (जिसे बुद्धिपूर्वक अनुमान लगाया जा सकता है), तो कुल इलेक्ट्रॉन की संख्या को अणुओं के बीच बंधन के रूप में साझा किए गए युग्मों के रूप में आसानी से वितरित किया जा सकता है।
-
सामान्य तौर पर सबसे कम विद्युत ऋणात्मकता वाला परमाणु अणु/आयन में केंद्रीय स्थिति ग्रहण करता है। उदाहरण के लिए $\mathrm{NF}_3$ और $CO_3^{2-}$ में नाइट्रोजन और कार्बन केंद्रीय परमाणु हैं जबकि फ्लूओरीन और ऑक्सीजन सिरे के स्थान पर हैं।
-
सिंगल बॉन्ड के लिए साझा इलेक्ट्रॉन युग्म के बाद, शेष इलेक्ट्रॉन युग्म या तो बहुबॉन्डिंग के लिए उपयोग किए जाते हैं या विच्छेदित युग्म के रूप में रह जाते हैं। मूल आवश्यकता यह है कि प्रत्येक बंधित परमाणु के आठ इलेक्ट्रॉन हों।
कुछ अणुओं/आयनों के लुईस प्रतिनिधित्व तालिका 4.1 में दिए गए हैं।
तालिका 4.1 कुछ अणुओं का लुईस प्रतिनिधित्व
समस्या 4.1
$\mathrm{CO}$ अणु के लुईस डॉट संरचना को लिखिए।
हल
चरण 1. कार्बन और ऑक्सीजन परमाणु के कुल वैलेंस इलेक्ट्रॉन की संख्या गणना करें। कार्बन और ऑक्सीजन परमाणु के बाहरी (वैलेंस) संरचना क्रमशः $2 s^{2} 2 p^{2}$ और $2 s^{2} 2 p^{4}$ है। उपलब्ध वैलेंस इलेक्ट्रॉन $4+6=10$ हैं।
चरण 2. $\mathrm{CO}$ की संरचना को लिखा जाता है: C O
चर नं. 3. $\mathrm{C}$ और $\mathrm{O}$ के बीच एक एकल बंध (एक साझा इलेक्ट्रॉन युग्म) खींचें और $\mathrm{O}$ पर आठ इलेक्ट्रॉन की पूर्ति करें, बचे हुए दो इलेक्ट्रॉन $\mathrm{C}$ पर अकेला युग्म हैं।
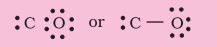
इससे कार्बन पर आष्टोत्तर नियम पूरा नहीं होता है और इसलिए हमें $\mathrm{C}$ और $\mathrm{O}$ परमाणुओं के बीच बहुलक बंधन (इस मामले में त्रिबंध) के उपयोग करना पड़ता है। यह दोनों परमाणुओं के लिए आष्टोत्तर नियम की शर्तों को संतुष्ट करता है।
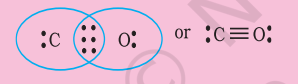
समस्या 4.2
नाइट्राइट आयन, $\mathrm{NO}_{2}^{-}$ के लुईस संरचना को लिखिए।
हल
चरण 1. नाइट्रोजन परमाणु, ऑक्सीजन परमाणु और एक अतिरिक्त नकारात्मक आवेश (एक इलेक्ट्रॉन के बराबर) के कुल बाह्य इलेक्ट्रॉनों की संख्या की गणना करें।
$$ \begin{aligned} & \mathrm{N}\left(2 s^{2} 2 p^{3}\right), \mathrm{O}\left(2 s^{2} 2 p^{4}\right) \\ & 5+(2 \times 6)+ = 17 \text { इलेक्ट्रॉन } \end{aligned} $$
एक इलेक्ट्रॉन के लिए एक नकारात्मक आवेश के कुल इलेक्ट्रॉनों की संख्या = 17+1 = 18
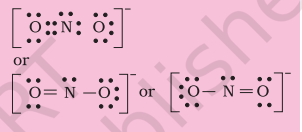
स्टेप 2। $\mathrm{NO}_{2}^{-}$ की कंकाल संरचना को इस प्रकार लिखा जाता है: $\mathrm{O} \quad \mathrm{N} \quad \mathrm{O}$
स्टेप 3। नाइट्रोजन और प्रत्येक ऑक्सीजन परमाणु के बीच एक एकल बंध (एक साझा इलेक्ट्रॉन युग्म) बनाएं जिससे ऑक्सीजन परमाणुओं पर आठ इलेक्ट्रॉन की संख्या पूरी हो जाए। हालांकि, इसके बाद नाइट्रोजन पर आठ इलेक्ट्रॉन की संख्या पूरी नहीं होती यदि बचे हुए दो इलेक्ट्रॉन इसके अकेले युग्म के रूप में हों।

इसलिए हमें नाइट्रोजन और ऑक्सीजन के एक परमाणु के बीच बहुत सारे बंधन करना पड़ता है (इस मामले में एक द्विबंध)। इससे निम्नलिखित Lewis डॉट संरचनाएं प्राप्त होती हैं।
4.1.4 सूचनात्मक आवेदन
सामान्यतः Lewis डॉट संरचनाएं अणुओं के वास्तविक आकार को प्रस्तुत नहीं करती हैं। यौगिक आयनों के मामले में, आयन के समग्र रूप से नेट आवेदन होता है और न कि किसी विशिष्ट परमाणु के। हालांकि, प्रत्येक परमाणु पर सूचनात्मक आवेदन निर्धारित करना संभव है। एक यौगिक अणु या आयन में एक परमाणु के सूचनात्मक आवेदन को उस परमाणु के अक्षय या मुक्त अवस्था में उसके मूल इलेक्ट्रॉनों की संख्या और Lewis संरचना में उस परमाणु के निर्धारित इलेक्ट्रॉनों की संख्या के अंतर के रूप में परिभाषित किया जा सकता है। इसे इस प्रकार व्यक्त किया जाता है :

गणना के लिए मान लीजिए कि अणु में परमाणु के प्रत्येक साझा युग्म के एक इलेक्ट्रॉन के मालिक होते हैं और एक अकेले युग्म के दोनों इलेक्ट्रॉन उस परमाणु के मालिक होते हैं।
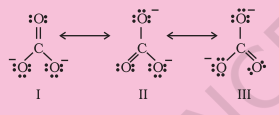
हम ऑजोन अणु $\left(\mathrm{O}_3\right)$ को लेकर विचार करें। $\mathrm{O}_3$ के लेविस संरचना को इस प्रकार बनाया जा सकता है:
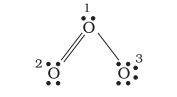
परमाणुओं को 1, 2 और 3 के रूप में संख्या दी गई है। निम्नलिखित परमाणुओं पर सूत्र आवेश है:
-
केंद्रीय $\mathrm{O}$ परमाणु जो 1 के रूप में चिह्नित है $=6-2-\dfrac{1}{2}(6)=+1$
-
सिरे पर $\mathrm{O}$ परमाणु जो 2 के रूप में चिह्नित है $=6-4-\dfrac{1}{2}(4)=0$
-
सिरे पर $\mathrm{O}$ परमाणु जो 3 के रूप में चिह्नित है $=6-6-\dfrac{1}{2}(2)=-1$
अतः, हम $\mathrm{O}_{3}$ को आवेश के साथ निम्नलिखित रूप में प्रस्तुत करते हैं:
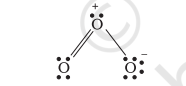
हमें समझना आवश्यक है कि सूचित चार्ज अणु में वास्तविक चार्ज विभाजन को दर्शाते नहीं हैं। लेविस संरचना में परमाणुओं पर चार्ज दर्शाना केवल अणु में वैलेंस इलेक्ट्रॉन की गिनती के लिए सहायता करता है। फॉर्मल चार्ज एक विशेष चयन के लिए सहायता करता है जो एक दिए गए विशिष्टता के लिए कई संभावित लेविस संरचनाओं में सबसे कम ऊर्जा वाली संरचना का चयन करता है। सामान्यतः सबसे कम ऊर्जा वाली संरचना वह होती है जिसमें परमाणुओं पर सबसे कम फॉर्मल चार्ज होते हैं। फॉर्मल चार्ज एक कारक है जो बंधन के शुद्ध सहसंयोजक दृष्टिकोण पर आधारित होता है जहां इलेक्ट्रॉन युग्म आसन्न परमाणुओं के बीच समान रूप से साझा किए जाते हैं।
4.1.5 अष्टक नियम की सीमाएं
अष्टक नियम, हालांकि उपयोगी होता है, सार्वत्रिक नहीं है। यह अधिकांश कार्बनिक यौगिकों के संरचना के बारे में समझने में बहुत उपयोगी है और यह मुख्य रूप से आवर्त सारणी के द्वितीय आवर्त तत्वों पर लागू होता है। अष्टक नियम के तीन प्रकार के अपवाद होते हैं।
केंद्रीय परमाणु का अपूर्ण अष्टक
कुछ यौगिकों में, केंद्रीय परमाणु के आसपास इलेक्ट्रॉनों की संख्या आठ से कम होती है। यह विशेष रूप से वैसे तत्वों के मामले में होता है जिनके वैद्युत ऋणात्मकता इलेक्ट्रॉन कम चार से कम होते हैं। उदाहरण के लिए, $\mathrm{LiCl}, \mathrm{BeH}_2$ और $\mathrm{BCl}_3$ हैं।
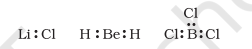
$\mathrm{Li}$, Be और B केवल 1, 2 और 3 बाह्य इलेक्ट्रॉन होते हैं। कुछ अन्य ऐसे यौगिक हैं $\mathrm{AlCl}_3$ और $\mathrm{BF}_3$।
विषम-इलेक्ट्रॉन अणु
इलेक्ट्रॉन की संख्या विषम संख्या वाले अणुओं में, जैसे नाइट्रिक ऑक्साइड, $\mathrm{NO}$ और नाइट्रोजन डाइऑक्साइड, $\mathrm{NO}_2$, सभी परमाणुओं के लिए आठ इलेक्ट्रॉन का नियम पूरा नहीं होता।
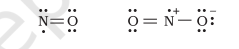
विस्तारित अष्टक
तत्वों के तीसरे आवर्त के बाद के तत्वों के अतिरिक्त, $3 s$ और $3 p$ कक्षक के अलावा, $3 d$ कक्षक भी बंधन के लिए उपलब्ध होते हैं। इन तत्वों के कई यौगिकों में केंद्रीय परमाणु के चारों ओर आठ से अधिक मूल इलेक्ट्रॉन होते हैं। इसे विस्तारित अष्टक कहा जाता है। स्पष्ट रूप से ऐसे मामलों में अष्टक नियम लागू नहीं होता।
कुछ ऐसे यौगिकों के उदाहरण हैं: $\mathrm{PF}_5, \mathrm{SF}_6, \mathrm{H}_2 \mathrm{SO}_4$ और कई समन्वय यौगिक।
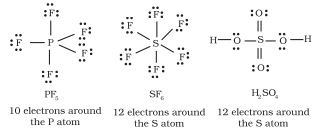
उत्सुकता के साथ, सल्फर भी ऐसे यौगिक बनाता है जहाँ आठ-इलेक्ट्रॉन नियम का पालन किया जाता है। सल्फर डाइक्लोराइड में, $\mathrm{S}$ परमाणु के आसपास आठ इलेक्ट्रॉन होते हैं।
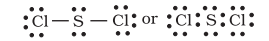
अष्टक नियम के अन्य दोष
-
यह स्पष्ट है कि अष्टक नियम नोबल गैसों की रासायनिक अक्रियता पर आधारित है। हालांकि, कुछ नोबल गैसें (उदाहरण के लिए क्सीनॉन और क्रिप्टॉन) ऑक्सीजन और फ्लूओरीन के साथ संयोग करके जैसे $\mathrm{XeF}_2, \mathrm{KrF}_2, \mathrm{XeOF}_2$ आदि कई यौगिक बनाती हैं।
-
इस सिद्धांत के अंतर्गत अणुओं के आकार के बारे में कोई बात नहीं कही गई है।
-
यह अणुओं की सापेक्ष स्थिरता के बारे में बिलकुल चुप रहता है, जबकि अणु की ऊर्जा के बारे में कुछ नहीं कहता है।
4.2 आयनिक या विद्युत आकर्षण बंधन
कोसल और लेविस द्वारा आयनिक बंधन के निर्माण के अध्ययन से यह स्पष्ट होता है कि आयनिक यौगिकों के निर्माण मुख्य रूप से निर्भर होता है:
-
संबंधित उदासीन परमाणुओं से धनात्मक और ऋणात्मक आयनों के निर्माण की आसानी;
-
ठोस में धनात्मक और ऋणात्मक आयनों के व्यवस्था, अर्थात ठोस यौगिक के क्रिस्टलीय संरचना के जालक के आधार पर।
एक धनावेशी आयन के निर्माण में आयनन की प्रक्रिया शामिल होती है, अर्थात उदासीन परमाणु से इलेक्ट्रॉन (ओ) के निकल जाने के कारण होता है और एक नकारात्मक आयन के निर्माण में इलेक्ट्रॉन (ओ) के उदासीन परमाणु में जोड़ देने के कारण होता है।
| $\mathrm{M}(\mathrm{g}) $ | $\rightarrow$ | $\mathrm{M}^{+}(\mathrm{g})+\mathrm{e}^{-} ;$ | |
| आयनन एंथैल्पी | |||
| $\mathrm{X}(\mathrm{g})+\mathrm{e}^{-}$ | $\rightarrow$ | $\mathrm{X}^{-}(\mathrm{g}) ;$ | |
| इलेक्ट्रॉन ग्रहण एंथैल्पी | |||
| $\mathrm{M}^{+}(\mathrm{g})+\mathrm{X}^{-}(\mathrm{g}) \rightarrow$ | $\mathrm{MX}(\mathrm{s})$ |
इलेक्ट्रॉन ग्रहण py, $\Delta_{e g} \boldsymbol{H}$, एक गैस अवस्था में अपने मूल अवस्था में रहे परमाणु के एक इलेक्ट्रॉन लेने के साथ उत्पन्न एंथैल्पी परिवर्तन (यूनिट 3) होती है। इलेक्ट्रॉन ग्रहण प्रक्रिया ऊष्माक्षेपी या ऊष्माशोषी हो सकती है। इसके विपरीत, आयनन हमेशा ऊष्माशोषी होती है। इलेक्ट्रॉन आकर्षण, इलेक्ट्रॉन ग्रहण के साथ उत्पन्न ऊर्जा परिवर्तन के ऋणात्मक होता है।
स्पष्ट रूप से आयनिक बंधन उन तत्वों के बीच आसानी से बनेंगे जिनके आयनन एंथैल्पी कम होती है और जिनके इलेक्ट्रॉन ग्रहण एंथैल्पी के ऋणात्मक मान अधिक होते हैं।
अधिकांश आयनिक यौगिकों में धातु तत्वों से निर्मित धनायन और अधातु तत्वों से निर्मित ऋणायन होते हैं। अमोनियम आयन, $\mathrm{NH}_{4}^{+}$ (दो अधातु तत्वों से बना) एक अपवाद है। यह कई आयनिक यौगिकों के धनायन बनाता है।
ठोस अवस्था में आयनिक यौगिकों में धनायन और ऋणायन के क्रमबद्ध त्रिविमीय व्यवस्था होती है जो कूलॉम्बिक अंतरक्रिया ऊर्जा द्वारा बंधे रहते हैं। ये यौगिक आयनों के आकार, उनके पैकिंग व्यवस्था और अन्य कारकों के आधार पर विभिन्न क्रिस्टल संरचनाओं में क्रिस्टलीकृत होते हैं। उदाहरण के लिए, सोडियम क्लोराइड, $\mathrm{NaCl}$ (पत्थर नमक) की क्रिस्टल संरचना नीचे दिखाई गई है।
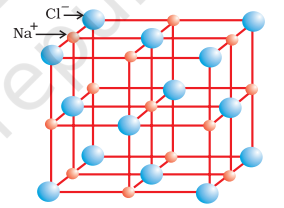
रॉक सॉल्ट संरचना
अयोग्य ठोसों में, इलेक्ट्रॉन ग्रहण py और आयनन py के योग धनात्मक हो सकता है, लेकिन अभिक्रमण जालक के निर्माण में विमुक्त ऊर्जा के कारण संरचना के स्थायित्व के कारण ठोस के निर्माण के कारण ऊर्जा विमुक्त होती है। उदाहरण के लिए: $\mathrm{Na}(\mathrm{g})$ से $\mathrm{Na}^{+}(\mathrm{g})$ के निर्माण के लिए आयनन एंथैल्पी $495.8 \mathrm{~kJ} \mathrm{~mol}^{-1}$ है; जबकि $\mathrm{Cl}(\mathrm{g})+\mathrm{e}^{-} \rightarrow \mathrm{Cl}^{-}(\mathrm{g})$ परिवर्तन के लिए इलेक्ट्रॉन ग्रहण एंथैल्पी $-348.7 \mathrm{~kJ} \mathrm{~mol}^{-1}$ ही है। दोनों के योग $147.1 \mathrm{~kJ} \mathrm{~mol}^{-1}$ है जो $\mathrm{NaCl}(\mathrm{s})$ के जालक निर्माण की एंथैल्पी $-788 \mathrm{~kJ} \mathrm{~mol}^{-1}$ द्वारा अधिक से अधिक कंपेंस कर दिया जाता है। अतः, प्रक्रिया में विमुक्त ऊर्जा अवशोषित ऊर्जा से अधिक होती है। अतः, एक आयनिक यौगिक के स्थायित्व के गुणात्मक मापदंड के रूप में इसकी जालक एंथैल्पी के बजाय आयनिक वस्तुओं के गैसीय अवस्था में इलेक्ट्रॉन के अष्टक के पूर्ण होने के आधार पर नहीं लिया जाता है।
लैटिस एन्थैल्पी आयनिक यौगिक के निर्माण में महत्वपूर्ण भूमिका निभाती है, इसलिए हमें इसके बारे में अधिक जानकारी हासिल करना आवश्यक है।
4.2.1 लैटिस एन्थैल्पी
एक आयनिक ठोस की लैटिस एन्थैल्पी को एक मोल ठोस आयनिक यौगिक को गैस अवस्था में अलग करने के लिए आवश्यक ऊर्जा के रूप में परिभाषित किया जाता है। उदाहरण के लिए, $\mathrm{NaCl}$ की लैटिस एन्थैल्पी $788 \mathrm{~kJ} \mathrm{~mol}^{-1}$ होती है। इसका अर्थ यह है कि 78 एक एक मोल ठोस $\mathrm{NaCl}$ को एक मोल $\mathrm{Na}^{+}(\mathrm{g})$ और एक मोल $\mathrm{Cl}^{-}(\mathrm{g})$ में अलग करने के लिए $788 \mathrm{~kJ}$ ऊर्जा की आवश्यकता होती है, जो अनंत दूरी तक होती है।
इस प्रक्रिया में विपरीत चार्ज के आयनों के बीच आकर्षण बल और समान चार्ज के आयनों के बीच प्रतिकर्षण बल दोनों शामिल होते हैं। ठोस क्रिस्टल तीन-आयामी होता है; इसलिए आकर्षण और प्रतिकर्षण बलों के अंतर्क्रिया के आधार पर लेटिस एंथैल्पी की गणना सीधे नहीं की जा सकती। क्रिस्टल ज्यामीट्री से संबंधित कारकों को शामिल करना आवश्यक होता है।
4.3 बंड पैरामीटर
4.3.1 बंड लंबाई
बंड लंबाई को अणु में दो बंडित अणुओं के नाभिकों के संतुलन दूरी के रूप में परिभाषित किया जाता है। बंड लंबाई को स्पेक्ट्रोस्कोपिक, X-किरण विवर्तन और इलेक्ट्रॉन-विवर्तन तकनीकों द्वारा मापा जाता है, जिसके बारे में आप उच्च श्रेणी की कक्षाओं में सीखेंगे। प्रत्येक बंडित युग्म के अणु के योगदान के बंड लंबाई में शामिल होता है (चित्र 4.1)। सहसंयोजक बंड के मामले में, प्रत्येक अणु के योगदान को उस अणु के सहसंयोजक त्रिज्या के रूप में जाना जाता है।
कोवलेंट त्रिज्या लगभग एक परमाणु के कोर के त्रिज्या के रूप में मापा जाता है, जो एक बंधन स्थिति में एक पड़ोसी परमाणु के कोर के संपर्क में होता है। कोवलेंट त्रिज्या एक ही अणु में एक कोवलेंट बंध से जुड़े दो समान परमाणुओं के बीच दूरी के आधा होता है।
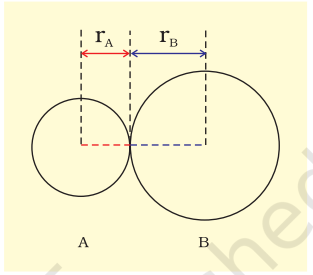
चित्र 4.1 सहसंयोजक अणु AB में बन्ध दूरी। R = rA + rB (R बन्ध दूरी है और rA तथा rB क्रमशः A तथा B परमाणुओं के सहसंयोजक त्रिज्याएँ हैं)
वैन डर वाल्स त्रिज्या एक परमाणु के समग्र आकार को दर्शाती है जो असंयोजी स्थिति में इसके बाह्य कोश को शामिल करती है। इसके अतिरिक्त, ठोस में दो समान परमाणुओं के बीच की दूरी के आधा वैन डर वाल्स त्रिज्या होती है। क्लोरीन के सहसंयोजक तथा वैन डर वाल्स त्रिज्याएँ चित्र 4.2 में दर्शाई गई हैं।
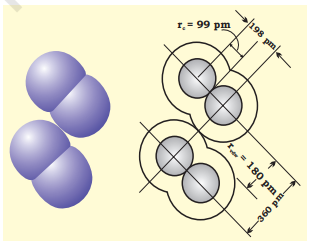
चित्र 4.2 क्लोरीन अणु में सहसंयोजक और वैन डर वाल्स त्रिज्याएँ। आंतरिक वृत्त वैन डर वाल्स त्रिज्या (rvdw) और सहसंयोजक त्रिज्या (rc) के आकार को दर्शाते हैं।
एकल, द्विगुणित और त्रिगुणित बंध के कुछ सामान्य औसत बंध दूरी तालिका 4.2 में दिखाई गई हैं। कुछ सामान्य अणुओं के बंध दूरी तालिका 4.3 में दिखाई गई हैं।
कुछ सामान्य तत्वों की सहसंयोजक त्रिज्याएँ तालिका 4.4 में सूचीबद्ध हैं।
4.3.2 बंध कोण
यह एक अणु/संकर आयन में केंद्रीय परमाणु के चारों ओर बंधन इलेक्ट्रॉन युग्मों को रखने वाले ऑर्बिटलों के बीच कोण को दर्शाता है। बंध कोण डिग्री में व्यक्त किया जाता है जिसे स्पेक्ट्रोस्कोपिक विधियों द्वारा प्रयोगशाला में निर्धारित किया जा सकता है। यह केंद्रीय परमाणु के चारों ओर ऑर्बिटलों के वितरण के बारे में कुछ धारणा प्रदान करता है और इसलिए इसके आकार का निर्धारण करने में सहायता करता है। उदाहरण के लिए, पानी में $\mathrm{H}-\mathrm{O}-\mathrm{H}$ बंध कोण निम्नलिखित तरीके से दर्शाया जा सकता है :

4.3.3 बॉन्ड एंथैल्पी
यह एक निश्चित प्रकार के दो परमाणुओं के गैसीय अवस्था में एक मोल बॉन्ड तोड़ने के लिए आवश्यक ऊर्जा की मात्रा को परिभाषित करता है। बॉन्ड एंथैल्पी की इकाई $\mathrm{kJ} \mathrm{mol}^{-1}$ होती है। उदाहरण के लिए, हाइड्रोजन अणु में $\mathrm{H}-\mathrm{H}$ बॉन्ड एंथैल्पी $435.8 \mathrm{~kJ} \mathrm{~mol}^{-1}$ होती है।
$\mathrm{H}_2 (\mathrm{~g}) \rightarrow \mathrm{H}(\mathrm{g})+\mathrm{H}(\mathrm{g})$;
$\Delta_{\mathrm{a}} H^\ominus =435.8 \mathrm{~kJ} \mathrm{~mol}^{-1}$
इसी तरह, अनेक बंधों वाले अणुओं के लिए बंध एन्थैल्पी, उदाहरण के लिए $\mathrm{O}_2$ और $\mathrm{N}_2$ के लिए नीचे दिया गया है :
$\mathrm{O}_{2}(\mathrm{O}=\mathrm{O})(\mathrm{g}) \rightarrow \mathrm{O}(\mathrm{g})+\mathrm{O}(\mathrm{g}) ;$
$$ \Delta_{\mathrm{a}} H^{\ominus}=498 \mathrm{~kJ} \mathrm{~mol}^{-1} $$
$\mathrm{N}_{2}(\mathrm{~N} \equiv \mathrm{N})(\mathrm{g}) \rightarrow \mathrm{N}(\mathrm{g})+\mathrm{N}(\mathrm{g}) ;$
$$ \Delta_{\mathrm{a}} H^{\ominus}=946.0 \mathrm{~kJ} \mathrm{~mol}^{-1} $$
बड़ी बंध वियोजन एन्थैल्पी होना, अणु में बंध के मजबूत होने का संकेत होता है। एक विषम परमाणु द्विपरमाणुक अणु जैसे $\mathrm{HCl}$ के मामले में हम लिख सकते हैं:
$$ \mathrm{HCl}(\mathrm{g}) \rightarrow \mathrm{H}(\mathrm{g})+\mathrm{Cl}(\mathrm{g}) ; \Delta_{\mathrm{a}} \mathrm{H}^{\omin $$
पॉलीएटोमिक अणुओं के मामले में बंध शक्ति के मापन में अधिक कठिनाई होती है। उदाहरण के लिए $\mathrm{H}_{2} \mathrm{O}$ अणु के मामले में, दो $\mathrm{O}-\mathrm{H}$ बंधों को तोड़ने के लिए आवश्यक एन्थैल्पी एक समान नहीं होती।
तालिका 4.2 कुछ एकल, द्विबंध और त्रिबंध के औसत बंध लंबाई
| बंध प्रकार | सहसंयोजक बंध लंबाई (पिकोमीटर में) |
|---|---|
| $\mathrm{O}-\mathrm{H}$ | 96 |
| $\mathrm{C}-\mathrm{H}$ | 107 |
| $\mathrm{~N}-\mathrm{O}$ | 136 |
| $\mathrm{C}-\mathrm{O}$ | 143 |
| $\mathrm{C}-\mathrm{N}$ | 143 |
| $\mathrm{C}-\mathrm{C}$ | 154 |
| $\mathrm{C}=\mathrm{O}$ | 121 |
| $\mathrm{~N}=\mathrm{O}$ | 122 |
| $\mathrm{C}=\mathrm{C}$ | 133 |
| $\mathrm{C}=\mathrm{N}$ | 138 |
| $\mathrm{C} \equiv \mathrm{N}$ | 116 |
| $\mathrm{C} \equiv \mathrm{C}$ | 120 |
तालिका 4.3 कुछ सामान्य अणुओं में बंध लंबाई
| अणु | बंध लंबाई (पिकोमीटर में) |
|---|---|
| $\mathrm{H}_{2}(\mathrm{H}-\mathrm{H})$ | 74 |
| $\mathrm{~F}_{2}(\mathrm{~F}-\mathrm{F})$ | 144 |
| $\mathrm{Cl}_{2}(\mathrm{Cl}-\mathrm{Cl})$ | 199 |
| $\mathrm{Br}_{2}(\mathrm{Br}-\mathrm{Br})$ | 228 |
| $\mathrm{I}_{2}(\mathrm{I}-\mathrm{I})$ | 267 |
| $\mathrm{~N}_{2}(\mathrm{~N} \equiv \mathrm{N})$ | 109 |
| $\mathrm{O}_{2}(\mathrm{O}=\mathrm{O})$ | 121 |
| $\mathrm{HF}(\mathrm{H}-\mathrm{F})$ | 92 | | $\mathrm{HCl}(\mathrm{H}-\mathrm{Cl})$ | 127 | | $\mathrm{HBr}(\mathrm{H}-\mathrm{Br})$ | 141 | | $\mathrm{HI}(\mathrm{H}-\mathrm{I})$ | 160 |
तालिका 4.4 सहसंयोजक त्रिज्याएँ, $ \mathbf{r}_{\text {cov }} /(\mathrm{pm})$
| $\mathrm{H}$ | 37 | ||||||
|---|---|---|---|---|---|---|---|
| $\mathrm{C}$ | $77(1)$ | $\mathrm{N}$ | $74(1)$ | $\mathrm{O}$ | $66(1)$ | $\mathrm{F}$ | 64 |
| $67(2)$ | $65(2)$ | $57(2)$ | $\mathrm{Cl}$ | 99 |
| | $60(3)$ | | $55(3)$ | | | | | | | | $\mathrm{P}$ | 110 | $\mathrm{~S}$ | $104(1)$ | $\mathrm{Br}$ | 114 | | | | | | | $95(2)$ | | | | | | | | | | | | | | | $\mathrm{As}$ | 121 | $\mathrm{Se}$ | 104 | $\mathrm{I}$ | 133 | | | | $\mathrm{Sb}$ | 141 | $\mathrm{Te}$ | 137 | | |
- उल्लेखित मूल्य एकल बंधों के लिए हैं, अन्यथा सूचित किए गए अंशों के अतिरिक्त। (परिस्थिति इकाई 3 के लिए भी देखें)।
$\mathrm{H}_2 \mathrm{O}(\mathrm{g}) \rightarrow \mathrm{H}(\mathrm{g})+\mathrm{OH}(\mathrm{g}) ; \Delta_a H_1^\ominus=502 \mathrm{~kJ} \mathrm{~mol}^{-1}$
$\mathrm{OH}(\mathrm{g}) \rightarrow \mathrm{H}(\mathrm{g})+\mathrm{O}(\mathrm{g}) ; \Delta_{\mathrm{a}} H_{2}^{\ominus}=427 \mathrm{~kJ} \mathrm{~mol}^{-1}$
$\Delta_{\mathrm{a}} H^{\ominus}$ मान के अंतर के कारण दूसरे $\mathrm{O}-\mathrm{H}$ बंध के कारण रासायनिक परिवेश में बदलाव के कारण कुछ परिवर्तन होता है। यही कारण है कि एक ही $\mathrm{O}-\mathrm{H}$ बंध के ऊर्जा में अंतर अलग-अलग अणुओं में जैसे $\mathrm{C}_2 \mathrm{H}_5 \mathrm{OH}$ (एथेनॉल) और पानी में देखा जाता है। इसलिए, बहुपरमाणुक अणुओं में माध्य या औसत बंध ऊष्मा के शब्द का उपयोग किया जाता है। यह ऊष्मा ऊर्जा के कुल वियोजन ऊष्मा को तोड़े गए बंधों की संख्या से विभाजित करके प्राप्त किया जाता है, जैसा कि नीचे पानी के अणु के मामले में समझाया गया है,
$ \text { औसत बंधन एंथैल्पी } =\dfrac{502+427}{2} $
$ =464.5 \mathrm{~kJ} \mathrm{~mol}^{-1} $
4.3.4 बंधन कोर्डर
सहसंयोजक बंध के लिए लुईस वर्णन में, बंधन कोर्डर अणु में दो परमाणुओं के बीच बंधों की संख्या द्वारा दिया जाता है। उदाहरण के लिए, $\mathrm{H}_2$ (एक साझा इलेक्ट्रॉन युग्म के साथ), $\mathrm{O}_2$ (दो साझा इलेक्ट्रॉन युग्म के साथ) और $\mathrm{N}_2$ (तीन साझा इलेक्ट्रॉन युग्म के साथ) में बंधन कोर्डर क्रमशः $1, 2, 3$ होता है। इसी तरह, CO में ( $\mathrm{C}$ और $\mathrm{O}$ के बीच तीन साझा इलेक्ट्रॉन युग्म) बंधन कोर्डर 3 होता है। $\mathrm{N}_2$ के लिए बंधन कोर्डर 3 होता है और इसका $\Delta_a H^\ominus$ $945 \mathrm{~kJ} \mathrm{~mol}^{-1}$ होता है; जो द्विपरमाणुक अणु में सबसे ऊँचा मान होता है।
इसोइलेक्ट्रॉनिक अणु और आयनों के बराबर बंधन क्रम होता है; उदाहरण के लिए, $F_2$ और $\mathrm{O}_{2}^{2-}$ के बंधन क्रम 1 होता है। $\mathrm{N}_2$, $\mathrm{CO}$ और $\mathrm{NO}^{+}$ के बंधन क्रम 3 होता है।
एक सामान्य संबंध जो अणुओं के स्थायित्व को समझने में उपयोगी होता है यह है: बंधन क्रम में वृद्धि के साथ, बंधन एंथैल्पी बढ़ती जाती है और बंधन लंबाई घटती जाती है।
4.3.5 रेज़ोनेंस संरचनाएं
एक अणु के प्रतिनिधित्व के लिए एक अकेला लीविस संरचना अक्सर अपर्याप्त पाया जाता है, जो इसके प्रयोगात्मक रूप से निर्धारित पैरामीटरों के साथ संगत नहीं होती। उदाहरण के लिए, ओजोन, $\mathrm{O}_{3}$ अणु को नीचे दिखाए गए संरचनाओं I और II द्वारा बराबर तौर पर प्रतिनिधित्व किया जा सकता है:
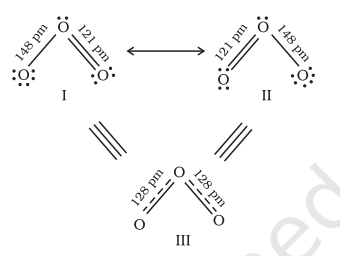
चित्र 4.3 O3 अणु में अनुगति
(संरचना I और II दोनों सांप्रदायिक रूपों को दर्शाती हैं जबकि संरचना III अनुगति मिश्रण है)
दोनों संरचनाओं में हमें एक $\mathrm{O}-\mathrm{O}$ एकल बंध और एक $\mathrm{O}=\mathrm{O}$ दुई बंध होती है। सामान्य $\mathrm{O}-\mathrm{O}$ और $\mathrm{O}=\mathrm{O}$ बंध लंबाई क्रमशः $148 \mathrm{pm}$ और $121 \mathrm{pm}$ होती है। अनुभागीय रूप से निर्धारित ऑक्सीजन-ऑक्सीजन बंध लंबाई O3 अणु में समान है ( $\left.128 \mathrm{pm}\right)$। अतः O3 अणु में ऑक्सीजन-ऑक्सीजन बंध एक दुई बंध और एक एकल बंध के बीच मध्य बिंदु पर होती है। स्पष्ट रूप से, यह ऊपर दिए गए दोनों लीविस संरचनाओं में से किसी एक द्वारा प्रस्तुत नहीं किया जा सकता।
अनुनाद के अवधारणा को अणुओं के सटीक संरचना के चित्रण में आने वाली कठिनाइयों के साथ निपटने के लिए प्रस्तुत किया गया था, जैसे $\mathrm{O}_3$। अनुनाद के अवधारणा के अनुसार, जब एक लीविस संरचना एक अणु को सटीक रूप से व्यक्त नहीं कर सके, तो एक समान ऊर्जा, नाभिक के स्थिति, आबन्धन और अनाबन्धन इलेक्ट्रॉन युग्म के साथ कई संरचनाओं को मिश्रित संरचना के अनुकूल संरचना (canonical structures) के रूप में लिया जाता है, जो अणु को सटीक रूप से व्यक्त करता है। इसलिए $\mathrm{O}_3$ के लिए, ऊपर दिखाए गए दो संरचनाएँ अनुकूल संरचनाएँ या अनुनाद संरचनाएँ हैं और उनके मिश्रण अर्थात तीसरी संरचना $\mathrm{O}_3$ की सटीक संरचना को व्यक्त करती है। इसे अनुनाद मिश्रण के रूप में भी जाना जाता है। अनुनाद को एक द्वि-शीर्षक तीर द्वारा प्रस्तुत किया जाता है।
कार्बोनेट आयन और कार्बन डाइऑक्साइड अणु भी अन्य उदाहरण हैं जो अनुनाद संरचनाओं के रूप में प्रस्तुत किए जा सकते हैं।
समस्या 4.3
$\mathrm{CO}_{3}^{2-}$ आयन की संरचना को अनुनाद के अनुसार समझाइए।
हल
कार्बन और ऑक्सीजन परमाणुओं के बीच दो एकल बंध और एक द्विबंध की उपस्थिति पर आधारित एकल लीविस संरचना अणु को ठीक तरीके से प्रस्तुत करने में अपर्याप्त है क्योंकि यह असमान बंधों को प्रस्तुत करती है। प्रयोगात्मक अध्ययनों के अनुसार, $\mathrm{CO}_{3}^{2-}$ में सभी कार्बन और ऑक्सीजन बंध समान हैं। अतः कार्बोनेट आयन को नीचे दिखाए गए संकल्पनिक रूप I, II और III के अनुनाद मिश्रण के रूप में सर्वोत्तम तरीके से वर्णित किया जा सकता है।
चित्र 4.4 $\mathrm{CO}_{3}^{2-}$ में रेजोनेंस, I, II और III तीन मानक रूपों को प्रदर्शित करते हैं।
समस्या 4.4
$\mathrm{CO}_{2}$ अणु की संरचना की व्याख्या करें।
हल
$\mathrm{CO}_2$ में कार्बन और ऑक्सीजन के बीच बंधन की व्यापक निर्धारित लंबाई $115 \mathrm{pm}$ है। सामान्य कार्बन और ऑक्सीजन के बीच द्विबंधन $(\mathrm{C}=\mathrm{O})$ और त्रिबंधन $(\mathrm{C} \equiv \mathrm{O})$ की लंबाई क्रमशः $121 \mathrm{pm}$ और $110 \mathrm{pm}$ है। $\mathrm{CO}_2$ में कार्बन और ऑक्सीजन के बीच बंधन की लंबाई $115 \mathrm{pm}$ है जो $\mathrm{C}=\mathrm{O}$ और $\mathrm{C} \equiv \mathrm{O}$ के मध्य मान है। स्पष्ट रूप से, एक अकेला लीविस संरचना इस स्थिति को दर्शाने में असमर्थ है और इसलिए एक से अधिक लीविस संरचनाओं को लिखना आवश्यक हो जाता है और यह बताया जाता है कि $\mathrm{CO}_2$ की संरचना को अनुमानित या रेजोनेंस रूपों I, II और III के मिश्रण के रूप में सर्वोत्तम रूप से व्यक्त किया जा सकता है।

चित्र 4.5 $\mathrm{CO}_{2}$ अणु में रेजोनेंस, I, II और III तीन अनुमानित संरचनाओं को प्रदर्शित करते हैं।
सामान्य रूप से यह कहा जा सकता है कि
-
रेजोनेंस अणु को स्थायी बनाता है क्योंकि रेजोनेंस मिश्रण की ऊर्जा कोई भी एक अनुमानित संरचना की ऊर्जा से कम होती है; और,
-
रेजोनेंस बंधन विशेषताओं को समग्र रूप से औसत बनाता है।
इस प्रकार $\mathrm{O}_{3}$ के रेज़ोनेंस हाइब्रिड की ऊर्जा दोनों कैनोनिकल रूपों I और II में से किसी एक की ऊर्जा से कम होती है (चित्र 4.3)।
रेज़ोनेंस के साथ कई गलत धारणाएं जुड़ी हुई हैं और इन्हें दूर करने की आवश्यकता है। आपको याद रखना चाहिए कि:
-
कैनोनिकल रूप वास्तव में मौजूद नहीं होते।
-
अणु एक कैनोनिकल रूप में कुछ समय के लिए नहीं मौजूद होता और अन्य समय अन्य कैनोनिकल रूप में नहीं मौजूद होता।
-
कैनोनिकल रूपों के बीच ऐसा साम्य नहीं होता जैसा कि टैउटोमरिज़म में केटो और एनॉल रूपों के बीच होता है।
-
अणु के रूप में इसका एक अकेला संरचना होती है जो कैनोनिकल रूपों के रेजोनेंस मिश्रण होता है और जिसे एक अकेले लेविस संरचना द्वारा नहीं दर्शाया जा सकता है।
4.3.6 बंधन की ध्रुवता
एक सौ प्रतिशत आयनिक या सहसंयोजक बंध के अस्तित्व का प्रतिनिधित्व एक आदर्श स्थिति है। वास्तविकता में कोई भी बंध या यौगिक पूरी तरह से सहसंयोजक या आयनिक नहीं होता। दो हाइड्रोजन परमाणुओं के बीच सहसंयोजक बंध के मामले में भी कुछ आयनिक गुण होते हैं।
जब दो समान परमाणुओं के बीच सहसंयोजक बंध बनता है, उदाहरण के लिए $\mathrm{H}_2, \mathrm{O}_2$, $\mathrm{Cl}_2, \mathrm{~N}_2$ या $\mathrm{F}_2$ में, साझा इलेक्ट्रॉन युग्म दोनों परमाणुओं द्वारा समान आकर्षित होता है। इसके परिणामस्वरूप
इलेक्ट्रॉन युग्म दो समान नाभिकों के बीच सटीक रूप से स्थित होता है। ऐसे बने बंधन को अपोलर सहसंयोजक बंधन कहते हैं। इसके विपरीत, एक विषम नाभिक अणु जैसे $\mathrm{HF}$ के मामले में, दो परमाणुओं के बीच साझा इलेक्ट्रॉन युग्म फ्लूओरीन की ओर अधिक विस्थापित हो जाता है क्योंकि फ्लूओरीन के विद्युत ऋणात्मकता (यूनिट 3) हाइड्रोजन के विद्युत ऋणात्मकता से काफी अधिक होती है। ऐसे बने सहसंयोजक बंधन को ध्रुवीय सहसंयोजक बंधन कहते हैं।
परिणामस्वरूप ध्रुवीकरण के कारण, अणु एक विद्युत द्विध्रुव आघूर्ण (नीचे दर्शाया गया है) के साथ अपनी विशिष्टता प्रदर्शित करता है जिसे धनात्मक और ऋणात्मक आवेश के केंद्रों के बीच दूरी और आवेश के परिमाण के गुणनफल के रूप में परिभाषित किया जाता है। यह आमतौर पर ग्रीक वर्ण ’ $\mu$ ’ द्वारा निर्दिष्ट किया जाता है। गणितीय रूप से इसे निम्नलिखित तरीके से व्यक्त किया जाता है :
द्विध्रुव आघूर्ण $(\mu)=$ आवेश $(Q) \times$ अलगाव की दूरी ( $\mathrm{r}$ )
द्विध्रुव आघूर्ण आमतौर पर डेबी इकाइयों (D) में व्यक्त किया जाता है। परिवर्तन गुणांक है
$$ 1 \mathrm{D}=3.33564 \times 10^{-30} \mathrm{C} \mathrm{m} $$
जहाँ $\mathrm{C}$ कूलॉम है और $\mathrm{m}$ मीटर है।
अतिरिक्त द्विध्रुव आघूर्ण एक सदिश राशि है और परंपरागत रूप से इसे एक छोटी तीर द्वारा दर्शाया जाता है जिसका ध्रुव ऋणात्मक केंद्र पर होता है और शीर्ष धनात्मक केंद्र की ओर बिंदु बनाता है। लेकिन रसायन विज्ञान में द्विध्रुव आघूर्ण की उपस्थिति को अणु के लेविस संरचना पर एक प्रतीक तीर $(\rightarrow)$ द्वारा दर्शाया जाता है। प्रतीक धनात्मक सिरे पर होता है और तीर का शीर्ष ऋणात्मक सिरे पर होता है। उदाहरण के लिए HF के द्विध्रुव आघूर्ण को इस प्रकार दर्शाया जा सकता है :
$$ \stackrel{+}{\mathrm{H} \longrightarrow} \underset{\because}{*}: $$
इस तीर का चिन्ह अणु में इलेक्ट्रॉन घनत्व के स्थानांतरण की दिशा को दर्शाता है। ध्यान दें कि प्रतिच्छेद तीर की दिशा सामान्य द्विध्रुव आघूर्ण सदिश की दिशा के विपरीत होती है।
पीटर डीबाइ, डच रसायन विज्ञानी 1936 में एक्स-रे विवर्तन और द्विध्रुव आघूर्ण के अपने कार्य के लिए नोबेल पुरस्कार जीते। द्विध्रुव आघूर्ण के मापदंड को डीबाइ इकाइयों में दिया जाता है ताकि उनकी सम्मान दें।

पॉलीअणुक अणुओं के मामले में, द्विध्रुव आघूर्ण न केवल बंधन द्विध्रुव आघूर्ण (bond dipoles) के व्यक्तिगत द्विध्रुव आघूर्ण पर निर्भर करता है, बल्कि अणु में विभिन्न बंधनों के अंतर्वेशी व्यवस्था पर भी निर्भर करता है। ऐसे मामले में, अणु के द्विध्रुव आघूर्ण विभिन्न बंधनों के द्विध्रुव आघूर्ण के सदिश योग होता है। उदाहरण के लिए, $\mathrm{H}_{2} \mathrm{O}$ अणु, जो एक झुका हुआ संरचना रखता है, में दो $\mathrm{O}-\mathrm{H}$ बंधन एक दूसरे से $104.5^{\circ}$ के कोण पर व्यवस्थित होते हैं। $6.17 \times 10^{-30} \mathrm{C} \mathrm{m} \mathrm{(1D} \mathrm{=} 3.33564$ $\times 10^{-30} \mathrm{C} \mathrm{m}$ ) का नेट द्विध्रुव आघूर्ण दो $\mathrm{O}-\mathrm{H}$ बंधनों के द्विध्रुव आघूर्ण के परिणाम होता है।
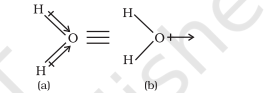
संयोजक आघूर्ण, $\mu=1.85 \mathrm{D}$
$=1.85 \times 3.33564 \times 10^{-30} \mathrm{C} \mathrm{m}=6.17 \times 10^{-30} \mathrm{C} \mathrm{m}$
$\mathrm{BeF}_{2}$ के मामले में आघूर्ण शून्य होता है। इसका कारण यह है कि दो समान बंध आघूर्ण विपरीत दिशाओं में बिंदु रहते हैं और एक दूसरे के प्रभाव को रद्द कर देते हैं।

तेट्रा-परमाणुक अणु में, उदाहरण के लिए $\mathrm{BF}_{3}$ में, विद्युत द्विध्रुव आघूर्ण शून्य होता है भले ही $\mathrm{B}-\mathrm{F}$ बंधन $120^{\circ}$ के कोण पर एक दूसरे से झुके हों, तीन बंधन आघूर्णों के योग शून्य होता है क्योंकि किसी भी दो के परिणामी आघूर्ण तीसरे के बराबर और विपरीत होते हैं।
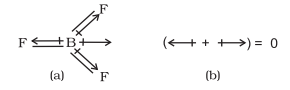
$\mathrm{BF}_3$ अणु; (a) आबन्ध विद्युत द्विध्रुवता और (b) कुल विद्युत द्विध्रुवता का प्रतिनिधित्व
हम एक रोचक मामले का अध्ययन करेंगे $\mathrm{NH}_3$ और $\mathrm{NF}_3$ अणु। दोनों अणुओं में नाइट्रोजन परमाणु पर एक अकेला इलेक्ट्रॉन युग्म होने के कारण पिरामिडीय आकृति होती है। यद्यपि फ्लूओरीन नाइट्रोजन की तुलना में अधिक विद्युत ऋणात्मक होता है, $\mathrm{NH}_3$ के कुल विद्युत द्विध्रुवता $\mathrm{NH}_3\left(4.90 \times 10^{-30} \mathrm{C} \mathrm{m}\right)$ अधिक होती है जबकि $\mathrm{NF}_3$ के कुल विद्युत द्विध्रुवता $\mathrm{NF}_3\left(0.8 \times 10^{-30} \mathrm{C} \mathrm{m}\right)$ होती है। इसका कारण यह है कि $\mathrm{NH}_3$ के मामले में अकेले इलेक्ट्रॉन युग्म के कारण आबन्ध विद्युत द्विध्रुवता नाइट्रोजन-हाइड्रोजन आबन्धों के कुल विद्युत द्विध्रुवता की दिशा में होती है, जबकि $\mathrm{NF}_3$ के मामले में अकेले इलेक्ट्रॉन युग्म के कारण आबन्ध विद्युत द्विध्रुवता तीन नाइट्रोजन-फ्लूओरीन आबन्धों के कुल विद्युत द्विध्रुवता की विपरीत दिशा में होती है। अकेले इलेक्ट्रॉन युग्म के कारण आबन्ध विद्युत द्विध्रुवता नाइट्रोजन-फ्लूओरीन आबन्धों के कुल विद्युत द्विध्रुवता के प्रभाव को कम करती है, जिसके कारण $\mathrm{NF}_3$ के कम विद्युत द्विध्रुवता होती है, जैसा कि नीचे दर्शाया गया है :

कुछ अणुओं के द्विध्रुव आघूर्ण तालिका 4.5 में दिखाए गए हैं।
जैसे ही सभी सहसंयोजक बंधन में कुछ आंशिक आयनिक गुण होता है, आयनिक बंधन में भी कुछ आंशिक सहसंयोजक गुण होता है। आयनिक बंधन के आंशिक सहसंयोजक गुण के बारे में फ़ेज़ैन ने निम्नलिखित नियमों के आधार पर चर्चा की है:
-
यदि धनायन का आकार छोटा हो और ऋणायन का आकार बड़ा हो, तो आयनिक बंधन में सहसंयोजक गुण अधिक होता है।
-
संकेंद्री आयन पर आवेश अधिक होने पर, आयनिक बंध के सहसंयोजक गुण अधिक होते हैं।
-
समान आकार और आवेश वाले आयनों में, उस आयन के प्रभावशाली होने की संभावना अधिक होती है, जिसकी इलेक्ट्रॉनिक विन्यास $(n-1) d^{n} n s^{\circ}$ होती है, जो संक्रमण धातुओं की विशिष्ट विन्यास होती है, जबकि उस आयन के प्रभावशाली होने की संभावना कम होती है, जिसकी इलेक्ट्रॉनिक विन्यास $n s^{2} n p^{6}$ होती है, जो क्षार एवं क्षारीय भूमि धातुओं के आयनों की विशिष्ट विन्यास होती है।
आयन द्वारा ऋणायन के आवेश के आकर्षण के कारण आवेश आयन के तरफ खिंच जाता है और इस प्रकार दोनों के बीच इलेक्ट्रॉनिक आवेश बढ़ जाता है। यह ठीक तौर पर सहसंयोजक बंध में होता है, अर्थात नाभिकों के बीच इलेक्ट्रॉन आवेश घनत्व के निर्माण। आयन के ध्रुवीय शक्ति, ऋणायन के ध्रुवीय अनुगामिता और ऋणायन के विकृति (ध्रुवीयता) के मात्रा आयनिक बंध के प्रतिशत सहसंयोजक गुण के निर्धारण करते हैं।
4.4 मूल्य बाह्य बर्तन इलेक्ट्रॉन युग्म प्रतिकर्षण (VSEPR) सिद्धांत
जैसा कि पहले समझाया गया है, लुईस के सिद्धांत को अणुओं के आकार की व्याख्या नहीं कर सकता। इस सिद्धांत ने एक सरल प्रक्रिया प्रदान की है जिसके माध्यम से सहसंयोजक अणुओं के आकार की भविष्यवाणी की जा सकती है। सिडगविच और पॉवेल ने 1940 में परमाणु के मूल्य बाह्य बर्तन में इलेक्ट्रॉन युग्मों के प्रतिकर्षण के आधार पर एक सरल सिद्धांत प्रस्तावित किया। इसे बाद में नैहोल्म और गिल्सपी (1957) द्वारा और विकसित और परिभाषित किया गया।
तालिका 4.5 चयनित अणुओं के द्विध्रुव आघूर्ण
| अणु के प्रकार | उदाहरण | विद्युत द्विध्रुव आघूर्ण, $\boldsymbol{\mu}(\mathbf{D})$ | ज्यामिति |
|---|---|---|---|
| अणु $(\mathbf{A B})$ | $\mathrm{HF}$ | 1.78 | सीधी |
| $\mathrm{HCl}$ | 1.07 | सीधी | |
| $\mathrm{HBr}$ | 0.79 | सीधी | |
| $\mathrm{Hl}$ | 0.38 | सीधी | |
| $\mathrm{H}_{2}$ | 0 | सीधी | |
| अणु $\left(\mathbf{A B}_{\mathbf{2}}\right)$ | $\mathrm{H}_{2} \mathrm{O}$ | 1.85 | वक्र |
| $\mathrm{H}_{2} \mathrm{~S}$ | 0.95 | वक्र | |
| $\mathrm{CO}_{2}$ | 0 | सीधी |
| मोलेक्यूल $\left(\mathbf{A B}{3}\right)$ | $\mathrm{NH}{3}$ | 1.47 | त्रिकोणी पिरामिड | | | $\mathrm{NF}{3}$ | 0.23 | त्रिकोणी पिरामिड | | | $\mathrm{BF}{3}$ | 0 | त्रिकोणी समतलीय | | मोलेक्यूल $\left(\mathbf{A B}{\mathbf{4}}\right)$ | $\mathrm{CH}{4}$ | 0 | चतुष्कोणी | | | $\mathrm{CHCl}{3}$ | 1.04 | चतुष्कोणी | | | $\mathrm{CCl}{4}$ | 0 | चतुष्कोणी |
VSEPR सिद्धांत के मुख्य प्रतिपादन निम्नलिखित हैं:
-
एक मोलेक्यूल के आकार केंद्रीय परमाणु के आवेश बाह्य बर्तन में विद्यमान इलेक्ट्रॉन युग्मों (बंधन या अबंधन) की संख्या पर निर्भर करता है।
-
मूलक कोश में इलेक्ट्रॉन युग्म एक दूसरे को प्रतिकर्षित करते हैं क्योंकि उनके इलेक्ट्रॉन बादल नकारात्मक चार्जित होते हैं।
-
इन इलेक्ट्रॉन युग्मों के बीच एक ऐसा स्थान अपनाने की प्रवृत्ति होती है जहां प्रतिकर्षण कम हो और उनके बीच की दूरी अधिकतम हो।
-
मूलक कोश को एक गोला माना जाता है जहां इलेक्ट्रॉन युग्म एक दूसरे से अधिकतम दूरी पर गोलीय सतह पर स्थित होते हैं।
-
एक बहुलक बंध को एक इलेक्ट्रॉन युग्म के रूप में ले जाया जाता है और बहुलक बंध के दो या तीन इलेक्ट्रॉन युग्म एक अतिरिक्त युग्म के रूप में ले जाया जाता है।
-
जब एक अणु को दो या अधिक अयुग्मित संरचनाओं द्वारा प्रस्तुत किया जा सके, तो VSEPR मॉडल कोई भी ऐसी संरचना के लिए लागू हो सकता है।
इलेक्ट्रॉन युग्मों के प्रतिकर्षण का क्रम इस प्रकार होता है:
अयुग्मित युग्म (lp) - अयुग्मित युग्म (lp) > अयुग्मित युग्म (lp) - बंधन युग्म (bp) > बंधन युग्म (bp) - बंधन युग्म (bp)
Nyholm और Gillespie (1957) ने VSEPR मॉडल को अयुग्मित इलेक्ट्रॉन युग्मों और बंधन युग्मों के महत्वपूर्ण अंतर की व्याख्या करके सुधार किया। जबकि अयुग्मित युग्म अंतर्मुखी परमाणु पर स्थित होते हैं, प्रत्येक बंधन युग्म दो परमाणुओं के बीच साझा किया जाता है। इस परिणामस्वरूप, अणु में अयुग्मित इलेक्ट्रॉन युग्म बंधन युग्मों की तुलना में अधिक अंतराल घेरते हैं। इसके परिणामस्वरूप, अयुग्मित इलेक्ट्रॉन युग्मों के बीच प्रतिकर्षण अयुग्मित-बंधन युग्म और बंधन-बंधन युग्मों के बीच प्रतिकर्षण की तुलना में अधिक होता है। इन प्रतिकर्षण प्रभावों के कारण अणुओं में आदर्श आकृतियों से विचलन और बंधन कोणों में परिवर्तन होता है।
मोलेक्यूल के ज्यामितीय आकार की भविष्यवाणी करने के लिए VSEPR सिद्धांत की सहायता से, आसानी से अणुओं को दो श्रेणियों में विभाजित किया जा सकता है जैसे (i) वे अणु जिनमें केंद्रीय परमाणु में कोई अकेला युग्म नहीं होता है और (ii) वे अणु जिनमें केंद्रीय परमाणु में एक या अधिक अकेले युग्म होते हैं।
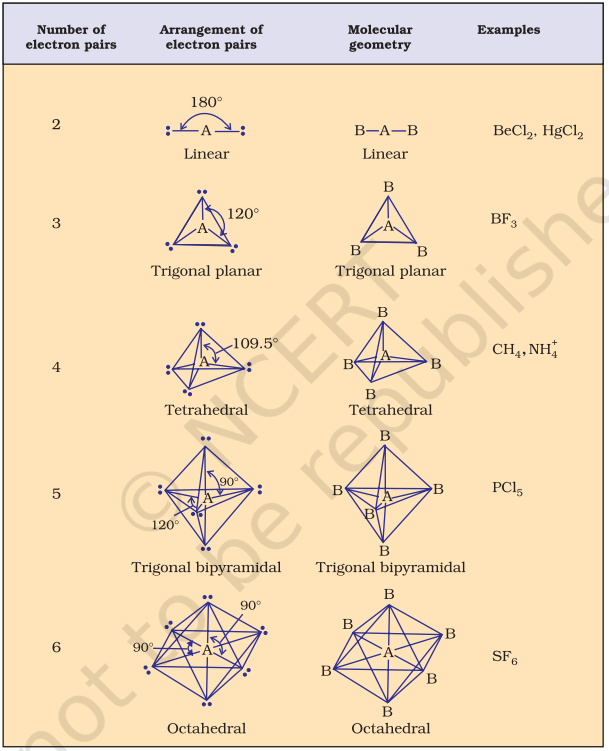
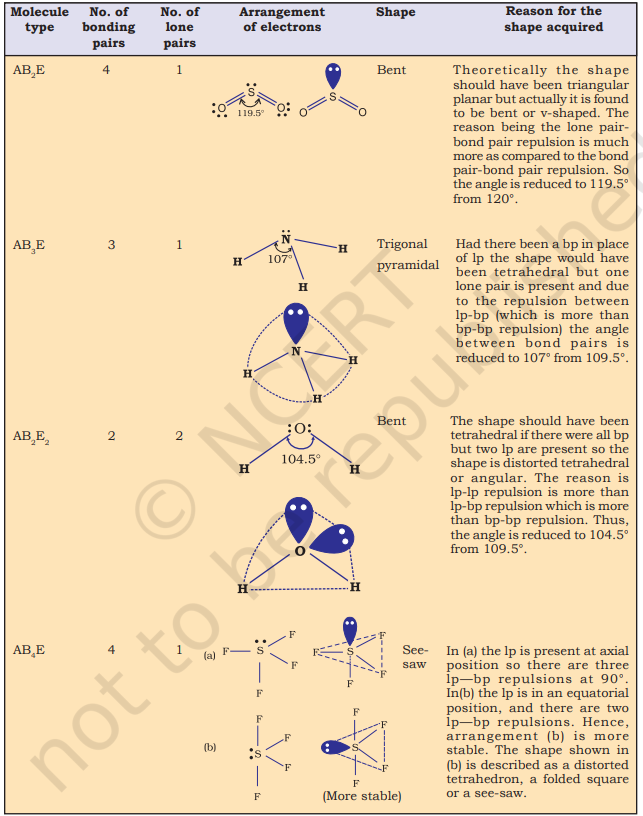
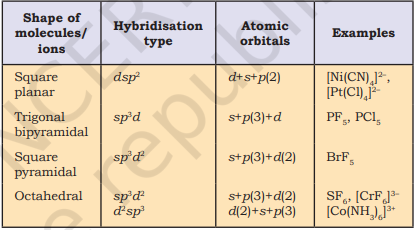
तालिका 4.6 (पृष्ठ 114) केंद्रीय परमाणु A (कोई अकेला युग्म नहीं होने वाले) के आसपास इलेक्ट्रॉन युग्मों की व्यवस्था और AB प्रकार के कुछ अणुओं/आयनों के ज्यामितियों को दर्शाती है। तालिका 4.7 (पृष्ठ 115) वे आकृतियाँ दर्शाती है जो कुछ सरल अणुओं और आयनों के लिए हैं जिनमें केंद्रीय परमाणु में एक या अधिक अकेले युग्म होते हैं। तालिका 4.8 (पृष्ठ 116) अणु के ज्यामितीय विकृतियों के कारणों को समझाती है।
जैसा कि तालिका 4.6 में दिखाया गया है, $\mathrm{AB}_2, \mathrm{AB}_3, \mathrm{AB}_4, \mathrm{AB}_5$ और $\mathrm{AB}_6$ के यौगिकों में, केंद्रीय परमाणु A के आसपास इलेक्ट्रॉन युग्मों और $\mathrm{B}$ परमाणुओं की व्यवस्था क्रमशः सीधी रेखा, त्रिकोणीय समतलीय, चतुष्कोणीय, त्रिकोणीय-बिपिरामिडल और अष्टफलकीय होती है। ऐसी व्यवस्था $\mathrm{BF}_3\left(\mathrm{AB}_3\right), \mathrm{CH}_4\left(\mathrm{AB}_4\right)$ और $\mathrm{PCl}_5\left(\mathrm{AB}_5\right)$ जैसे अणुओं में देखी जा सकती है, जैसा कि नीचे उनके बॉल एंड स्टिक मॉडल द्वारा दिखाया गया है।
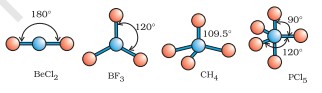
चित्र 4.8 केंद्रीय परमाणु में कोई अकेला युग्म नहीं वाले अणुओं के आकार
VSEPR सिद्धांत बहुत से अणुओं के आकार का अनुमान लगाने में सक्षम है, विशेषकर $p$-ब्लॉक तत्वों के यौगिकों के लिए सटीक रूप से। यह अत्यधिक सफल रूप से अणु के आकार का निर्धारण भी कर सकता है, भले ही संभावित संरचनाओं के बीच ऊर्जा के अंतर बहुत कम हो। VSEPR सिद्धांत के सिद्धांतीय आधार के बारे में इलेक्ट्रॉन युग्मों के प्रतिकर्षण के प्रभाव अणु के आकार पर कैसे प्रभाव डालते हैं, इसके बारे में स्पष्ट नहीं है और यह अभी भी संदेह और चर्चा के विषय है।
तालिका 4.6 केंद्रीय परमाणु में कोई अकेला इलेक्ट्रॉन युग्म नहीं रखने वाले अणुओं के ज्यामिति
तालिका 4.7 केंद्रीय आयन में एक या अधिक अकेले इलेक्ट्रॉन युग्म (E) रखने वाले कुछ सरल अणुओं/आयनों के आकार (ज्यामिति)

तालिका 4.8 आबंध युग्म और अकेले युग्म वाले अणुओं के आकार

4.5 VALENCE BOND THEORY
हम जानते हैं कि Lewis अनुपात में अणुओं के संरचना लिखने में सहायता करता है, लेकिन रासायनिक बंधन के निर्माण की व्याख्या करने में विफल रहता है। यह अणुओं में बंधन विखंडन एंथैल्पी और बंधन लंबाई में अंतर के कारण भी बताने में विफल रहता है, जैसे कि $\mathrm{H}_2(435.8 \mathrm{~kJ}$ $\left.\mathrm{mol}^{-1}, 74 \mathrm{pm}\right)$ और $\mathrm{F}_2\left(155 \mathrm{~kJ} \mathrm{~mol}^{-1}, 144 \mathrm{pm}\right)$, जहां दोनों में क्रमशः एक इलेक्ट्रॉन युग्म के साझा करके एक सहसंयोजक बंध बनता है। यह बहुपरमाणुक अणुओं के आकार के बारे में कोई धारणा नहीं देता।
अत: VSEPR सिद्धांत सरल अणुओं के आकार को बताता है, लेकिन सिद्धांतिक रूप से इन्हें समझाता नहीं है और इसके अनुप्रयोग भी सीमित हैं। इन सीमाओं को दूर करने के लिए दो महत्वपूर्ण सिद्धांतों को तैयार किया गया है जो क्वांटम यांत्रिक सिद्धांत पर आधारित हैं। ये सिद्धांत हैं- संयोजक बंध सिद्धांत (VB सिद्धांत) और अणु ऑर्बिटल सिद्धांत (MO सिद्धांत)।
संयोजक बंध सिद्धांत को हाइटलर और लंदन (1927) द्वारा प्रस्तुत किया गया था और पॉलिंग और अन्य द्वारा आगे विकसित किया गया था। संयोजक बंध सिद्धांत के बारे में चर्चा अणुओं के आणुविक ऑर्बिटल, तत्वों की इलेक्ट्रॉनिक विन्यास (यूनिट 2), ऑर्बिटल के ओवरलैप की क्रिटिरिया, ऑर्बिटल के हाइब्रिडाइजेशन और वैरिएशन और सुपरपोजिशन के सिद्धांत पर आधारित होती है। इन दृष्टिकोणों के आधार पर VB सिद्धांत के गहरे अध्ययन के बारे में इस किताब के दायरे से बाहर है। अतः सुविधा के लिए, संयोजक बंध सिद्धांत के बारे में केवल गुणात्मक और गणितीय रूप से असंगत चर्चा की गई है। शुरू करते हुए, हम अमोनिया अणु के निर्माण के बारे में विचार करेंगे जो सभी अणुओं में सबसे सरल अणु है।
दो हाइड्रोजन परमाणु A और B एक दूसरे की ओर आ रहे हैं, जिनके नाभिक $\mathrm{N}_{\mathrm{A}}$ और $N_B$ हैं और उनमें उपस्थित इलेक्ट्रॉन $e_A$ और $e_B$ द्वारा प्रतिनिधित्व किए गए हैं। जब दोनों परमाणु एक दूसरे से बहुत दूर होते हैं, तो उनके बीच कोई अंतरक्रिया नहीं होती। जब ये दोनों परमाणु एक दूसरे की ओर आते हैं, तो नए आकर्षण और प्रतिकर्षण बल शुरू हो जाते हैं।
आकर्षण बल निम्नलिखित के बीच उत्पन्न होते हैं:
(i) एक परमाणु के नाभिक और अपने इलेक्ट्रॉन के बीच अर्थात $N_{A}-e_{A}$ और $N_{B}-e_{B}$।
(ii) एक परमाणु के नाभिक और दूसरे परमाणु के इलेक्ट्रॉन के बीच अर्थात $N_{A}-e_{B}, N_{B}-e_{A}$।
उतने ही प्रतिकर्षण बल दो अणुओं के बीच उत्पन्न होते हैं
(i) दो अणुओं के इलेक्ट्रॉनों के बीच जैसे $e_{A}-e_{B}$,
(ii) दो अणुओं के नाभिकों के बीच $N_{A}-N_{B}$।
आकर्षण बल दो अणुओं को एक दूसरे के पास लाने की कोशिश करते हैं जबकि प्रतिकर्षण बल उन्हें एक दूसरे से दूर धकेलने की कोशिश करते हैं (चित्र 4.7)।

चित्र 4.7 H2 अणु के निर्माण के दौरान आकर्षण और प्रतिकर्षण बल
अनुभव के आधार पर पाया गया है कि नए आकर्षण बल के मापदंड के मान नए विपरीत बल के मापदंड से अधिक होते हैं। इसके परिणामस्वरूप, दो परमाणु एक दूसरे की ओर आते हैं और संभावित ऊर्जा कम हो जाती है। अंततः एक चरण पहुंच जाता है जहां आकर्षण बल के नेट बल विपरीत बल के बराबर हो जाते हैं और तंत्र के न्यूनतम ऊर्जा के साथ एक निर्माण अवस्था प्राप्त हो जाती है। इस अवस्था में दो हाइड्रोजन परमाणु एक दूसरे के साथ बंधे होने कहे जाते हैं और एक स्थायी अणु के रूप में बन जाते हैं जिसकी बंधन लंबाई $74 \mathrm{pm}$ होती है।
जब दो हाइड्रोजन परमाणुओं के बीच बंधन बनता है तो ऊर्जा विमुक्त होती है, इसलिए हाइड्रोजन अणु अकल्पित हाइड्रोजन परमाणुओं की तुलना में अधिक स्थायी होता है। इस ऊर्जा को बंधन एंथैल्पी कहते हैं, जो चित्र 4.8 में दर्शाए गए वक्र में न्यूनतम के संगत होती है। विपरीत रूप से, एक मोल के $\mathrm{H}_{2}$ अणु को वियोजित करने के लिए $435.8 \mathrm{~kJ}$ ऊर्जा की आवश्यकता होती है।
$\mathrm{H}_{2}(\mathrm{~g})+435.8 \mathrm{~kJ} \mathrm{~mol}^{-1} \rightarrow \mathrm{H}(\mathrm{g})+\mathrm{H}(\mathrm{g})$

चित्र 4.8 H अणु के निर्माण के लिए संभावना ऊर्जा वक्र, H परमाणुओं के बीच अंतराणुक दूरी के फलन के रूप में। वक्र में न्यूनतम बिंदु $H_2$ के सबसे स्थायी अवस्था के संगत है।
4.5.1 ऑर्बिटल ओवरलैप कонसेप्ट
हाइड्रोजन अणु के निर्माण में, जब दो हाइड्रोजन परमाणु इतने करीब होते हैं कि उनके परमाणु ऑर्बिटल आंशिक रूप से प्रवेश कर लेते हैं, तब न्यूनतम ऊर्जा अवस्था होती है। इस आंशिक मिलान के कारण परमाणु ऑर्बिटल के ओवरलैप कहलाता है जो इलेक्ट्रॉन के युग्मन के परिणामस्वरूप होता है। ओवरलैप के मात्रा बंधन की शक्ति के निर्धारक होती है। सामान्यतः, ओवरलैप के अधिक होने पर दो परमाणुओं के बीच बने बंधन की शक्ति अधिक होती है। इसलिए, ऑर्बिटल ओवरलैप के कन्सेप्ट के अनुसार, दो परमाणुओं के बीच एक सहसंयोजक बंधन के निर्माण के लिए उनके बाह्य आवरण में उपस्थित इलेक्ट्रॉनों के विपरीत चार्ज वाले युग्मन के कारण होता है।
4.5.2 बंधों के दिशात्मक गुण
हम पहले से ही देख चुके हैं कि सहसंयोजक बंध परमाणु कक्षकों के ओवरलैप के कारण बनता है। हाइड्रोजन अणु के निर्माण के लिए दो $\mathrm{H}$ परमाणुओं के $1 s$-कक्षकों के ओवरलैप के कारण होता है।
पॉलीएटमिक अणुओं के मामले में, जैसे $\mathrm{CH}_4$, $\mathrm{NH}_3$ और $\mathrm{H}_2 \mathrm{O}$, अणु के आकार के साथ-साथ बंधन के निर्माण के लिए अणु के ज्यामिति का भी महत्व होता है। उदाहरण के लिए, $\mathrm{CH}_4$ अणु के टेट्राहेड्रल आकार के कारण $\mathrm{HCH}$ बंध कोण $109.5^{\circ}$ क्यों होते हैं? $\mathrm{NH}_3$ अणु के आकार क्यों पिरामिडल होता है?
मूल बंधन सिद्धांत बहुपरमाणुक अणुओं जैसे $\mathrm{CH}_4$, $\mathrm{NH}_3$ और $\mathrm{H}_2 \mathrm{O}$ आदि के आकार, बनावट और दिशात्मक गुणों को परमाणु कक्षकों के ओवरलैप और हाइब्रिडाइजेशन के आधार पर समझाता है।
4.5.3 परमाणु कक्षकों का ओवरलैप
जब दो परमाणुओं के कक्षक बंधन बनाने के लिए निकट आ जाते हैं, तो उनके ओवरलैप धनात्मक, ऋणात्मक या शून्य हो सकते हैं, जो आम तौर पर कक्षक तरंग फलन के चिह्न (पेज) और अंतरिक्ष में तरंग फलन के आम्प्लीट्यूड के दिशा एवं चिह्न पर निर्भर करता है (चित्र 4.9)। चित्र 4 बर्डर सतह आरेख में धनात्मक और ऋणात्मक चिह्न तरंग फलन के चिह्न (पेज) को दर्शाते हैं और आवेश से संबंधित नहीं हैं। बंधन बनाने वाले कक्षकों के समान चिह्न (पेज) और अंतरिक्ष में दिशा होनी चाहिए। इसे धनात्मक ओवरलैप कहते हैं। विभिन्न $s$ और $p$ कक्षकों के ओवरलैप चित्र 4.9 में दिखाए गए हैं।
क्रमवृद्धि के मानक, जो सहसंयोजक बंधन के निर्माण के लिए मुख्य कारक है, हमोन्यूक्लियर/हेटरोन्यूक्लियर डाइएट्रिक अणु और पॉलीएट्रिक अणु में एक समान रूप से लागू होता है। हम जानते हैं कि $\mathrm{CH}_4, \mathrm{NH}_3$, और $\mathrm{H}_2 \mathrm{O}$ अणुओं के आकार क्रमशः चतुष्फलकीय, पिरामिडीय और वक्र होते हैं। इसलिए इन ज्यामितीय आकृतियों को ऑर्बिटल ओवरलैप के आधार पर समझा जा सकता है, इसकी जांच करना दिलचस्प होगा।
हम पहले $CH_4$ (मेथेन) अणु के बारे में सोचें। कार्बन के आधुनिक अवस्था में इलेक्ट्रॉनिक विन्यास $[\mathrm{He}] 2 s^2 2 p^2$ होता है, जो उत्तेजित अवस्था में $[\mathrm{He}] 2 s^1 2 p_{\mathrm{x}}^1$ $2 p_{\mathrm{y}}^1$ $2 p_z^1$ बन जाता है। कार्बन और हाइड्रोजन के ऑर्बिटल के बीच ओवरलैप के कारण उत्पन्न ऊर्जा के अपसामग्री के लिए इस उत्तेजन के लिए आवश्यक ऊर्जा को संतुलित कर दिया जाता है।
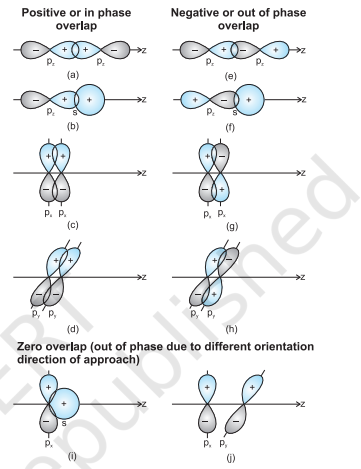
चित्र 4.9 s और p परमाणु कक्षकों के धनात्मक, ऋणात्मक और शून्य अधिरोपण
कार्बन के चार परमाणु कक्षक, प्रत्येक में एक अकुल इलेक्ट्रॉन हो सकते हैं, जो चार H परमाणुओं के $1 \mathrm{~s}$ कक्षकों के साथ अधिरोपित हो सकते हैं, जो भी एकल रूप से उपयोग किए गए होते हैं। इसके परिणामस्वरूप चार $\mathrm{C}-\mathrm{H}$ बंधन बनेंगे। हालांकि, यह देखा जा सकता है कि जबकि कार्बन के तीन p कक्षक एक दूसरे से $90^{\circ}$ के कोण पर होते हैं, तो इन बंधनों के लिए $\mathrm{HCH}$ कोण भी $90^{\circ}$ होगा। अर्थात तीन $\mathrm{C}-\mathrm{H}$ बंधन एक दूसरे से $90^{\circ}$ के कोण पर दिशा लेंगे। कार्बन के $2 \mathrm{~s}$ कक्षक और H के $1 \mathrm{~s}$ कक्षक गोलीय सममिति रखते हैं और वे किसी भी दिशा में अधिरोपित हो सकते हैं। इसलिए चौथे $\mathrm{C}-\mathrm{H}$ बंध की दिशा निर्धारित नहीं की जा सकती। यह वर्णन चतुर्फलक $\mathrm{HCH}$ कोणों के $109.5^{\circ}$ के साथ मेल नहीं खाता। स्पष्ट रूप से, यह बताता है कि सरल परमाणु कक्षक अधिरोपण बंधनों की दिशात्मक विशेषताओं के लिए उत्तरदायी नहीं है। समान प्रक्रिया और तर्क के उपयोग द्वारा देखा जा सकता है कि $\mathrm{NH}_3$ और $\mathrm{H}_2 \mathrm{O}$ अणुओं के मामले में $\mathrm{HNH}$ और $\mathrm{HOH}$ कोण $90^{\circ}$ होने चाहिए। यह वास्तविक बंधन कोणों $107^{\circ}$ और $104.5^{\circ}$ के साथ असहमति है, जो क्रमशः $\mathrm{NH}_3$ और $\mathrm{H}_2 \mathrm{O}$ अणुओं में होते हैं।
4.5.4 परस्पर घुलमिलाव के प्रकार एवं सहसंयोजक बंध की प्रकृति
सहसंयोजक बंध को घुलमिलाव के प्रकार के आधार पर दो प्रकार में वर्गीकृत किया जा सकता है:
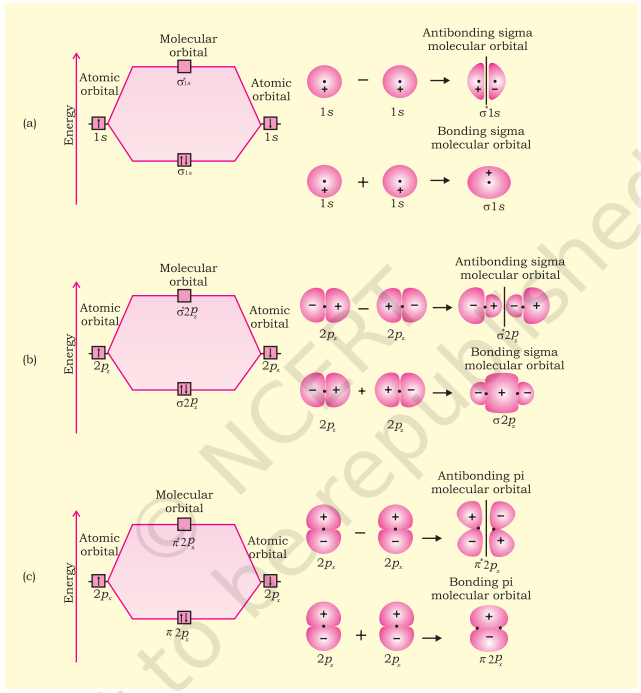
(i) सिग्मा (σ) बंध, और (ii) पाई (π) बंध
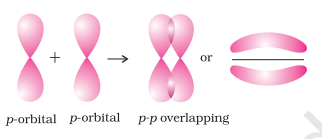
(i) सिग्मा (σ) बंध : यह सहसंयोजक बंध बंधन ऑर्बिटल के सिरे से सिरे (मुख्य रेखा पर) घुलमिलाव के द्वारा बनता है। इसे मुख्य रेखा पर घुलमिलाव या अक्षीय घुलमिलाव कहा जाता है। यह किसी भी निम्नलिखित प्रकार के परमाणु ऑर्बिटल के संयोजन द्वारा बनाया जा सकता है।
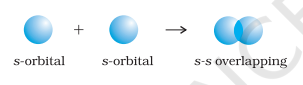
- s-s अधिचापन : इस स्थिति में, दो आंशिक भरे s-कक्षकों के अधिचापन के कारण अंतराणु अक्ष पर अधिचापन होता है, जैसा कि नीचे दिखाया गया है :
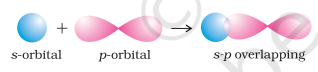
- s-p अधिचापन : इस प्रकार का अधिचापन एक परमाणु के आंशिक भरे $s$-कक्षक और दूसरे परमाणु के आंशिक भरे $p$-कक्षक के बीच होता है।
- $\boldsymbol{p}-\boldsymbol{p}$ अधिचालन : इस प्रकार का अधिचालन दो आगत अणुओं के आंशिक भरे हुए $p$-कक्षकों के बीच होता है।

(ii) पाई (π) बंध : पाई (π) बंध के निर्माण में परमाणु कक्षक एक दूसरे के अक्ष के समानांतर रहते हुए तथा अंतरानुमोलक अक्ष के लंबवत रूप से अधिचालन करते हैं। ओर्बिटल जो तरफ से अधिचालन के कारण बनते हैं, भाग लेने वाले परमाणुओं के तल के ऊपर और नीचे दो चालक आवेश वाले बर्तन के रूप में होते हैं।
4.5.5 सिग्मा और पाई बंध की शक्ति
मूल रूप से बंध की शक्ति अधिकतम ओवरलैप के विस्तार पर निर्भर करती है। सिग्मा बंध के मामले में, ऑर्बिटल के ओवरलैप का विस्तार अधिक होता है। इसलिए, इसकी तुलना में पाई बंध में ओवरलैप का विस्तार कम होता है, इसलिए सिग्मा बंध कमजोर होता है। इसके अतिरिक्त, यह ध्यान देने योग्य है कि अणु के दो परमाणुओं के बीच बहुल बंध बनाने के दौरान, सिग्मा बंध के अलावा पाई बंध (s) भी बनता है।
4.6 हाइब्रिडाइजेशन
पॉलिंग ने $\mathrm{CH}_4, \mathrm{NH}_3$ और $\mathrm{H}_2 \mathrm{O}$ आदि ऐसे बहुपरमाणुक अणुओं के विशिष्ट ज्यामितीय आकार की व्याख्या करने के लिए हाइब्रिडाइजेशन की अवधारणा प्रस्तुत की। उनके अनुसार, परमाणु कक्षक नए समान ऊर्जा वाले कक्षकों के सेट के रूप में संयोजित होते हैं जिन्हें हाइब्रिड कक्षक कहते हैं। शुद्ध कक्षक के विपरीत, हाइब्रिड कक्षक बंधन निर्माण में उपयोग किए जाते हैं। इस घटना को हाइब्रिडाइजेशन कहते हैं जिसे ऊर्जा के बहुत हल्के अंतर वाले कक्षकों के बीच अंतरमिश्रण की प्रक्रिया के रूप में परिभाषित किया जा सकता है, जिससे उनकी ऊर्जा वितरण के बारे में नए समान ऊर्जा वाले और आकार वाले कक्षकों के सेट के निर्माण होता है। उदाहरण के रूप में, जब कार्बन के एक $2 s$ और तीन $2 p$-कक्षक हाइब्रिडाइजेशन करते हैं, तो चार नए $s p^{3}$ हाइब्रिड कक्षक के निर्माण होता है।
हाइब्रिडाइजेशन के मुख्य विशेषताएं: हाइब्रिडाइजेशन के मुख्य विशेषताएं नीचे दी गई हैं:
1. हाइब्रिड ऑर्बिटल की संख्या उन एटॉमिक ऑर्बिटल के बराबर होती है जो हाइब्रिडाइजेशन के अंतर्गत मिश्रित होते हैं।
2. हाइब्रिड ऑर्बिटल हमेशा ऊर्जा और आकार में समान होते हैं।
3. हाइब्रिड ऑर्बिटल शुद्ध एटॉमिक ऑर्बिटल की तुलना में स्थायी बंधन बनाने में अधिक प्रभावी होते हैं।
4. ये हाइब्रिड ऑर्बिटल इलेक्ट्रॉन युग्मों के बीच न्यूनतम प्रतिकर्षण के लिए अंतरिक दिशाओं में दिशात्मक होते हैं और इसलिए एक स्थायी व्यवस्था होती है। इसलिए, हाइब्रिडाइजेशन के प्रकार अणुओं के आकार को बताते हैं।
हाइब्रिडाइज़ेशन के महत्वपूर्ण शर्त
(i) परमाणु के बाह्य कोश में मौजूद ऑर्बिटल हाइब्रिडाइज़ेशन के अंतर्गत शामिल होते हैं।
(ii) हाइब्रिडाइज़ेशन के लिए ले जाए जा रहे ऑर्बिटल में लगभग समान ऊर्जा होनी चाहिए।
(iii) हाइब्रिडाइज़ेशन के पहले इलेक्ट्रॉन के प्रोमोशन की आवश्यकता नहीं होती।
(iv) हाइब्रिडाइज़ेशन में केवल अर्ध-भरे ऑर्बिटल के भाग लेना आवश्यक नहीं होता। कुछ मामलों में, बाह्य कोश के भरे हुए ऑर्बिटल भी हाइब्रिडाइज़ेशन में शामिल हो सकते हैं।
4.6.1 हाइब्रिडाइज़ेशन के प्रकार
$ s, p $ और $ d $ ऑर्बिटल के बीच विभिन्न प्रकार की हाइब्रिडाइज़ेशन हो सकती है। हाइब्रिडाइज़ेशन के विभिन्न प्रकार नीचे दिए गए हैं:
(I) sp हाइब्रिडाइजेशन: इस प्रकार की हाइब्रिडाइजेशन में एक $s$ और एक $p$ ऑर्बिटल के मिश्रण से दो समान $sp$ हाइब्रिड ऑर्बिटल के निर्माण होता है। $sp$ हाइब्रिडाइजेशन के लिए उपयुक्त ऑर्बिटल $s$ और $p_{z}$ होते हैं, यदि हाइब्रिड ऑर्बिटल $z$-अक्ष के अनुदिश होने वाले हों। प्रत्येक $sp$ हाइब्रिड ऑर्बिटल में $50 %$ s-भाग और $5 बराबर $p$-भाग होता है। ऐसे अणु जिनमें केंद्रीय परमाणु $sp$-हाइब्रिडिज़ेशन होता है और दो अन्य केंद्रीय परमाणुओं से सीधे जुड़ा होता है, रैखिक ज्यामिति के अणु होते हैं। इस प्रकार की हाइब्रिडाइजेशन को विकर्ण हाइब्रिडाइजेशन के रूप में भी जाना जाता है।
दो $s p$ हाइब्रिड ऑर्बिटल $z$-अक्ष के विपरीत दिशा में बिंदु रूप में बराबर धनात्मक लोब और बहुत छोटे ऋणात्मक लोब के साथ होते हैं, जो अधिक प्रभावी ओवरलैप के निर्माण के लिए जिम्मेदार होते हैं, जिसके परिणामस्वरूप तीव्र बंधन के निर्माण होता है।
$s p$ हाइब्रिडीकरण वाले अणु का उदाहरण
$\mathbf{B e C l}_{2}$ : बे के आधार अवस्था में इलेक्ट्रॉनिक विन्यास $1 s^{2} 2 s^{2}$ होता है। उत्तेजित अवस्था में, एक $2 \mathrm{~s}$-इलेक्ट्रॉन खाली $2 p$ ऑर्बिटल में उत्तेजित हो जाता है ताकि इसकी द्विवैशिष्ट्यता के लिए खाता लिया जा सके। एक $2 s$ और एक $2 p$ ऑर्बिटल के हाइब्रिडीकरण से दो $s p$ हाइब्रिड ऑर्बिटल बनते हैं। ये दोनों $s p$ हाइब्रिड ऑर्बिटल विपरीत दिशा में व्यवस्थित होते हैं और $180^{\circ}$ के कोण बनाते हैं। प्रत्येक $s p$ हाइब्रिड ऑर्बिटल ब्रोमीन के $2 p$ ऑर्बिटल के अक्षीय ओवरलैप के माध्यम से दो Be$\mathrm{Cl}$ सिग्मा बंध बनाते हैं। यह चित्र 4.10 में दिखाया गया है।
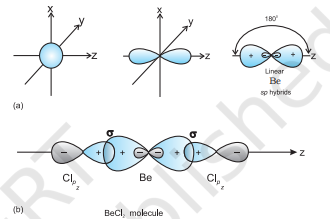
चित्र 4.10 (a) s और p कक्षक से sp हाइब्रिड कक्षक के निर्माण; (b) सीधी रेखा में $BeCl_2$ अणु के निर्माण
(II) $\boldsymbol{s p}^{2}$ हाइब्रिडीकरण : इस हाइब्रिडीकरण में एक $s$ और दो $p$ कक्षकों के भाग लेने के कारण तीन समान $s p^{2}$ हाइब्रिड कक्षक बनते हैं। उदाहरण के लिए, $\mathrm{BCl} _{3}$ अणु में केंद्रीय बोरॉन परमाणु की आधुनिक इलेक्ट्रॉनिक विन्यास $1 s^{2} 2 s^{2} 2 p^{1}$ होता है। उत्तेजित अवस्था में, एक $2 s$ इलेक्ट्रॉन खाली $2 p$ कक्षक में उत्तेजित हो जाता है जिसके कारण बोरॉन के तीन अकेले इलेक्ट्रॉन हो जाते हैं। इन तीन कक्षकों (एक $2 s$ और दो $2 p$) के हाइब्रिडीकरण से तीन $s p^{2}$ हाइब्रिड कक्षक बनते हैं। इन तीन हाइब्रिड कक्षकों के निर्माण त्रिकोणीय समतलीय व्यवस्था में होते हैं और इनके अतिरिक्त क्लोरीन के $2 p$ कक्षकों के साथ अधिकतम ओवरलैप करके तीन $\mathrm{B}-\mathrm{Cl}$ बंधन बनते हैं। अतः, $\mathrm{BCl} _{3}$ (चित्र 4.11) में त्रिकोणीय समतलीय ज्यामिति होती है जिसमें $\mathrm{ClBCl}$ बंधन कोण $120^{\circ}$ होता है।
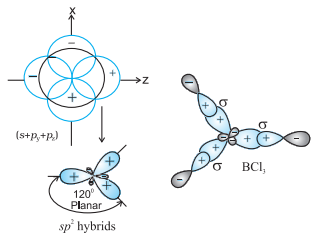
चित्र 4.11 $sp_2$ हाइब्रिडीकरण और $BCl_3$ अणु के निर्माण
(III) $\boldsymbol{s p}^{3}$ हाइब्रिडीकरण: इस प्रकार के हाइब्रिडीकरण को $\mathrm{CH}_{4}$ अणु के उदाहरण के माध्यम से समझा जा सकता है, जहाँ तल के एक s-कक्षक और तीन p-कक्षक के मिश्रण से चार समान ऊर्जा और आकृति वाले $sp^{3}$ हाइब्रिड ऑर्बिटल बनते हैं। प्रत्येक $sp^{3}$ हाइब्रिड ऑर्बिटल में 25% s-भाग और 75% p-भाग होता है। इस प्रकार बने चार $sp^{3}$ हाइब्रिड ऑर्बिटल चतुष्कोणीय ठोस के चारों कोनों की ओर दिशात्मक होते हैं। $sp^{3}$ हाइब्रिड ऑर्बिटल के बीच कोण $109.5^{\circ}$ होता है, जैसा कि चित्र 4.12 में दिखाया गया है।
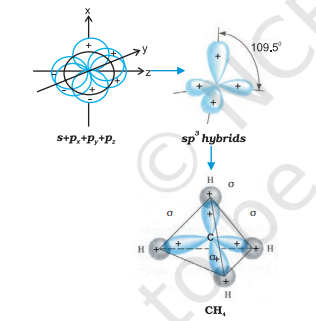
चित्र 4.12 कार्बन के s, $p_x$, $p_y$ और $p_z$ परमाणु कक्षकों के संयोजन द्वारा sp³ हाइब्रिड कक्षकों के निर्माण और $CH_4$ अणु के निर्माण
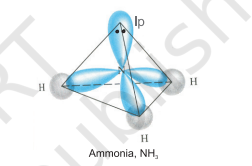
$ \mathrm{NH}_3 $ और $ \mathrm{H}_2 \mathrm{O} $ अणुओं की संरचना को $ s p^{3} $ हाइब्रिडीकरण की सहायता से भी समझा जा सकता है। $ \mathrm{NH}_3 $ में, नाइट्रोजन के आधुनिक अवस्था में इलेक्ट्रॉनिक विन्यास $ 2 S^{2} 2 p_x^{1} 2 p_y^{1} 2 p_z^{1} $ होता है जिसमें $ s p^{3} $ हाइब्रिड कक्षकों में तीन अनुनयित इलेक्ट्रॉन होते हैं और चौथे में एक अकेला इलेक्ट्रॉन युग्म होता है। इन तीन हाइब्रिड कक्षकों के अतिरिक्त, हाइड्रोजन परमाणुओं के $ 1 \mathrm{~s} $ कक्षकों के संकरण द्वारा तीन $ \mathrm{N}-\mathrm{H} $ सिग्मा बंध बनते हैं। हम जानते हैं कि एक अकेले इलेक्ट्रॉन युग्म और एक बंध युग्म के बीच प्रतिकर्षण दो बंध युग्मों के बीच प्रतिकर्षण से अधिक होता है। अतः अणु विकृत हो जाता है और बंध कोण $ 109.5^{\circ} $ से $ 107^{\circ} $ तक कम हो जाता है। ऐसे अणु की ज्यामिति पिरामिड आकार की होती है जैसा कि चित्र 4.13 में दिखाया गया है।
चित्र 4.13 $NH_3$ अणु के निर्माण
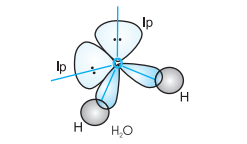
$H_2O$ अणु के मामले में, ऑक्सीजन के चार ऑर्बिटल (एक $2s$ और तीन $2p$) $sp^3$ हाइब्रिडीकरण करते हैं जिससे चार $sp^3$ हाइब्रिड ऑर्बिटल बनते हैं। इन चार $sp^3$ हाइब्रिड ऑर्बिटल में से दो में एक इलेक्ट्रॉन होता है और दो ऑर्बिटल में इलेक्ट्रॉन के युग्म होते हैं। इन चार $sp^3$ हाइब्रिड ऑर्बिटल एक टेट्राहेड्रल ज्यामिति लेते हैं, जिसमें दो कोने हाइड्रोजन अणुओं द्वारा घेरे गए होते हैं जबकि अन्य दो कोने अकेले इलेक्ट्रॉन युग्मों द्वारा घेरे गए होते हैं। इस मामले में बंधन कोण $109.5^{\circ}$ से कम करके $104.5^{\circ}$ हो जाता है (चित्र 4.14) और अणु इस प्रकार एक V-आकार या कोणीय ज्यामिति लेता है।
चित्र 4.14 $H_2 O$ अणु के निर्माण
4.6.2 $s p^{3}, s p^{2}$ और $s p$ हाइब्रिडाइजेशन के अन्य उदाहरण
$\boldsymbol{s p} ^{3}$ हाइब्रिडाइजेशन $ \mathrm{C}_2 \mathrm{H}_6 $ अणु में : एथेन अणु में दोनों कार्बन परमाणु $s p^{3}$ हाइब्रिड अवस्था में होते हैं। कार्बन परमाणु के चारों $s p^{3}$ हाइब्रिड ऑर्बिटल में से एक अक्षीय अतिव्यापन दूसरे परमाणु के समान ऑर्बिटल के साथ होता है जिससे $s p^{3}-s p^{3}$ सिग्मा बंध बनता है। जबकि प्रत्येक कार्बन परमाणु के अन्य तीन हाइब्रिड ऑर्बिटल $s p^{3}-s$ सिग्मा बंध बनाने के लिए हाइड्रोजन परमाणुओं के साथ उपयोग किए जाते हैं, जैसा कि अनुच्छेद 4.6.1(iii) में चर्चा की गई है। अतः एथेन में $\mathrm{C}-\mathrm{C}$ बंध की लंबाई 154 $\mathrm{pm}$ होती है और प्रत्येक $\mathrm{C}-\mathrm{H}$ बंध की लंबाई $109 \mathrm{pm}$ होती है।
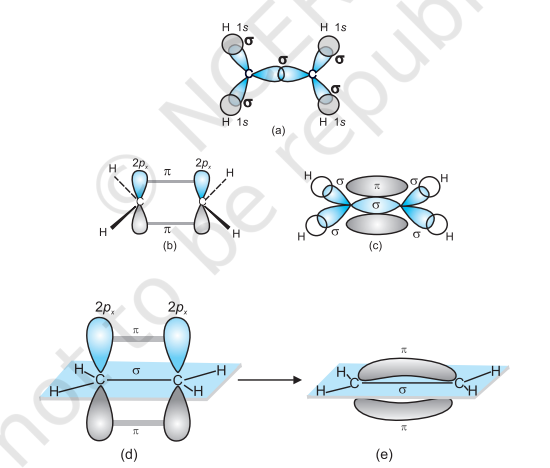
$\boldsymbol{s p}^{2}$ हाइब्रिडाइजेशन $\mathbf{C}_2 \boldsymbol{H}_4$ में : एथीन अणु के निर्माण में, कार्बन परमाणु के एक $s p^2$ हाइब्रिड ऑर्बिटल, दूसरे कार्बन परमाणु के $s p^2$ हाइब्रिड ऑर्बिटल के अक्षीय अधोलिप्ति के माध्यम से $\mathrm{C}-\mathrm{C}$ सिग्मा बंध बनता है। जबकि प्रत्येक कार्बन परमाणु के अन्य दो $s p^{2}$ हाइब्रिड ऑर्बिटल कार्बन परमाणु के दो हाइड्रोजन परमाणुओं के साथ $s p^2-s$ सिग्मा बंध बनाने के लिए उपयोग किए जाते हैं। एक कार्बन परमाणु के अहाइब्रिडाइज्ड ऑर्बिटल ($2 p_x$ या $2 p_y$) दूसरे कार्बन परमाणु के समान ऑर्बिटल के साथ ओर्धोलिप्ति के माध्यम से एक कमजोर $\pi$ बंध बनाता है, जो कार्बन और हाइड्रोजन परमाणुओं के तल के ऊपर और नीचे वितरित दो समान इलेक्ट्रॉन बादलों से मिलकर बनता है।
इस प्रकार, एथीन अणु में कार्बन-कार्बन बंध एक $s p^{2}-s p^{2}$ सिग्मा बंध और एक पाई $(\pi)$ बंध से बना होता है, जो $p$ कक्षकों से बना होता है जो हाइब्रिडाइजेशन में उपयोग नहीं होते हैं और अणु के तल के लंबवत होते हैं; बंध लंबाई $134 \mathrm{pm}$ होती है। $\mathrm{C}-\mathrm{H}$ बंध $s p^{2}-\mathrm{s}$ सिग्मा बंध होता है जिसकी बंध लंबाई $108 \mathrm{pm}$ होती है। $\mathrm{H}-\mathrm{C}-\mathrm{H}$ बंध कोण $117.6^{\circ}$ होता है जबकि $\mathrm{H}-\mathrm{C}-\mathrm{C}$ कोण $121^{\circ}$ होता है। एथीन में सिग्मा और पाई बंध के निर्माण को चित्र 4.15 में दिखाया गया है।
चित्र 4.15 एथिलीन में सिग्मा और पाई बॉंड के निर्माण
$\mathbf{C}_2 \mathbf{H}_2$ में sp हाइब्रिडाइजेशन : एथाइन अणु के निर्माण में, दोनों कार्बन परमाणु $sp$-हाइब्रिडाइजेशन अवस्था में होते हैं जिसमें दो अहाइब्रिडित ऑर्बिटल होते हैं अर्थात $2 p_y$ और $2 p_x$।
एक कार्बन परमाणु के एक $sp$ हाइब्रिड ऑर्बिटल दूसरे कार्बन परमाणु के $sp$ हाइब्रिड ऑर्बिटल के साथ अक्षीय अधिरोधन करते हैं जिससे $\mathrm{C}-\mathrm{C}$ सिग्मा बॉंड बनता है, जबकि प्रत्येक कार्बन परमाणु के अन्य हाइब्रिडित ऑर्बिटल अम्लीय अधिरोधन करते हैं जिससे हाइड्रोजन परमाणुओं के आंशिक भरे $s$ ऑर्बिटल के साथ $\sigma$ बॉंड बनते हैं। दोनों कार्बन परमाणुओं के दो अहाइब्रिडित $p$ ऑर्बिटल एक दूसरे के ओर ओर ओर अधिरोधन करते हैं जिससे कार्बन परमाणुओं के बीच दो पाई बॉंड बनते हैं। इस प्रकार दोनों कार्बन परमाणुओं के बीच त्रिक बॉंड एक सिग्मा और दो पाई बॉंडों से बना होता है जैसा कि चित्र 4.16 में दिखाया गया है।

चित्र 4.16 एथाइन में सिग्मा और पाई बॉन्ड के निर्माण
4.6.3 d ऑर्बिटल शामिल तत्वों के हाइब्रिडाइजेशन
तीसरे काले के उपस्थित तत्वों में $s$ और $p$ ऑर्बिटल के अलावा $d$ ऑर्बिटल भी होते हैं। $3d$ ऑर्बिटल की ऊर्जा $3s$ और $3p$ ऑर्बिटल की ऊर्जा के समान होती है। $3d$ ऑर्बिटल की ऊर्जा $4s$ और $4p$ ऑर्बिटल की ऊर्जा के समान भी होती है। इस कारण, $3s, 3p$ और $3d$ या $3d, 4s$ और $4p$ के संयोजन में हाइब्रिडाइजेशन संभव होती है। हालांकि, $3p$ और $4s$ ऑर्बिटल के ऊर्जा के बीच अंतर अधिक होने के कारण, $3p, 3d$ और $4s$ ऑर्बिटल के संयोजन में हाइब्रिडाइजेशन संभव नहीं होती।
महत्वपूर्ण $s, p$ और $d$ कक्षकों के बीच हाइब्रिडाइज़ेशन योजनाएँ नीचे सारांशित की गई हैं:
(i) $\mathrm{PCl}_{5}$ के निर्माण ($\mathrm{sp}^{3} \mathrm{~d}$ हाइब्रिडाइज़ेशन): फॉस्फोरस $(Z=15)$ के आधार अवस्था और उत्तेजित अवस्था के बाहरी इलेक्ट्रॉनिक विन्यास नीचे दिए गए हैं।
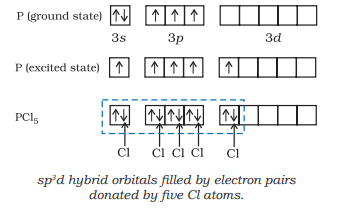
अब पाँच ऑर्बिटल (अर्थात, एक $s$, तीन $p$ और एक $d$ ऑर्बिटल) हाइब्रिडाइजेशन के लिए उपलब्ध हैं जो पांच $s p^{3} d$ हाइब्रिड ऑर्बिटल के सेट के रूप में बनाते हैं जो त्रिकोणी बिपिरामिड के पांच कोनों की ओर दिशात्मक होते हैं, जैसा कि चित्र 4.17 में दिखाया गया है।

चित्र 4.17 $PCl_5$ अणु के त्रिकोणीय बिपिरामिडीय ज्यामिति
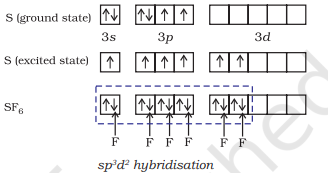
(ii) $\mathbf{S F}_6$ के निर्माण ($\mathrm{sp}^{3} d^{2}$ हाइब्रिडीकरण): $\mathrm{SF}_6$ में केंद्रीय सल्फर परमाणु की मूल अवस्था में बाहरी इलेक्ट्रॉनिक विन्यास $3 s^{2} 3 p^{4}$ होता है। उत्तेजित अवस्था में उपलब्ध छह ऑर्बिटल, अर्थात् एक s, तीन p और दो d ऑर्बिटल, इलेक्ट्रॉनों द्वारा एकल रूप से ठीक किए गए होते हैं। इन ऑर्बिटल आपस में हाइब्रिडीकरण करते हैं और छह नए $s p^{3} d^{2}$ हाइब्रिड ऑर्बिटल बनते हैं, जो $\mathrm{SF}_6$ में एक सामान्य अष्टफलक के छह कोनों की ओर बिछे होते हैं। इन छह $s p^{3} d^{2}$ हाइब्रिड ऑर्बिटल फ्लूओरीन परमाणुओं के एकल रूप से ठीक ऑर्बिटल के साथ अधिकतम घनत्व बनाते हैं और छह $\mathrm{S}-\mathrm{F}$ सिग्मा बंध बनाते हैं। इस प्रकार $\mathrm{SF}_6$ अणु की एक सामान्य अष्टफलकीय ज्यामिति होती है, जैसा कि चित्र 4.18 में दिखाया गया है।
चित्र 4.18 SF6 अणु की अष्टफलकीय ज्यामिति
4.7 अणुक कक्षक सिद्धांत
मोलेक्यूलर ऑर्बिटल (MO) सिद्धांत का विकास 1932 में F. Hund और R.S. Mulliken द्वारा किया गया था। इस सिद्धांत के मुख्य विशेषताएं निम्नलिखित हैं :
(i) एक अणु में इलेक्ट्रॉन विभिन्न मोलेक्यूलर ऑर्बिटल में होते हैं जैसे कि परमाणु में इलेक्ट्रॉन विभिन्न परमाणु ऑर्बिटल में होते हैं।
(ii) समान ऊर्जा वाले एवं सही सममिति वाले परमाणु ऑर्बिटल एक साथ मोलेक्यूलर ऑर्बिटल बनाते हैं।
(iii) एक परमाणु ऑर्बिटल में इलेक्ट्रॉन एक नाभिक द्वारा प्रभावित होता है, जबकि एक मोलेक्यूलर ऑर्बिटल में इलेक्ट्रॉन दो या अधिक नाभिकों द्वारा प्रभावित होता है, जिसके आधार पर अणु में परमाणुओं की संख्या होती है। इसलिए,
एक परमाणु कक्षक एक केंद्रीय होता है जबकि एक अणु कक्षक अनेक केंद्रीय होता है।
(iv) उत्पन्न अणु कक्षकों की संख्या संयोजन कर रहे परमाणु कक्षकों की संख्या के बराबर होती है। जब दो परमाणु कक्षक संयोजित होते हैं, तो दो अणु कक्षक बनते हैं। एक को आबंधन अणु कक्षक कहा जाता है जबकि दूसरे को विरोधी आबंधन अणु कक्षक कहा जाता है।
(v) आबंधन अणु कक्षक कम ऊर्जा वाला होता है और इसलिए उसकी स्थिरता उसके संगत विरोधी आबंधन अणु कक्षक की अपेक्षा अधिक होती है।
(vi) ठीक इसी तरह जैसे कि एक परमाणु में नाभिक के चारों ओर इलेक्ट्रॉन की प्रायिकता बट्टा एक परमाणु कक्षक द्वारा दिया जाता है, एक अणु में एक समूह के नाभिकों के चारों ओर इलेक्ट्रॉन की प्रायिकता बट्टा एक अणु कक्षक द्वारा दिया जाता है।
(vii) अणुक कक्षक ऐसे परमाणु कक्षक के समान हैं जो ऑफ़बाउ प्रमेय के अनुसार भरे जाते हैं, पॉली के अपवाद के सिद्धांत और हंड के नियम का पालन करते हुए।
4.7.1 अणुक कक्षक के निर्माण अणुक कक्षक के लिनियर संयोजन (LCAO)
तरंग भौतिकी के अनुसार, अणु कक्षक तरंग फ़ंक्शन (ψ) द्वारा व्यक्त किए जा सकते हैं, जो इलेक्ट्रॉन तरंगों के आयाम को प्रदर्शित करते हैं। ये श्रोडिंगर तरंग समीकरण के समाधान से प्राप्त किए जाते हैं। हालांकि, इसे किसी भी तंत्र के लिए हल करना संभव नहीं है जिसमें एक से अधिक इलेक्ट्रॉन हों। इसलिए, अणु कक्षक जो अणुओं के लिए एक इलेक्ट्रॉन तरंग फ़ंक्शन होते हैं, श्रोडिंगर तरंग समीकरण के समाधान से आगे निर्मित करना कठिन होता है। इस समस्या को दूर करने के लिए, एक अनुमानित विधि जो अणुक कक्षक के लिनियर संयोजन (LCAO) के रूप में जानी जाती है, का उपयोग किया गया है।
मान लीजिए हम इस विधि को हमोन्यूक्लियर डाइएटोमिक हाइड्रोजन अणु पर लागू करते हैं। एक हाइड्रोजन अणु को दो परमाणु A और B से बना मान लीजिए। प्रत्येक हाइड्रोजन परमाणु के आधार अवस्था में $1 \mathrm{~s}$ ऑर्बिटल में एक इलेक्ट्रॉन होता है। इन परमाणुओं के परमाणु ऑर्बिटल इनके तरंग फलन $\psi_{\mathrm{A}}$ और $\psi_{\mathrm{B}}$ द्वारा प्रस्तुत किए जा सकते हैं। गणितीय रूप से, अणु ऑर्बिटल के निर्माण की व्याख्या परमाणु ऑर्बिटल के रूप में तरंग फलनों के जोड़ और घटाव द्वारा हो सकती है जैसा कि नीचे दिखाया गया है :
$$ \psi_{\mathrm{MO}}=\psi_{\mathrm{A}} \pm \psi_{\mathrm{B}} $$
इसलिए, दो अणुओं के ऑर्बिटल $\sigma$ और $\sigma^{*}$ इस प्रकार बनते हैं :
$$ \begin{aligned} & \sigma=\psi_{\mathrm{A}}+\psi_{\mathrm{B}} \\ & \sigma^{*}=\psi_{\mathrm{A}}-\psi_{\mathrm{B}} \end{aligned} $$
अणु ऑर्बिटल $\sigma$ जो परमाणु ऑर्बिटल के जोड़ से बनता है, बंधन अणु ऑर्बिटल कहलाता है जबकि अणु ऑर्बिटल $\sigma^{*}$ जो परमाणु ऑर्बिटल के घटाव से बनता है, विरोधी बंधन अणु ऑर्बिटल कहलाता है, जैसा कि चित्र 4.19 में दिखाया गया है।
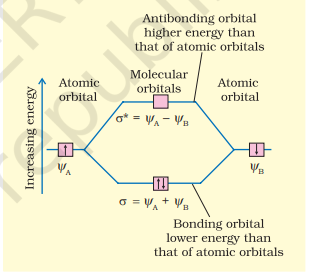
चित्र 4.19 बंधन (σ) और विरोधी बंधन (σ*) अणुओं के ऑर्बिटल के निर्माण के लिए परमाणु ऑर्बिटल ψA और ψB के रैखिक संयोजन द्वारा दो परमाणुओं A और B के केंद्र पर।
गुणात्मक रूप से, अणु ऑर्बिटल के निर्माण को संयोजन करते हुए परमाणुओं के इलेक्ट्रॉन तरंगों के निर्माण या विनाश के अनुसार समझा जा सकता है। बंधन अणु ऑर्बिटल के निर्माण में, बंधन परमाणुओं के दो इलेक्ट्रॉन तरंगें निर्माण के कारण एक दूसरे के साथ बलपूर्वक बल डालती हैं जबकि विरोधी बंधन अणु ऑर्बिटल के निर्माण में, दो इलेक्ट्रॉन तरंजें विनाश के कारण एक दूसरे के विरोध में बल डालती हैं।
अंतरबंध अणुओं के अणु कक्षक में, इलेक्ट्रॉन तरंगें नष्ट संकरण के कारण एक दूसरे को रद्द कर देती हैं। इसके परिणामस्वरूप, बंधन अणु कक्षक में इलेक्ट्रॉन घनत्व बंधे हुए परमाणुओं के नाभिकों के बीच स्थित होता है, जिसके कारण नाभिकों के बीच प्रतिकर्षण बहुत कम होता है। विपरीत, अंतरबंध अणु कक्षक में इलेक्ट्रॉन घनत्व अधिकांश रूप से नाभिकों के बीच के अंतर के बाहर स्थित होता है। वास्तव में, नाभिकों के बीच एक नोडल तल (जहां इलेक्ट्रॉन घनत्व शून्य होता है) होता है और इस कारण नाभिकों के बीच प्रतिकर्षण अधिक होता है। बंधन अणु कक्षक में रखे गए इलेक्ट्रॉन नाभिकों को एक साथ रखते हैं और अणु को स्थायी बनाते हैं। इसलिए, बंधन अणु कक्षक हमेशा उस अणु कक्षक से कम ऊर्जा वाला होता है जिसके निर्माण के लिए अणुओं के संयोजन से बना होता है। विपरीत, अंतरबंध अणु कक्षक में रखे गए इलेकट्रॉन अणु को अस्थायी बनाते हैं। इसका कारण यह है कि इस कक्षक में इलेक्ट्रॉनों के बीच परस्पर प्रतिकर्षण इलेक्ट्रॉनों और नाभिकों के बीच आकर्षण से अधिक होता है, जिसके कारण ऊर्जा में एक नेट वृद्धि होती है।
ध्यान दिया जा सकता है कि विरोधी बंधन अर्बिटल की ऊर्जा मूल परमाणु अर्बिटल की ऊर्जा से ऊपर बढ़ जाती है जो जुड़ चुके हैं और बंधन अर्बिटल की ऊर्जा मूल अर्बिटल की तुलना में कम हो जाती है। दो अणु अर्बिटल की कुल ऊर्जा हालांकि दो मूल परमाणु अर्बिटल के बराबर रहती है।
4.7.2 परमाणु अर्बिटल के संयोजन के शर्तें
परमाणु अर्बिटल के रूपांतरण अणु अर्बिटल बनाने के लिए केवल निम्नलिखित शर्तों के अनुपालन के बाद ही हो सकता है:
1. संयोजन अपरिवर्ती कक्षकों के ऊर्जा समान या लगभग समान होना आवश्यक है। इसका अर्थ यह है कि $1 \mathrm{~s}$ कक्षक दूसरे $1 s$ कक्षक के साथ संयोजन कर सकता है लेकिन $2 s$ कक्षक के साथ नहीं कर सकता क्योंकि $2 s$ कक्षक की ऊर्जा $1 \mathrm{~s}$ कक्षक की ऊर्जा से बहुत अधिक होती है। यह बात गैर-समान परमाणुओं के मामले में सत्य नहीं होती।
2. संयोजन अपरिवर्ती कक्षकों के अपने अणु अक्ष के संबंध में सममिति होना आवश्यक है। परंपरागत रूप से $z$-अक्ष को अणु अक्ष के रूप में लिया जाता है। यह ध्यान देने योग्य है कि ऊर्जा समान या लगभग समान अपरिवर्ती कक्षक अगर अपनी सममिति के अधिकांश नहीं हों तो संयोजन नहीं कर सकते। उदाहरण के लिए, एक परमाणु के $2 p_{z}$ कक्षक दूसरे परमाणु के $2 p_{z}$ कक्षक के साथ संयोजन कर सकते हैं लेकिन $2 p_{x}$ या $2 p_{y}$ कक्षक के साथ नहीं कर सकते क्योंकि उनकी सममिति अलग होती है।
मोलेक्यूलर ऑर्बिटल जो $2 p_{\mathrm{x}}$ और $2 p$ ऑर्बिटल से प्राप्त होते हैं, बंधन अक्ष के चारों ओर सममित नहीं होते क्योंकि अणु के तल के ऊपर धनात्मक लोब और नीचे नकारात्मक लोब की उपस्थिति के कारण। ऐसे मोलेक्यूलर ऑर्बिटल को $\pi$ और $\pi^{*}$ के रूप में चिह्नित किया जाता है [चित्र 4.20(c)]। एक $\pi$ बंधन ऑर्बिटल में इलेक्ट्रॉन घनत्व बंधन अक्ष के ऊपर और नीचे अधिक होता है। $\pi^{\star}$ विरोधी बंधन ऑर्बिटल में नाभिकों के बीच एक नोड होता है।
4.7.4 अणु ऑर्बिटल के ऊर्जा स्तर आरेख
हम देख चुके हैं कि दो परमाणुओं पर $1 \mathrm{~s}$ परमाणु ऑर्बिटल दो मोलेक्यूलर ऑर्बिटल बनाते हैं जिन्हें $\sigma 1 \mathrm{~s}$ और $\sigma^{*} 1 \mathrm{~s}$ के रूप में निर्दिष्ट किया गया है। इसी तरह, $2 \mathrm{~s}$ और $2 p$ परमाणु ऑर्बिटल (दो परमाणुओं पर आठ परमाणु ऑर्बिटल) निम्नलिखित आठ मोलेक्यूलर ऑर्बिटल के उत्पादन करते हैं:
चित्र 4.20 आबन्धन एवं विरोधाभांधन अणुओं के आर्बिटल के बाह्य रूप एवं ऊर्जा। इनके निर्माण के लिए (a) 1s परमाणु आर्बिटल, (b) $2p_z$ परमाणु आर्बिटल एवं (c) $2p_x$ परमाणु आर्बिटल के संयोजन के द्वारा।
$\begin{array}{llllll} \text{विरोधाभांधन } & \mathrm{MOs} & \sigma^* 2 s & \sigma^* 2 p_z & \pi^* 2 p_x & \pi^* 2 p_y \\ \text { आबन्धन } & \mathrm{MOs} & \sigma 2 \mathrm{~s} & \sigma 2 p_{z} & \pi 2 p_{x} & \pi 2 p_y\end{array}$
The energy levels of these molecular orbitals have been determined experimentally from spectroscopic data for homonuclear diatomic molecules of second row elements of the periodic table. The increasing order of energies of various molecular orbitals for $\mathrm{O}_2$ and $\mathrm{F}_2$ is given below:
$\sigma 1 s<\sigma^* 1 s<\sigma 2 s<\sigma^* 2 s<\sigma 2 p_z < \left(\pi 2 p_x = \pi 2 p_y\right) $
$<\left(\pi^* 2 p_x=\pi^* 2 p_y\
However, this sequence of energy levels of molecular orbitals is not correct for the remaining molecules $\mathrm{Li}_2, \mathrm{Be}_2, \mathrm{~B}_2, \mathrm{C}_2, \mathrm{~N}_2$. For instance, it has been observed experimentally that for molecules such as $\mathrm{B}_2, \mathrm{C}_2, \mathrm{~N}_2$, etc. the increasing order of energies of various molecular orbitals is
$\sigma 1 s<\sigma^* 1 s<\sigma 2 s<\sigma^* 2 s<\left(\pi 2 p_x=\pi 2 p_y\right)$
$<\sigma 2 p_z<\left(\pi^* 2 p_x=\pi^* 2 p_y\right)<\sigma^* 2 p_z$
इस क्रम की महत्वपूर्ण विशेषता यह है कि $\boldsymbol{\sigma 2} \boldsymbol{p}_z$ अणुओर्बिटल की ऊर्जा $\pi 2 p_x$ और $\pi 2 p_y$ अणुओर्बिटल की ऊर्जा से अधिक होती है।
4.7.5 इलेक्ट्रॉनिक विन्यास और अणु के आचरण
विभिन्न अणुओर्बिटल में इलेक्ट्रॉनों के वितरण को अणु के इलेक्ट्रॉनिक विन्यास कहते हैं। अणु के इलेक्ट्रॉनिक विन्यास से अणु के बारे में महत्वपूर्ण जानकारी प्राप्त की जा सकती है, जैसा कि नीचे चर्चा की गई है।
अणुओं की स्थायित्व: यदि $\mathrm{N}_b$ बंधन बनाम बंधन विरोधी ऑर्बिटल में इलेक्ट्रॉनों की संख्या है और $\mathrm{N}_a$ विरोधी बंधन ऑर्बिटल में इलेक्ट्रॉनों की संख्या है, तो
(i) अणु स्थायी होगा यदि $\mathrm{N}_b$ $\mathrm{N}_a$ से अधिक हो, और
(ii) अणु अस्थायी होगा यदि $\mathrm{N}_b$ $\mathrm{N}_a$ से कम हो।
(i) में अधिक बंधन ऑर्बिटल भरे हुए हैं और इसलिए बंधन प्रभाव अधिक है और एक स्थायी अणु के निर्माण होता है। (ii) में विरोधी बंधन प्रभाव अधिक है और इसलिए अणु अस्थायी होता है।
बॉन्ड क्रम
बॉन्ड क्रम (b.o.) को बंधन एवं विरोधी बंधन कक्षकों में उपस्थित इलेक्ट्रॉनों की संख्या के अंतर के आधा के रूप में परिभाषित किया जाता है, अर्थात,
बॉन्ड क्रम (b.o.) $=1 / 2\left(\mathrm{~N}_b-\mathrm{N}_a\right)$
ऊपर चर्चा किए गए अणु के स्थायित्व के संबंधित नियमों को बॉन्ड क्रम के रूप में निम्नलिखित रूप में पुनर्परिभाषित किया जा सकता है: एक धनात्मक बॉन्ड क्रम (अर्थात $\mathrm{N}_b>\mathrm{N}_a$ ) एक स्थायी अणु को दर्शाता है जबकि एक नकारात्मक (अर्थात $\mathrm{N}b < \mathrm{N a}$ ) या शून्य (अर्थात $\mathrm{N}_b=\mathrm{N}_a$ ) बॉन्ड क्रम एक अस्थायी अणु को दर्शाता है।
बंध की प्रकृति
एकल, द्विबंध या त्रिबंध के रूप में क्रमशः 1, 2 या 3 के समाकरण बंध के क्लासिक अवधारणा में अध्ययन किए जाते हैं।
बंध लंबाई
एक अणु में दो परमाणुओं के बीच बंध कोर के बीच बंध लंबाई का एक अनुमानित माप माना जा सकता है। बंध कोर के बढ़ने के साथ-साथ बंध लंबाई घटती जाती है।
चुंबकीय प्रकृति
यदि एक अणु में सभी अणुओं के ऑर्बिटल द्विगुणित अधिकृत हों, तो पदार्थ विषुवत चुंबकीय (चुंबकीय क्षेत्र से विरोधी) होता है। हालांकि, यदि एक या अधिक अणुओं के ऑर्बिटल एकल अधिकृत हों, तो यह प्रामाणिक चुंबकीय (चुंबकीय क्षेत्र की ओर आकर्षित) होता है, उदाहरण के लिए, $\mathrm{O}_{2}$ अणु।
4.8 कुछ होमोन्यूक्लियर डाइएटोमिक अणुओं में बंधन
इस अनुच्छेद में हम कुछ होमोन्यूक्लियर डाइएटोमिक अणुओं में बंधन के बारे में चर्चा करेंगे।
1. हाइड्रोजन अणु $\left(\boldsymbol{H}_{2}\right)$ : यह दो हाइड्रोजन परमाणुओं के संयोजन से बनता है। प्रत्येक हाइड्रोजन परमाणु में 1s ऑर्बिटल में एक इलेक्ट्रॉन होता है। अतः, हाइड्रोजन अणु में कुल दो इलेक्ट्रॉन होते हैं जो $\sigma 1 \mathrm{~s}$ अणुओत्सर्गी ऑर्बिटल में उपस्थित होते हैं। अतः हाइड्रोजन अणु की इलेक्ट्रॉनिक विन्यास होता है
$$ \mathrm{H}_{2}:(\sigma 1 s)^{2} $$
$$
$\mathrm{H}_{2}$ अणु के बन्ड आर्डर की गणना नीचे दिए गए तरीके से की जा सकती है:
$$ \text { बन्ड आर्डर }=\dfrac{\mathrm{N}_b-\mathrm{N}_a}{2}=\dfrac{2-0}{2}=1 $$
इसका अर्थ है कि दो हाइड्रोजन परमाणु एकल सहसंयोजक बन्ड द्वारा एक दूसरे से जुड़े हुए हैं। हाइड्रोजन अणु के बन्ड वियोजन ऊर्जा के अध्ययन से पता चलता है कि इसका मान $438 \mathrm{~kJ} \mathrm{~mol}^{-1}$ है और बन्ड लंबाई $74 \mathrm{pm}$ है। क्योंकि हाइड्रोजन अणु में कोई असुमेक इलेक्ट्रॉन नहीं होता है, इसलिए यह द्विचुम्बकीय होता है।
2. हीलियम अणु $\left(\mathbf{He}_2\right)$ : हीलियम परमाणु की इलेक्ट्रॉनिक विन्यास $1 s^2$ होती है। प्रत्येक हीलियम परमाणु में 2 इलेक्ट्रॉन होते हैं, इसलिए $\mathrm{He}_2$ अणु में 4 इलेक्ट्रॉन होंगे। इन इलेक्ट्रॉनों को $\sigma 1 s$ और $\sigma^{*} 1 s$ अणुओं के बन्ड में रखा जाएगा जिससे इलेक्ट्रॉनिक विन्यास होगा:
$\mathrm{He}_{2}:(\sigma 1 s)^{2}\left(\sigma^{*} 1 s\right)^{2}$
$\mathrm{He}_{2}$ के बंधन क्रम $1 / 2(2-2)=0$ है
$\mathrm{He}_{2}$ अणु अत: अस्थायी है और अस्तित्व नहीं रखता।
उसी तरह, यह दिखाया जा सकता है कि $\mathrm{Be}_2$ अणु $(\sigma 1 s)^2\left(\sigma^* 1 s\right)^2(\sigma 2 s)^2\left(\sigma^* 2 s\right)^2$ भी अस्तित्व नहीं रखता।
3. लिथियम अणु $\left(\mathbf{L i}_2\right)$ : लिथियम की इलेक्ट्रॉनिक विन्यास $1 s^2, 2 s^1$ है। $\mathrm{Li}_2$ में छह इलेक्ट्रॉन होते हैं। अत: $\mathrm{Li}_2$ अणु की इलेक्ट्रॉनिक विन्यास निम्नलिखित होती है
$$ \operatorname{Li}_{2}:(\sigma 1 s)^{2}\left(\sigma^{*} 1 s\right)^{2}(\sigma 2 s)^{2} $$
ऊपर की अवस्था को भी $\mathrm{KK}(\sigma 2 \mathrm{~s})^{2}$ के रूप में लिखा जा सकता है, जहाँ $\mathrm{KK}$ बंद $K$ कोश संरचना को दर्शाता है $(\sigma 1 s)^{2}\left(\sigma^{*} 1 s\right)^{2}$।
$\mathrm{Li}_2$ अणु की इलेक्ट्रॉनिक अवस्था से स्पष्ट है कि बंधन अणुओं में चार इलेक्ट्रॉन उपस्थित हैं और विरोधी बंधन अणुओं में दो इलेक्ट्रॉन उपस्थित हैं। इसलिए, इसका बंधन क्रम $1 / 2$ (42) $=1$ है। इसका अर्थ है कि $\mathrm{Li}_2$ अणु स्थायी है और इसके कोई असुमेलित इलेक्ट्रॉन नहीं होने के कारण इसे विषुवतीय चुंबकीय होना चाहिए। वास्तव में, वाष्प अवस्था में विषुवतीय $\mathrm{Li}_2$ अणुओं के अस्तित्व के बारे में जानकारी है।
4. कार्बन अणु $\left(\boldsymbol{C}_2\right)$ : कार्बन की इलेक्ट्रॉनिक विन्यास $1 s^{2} 2 s^{2} 2 p^{2}$ है। $\mathrm{C}_2$ में बारह इलेक्ट्रॉन होते हैं। अतः $\mathrm{C}_2$ अणु की इलेक्ट्रॉनिक विन्यास निम्नलिखित है
$\mathrm{C}_2:(\sigma 1 \mathrm{~s})^{2}\left(\sigma^{*} 1 \mathrm{~s}\right)^{2}(\sigma * 2 \mathrm{~s})^{2}\left(\pi 2 \mathrm{p}_x^{2}=\pi 2 \mathrm{p}_y^{2}\right)$
या $K K(\sigma 2 s)^{2}(\sigma * 2 s)^{2}\left(\pi 2 \mathrm{p}_x^{2}=\pi 2 \mathrm{p}_y^{2}\right)$
The bond order of $\mathrm{C}_2$ is $1 / 2(8-4)=2$ and $\mathrm{C}_2$ should be diamagnetic. Diamagnetic $\mathrm{C}_2$ molecules have indeed been detected in vapour phase. It is important to note that double bond in $\mathrm{C}_2$ consists of both pi Bonds because of the presence of four electrons in two pi molecular orbitals. In most of the other molecules a double bond is made up of a sigma bond and a pi bond. In a similar fashion the bonding in $\mathrm{N}_2$ molecule can be discussed.
5. Oxygen molecule $\left(\mathrm{O}_2\right)$ : The electronic configuration of oxygen atom is $1 s^{2} 2 s^{2} 2 p^{4}$. Each oxygen atom has 8 electrons, hence, in $\mathrm{O}_2$ molecule there are 16 electrons. The electronic configuration of $\mathrm{O}_2$ molecule, therefore, is
$\mathrm{O}_{2}:(\sigma 1 s)^{2}\left(\sigma^{*} 1 s\right)^{2}(\sigma 2 s)^{2}(\sigma * 2 s)^{2}\left(\sigma 2 \mathrm{p}_z\right)^{2}$
$\left(\pi 2 p_x{ }^{2} \equiv \pi 2 p_y{ }^{2}\right)\left(\pi^{*} 2 p^{1}{ }_x \equiv \pi * 2 p_y{ }^{1}\right)$
या $\mathrm{O}^{2}:\left[\begin{array}{c}\mathrm{KK}(\sigma 2 \mathrm{~s})^{2}\left(\sigma 2 p_S\right)^{2}\left(\sigma 2 p_z\right)^{2} \\ \left(\pi 2 p_x^{2} \equiv \pi 2 p_y^{2}\right),\left(\pi * 2 \mathrm{p}_x^{1} \equiv \pi * 2_y^{1}\right)\end{array}\right]$
संकरण विन्यास से $\mathrm{O}_{2}$ अणु के लिए स्पष्ट है कि बंधन अणुओं के ऑर्बिटल में दस इलेक्ट्रॉन उपस्थित हैं और विरोधी बंधन अणुओं के ऑर्बिटल में छ: इलेक्ट्रॉन उपस्थित हैं। इसलिए, इसका बंधन क्रम है
बंधन क्रम $=\dfrac{1}{2}\left[N_{b}-N_{a}\right]=\dfrac{1}{2}[10-6]=2$
इस प्रकार, ऑक्सीजन अणु में परमाणु एक द्विबंध द्वारा बंधित होते हैं। इसके अतिरिक्त, यह ध्यान देने योग्य है कि इसमें $\pi^* 2 p_x$ और $\pi^* 2 p_y$ अणुओं के ऑर्बिटल में दो असुमेकित इलेक्ट्रॉन उपस्थित हैं, इसलिए $\mathrm{O}_2$ अणु प्रामाणिक चुंबकीय होना चाहिए, जो प्रयोगात्मक अवलोकन के साथ मेल खाता है। इस तरह सिद्धांत ऑक्सीजन के प्रामाणिक प्रकृति की सफल व्याख्या करता है।
उतना ही, आवर्त सारणी के द्वितीय पंक्ति के अन्य समान परमाणु द्विपरमाणु अणुओं के इलेक्ट्रॉनिक विन्यास लिखे जा सकते हैं। आकृति 4.21 में $\mathrm{B}_2$ से $\mathrm{Ne}_2$ तक के अणुओं के अणु कक्षक उपस्थिति और अणु गुण दिए गए हैं। अणु कक्षक क्रम और उनके इलेक्ट्रॉन आवेश दिखाए गए हैं। बंधन ऊर्जा, बंधन लंबाई, बंधन क्रम, चुंबकीय गुण और मूल इलेक्ट्रॉन विन्यास कक्षक आरेख के नीचे दिखाए गए हैं।
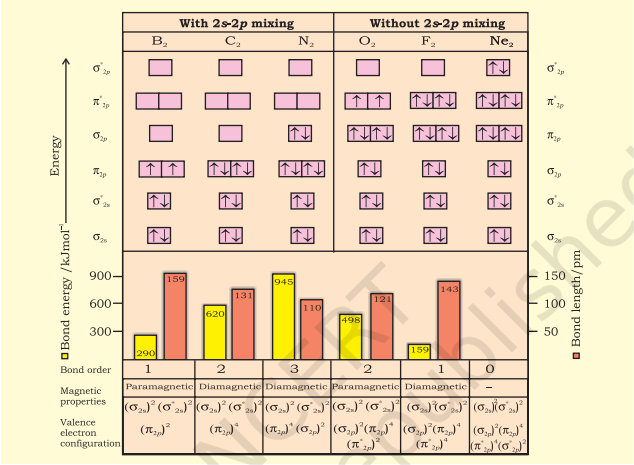

4.9 नाइट्रोजन बंधन
नाइट्रोजन, ऑक्सीजन और फ्लूओरीन उच्च विद्युत ऋणात्मकता वाले तत्व हैं। जब वे हाइड्रोजन परमाणु के साथ सहसंयोजक बंधन बनाते हैं, तो सहसंयोजक बंधन के इलेक्ट्रॉन अधिक विद्युत ऋणात्मक तत्व की ओर खिसक जाते हैं। इस प्रकार आंशिक धनात्मक चार्ज वाला हाइड्रोजन परमाणु दूसरे अधिक विद्युत ऋणात्मक परमाणु के साथ बंधन बनाता है। इस बंधन को हाइड्रोजन बंधन कहते हैं और यह सहसंयोजक बंधन की तुलना में कमजोर होता है। उदाहरण के लिए, HF अणु में एक अणु के हाइड्रोजन परमाणु और दूसरे अणु के फ्लूओरीन परमाणु के बीच हाइड्रोजन बंधन उपस्थित होता है, जैसा कि नीचे दर्शाया गया है :
$\text{ - - - }\mathrm{H}^{\delta+}-\mathrm{F}^{\delta-}\text{ - - - }\mathrm{H}^{\delta+}-\mathrm{F}^{\delta-}\text{ - - - }\mathrm{H}^{\delta+}-\mathrm{F}^{\delta-}$
यहाँ, हाइड्रोजन बंध दो परमाणुओं के बीच एक पुल के रूप में कार्य करता है जो एक परमाणु को सहसंयोजक बंध द्वारा और दूसरे परमाणु को हाइड्रोजन बंध द्वारा बांधता है। हाइड्रोजन बंध एक बिंदु रेखा ($\text{ - - - }$) द्वारा दर्शाया जाता है जबकि एक ठोस रेखा सहसंयोजक बंध को दर्शाती है। इस प्रकार, हाइड्रोजन बंध को एक आकर्षण बल के रूप में परिभाषित किया जा सकता है जो एक अणु के हाइड्रोजन परमाणु को दूसरे अणु के विद्युत ऋणात्मक परमाणु ( $\mathrm{F}, \mathrm{O}$ या $\mathrm{N}$ ) से बांधता है।
4.9.1 हाइड्रोजन बन्ध के निर्माण के कारण
जब हाइड्रोजन को बहुत विद्युत ऋणात्मक तत्व ’ $\mathrm{X}$ ’ के साथ बंधन होता है, तो दो परमाणुओं के बीच साझा किए गए इलेक्ट्रॉन युग्म हाइड्रोजन परमाणु से दूर चले जाते हैं। इस प्रकार हाइड्रोजन परमाणु अन्य परमाणु ’ $X$ ’ के सापेक्ष बहुत विद्युत धनात्मक बन जाता है। चूंकि इलेक्ट्रॉन तीव्रता से $\mathrm{X}$ की ओर विस्थापित हो जाते हैं, हाइड्रोजन आंशिक धनावेश $\left(\delta^{+}\right)$ के साथ बन जाता है जबकि ’ $\mathrm{X}$ ’ आंशिक ऋणावेश $\left(\delta^{-}\right)$ के साथ बन जाता है। इसके परिणामस्वरूप एक ध्रुवीय अणु के निर्माण के लिए विद्युत आकर्षण बल उत्पन्न होता है जिसे निम्नलिखित रूप में प्रस्तुत किया जा सकता है:
$\mathrm{H}^{\delta+}-\mathrm{X}^{\delta-}\text{ - - - }\mathrm{H}^{\delta+}-\mathrm{X}^{\delta-}\text{ - - - }\mathrm{H}^{\delta+}-\mathrm{X}^{\delta-}$
$\mathrm{H}$-बंधन के मापदंड यौगिक के भौतिक अवस्था पर निर्भर करता है। यह ठोस अवस्था में अधिकतम और गैसीय अवस्था में न्यूनतम होता है। इसलिए, हाइड्रोजन बंध यौगिकों के संरचना और गुणों पर मजबूत प्रभाव डालते हैं।
4.9.2 $H$-बंध के प्रकार
$\mathrm{H}$-बंध के दो प्रकार होते हैं
(i) अंतरमोलेकुलर हाइड्रोजन बंध
(ii) अंतराणुक हाइड्रोजन बंध
(1) अंतराणुक हाइड्रोजन बंध: यह एक ही या भिन्न यौगिकों के दो अलग-अलग अणुओं के बीच बनता है। उदाहरण के लिए, HF अणु, एल्कोहल या पानी के अणुओं में हाइड्रोजन बंध।
(2) अंतराणुक हाइड्रोजन बंध: यह उस स्थिति में बनता है जब हाइड्रोजन परमाणु एक ही अणु में दो उच्च विद्युत ऋणात्मक $(\mathrm{F}, \mathrm{O}, \mathrm{N})$ परमाणुओं के बीच होता है। उदाहरण के लिए, o-नाइट्रोफेनॉल में हाइड्रोजन दो ऑक्सीजन परमाणुओं के बीच होता है।
चित्र 4.22 अंतराणुक हाइड्रोजन
सारांश
कॉसेल के पहले अवलोकन धनात्मक और ऋणात्मक आयनों के निर्माण के यांत्रिक तंत्र के संबंध में आयनों के अपने अपवाही गैस विन्यास के प्राप्त करने से संबंधित था। आयनों के बीच विद्युत आकर्षण उनकी स्थायिता के कारण होता है। इससे विद्युत आकर्षण की अवधारणा बनती है।
The first description of covalent bonding was provided by Lewis in terms of the sharing of electron pairs between atoms and he related the process to the attainment of noble gas configurations by reacting atoms as a result of sharing of electrons. The Lewis dot symbols show the number of valence electrons of the atoms of a given element and Lewis dot structures show pictorial representations of bonding in molecules.
An ionic compound is pictured as a three-dimensional aggregation of positive and negative ions in an ordered arrangement called the crystal lattice. In a crystalline solid there is a charge balance between the positive and negative ions. The crystal lattice is stabilized by the enthalpy of lattice formation.
जबकि एक एकल सहसंयोजक बंध दो परमाणुओं के बीच एक इलेक्ट्रॉन युग्म के साझा करके बनाया जाता है, बहुल बंध दो या तीन इलेक्ट्रॉन युग्मों के साझा करके बनते हैं। कुछ बंधित परमाणुओं के बंधन में शामिल नहीं होने वाले अतिरिक्त इलेक्ट्रॉन युग्म होते हैं। इन्हें इलेक्ट्रॉन के अकेले युग्म कहा जाता है। लेविस डॉट संरचना एक अणु में प्रत्येक परमाणु के बंधित युग्म और अकेले युग्म के व्यवस्था को दर्शाती है। रासायनिक बंधों से संबंधित महत्वपूर्ण पैरामीटर, जैसे: बंध लंबाई, बंध कोण, बंध एंथैल्पी, बंध क्रम और बंध ध्रुवता, यौगिकों के गुणों पर महत्वपूर्ण प्रभाव डालते हैं।
एक संख्या में अणु और बहुपरमाणुक आयन एक लेविस संरचना द्वारा ठीक तरह से वर्णित नहीं किए जा सकते हैं और एक ही संरचना आधारित कई विवरण (प्रतिनिधित्व) लिखे जाते हैं और इनके मिलकर अणु या आयन को प्रतिनिधित्व करते हैं। यह एक बहुत महत्वपूर्ण और बहुत उपयोगी अवधारणा है जिसे रेजोनेंस कहते हैं। योगदानकर्ता संरचनाएं या कैनोनिकल रूप एक साथ ले जाकर रेजोनेंस हाइब्रिड को बनाते हैं जो अणु या आयन को प्रतिनिधित्व करते हैं।
VSEPR मॉडल जो अणुओं के ज्यामितीय आकार की भविष्यवाणी के लिए उपयोग किया जाता है, यह इस धारणा पर आधारित है कि इलेक्ट्रॉन युग्म एक दूसरे को प्रतिकर्षित करते हैं और इसलिए वे एक दूसरे से जितनी दूर रह सकें उतनी दूर रहना चाहते हैं। इस मॉडल के अनुसार, अणु ज्यामिति अकेले युग्म और युग्म के बीच प्रतिकर्षण, युग्म और बंधन युग्म के बीच प्रतिकर्षण, बंधन युग्म और बंधन युग्म के बीच प्रतिकर्शण द्वारा निर्धारित की जाती है। इन प्रतिकर्षणों का क्रम इस प्रकार है: lp-lp $>1 \mathrm{p}-\mathrm{bp}>\mathrm{bp}-\mathrm{bp}$
मूल बंध (VB) अनुपात के अनुसार सहसंयोजक बंधन के ऊर्जा विन्यास के बारे में बात की जाती है, जिसके बारे में लुईस और VSEPR मॉडल चुप रहते हैं। मूल रूप से VB सिद्धांत बंधन के निर्माण के बारे में ऑर्बिटल ओवरलैप के आधार पर चर्चा करता है। उदाहरण के लिए, दो हाइड्रोजन परमाणुओं से $\mathrm{H}_{2}$ अणु के निर्माण में दोनों $\mathrm{H}$ परमाणुओं के $1 \mathrm{~s}$ ऑर्बिटल के ओवरलैप की भाग लेना शामिल होता है, जो एकल उपयोग के होते हैं। यह देखा जाता है कि जब दो $\mathrm{H}$ परमाणु एक दूसरे के पास आते हैं तो प्रणाली की संभावित ऊर्जा कम हो जाती है। संतुलन अंतर-परमाणु दूरी (बंध दूरी) पर ऊर्जा न्यूनतम तक पहुंच जाती है। कोई भी प्रयास नाभिकों को और भी करीब लाने के लिए ऊर्जा में अचानक वृद्धि हो जाती है और अणु के अस्थिर बन जाने के लिए नतीजा होता है। ऑर्बिटल ओवरलैप के कारण नाभिकों के बीच इलेक्ट्रॉन घनत्व बढ़ जाता है जो उन्हें एक दूसरे के पास लाने में सहायता करता है। लेकिन यह देखा जाता है कि वास्तविक बंध एंथैल्पी और बंध लंबाई के मान ओवरलैप के द्वारा नहीं प्राप्त होते हैं और अन्य चर भी ध्यान में लिए जाने चाहिए।
पॉलिएट्रॉमिक अणुओं के विशिष्ट आकार की व्याख्या करने के लिए पॉलिंग ने परमाणु कक्षकों के हाइब्रिडाइजेशन के अवधारणा को प्रस्तुत किया। $s p, s p^{2}, s p^{3}$ हाइब्रिडाइजेशन के परमाणु कक्षकों का उपयोग $\mathrm{Be}, \mathrm{B}, \mathrm{C}, \mathrm{N}$ और $\mathrm{O}$ के अणुओं जैसे $\mathrm{BeCl}_2, \mathrm{BCl}_3, \mathrm{CH}_4, \ी. NH_3$ और $\mathrm{H}_2 \mathrm{O}$ के निर्माण और ज्यामितीय आकार की व्याख्या करने में किया गया है। वे अणुओं जैसे $\mathrm{C}_2 \mathrm{H}_2$ और $\mathrm{C}_2 \mathrm{H}_4$ में बहुलक बंधन के निर्माण की भी व्याख्या करते हैं।
मोलेक्यूलर ऑर्बिटल (MO) सिद्धांत अणुओं में बंधन को परमाणु ऑर्बिटलों के संयोजन और व्यवस्था के आधार पर वर्णित करता है, जो अणु के समग्र रूप से संबंधित मोलेक्यूलर ऑर्बिटल बनाते हैं। मोलेक्यूलर ऑर्बिटल की संख्या हमेशा उनसे बने हुए परमाणु ऑर्बिटल की संख्या के बराबर होती है। बंधन ऑर्बिटल में नाभिकों के बीच इलेक्ट्रॉन घनत्व बढ़ता है और वे व्यक्तिगत परमाणु ऑर्बिटल की तुलना में कम ऊर्जा के होते हैं। विरोधी बंधन ऑर्बिटल में नाभिकों के बीच इलेक्ट्रॉन घनत्व शून्य होता है और वे व्यक्तिगत परम ऑर्बिटल की तुलना में अधिक ऊर्जा के होते हैं।
मोलेक्यूल के इलेक्ट्रॉनिक विन्यास को ऊर्जा स्तर के बढ़ते क्रम में अणुओं के ऑर्बिटल में इलेक्ट्रॉनों को भरकर लिखा जाता है। परमाणुओं के मामले में जैसे, पॉली अपवर्जन सिद्धांत और हंड के नियम अणु ऑर्बिटल के भरने के लिए लागू होते हैं। एक अणु को स्थायी माना जाता है यदि बंधन अणु ऑर्बिटल में इलेक्ट्रॉनों की संख्या विरोधी बंधन अणु ऑर्बिटल में इलेकट्रॉनों की संख्या से अधिक हो।
जब हाइड्रोजन परमाणु दो अत्यधिक विद्युत ऋणात्मक परमाणुओं जैसे F, O और N के बीच स्थित होता है तो हाइड्रोजन बंध बनता है। यह अंतराणुक (एक या अधिक अणुओं के बीच जो एक ही या भिन्न पदार्थ हो सकते हैं) या अंतर्णुक (एक ही अणु में उपस्थित) हो सकता है। हाइड्रोजन बंध कई यौगिकों के संरचना और गुणों पर बहुत शक्तिशाली प्रभाव डालता है।
अभ्यास
4.1 रासायनिक आबंधन के निर्माण की व्याख्या करें।
उत्तर दिखाएं
उत्तर रासायनिक आबंधन एक आकर्षण बल है जो एक रासायनिक वस्तु में घटक (परमाणु, आयन आदि) को एक साथ बांधे रखता है।
रासायनिक आबंधन के निर्माण के लिए विभिन्न सिद्धांतों का प्रस्तावित किया गया है, जैसे इलेक्ट्रॉन सिद्धांत, वैलेंस शेल इलेक्ट्रॉन युग्म प्रतिकर्षण सिद्धांत, वैलेंस आबंध सिद्धांत और अणु ऑर्बिटल सिद्धांत।
रासायनिक आबंधन के निर्माण को एक प्रणाली के स्थायित्व के प्राप्त करने की प्रवृत्ति के कारण समझा जाता है। यह देखा गया कि नोबल गैसों की अक्रियता उनके बाहरी सबसे बाहरी कक्षा के पूर्ण भरे होने के कारण है। इसलिए, यह प्रस्तावित किया गया कि वे तत्व जिनके बाहरी सबसे बाहरी कक्षा अपूर्ण होते हैं, अस्थिर (अभिक्रियाशील) होते हैं। अतः, परमाणु एक दूसरे के साथ संयोजन करते हैं और अपने क्रमानुसार अष्टक या दुपल्ट को पूरा करके सबसे करीबी नोबल गैस के स्थायी संरचना के अनुरूप बन जाते हैं। यह संयोजन एक दूसरे के इलेक्ट्रॉन साझा करके या एक या एक से अधिक इलेक्ट्रॉन के एक परमाणु से दूसरे परमाणु में स्थानांतरित करके हो सकता है। परमाणुओं के बीच इलेक्ट्रॉन साझा करने के परिणामस्वरूप बने रासायनिक आबंध को सहसंयोजक आबंध कहते हैं। एक आयनिक आबंध एक अणु से दूसरे अणु में इलेक्ट्रॉन के स्थानांतरण के परिणामस्वरूज होता है।
4.2 निम्न तत्वों के परमाणुओं के लुईस डॉट संकेत लिखें : Mg, Na, B, O, N, Br.
उत्तर दिखाएं
उत्त र
Mg : Mg परमाणु में दो वैलेंस इलेक्ट्रॉन होते हैं। इसलिए, Mg के लुईस डॉट संकेत इस प्रकार होता है :
$ \hspace{5cm} \boldsymbol{\overset{\bullet \ \bullet}{ \ \ Mg}}$
Na : सोडियम परमाणु में केवल एक वैलेंस इलेक्ट्रॉन होता है। इसलिए, लुईस डॉट संरचना इस प्रकार होती है :
$ \hspace{5cm} \boldsymbol{\overset{\bullet}Na}$
B : बोरॉन परमाणु में तीन वैलेंस इलेक्ट्रॉन होते हैं। इसलिए, लुईस डॉट संरचना इस प्रकार होती है :
$ \hspace{5cm} {}^{\bullet}{\overset{\bullet\bullet}{B}}$
O : ऑक्सीजन परमाणु में छह वैलेंस इलेक्ट्रॉन होते हैं। इसलिए, लुईस डॉट संरचना इस प्रकार होती है :
$ \hspace{5cm} \overset{\bullet\bullet}{{}^\bullet_\bullet{\mathrm{ \ O \ }}^\bullet_\
N : नाइट्रोजन के परमाणु में पांच संयोजक इलेक्ट्रॉन होते हैं। इसलिए, लुईस डॉट संरचना निम्नलिखित होती है:
$ \hspace{5cm} \overset{\bullet\bullet}{{}^\bullet{\mathrm{ \ N \ }}^\bullet_\bullet}$
Br : ब्रोमीन में सात संयोजक इलेक्ट्रॉन होते हैं। इसलिए, लुईस डॉट संरचना निम्नलिखित होती है :
$ \hspace{5cm} \overset{\bullet\bullet}{{}^\bullet_\bullet{\mathrm{ \ Br \ }}^\bullet_\bullet}$
4.3 निम्नलिखित परमाणु और आयनों के लुईस संकेत लिखिए: $\mathrm{S}$ और $\mathrm{S}^{2-} ; \mathrm{Al}$ और $\mathrm{Al}^{3+} ; \mathrm{H}$ और $\mathrm{H}^{-}$
उत्तर दिखाएं
Answer
(i) $S$ और $S^{2}$
सल्फर में संयोजक इलेक्ट्रॉन की संख्या 6 होती है।
सल्फर $(S)$ के लुईस डॉट संकेत है $\hspace{0.5cm}$ $ \overset{\bullet\bullet}{{}^\bullet_\bullet{\mathrm{ \ Br \ }}^\bullet_\bullet}$
द्विऋणात्मक आवेश यह बताता है कि छह संयोजक इलेक्ट्रॉन के अतिरिक्त दो इलेक्ट्रॉन भी होंगे। इसलिए, $S^{2 \cdot}$ के लुईस डॉट संकेत है

(ii) $Al$ और $Al^{3+}$
एल्यूमिनियम में संयोजक इलेक्ट्रॉन की संख्या 3 होती है।
एल्यूमिनियम $(Al)$ के लुईस डॉट संकेत है $ \hspace{0.5cm} {}^{\bullet}{\overset{\bullet\bullet}{Al}}$
एक त्रिधनात्मक आवेश एक वस्तु पर यह बताता है कि इसने अपने तीन इलेक्ट्रॉन दान कर दिए हैं। इसलिए, लुईस डॉट संकेत $[Al]^{3+}$ होता है।
(iii) $H$ और $H$
हाइड्रोजन में संयोजक इलेक्ट्रॉन की संख्या 1 होती है।
हाइड्रोजन $(H)$ के लुईस डॉट संकेत है $ \hspace{0.5cm} \boldsymbol{\overset{\bullet}H}$
एक ऋणात्मक आवेश यह बताता है कि एक संयोजक इलेक्ट्रॉन के अतिरिक्त एक इलेक्ट्रॉन भी होगा। इसलिए, लुईस डॉट संकेत $ \hspace{0.5cm} \big[\boldsymbol{\overset{\bullet \ \bullet}{ \ H}} \ \big]^-$ होता है।
4.4 निम्नलिखित अणु और आयनों के लुईस संरचना बनाइए:
$\mathrm{H}_2 \mathrm{S}, \mathrm{SiCl}_4, \mathrm{BeF}_2, \mathrm{CO}_3^{2-}$, $\mathrm{HCOOH}$
उत्तर दिखाएं
उत्तर
$H_2S$
$SiCl_4$
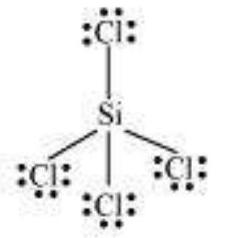
$BeF_2$
$ \overset{ \ \ \bullet \ \bullet}{^\bullet_\bullet\underset{\bullet \ \bullet}{{F}}}{\LARGE{\boldsymbol{-}}}{Be}{\LARGE{\boldsymbol{-}}} \underset{\bullet \ \bullet \ \ \ }{\overset{\bullet \ \bullet \ \ }{F{ \ }^\bullet_\bullet}} $
$CO_3^{2-}$

4.5 आठ-इलेक्ट्रॉन नियम को परिभाषित करें। इसके महत्व और सीमाएं लिखें।
उत्तर दिखाएं
उत्तर
आठ-इलेक्ट्रॉन नियम या रासायनिक बंधन के इलेक्ट्रॉनिक सिद्धांत को कोसल और लुईस द्वारा विकसित किया गया था। इस नियम के अनुसार, परमाणु एक दूसरे के वैलेंस इलेक्ट्रॉन के स्थानांतरण या उनके वैलेंस इलेक्ट्रॉन के साझा करके सबसे करीबी नोबल गैस विन्यास प्राप्त करने के लिए आठ इलेक्ट्रॉन वाले अपने वैलेंस शेल में आ जाते हैं।
आठ-इलेक्ट्रॉन नियम ने तत्व की प्रकृति पर आधारित रासायनिक बंधन के निर्माण को सफलतापूर्वक समझाया है।
आठ-इलेक्ट्रॉन सिद्धांत की सीमाएं:
आठ-इलेक्ट्रॉन नियम की निम्नलिखित सीमाएं हैं:
(a) नियम अणु के आकार और संबंधित स्थायित्व की भविष्यवाणी नहीं कर सकता।
(b) यह स्पष्ट है कि आठ-इलेक्ट्रॉन नियम नोबल गैसों की रासायनिक अक्रियता पर आधारित है। हालांकि, कुछ नोबल गैस (उदाहरण के लिए एक्ज़ेनॉन और क्रिप्टॉन) ऑक्सीजन और फ्लूओरीन के साथ संयोजित होकर जैसे $\mathrm{XeF}_2, \mathrm{KrF}_2, \mathrm{XeOF}_2$ आदि अनेक यौगिक बनाते हैं।
(c) आवर्त सारणी के तीसरे आवर्त और उससे आगे के तत्वों में, अलावा $3 s$ और $3 p$ कक्षकों के बाहर, $3 d$ कक्षक भी बंधन के लिए उपलब्ध होते हैं। इन तत्वों के कई यौगिकों में केंद्रीय परमाणु के आसपास आठ से अधिक आबंधन इलेक्ट्रॉन होते हैं। इसे विस्तारित आठ इलेक्ट्रॉन कहा जाता है। स्पष्ट रूप से ऐसे मामलों में आठ इलेक्ट्रॉन के नियम काम नहीं करता है।
ऐसे यौगिकों के कुछ उदाहरण हैं: $\mathrm{PF}_5, \mathrm{SF}_6, \mathrm{H}_2 \mathrm{SO}_4$ और कई समन्वय यौगिक।

(d) इलेक्ट्रॉन की विषम संख्या वाले अणुओं में, जैसे नाइट्रिक ऑक्साइड, NO और नाइट्रोजन डाइऑक्साइड, $\mathrm{NO}_2$, सभी परमाणुओं में आठ इलेक्ट्रॉन के नियम की पूर्ति नहीं होती है।

(e) कुछ यौगिकों में केंद्रीय परमाणु के आसपास इलेक्ट्रॉन की संख्या आठ से कम होती है। यह विशेष रूप से वह तत्व होते हैं जिनके आठ से कम आबंधन इलेक्ट्रॉन होते हैं। उदाहरण हैं $\mathrm{LiCl}, \mathrm{BeH}_2$ और $\mathrm{BCl}_3$।

Li, Be और B केवल 1, 2 और 3 आबंधन इलेक्ट्रॉन होते हैं। कुछ अन्य ऐसे यौगिक हैं $\mathrm{AlCl}_3$ और $\mathrm{BF}_3$।
4.6 आयनिक आबंधन के निर्माण के अनुकूल कारक लिखिए।
उत्तर दिखाएं
उत्तर
एक आयनिक आबंध एक या अधिक इलेक्ट्रॉन के स्थानांतरण के कारण बनता है। इसलिए, आयनिक आबंध के निर्माण पर उदासीन परमाणुओं के इलेक्ट्रॉन खोने या लेने की आसानी पर निर्भर करता है। आबंध के निर्माण पर बने यौगिक की लेटिस ऊर्जा भी प्रभाव डालती है।
इसलिए, आयनिक आबंध के निर्माण के अनुकूल कारक निम्नलिखित हैं:
(i) धातु परमाणु की कम आयनन एन्थैल्पी।
(ii) अधातु परमाणु की उच्च इलेक्ट्रॉन ग्रहण एन्थैल्पी $(\Delta _{e g} H)$।
(iii) बने हुए यौगिक की उच्च लैटिस ऊर्जा।
4.7 VSEPR मॉडल के आधार पर निम्नलिखित अणुओं के आकार की चर्चा कीजिए :
$\mathrm{BeCl}_2, \mathrm{BCl}_3, \mathrm{SiCl}_4, \mathrm{AsF}_5, \mathrm{H}_2 \mathrm{~S}, \mathrm{PH}_3$
उत्तर दिखाएं
उत्तर
${BeCl_2}$
केंद्रीय परमाणु में कोई अकेला युग्म नहीं है और दो आबंध युग्म हैं। अर्थात, $BeCl_2$ के प्रकार $AB_2$ है। इसलिए, इसका आकार सीधा है।
$Cl: Be: Cl$
$BCl_3$
केंद्रीय परमाणु में कोई अकेला युग्म नहीं है और तीन आबंध युग्म हैं। इसलिए, इसके प्रकार $AB_3$ है। इसलिए, इसका आकार त्रिकोणीय समतलीय है।
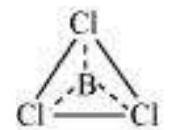
${SiCl_4}$
केंद्रीय परमाणु में कोई अकेला युग्म नहीं है और चार आबंध युग्म हैं। इसलिए, $SiCl_4$ का आकार चतुष्कोणीय है जो $AB_4$ प्रकार के अणु होते हैं।
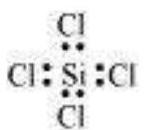
$\mathrm{AsF}_5$
केंद्रीय परमाणु में कोई अकेला युग्म नहीं है और पांच आबंध युग्म हैं। इसलिए, $AsF_5$ के प्रकार $AB_5$ है। इसलिए, इसका आकार त्रिकोणीय बिपिरामिडल है।
$H_2 S$ :
केंद्रीय परमाणु में एक अकेला युग्म है और दो आबंध युग्म हैं। इसलिए, $H_2 S$ के प्रकार $AB_2 E$ है। आकार घुमावदार है।
н: $\ddot{s}: H$
$PH_3:$
केंद्रीय परमाणु में एक अकेला युग्म है और तीन आबंध युग्म हैं। इसलिए, $PH_3$ के प्रकार $AB_3 E$ है। इसलिए, इसका आकार त्रिकोणीय पिरामिडल है।
$H: \underset{H}{\ddot{P}}: H$
4.8 हालांकि $\mathrm{NH}_3$ और $\mathrm{H}_2 \mathrm{O}$ अणुओं के आकार विकृत चतुष्कोणीय हैं, पानी के बंधन कोण अमोनिया के बंधन कोण से कम है। चर्चा कीजिए।
उत्तर दिखाएं
उत्तर
$NH_3$ और $H_2 O$ के आणविक आकृति को दिखाया जा सकता है:

$NH_3$ में केंद्रीय परमाणु $(N)$ एक अकेला युग्म और तीन आबंध युग्म होता है। $H_2 O$ में दो अकेले युग्म और दो आबंध युग्म होते हैं।
$H_2 O$ अणु के ऑक्सीजन परमाणु में दो अकेले युग्म उपस्थित होते हैं जो दो आबंध युग्म को प्रतिकर्षित करते हैं। इस प्रतिकर्षण के बीच बल नाइट्रोजन परमाणु पर एक अकेला युग्म और तीन आबंध युग्म के बीच प्रतिकर्षण की तुलना में अधिक होता है।
क्योंकि $H_2 O$ अणु में आबंध युग्मों पर प्रतिकर्षण $NH_3$ में आबंध युग्मों पर प्रतिकर्षण की तुलना में अधिक होता है, तो पानी के आबंध कोण अमोनिया के आबंध कोण से कम होता है।
4.9 आबंध शक्ति को आबंध क्रम के रूप में कैसे व्यक्त करते हैं?
उत्तर दिखाएं
उत्तर
आबंध शक्ति दो परमाणुओं के बीच आबंधन के बारे में बताती है। आबंध ऊर्जा जितनी अधिक होती है, आबंध उतना मजबूत होता है और आबंध क्रम उतना अधिक होता है।
4.10 आबंध लंबाई को कैसे परिभाषित करते हैं?
उत्तर दिखाएं
उत्तर
आबंध लंबाई को एक अणु में दो आबंधित परमाणुओं के नाभिकों के बीच संतुलित दूरी के रूप में परिभाषित किया जाता है। आबंध लंबाई को उच्च श्रेणी के विद्यार्थियों के लिए आप अधिक जानकारी प्राप्त करेंगे जैसे स्पेक्ट्रोस्कोपी, X-किरण विवर्जन और इलेक्ट्रॉन-विवर्जन तकनीकों द्वारा मापा जाता है। प्रत्येक आबंधित युग्म के परमाणु आबंध लंबाई में योगदान देते हैं। सहसंयोजक आबंध के मामले में, प्रत्येक परमाणु के योगदान को उस परमाणु की सहसंयोजक त्रिज्या के रूप में जाना जाता है।

$R=r_A+r_B\left(R\right.$ आबंध लंबाई है और $r_A$ और $r_B$ परमाणु $A$ और $B$ की सहसंयोजक त्रिज्या हैं)
4.11 $\mathrm{CO}_{3}^{2-}$ आयन के संदर्भ में आवर्तन के महत्वपूर्ण पहलू को समझाइए।
उत्तर दिखाएँ
उत्तर
कार्बन और ऑक्सीजन परमाणुओं के बीच दो एकल बंध और एक द्विबंध की उपस्थिति के आधार पर एकल लुईस संरचना अणु को ठीक तरीके से प्रतिनिधित्व नहीं कर सकती क्योंकि यह असमान बंधों को प्रस्तुत करती है। प्रयोगात्मक खोज के अनुसार, $\mathrm{CO}_3^{2-}$ में सभी कार्बन और ऑक्सीजन बंध समान होते हैं। इसलिए कार्बोनेट आयन को नीचे दिखाए गए मानक रूपों के रेजोनेंस मिश्रण के रूप में सर्वोत्तम रूप से वर्णित किया जा सकता है।
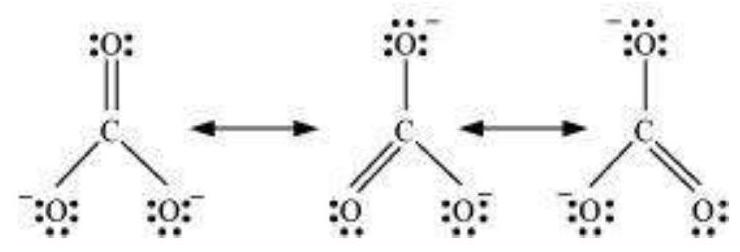
4.12 $ \mathrm{H}_3 \mathrm{PO}_3$ को नीचे दिखाए गए संरचनाओं 1 और 2 द्वारा प्रस्तुत किया जा सकता है। क्या ये दोनों संरचनाएँ $ \mathrm{H}_3 \mathrm{PO}_3$ के रेजोनेंस मिश्रण के मानक रूपों के रूप में ली जा सकती हैं? यदि नहीं, तो इसके लिए कारण दीजिए।

उत्तर दिखाएँ
उत्तर
दी गई संरचनाएँ $H_3 PO_3$ के रेजोनेंस मिश्रण के मानक रूपों के रूप में ली जा सकती हैं क्योंकि परमाणुओं के स्थान बदल गए हैं।
4.13 $\mathrm{SO}_3, \mathrm{NO}_2$ और $\mathrm{NO}_3^{-}$ के रेजोनेंस संरचनाएँ लिखिए।
उत्तर दिखाएँ
उत्तर
रेजोनेंस संरचनाएँ निम्नलिखित हैं:
(a) $SO_3$ :
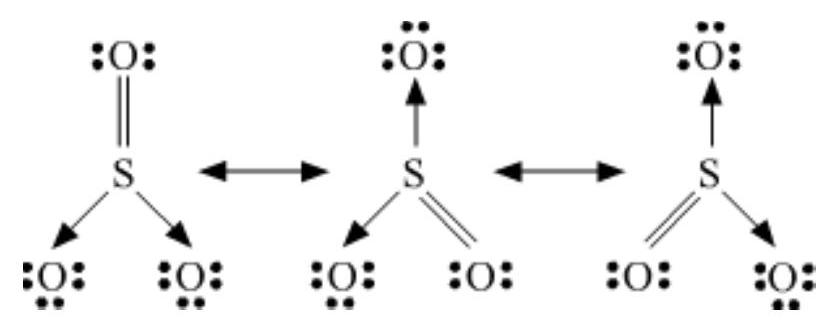
(b) $NO_2$ :
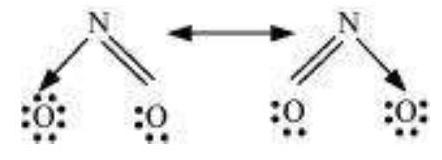
(c) $NO_3^{-}$:
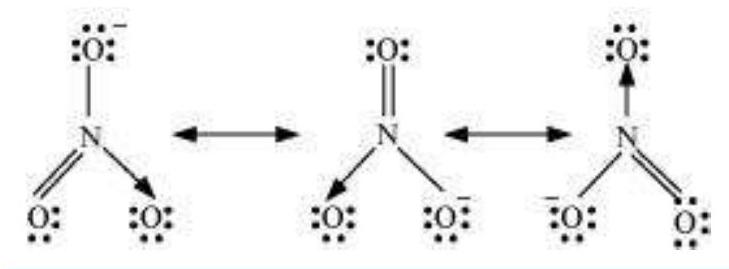
4.14 निम्नलिखित परमाणुओं के बीच इलेक्ट्रॉन परिवहन को लेविस संकेतों के माध्यम से दिखाइए जिससे आयन बने : (a) $\mathrm{K}$ और $\mathrm{S}$ (b) $\mathrm{Ca}$ और $\mathrm{O}$ (c) $\mathrm{Al}$ और $\mathrm{N}$.
उत्तर दिखाएं
उत्तर
(a) $K$ और $S$ -
$K$ और $S$ के इलेक्ट्रॉनिक विन्यास निम्नलिखित हैं:
$K : 2, 8, 8, 1$
$S : 2,8,6$
सल्फर (S) अपने अष्टक को पूरा करने के लिए 2 अतिरिक्त इलेक्ट्रॉन चाहता है। पोटेशियम (K) के लिए निकटतम नोबल गैस (आर्गन) के बराबर एक इलेक्ट्रॉन अधिक आवश्यक है। इसलिए, इलेक्ट्रॉन परिवहन को निम्नलिखित तरीके से दिखाया जा सकता है:

(b) Ca और O -
$Ca$ और $O$ के इलेक्ट्रॉनिक विन्यास निम्नलिखित हैं :
$Ca : 2,8,8,2$
$O : 2,6$
ऑक्सीजन के लिए अष्टक को पूरा करने के लिए दो अतिरिक्त इलेक्ट्रॉन आवश्यक हैं, जबकि कैल्शियम के लिए निकटतम नोबल गैस (आर्गन) के बराबर दो इलेक्ट्रॉन अधिक हैं। इसलिए, इलेक्ट्रॉन परिवहन निम्नलिखित तरीके से होता है:

(c) Al और $N$ :
$Al$ और $N$ के इलेक्ट्रॉनिक विन्यास निम्नलिखित हैं:
$Al : 2, 8, 3$
$N : 2,5$
नाइट्रोजन के लिए निकटतम नोबल गैस (नीऑन) के बराबर तीन इलेक्ट्रॉन कम हैं, जबकि एल्यूमीनियम के लिए नीऑन के बराबर तीन इलेक्ट्रॉन अधिक हैं। इसलिए, इलेक्ट्रॉन परिवहन को निम्नलिखित तरीके से दिखाया जा सकता है:

4.15 हालांकि, $\mathrm{CO}_2$ और $\mathrm{H}_2 \mathrm{O}$ दोनों त्रि-परमाणुक अणु हैं, लेकिन $\mathrm{H}_2 \mathrm{O}$ अणु के आकार घुमावदार होता है जबकि $\mathrm{CO}_2$ के आकार सीधा होता है। इसे विद्युत द्विध्रुव आघूर्ण के आधार पर समझाइए।
उत्तर दिखाएं
उत्तर
प्रयोगात्मक परिणामों के अनुसार, कार्बन डाइऑक्साइड के द्विध्रुव आघूर्ण शून्य है। यह संभव हो सकता है केवल तभी जब अणु सीधा हो ताकि $C-O$ बंधों के द्विध्रुव आघूर्ण बराबर और विपरीत हों जिससे एक दूसरे को निरस्त कर दें।

परिणामी $\mu=0$ D
दूसरी ओर, $H_2 O$ के द्विध्रुव आघूर्ण का मान $1.84 \hspace{0.8mm} D$ है (हालांकि यह एक त्रि-परमाणुक अणु है जैसे $CO_2$)। द्विध्रुव आघूर्ण के मान से यह सुझाव देता है कि $H_2 O$ अणु की संरचना घुमावदार है जहां $O-H$ बंधों के द्विध्रुव आघूर्ण असमान हैं।

4.16 द्विध्रुव आघूर्ण के महत्व/उपयोगों को लिखिए।
उत्तर दिखाएं
उत्तर
असमान परमाणु अणुओं में, परमाणुओं के विद्युत ऋणात्मकता में अंतर के कारण विद्युत ध्रुवता उत्पन्न होती है। इसके परिणामस्वरूप, अणु के एक सिरे पर धनात्मक आवेश और दूसरे सिरे पर ऋणात्मक आवेश लग जाता है। इसलिए, एक अणु को द्विध्रुव कहा जाता है।
आवेश के मान और धनात्मक-ऋणात्मक आवेश के केंद्रों के बीच दूरी के गुणनफल को अणु के द्विध्रुव आघूर्ण $ \mu $ कहते हैं।
द्विध्रुव आघूर्ण $(\mu)=$ आवेश $(Q) \times$ अलग-अलग आवेश केंद्रों के बीच दूरी $(r)$
इसके अतिरिक्त, द्विध्रुव आघूर्ण के चिह्न और दिशा के बारे में अधिक जानकारी देता है। इसके परिपाटी अनुसार, यह एक तीर द्वारा प्रदर्शित किया जाता है जिसका खोल धनात्मक सिरे पर होता है और छोटा ऋणात्मक सिरे पर होता है। उदाहरण के लिए, HF को इस प्रकार दर्शाया जा सकता है:

इस तीर का चिह्न अणु में इलेक्ट्रॉन घनत्व के विस्थापन की दिशा को दर्शाता है। ध्यान दें कि घुमावदार तीर की दिशा आम द्विध्रुव आघूर्ण सदिश की दिशा के विपरीत होती है।
4.17 विद्युत ऋणात्मकता को परिभाषित करें। यह इलेक्ट्रॉन ग्रहण py से कैसे भिन्न है?
उत्तर दिखाएं
उत्तर
विद्युत ऋणात्मकता एक रासायनिक यौगिक में एक परमाणु के आकर्षण क्षमता को कहते हैं जो बंधन युग्म इलेक्ट्रॉन को अपने केंद्र की ओर आकर्षित करता है।
किसी भी तत्व की विद्युत ऋणात्मकता निरंतर नहीं होती। यह उस तत्व के साथ जिससे यह बंधे होने पर बदलती रहती है। यह एक माप्य राशि नहीं है। यह केवल एक संबंधित संख्या है।
दूसरी ओर, इलेक्ट्रॉन ग्रहण py एक उदासीन गैसीय परमाणु में एक इलेक्ट्रॉन के जोड़ने से एक ऋणायन के निर्माण के दौरान होने वाले enthalpy परिवर्तन को कहते हैं। यह इलेक्ट्रॉन के जोड़े या हटाए जाने पर नकारात्मक या धनात्मक हो सकता है। एक तत्व के इलेक्ट्रॉन ग्रहण py का मान निरंतर होता है जिसे प्रयोगशाला में मापा जा सकता है।
4.18 उपयुक्त उदाहरण के साथ ध्रुवीय सहसंयोजक बंध को समझाइए।
उत्तर दिखाएं
उत्तर
जब दो असमान परमाणु जो विद्युत ऋणात्मकता में अलग होते हैं, सहसंयोजक बंध बनाते हैं, तो बंधन युग्म इलेक्ट्रॉन के समान बाँटे जाने के बजाय बराबर बाँटे जाने के लिए नहीं होते। बंधन युग्म उस परमाणु के नाभिक की ओर विस्थापित हो जाते हैं जो अधिक विद्युत ऋणात्मकता रखता है। इस प्रकार, इलेक्ट्रॉन वितरण विकृत हो जाता है और इलेक्ट्रॉन बादल विद्युत ऋणात्मक परमाणु की ओर विस्थापित हो जाता है।
इस कारण, विद्युत ऋणात्मक परमाणु थोड़ा ऋणावेशित हो जाता है जबकि दूसरा परमाणु थोड़ा धनावेशित हो जाता है। इस प्रकार, अणु में विपरीत ध्रुव विकसित हो जाते हैं और इस प्रकार के बंध को ध्रुवीय सहसंयोजक बंध कहते हैं।
उदाहरण के लिए, $HCl$ में एक ध्रुवीय सहसंयोजक बंध होता है। क्लोरीन परमाणु हाइड्रोजन परमाणु की तुलना में अधिक विद्युत ऋणात्मकता रखता है। इसलिए, बंधन युग्म क्लोरीन की ओर होता है और इसलिए, यह आंशिक ऋणावेश ले लेता है।
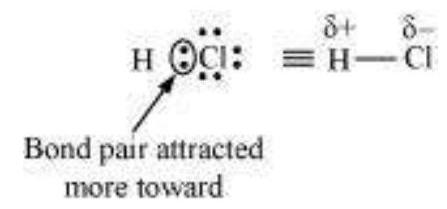
4.19 अणुओं $\mathrm{LiF}, \mathrm{K}_2 \mathrm{O}$, $\mathrm{N}_2, \mathrm{SO}_2$ और $\mathrm{ClF}_3$ में आयनिक चारित्र के बढ़ते क्रम में बंधों को व्यवस्थित करें।
उत्तर दिखाएँ
उत्तर
एक अणु में आयनिक चरित्र उसके बनाने वाले परमाणुओं के विद्युत ऋणात्मकता के अंतर पर निर्भर करता है। अंतर जितना अधिक होगा, अणु के आयनिक चरित्र उतना ही अधिक होगा।
इस आधार पर, दिए गए अणुओं में आयनिक चरित्र के बढ़ते क्रम के अनुसार है:
$N_2 < SO_2 < ClF_3 < K_2 O < LiF $।
4.20 $\mathrm{CH}_{3} \mathrm{COOH}$ की संरचना नीचे दी गई है, जो सही है, लेकिन कुछ बंधन गलत दिखाए गए हैं। सही लेविस संरचना लिखिए।

उत्तर दिखाएँ
उत्तर
एसिटिक अम्ल की सही लेविस संरचना निम्नलिखित है :

4.21 $\mathrm{CH_4}$ के अलावा टेट्राहेड्रल ज्योति के अतिरिक्त, एक अन्य संभावित ज्योति वर्गीय तलीय हो सकती है जिसमें चार $\mathrm{H}$ परमाणु वर्ग के कोनों पर और $\mathrm{C}$ परमाणु इसके केंद्र पर होता है। कारण बताइए कि $\mathrm{CH_4}$ वर्गीय तलीय नहीं हो सकता?
उत्तर दिखाएँ
उत्तर
कार्बन परमाणु की इलेक्ट्रॉनिक विन्यास :
$ _6 C: 1 s^{2} 2 s^{2} 2 p^{2}$
उत्तेजित अवस्था में, कार्बन के ऑर्बिटल चित्र इस प्रकार दर्शाया जा सकता है :
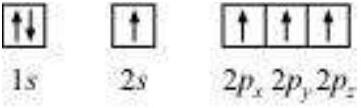
अतः, $CH_4$ अणु में कार्बन परमाणु $s p^{3}$ हाइब्रिडाइजेशन अवस्था में होता है और टेट्राहेड्रल आकृति ले लेता है।
वर्गीय तलीय आकृति के लिए, केंद्रीय परमाणु के हाइब्रिडाइजेशन $d s p^{2}$ होना आवश्यक होता है। हालांकि, कार्बन परमाणु में $d$-ऑर्बिटल नहीं होते हैं जिसके कारण $d s p^{2}$ हाइब्रिडाइजेशन नहीं हो सकता। अतः, $CH_4$ की संरचना वर्गीय तलीय नहीं हो सकती।
अतिरिक्त, वर्गीय समतल में $90^{\circ}$ के कोण के कारण $CH_4$ की स्थायित्व बहुत कम होगी क्योंकि बंधन युग्मों के बीच प्रतिकर्षण उपस्थित होता है। अतः, VSEPR सिद्धांत भी $CH_4$ के टेट्राहेड्रल संरचना को समर्थन देता है।
4.22 स्पष्ट करें कि $\mathrm{BeH_2}$ अणु के द्विध्रुव आघूर्ण शून्य होता है भले ही $\mathrm{Be}-\mathrm{H}$ बंध ध्रुवीय हों।
उत्तर दिखाएं
उत्तर
$\mathrm{BeH_2}$ के Lewis संरचना निम्नलिखित है:
$H: Be: H$
केंद्रीय परमाणु (Be) पर कोई अकेला युग्म नहीं होता और दो बंधन युग्म होते हैं। अतः, $\mathrm{BeH_2}$ के प्रकार $AB_2$ होता है। इसकी संरचना सीधी होती है।

प्रत्येक $H-Be$ बंध के द्विध्रुव आघूर्ण समान होते हैं और विपरीत दिशा में होते हैं। अतः, वे एक दूसरे को निरस्त कर देते हैं। अतः, $\mathrm{BeH_2}$ अणु के द्विध्रुव आघूर्ण शून्य होता है।
4.23 $\mathrm{NH_3}$ और $\mathrm{NF_3}$ में से कौन सा अधिक द्विध्रुव आघूर्ण रखता है और क्यों?
उत्तर दिखाएं
उत्तर
हम $\mathrm{NH}_3$ और $\mathrm{NF}_3$ अणु के एक रोचक मामले के बारे में अध्ययन करते हैं। दोनों अणुओं में नाइट्रोजन परमाणु पर एक अकेला इलेक्ट्रॉन युग्म होता है और इनकी आकृति पिरामिडी होती है। फ्लूओरीन नाइट्रोजन की तुलना में अधिक विद्युत ऋणात्मक होता है, लेकिन $\mathrm{NH_3}$ के द्विध्रुव आघूर्ण $\mathrm{NH}_3\left(4.90 \times 10^{-30} \mathrm{C} \mathrm{m}\right)$ वह ज्यादा होता है जो $\mathrm{NF}_3\left(0.8 \times 10^{-30} \mathrm{C} \mathrm{m}\right)$ के द्विध्रुव आघूर्ण की तुलना में। इसका कारण यह है कि $\mathrm{NH_3}$ के मामले में अकेले इलेक्ट्रॉन युग्म के कारण आवर्त द्विध्रुव के द्विध्रुव आघूर्ण की दिशा एक ही होती है जो $\mathrm{N}-\mathrm{H}$ बंध के परिणामी द्विध्रुव आघूर्ण की दिशा के समान होती है, जबकि $\mathrm{NF}_3$ के मामले में आवर्त द्विध्रुव की दिशा तीन $\mathrm{N}-\mathrm{F}$ बंध के परिणामी द्विध्रुव आघूर्ण की दिशा के विपरीत होती है। अकेले इलेक्ट्रॉन युग्म के कारण आवर्त द्विध्रुव तीन $\mathrm{N}-\mathrm{F}$ बंध के परिणामी द्विध्रुव आघूर्ण के प्रभाव को कम कर देता है, जिसके कारण $\mathrm{NF}_3$ के निम्न द्विध्रुव आघूर्ण होता है जैसा कि नीचे दर्शाया गया है :

इसलिए, $NF_3$ के नेट डायपोल आघूर्ण $NH_3$ के आघूर्ण के कम होता है।
4.24 परमाणु कक्षकों के हाइब्रिडाइजेशन के अर्थ क्या है? $s p, s p^{2}$, $s p^{3}$ हाइब्रिड कक्षकों के आकार का वर्णन करें।
उत्तर दिखाएं
उत्तर
हाइब्रिडाइजेशन को एक सेट के परमाणु कक्षकों के बीच थोड़े अलग ऊर्जा वाले कक्षकों के मिश्रण के रूप में परिभाषित किया जाता है, जिससे एक नए सेट के कक्षकों का निर्माण होता है जो समान ऊर्जा और आकार वाले होते हैं।
उदाहरण के लिए, कार्बन के दो $2 p$-कक्षक एक $2 s$-कक्षक के साथ हाइब्रिडाइजेशन करते हैं जिससे तीन नए $s p^{2}$ हाइब्रिड कक्षक बनते हैं।
इन हाइब्रिड कक्षकों में इलेक्ट्रॉन युग्मों के बीच न्यूनतम प्रतिकर्षण होता है और इसलिए वे अधिक स्थायी होते हैं। हाइब्रिडाइजेशन अणु के ज्यामिति को सूचित करता है।
$s p$ हाइब्रिड कक्षकों के आकार: $s p$ हाइब्रिड कक्षक एक रेखीय आकार रखते हैं। वे $s$ और $p$ कक्षकों के मिश्रण के रूप में बनते हैं जैसा कि नीचे दिखाया गया है:

$s p$-हाइब्रिड
$s p^{2}$ हाइब्रिड कक्षकों के आकार:
$s p^{2}$ हाइब्रिड कक्षक एक $s$-कक्षक और दो $2 p$-कक्षकों के मिश्रण के रूप में बनते हैं। हाइब्रिड कक्षक त्रिकोणीय समतलीय व्यवस्था में व्यवस्थित होते हैं जैसा कि नीचे दिखाया गया है:

$s p^{3}$ हाइब्रिड कक्षकों के आकार:
चार $s p^{3}$ हाइब्रिड कक्षक एक $s$-कक्षक और तीन $p$-कक्षकों के मिश्रण के रूप में बनते हैं। चार $s p^{3}$ हाइब्रिड कक्षक टेट्राहेड्रल व्यवस्था में व्यवस्थित होते हैं जैसा कि नीचे दिखाया गया है:
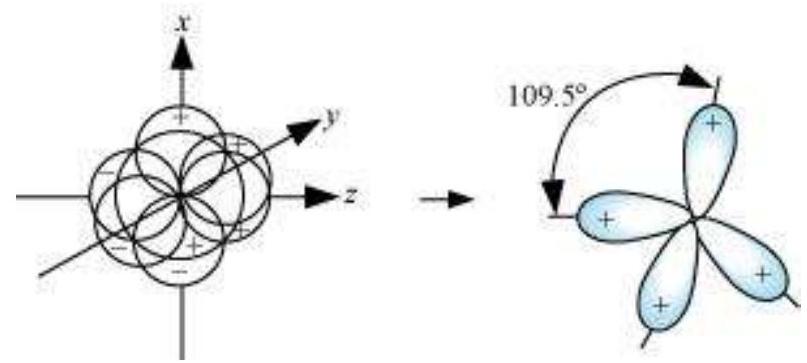
4.25 अगले अभिक्रिया में ऐलुमिनियम (Al) परमाणु के हाइब्रिडाइजेशन में कोई परिवर्तन (यदि हो तो) बताइए।
$\mathrm{AlCl_3}+\mathrm{Cl}^{-} \rightarrow \mathrm{AlCl_4}^{-}$
उत्तर दिखाएं
उत्तर
$AlCl_4^{-}$ के निर्माण के लिए, खाली $3 p_z$ ऑर्बिटल भी शामिल हो जाता है और हाइब्रिडाइजेशन $s p^{2}$ से $s p^{3}$ में परिवर्तित हो जाता है। इसके परिणामस्वरूप, आकृति चतुष्फलकीय बन जाती है।

4.26 निम्नलिखित अभिक्रिया के परिणामस्वरूप $\mathrm{B}$ और $\mathrm{N}$ परमाणु के हाइब्रिडाइजेशन में कोई परिवर्तन होता है या नहीं?
$\mathrm{BF_3}+\mathrm{NH_3} \rightarrow \mathrm{F_3} \mathrm{B} - \mathrm{NH_3}$
उत्तर दिखाएं
उत्तर
$\mathrm{BF}_3$ में, $\mathrm{~B}$ $s p^2$ हाइब्रिडिज़ किया गया है और $\mathrm{NH}_3$ में, $\mathrm{~N}$ $s p^3$ हाइब्रिडिज़ किया गया है। अभिक्रिया के बाद, $B$ के हाइब्रिडाइजेशन $s p^3$ में परिवर्तित हो जाता है लेकिन $N$ के हाइब्रिडाइजेशन में कोई परिवर्तन नहीं होता।
4.27 $\mathrm{C_2} \mathrm{H_4}$ और $\mathrm{C_2} \mathrm{H_2}$ अणुओं में कार्बन परमाणुओं के बीच डबल बॉन्ड और ट्रिपल बॉन्ड के निर्माण को दिखाने वाले चित्र बनाइए।
उत्तर दिखाएं
उत्तर
$ C_2 H_4$ :
ईथीन अणु के निर्माण में, एक कार्बन परमाणु के $s p^2$ हाइब्रिड ऑर्बिटल दूसरे कार्बन परमाणु के $s p^2$ हाइब्रिड ऑर्बिटल के साथ अक्षीय अधिरोपण करते हैं ताकि $\mathrm{C}-\mathrm{C}$ सिग्मा बॉन्ड बन जाए। जबकि प्रत्येक कार्बन परमाणु के अन्य दो $s p^2$ हाइब्रिड ऑर्बिटल दो हाइड्रोजन परमाणुओं के साथ $s p^2-s$ सिग्मा बॉन्ड बनाने के लिए उपयोग किए जाते हैं। एक कार्बन परमाणु के अनुहाइब्रिडिज़ ऑर्बिटल $\left(2 p_x\right.$ या $2 p_y$ ) दूसरे कार्बन परमाणु के समान ऑर्बिटल के साथ ओर्थोगोनल अधिरोपण करते हैं ताकि एक कमजोर $\pi$ बॉन्ड बन जाए, जो कार्बन और हाइड्रोजन परमाणुओं के तल के ऊपर और नीचे वितरित दो समान इलेक्ट्रॉन बादलों से बना होता है।

$ C_2 H_2$ :
एथिन मॉलेक्यूल के निर्माण में, दोनों कार्बन परमाणु $s p$-हाइब्रिडीकरण करते हैं जिनके दो अहाइब्रिड ऑर्बिटल होते हैं अर्थात, $2 p_y$ और $2 p_{\mathrm{x}}$।
एक कार्बन परमाणु के एक $s p$ हाइब्रिड ऑर्बिटल दूसरे कार्बन परमाणु के $s p$ हाइब्रिड ऑर्बिटल के अक्षीय अधिच्छेदन से $\mathrm{C}-\mathrm{C}$ सिग्मा बंध बनता है, जबकि प्रत्येक कार्बन परमाणु के अन्य हाइब्रिड ऑर्बिटल अपने अपने हाइड्रोजन परमाणु के आंशिक भरे $s$ ऑर्बिटल के अक्षीय अधिच्छेदन से $\sigma$ बंध बनाते हैं। दोनों कार्बन परमाणुओं के दो अहाइब्रिड $p$ ऑर्बिटल एक दूसरे के ओर ओर ओर अधिच्छेदन करके कार्बन परमाणुओं के बीच दो $\pi$ बंध बनाते हैं। इस प्रकार दोनों कार्बन परमाणुओं के बीच त्रिबंध एक सिग्मा और दो पाई बंधों से बना होता है जैसा कि चित्र में दिखाया गया है।

4.28 निम्नलिखित अणुओं में सिग्मा और पाई बंधों की कुल संख्या क्या है?
(a) $\mathrm{C_2} \mathrm{H_2}$ (b) $\mathrm{C_2} \mathrm{H_4}$
उत्तर दिखाएं
Answer
(a) $\mathrm{C_2} \mathrm{H_2}$
एक कार्बन परमाणु के एक $s p$ हाइब्रिड ऑर्बिटल दूसरे कार्बन परमाणु के $s p$ हाइब्रिड ऑर्बिटल के अक्षीय अधिच्छेदन से $\mathrm{C}-\mathrm{C}$ सिग्मा बंध बनता है, जबकि प्रत्येक कार्बन परमाणु के अन्य हाइब्रिड ऑर्बिटल अपने अपने हाइड्रोजन परमाणु के आंशिक भरे $s$ ऑर्बिटल के अक्षीय अधिच्छेदन से $\sigma$ बंध बनाते हैं। दोनों कार्बन परमाणुओं के दो अहाइब्रिड $p$ ऑर्बिटल एक दूसरे के ओर ओर ओर अधिच्छेदन करके कार्बन परमाणुओं के बीच दो $\pi$ बंध बनाते हैं। इस प्रकार दोनों कार्बन परमाणुओं के बीच त्रिबंध एक सिग्मा और दो पाई बंधों से बना होता है जैसा कि चित्र में दिखाया गया है।

इसलिए, $C_2 H_2$ में तीन सिग्मा और दो पाई बंध होते हैं।
(b) $\mathrm{C_2} \mathrm{H_4}$
इसलिए, एथीन अणु में, कार्बन-कार्बन बंध एक $s p^2-s p^2$ सिग्मा बंध और एक पाई ( $\pi$ ) बंध से बना होता है जो $p$ कक्षकों से बनता है जो हाइब्रिडाइजेशन में नहीं उपयोग किए जाते हैं और अणु के तल के लंबवत होते हैं; बंध लंबाई 134 pm होती है। एक $\mathrm{C}-\mathrm{H}$ बंध $s p^2-s$ सिग्मा बंध होता है जिसकी बंध लंबाई 108 pm होती है। $\mathrm{H}-\mathrm{C}-\mathrm{H}$ बंध कोण $117.6^{\circ}$ होता है जबकि $\mathrm{H}-\mathrm{C}-\mathrm{C}$ कोण $121^{\circ}$ होता है। एथीन में सिग्मा और पाई बंध के निर्माण को चित्र 4.15 में दिखाया गया है।

इसलिए, $C_2 H_4$ में पांच सिग्मा बंध और दो पाई बंध होते हैं।
4.29 $x$-अक्ष को अंतराणु अक्ष के रूप में लें तो निम्नलिखित में से कौन एक सिग्मा बंध बनाएगा और क्यों नहीं बनाएगा? (a) $1 \mathrm{~s}$ और $1 \mathrm{~s}$ (b) $1 \mathrm{~s}$ और $2 p_{\mathrm{x}}$; (c) $2 p_{\mathrm{y}}$ और $2 p_{\mathrm{y}}$ (d) $1 s$ और $2 s$.
उत्तर दिखाएं
उत्तर
$2 p_y$ और $2 p_y$ कक्षक एक सिग्मा बंध बनाएंगे। $x$-अक्ष को अंतराणु अक्ष के रूप में लें तो $2 p_y$ और $2 p_y$ कक्षक लंबवत ओवरलैप करेंगे, जिसके कारण एक पाई ( $\pi$ ) बंध बनेगा।
4.30 निम्नलिखित अणुओं में कार्बन परमाणु के द्वारा किस प्रकार के हाइब्रिड कक्षक का उपयोग किया जाता है?
(a) $\mathrm{CH_3}-\mathrm{CH_3}$;
(b) $\mathrm{CH_3}-\mathrm{CH}=\mathrm{CH_2}$;
(c) $\mathrm{CH_3}-\mathrm{CH_2}-\mathrm{OH}$;
(d) $\mathrm{CH_3}-\mathrm{CHO}$;
(e) $\mathrm{CH_3} \mathrm{COOH}$;
उत्तर दिखाएं
उत्तर
(a) $\mathrm{CH}_3-\mathrm{CH}_3$
दोनों कार्बन परमाणु $s p^3$ हाइब्रिडिज किए गए हैं।
(b) $\mathrm{CH}_3-\mathrm{CH}=\mathrm{CH}_2$
मेथिल समूह के कार्बन परमाणु $s p^3$ हाइब्रिडिज किए गए हैं जबकि अन्य दो कार्बन परमाणु $s p^2$ हाइब्रिडिज किए गए हैं।
(c) $\mathrm{CH}_3-\mathrm{CH}_2-\mathrm{OH}$
दोनों कार्बन परमाणु $s p^3$ हाइब्रिडिज किए गए हैं।
(d) $\mathrm{CH}_3-\mathrm{CHO}$
कार्बन परमाणु के मेथिल समूह के $\mathrm s{p}^3$ हाइब्रिडाइज़्ड होते हैं जबकि दूसरे कार्बन परमाणु $\mathrm s{p}^2$ हाइब्रिडाइज़्ड होते हैं।
(e) $\mathrm{CH}_3 \mathrm{COOH}$
कार्बन परमाणु के मेथिल समूह के $\mathrm s{p}^3$ हाइब्रिडाइज़्ड होते हैं जबकि दूसरे कार्बन परमाणु $\mathrm s{p}^2$ हाइब्रिडाइज़्ड होते हैं।
4.31 आपको बॉंड युग्म और अकेले युग्म इलेक्ट्रॉन के बारे में क्या समझ आता है? प्रत्येक प्रकार के एक उदाहरण देकर दर्शाइए।
उत्तर दिखाएं
Answer
जब दो परमाणु अपने एक या अधिक संयोजक इलेक्ट्रॉन साझा करके बर्फ बनाते हैं, तो उनके बीच एक सहसंयोजक बंध बनता है।
बर्फ बनाने वाले परमाणुओं के बीच साझा इलेक्ट्रॉन युग्म बॉंड युग्म कहलाते हैं। सभी संयोजक इलेक्ट्रॉन बंधन में भाग ले सकते हैं। बंधन में भाग न लेने वाले इलेक्ट्रॉन युग्म अकेले युग्म इलेक्ट्रॉन कहलाते हैं।
उदाहरण के लिए, $C_2 H_6$ (एथेन) में सात बॉंड युग्म होते हैं लेकिन कोई अकेले युग्म नहीं होता।
$\mathrm{\boldsymbol{{H-}\overset{\overset{\huge{H}}{|}}{\underset{\underset{\huge{H}}{|}}{C}}-\overset{\overset{\huge{H}}{|}}{\undersटे{\underset{\underset{\huge{H}}{|}}{{C}}}{-H}}}$
$H_2 O$ में दो बॉंड युग्म और केंद्रीय परमाणु (ऑक्सीजन) पर दो अकेले युग्म होते हैं।

4.32 सिग्मा बंध और पाई बंध के बीच अंतर क्या है?
उत्तर दिखाएं
Answer
सिग्मा बंध और पाई बंध के बीच अंतर निम्नलिखित हैं :
| सिग्मा ( $ \sigma $) बंध | पाई $(\pi)$ बंध |
|---|---|
| (a) इसका निर्माण ऑर्बिटल के सिरे से सिरे ओवरलैप के द्वारा होता है। | इसका निर्माण ऑर्बिटल के लेटरल ओवरलैप के द्वारा होता है। |
| (b) ओवरलैप करने वाले ऑर्बिटल s -s, s- $p$, या p - $p$ हो सकते हैं। |
इन बंधों का निर्माण केवल $p - p$ ऑर्बिटल के ओवरलैप के द्वारा होता है। |
| ((c) यह एक मजबूत बंध है। | यह एक कमजोर बंध है। |
| (d) इलेक्ट्रॉन क्लाउड दो नाभिकों को जोड़ने वाली रेखा के सापेक्ष सममित होता है। | इलेक्ट्रॉन क्लाउड सममित नहीं होता। |
| (e) इसमें एक इलेक्ट्रॉन क्लाउड होता है, जो दो नाभिकों के अक्ष के सापेक्ष सममित होता है। |
दो इलेक्ट्रॉन क्लाउड अणुओं के तल के ऊपर और नीचे विद्यमान होते हैं। |
| (फ) सिग्मा बॉन्ड के बारे में मुक्त घूर्णन संभव है। | पाई बॉन्ड के मामले में घूर्णन सीमित होता है। |
4.33 मूल्य बंधन सिद्धांत के आधार पर $\mathrm{H_2}$ अणु के निर्माण की व्याख्या कीजिए।
उत्तर दिखाएं
उत्तर
मान लीजिए कि दो हाइड्रोजन परमाणु ( $A$ और $B$ ) जिनके नाभिक $(N_A$ और $N_B)$ और इलेक्ट्रॉन $(e_A$ और $e_B)$ हैं, एक रासायनिक प्रतिक्रिया में भाग लेकर हाइड्रोजन अणु के निर्माण करते हैं।
जब $A$ और $B$ बहुत दूर पर होते हैं, तो उनके बीच कोई प्रतिक्रिया नहीं होती। जब वे एक दूसरे के निकट आना शुरू करते हैं, तो आकर्षण और विपरीत बल शुरू हो जाते हैं।
आकर्षण बल निम्नलिखित विस्थापनों में उत्पन्न होता है:
(a) एक परमाणु के नाभिक और उसके इलेक्ट्रॉन के बीच, अर्थात $N_A-e_A$ और $N_B-e_B$।
(b) एक परमाणु के नाभिक और दूसरे परमाणु के इलेकट्रॉन के बीच, अर्थात $N_A-e_B$ और $N_B-e_A$।
विपरीत बल निम्नलिखित विस्थापनों में उत्पन्न होता है:
(a) दो परमाणुओं के इलेक्ट्रॉन के बीच, अर्थात $e_A-e_B$।
(b) दो परमाणुओं के नाभिक के बीच, अर्थात $N_A-N_B$।
आकर्षण बल दो परमाणुओं को एक दूसरे के निकट लाता है, जबकि विपरीत बल उन्हें अलग करने की कोशिश करता है।

नए आकर्षण बल के मापदंड के मान नए विपरीत बल से अधिक होता है। इस कारण दो परमाणु एक दूसरे के निकट आ जाते हैं और संभावित ऊर्जा कम हो जाती है। अंततः एक अवस्था पहुंच जाती है जहां आकर्षण बल का नेट बल विपरीत बल के बराबर हो जाता है और तंत्र के ऊर्जा कम से कम हो जाती है। इस अवस्था में दो हाइड्रोजन परमाणु एक दूसरे के साथ बंध जाते हैं और एक स्थायी अणु के रूप में बन जाते हैं जिसकी बंधन लंबाई 74 पिकोमीटर होती है। इससे डाइहाइड्रोजन अणु के निर्माण के लिए जाता है।
4.34 परमाणु कक्षकों के रूपांतरण के लिए आवश्यक महत्वपूर्ण शर्तों को लिखिए जो अणु कक्षक बनाने के लिए होती हैं।
उत्तर दिखाएं
उत्तर
अणु कक्षक बनाने के लिए परमाणु कक्षकों के निम्नलिखित शर्तों को संतुष्ट करना आवश्यक है:
-
संयोजन करने वाले परमाणु कक्षकों में एक समान या लगभग समान ऊर्जा होनी चाहिए। इसका अर्थ है कि $1 s$ कक्षक $1 s$ कक्षक के साथ संयोजन कर सकता है लेकिन $2 s$ कक्षक के साथ नहीं कर सकता क्योंकि $2 s$ कक्षक की ऊर्जा $1 s$ कक्षक की ऊर्जा से बहुत अधिक होती है। यह तभी सत्य नहीं होता जब परमाणु बहुत अलग हों।
-
संयोजन करने वाले परमाणु कक्षक अणु अक्ष के संबंध में समान सममिति रखना चाहिए। परंपरागत रूप से z-अक्ष को अणु अक्ष के रूप में लिया जाता है। यह ध्यान देने योग्य है कि ऊर्जा में समान या लगभग समान वाले परमाणु कक्षक यदि वे समान सममिति नहीं रखते हैं तो संयोजन नहीं करेंगे। उदाहरण के लिए, एक परमाणु के $2 p_z$ कक्षक दूसरे परमाणु के $2 p_z$ कक्षक के साथ संयोजन कर सकते हैं लेकिन $2 p_x$ या $2 p_y$ कक्षक के साथ नहीं कर सकते हैं क्योंकि उनकी अलग-अलग सममिति होती है।
$\mathrm{O}_2$ अणु के इलेक्ट्रॉनिक विन्यास से स्पष्ट है कि बंधन अणु ऑर्बिटल में दस इलेक्ट्रॉन तथा विरोधी बंधन अणु ऑर्बिटल में छह इलेक्ट्रॉन उपस्थित हैं। इसलिए, इसका बंधन क्रम है
बंधन क्रम $=\dfrac{1}{2}\left[\mathrm{~N}{\mathrm{b}}-\mathrm{N}{\mathrm{a}}\right]=\dfrac{1}{2}[10-6]=2$
उसी तरह, $O_2^{+}$ के इलेक्ट्रॉनिक विन्यास को इस प्रकार लिखा जा सकता है :
$\begin{aligned} & \mathrm{O}_2^{+}:(\sigma 1 s)^2\left(\sigma^* 1 s\right)^2(\sigma 2 s)^2(\sigma * 2 s)^2\left(\sigma 2 \mathrm{p}_z\right)^2 \left(\pi 2 p_x^2=\pi 2 p_y^2\right)\left(\pi^* 2 p_x^1=\pi^* 2 p_y^1\right)\end{aligned}$
$N_b=10$
$N_a=5$
$O_2^{+}$ का बंधन क्रम $=\dfrac{1}{2}(10-5)$
$ \hspace{3.2cm}=2.5$
$O_2^{-}$ आयन के इलेक्ट्रॉनिक विन्यास इस प्रकार होगा :
$\begin{aligned} & \mathrm{O}_2^{-}:(\sigma 1 s)^2\left(\sigma^* 1 s\right)^2(\sigma 2 s)^2(\sigma * 2 s)^2\left(\sigma 2 \mathrm{p}_z\right)^2 \left(\pi 2 p_x^2=\pi 2 p_y^2\right)\left(\pi^* 2 p_x^2=\pi^* 2 p_y^1\right)\end{aligned}$
$N_b=10$
$N_a=7$
$O_2^{-}$ का बंधन क्रम $=\dfrac{1}{2}(10-7)$
$ \hspace{3.2cm} =1.5$
$O_2^{2-}$ आयन के इलेक्ट्रॉनिक विन्यास इस प्रकार होगा :
$\begin{aligned} & \mathrm{O}_2^{2-}:(\sigma 1 s)^2\left(\sigma^* 1 s\right)^2(\sigma 2 s)^2(\sigma * 2 s)^2\left(\sigma 2 \mathrm{p}_z\right)^2 \left(\pi 2 p_x^2=\pi 2 p_y^2\right)\left(\pi^* 2 p_x^2=\pi^* 2 p_y^2\right)\end{aligned}$
$N_b=10$
$N_a=8$
$O_2^{2-}$ का बंधन क्रम $=\dfrac{1}{2}(10-8)$
$ \hspace{3.4cm} =1$
बंधन वियोजन ऊर्जा बंधन क्रम के सीधे अनुपात में होती है। अतः बंधन क्रम जितना अधिक होगा, उतनी अधिक स्थायित्व होगा। इस आधार पर स्थायित्व का क्रम $ O_2^{+} > O_2 > O_2^{-} > O_2^{2-} $ होता है।
4.37 अणु ऑर्बिटल को प्रकट करने में एक धन चिह्न और एक ऋण चिह्न के महत्व को लिखिए।
उत्तर दिखाएं
उत्तर
अणु ऑर्बिटल को तरंग फलन द्वारा प्रकट किया जाता है। एक ऑर्बिटल में धन चिह्न एक धनात्मक तरंग फलन को दर्शाता है जबकि एक ऑर्बिटल में ऋण चिह्न एक ऋणात्मक तरंग फलन को दर्शाता है।
4.38 $\mathrm{PCl_5}$ के मामले में हाइब्रिडाइज़ेशन का वर्णन करें। अक्षीय बंधन तुलनात्मक रूप से समतलीय बंधन से लंबे क्यों होते हैं?
उत्तर दिखाएं
उत्तर
फॉस्फोरस $(Z=15)$ के आधार अवस्था और उत्तेजित अवस्था के बाहरी इलेक्ट्रॉनिक विन्यास नीचे दिए गए हैं।

अब पांच ऑर्बिटल (अर्थात, एक s, तीन p और एक d ऑर्बिटल) हाइब्रिडाइज़ेशन के लिए उपलब्ध हैं जो पांच $s p^3 d$ हाइब्रिड ऑर्बिटल के सेट का निर्माण करते हैं जो त्रिकोणीय बिपिरामिड के पांच कोनों की ओर दिशात्मक होते हैं।

ध्यान दें कि त्रिकोणीय बिपिरामिड ज्यामिति में सभी बंधन कोण समान नहीं होते हैं। $\mathrm{PCl}_5$ में फॉस्फोरस के पांच $s p^3 d$ ऑर्बिटल ब्रोमीन अणुओं के एकल उपस्थित ऑर्बिटल के साथ अधिक बंधन बनाते हैं जो पांच $\mathrm{P}-\mathrm{Cl}$ सिग्मा बंधन का निर्माण करते हैं।
तीन $\mathrm{P}-\mathrm{Cl}$ बंधन एक समतल में होते हैं और एक दूसरे से $120^{\circ}$ के कोण बनाते हैं; इन बंधन को समतलीय बंधन कहा जाता है।
शेष दो $\mathrm{P}-\mathrm{Cl}$ बंधन-एक ऊपर और एक नीचे समतलीय समतल में होते हैं, जो समतल से $90^{\circ}$ के कोण बनाते हैं। इन बंधन को अक्षीय बंधन कहा जाता है।
जैसे कि अक्षीय बंधन युग्म समतलीय बंधन युग्म से अधिक प्रतिकर्षण अनुभव करते हैं, इसलिए अक्षीय बंधन थोड़े लंबे और अतिरिक्त रूप से कम शक्तिशाली होते हैं; जो $\mathrm{PCl}_5$ अणु के अधिक प्रतिक्रियाशील होने के कारण होता है।
4.39 हाइड्रोजन बंध को परिभाषित करें। यह वैन डर वाल्स बलों से कमजोर या मजबूत होता है?
उत्तर दिखाएं
उत्तर
हाइड्रोजन बंध एक आकर्षण बल होता है जो एक अणु के एक विद्युत ऋणात्मक परमाणु के संगत हाइड्रोजन और दूसरे अणु के विद्युत ऋणात्मक परमाणु के बीच कार्य करता है (यह एक ही प्रकार के अणु हो सकते हैं)।
कार्बन और अन्य परमाणुओं के बीच विभिन्न विद्युत ऋणात्मकता के कारण, हाइड्रोजन और विद्युत ऋणात्मक परमाणु के बीच बने बंधन युग्म बहुत दूर तक विस्थापित हो जाते हैं। इस प्रकार हाइड्रोजन परमाणु अन्य परमाणु के सापेक्ष विद्युत धनात्मक बन जाता है और धनावेश ले लेता है।
$\mathrm{H}^{\delta+}-\mathrm{X}^{\delta-}—\mathrm{H}^{\delta+}-\mathrm{X}^{\delta-}—\mathrm{H}^{\delta+}-\mathrm{X}^{\delta-}$
हाइड्रोजन बंधन के मात्रा यौगिक के भौतिक अवस्था पर निर्भर करती है। यह ठोस अवस्था में अधिकतम और गैस अवस्था में न्यूनतम होती है। इसलिए, हाइड्रोजन बंधन यौगिकों के संरचना और गुणों पर मजबूत प्रभाव डालते हैं।
हाइड्रोजन बंधन के दो प्रकार होते हैं:
(1) अंतर-अणुक हाइड्रोजन बंधन : यह एक ही या अलग-अलग यौगिक के दो अलग अणुओं के बीच बनता है। उदाहरण के लिए, HF अणु, अल्कोहल या पानी के अणुओं में हाइड्रोजन बंधन होता है, आदि।
(2) अंतर्मुखी हाइड्रोजन बंधन : यह उस स्थिति में बनता है जब हाइड्रोजन परमाणु एक ही अणु में दो उच्च विद्युत ऋणात्मक ( $\mathrm{F}, \mathrm{O}, \mathrm{N}$ ) परमाणुओं के बीच हो। उदाहरण के लिए, o-नाइट्रोफेनॉल में हाइड्रोजन दो ऑक्सीजन परमाणुओं के बीच होता है।

हाइड्रोजन बंधन वैन डर वॉल्स बल से ज्यादा मजबूत होते हैं क्योंकि हाइड्रोजन बंधन एक अत्यधिक रूप में द्विध्रुव-द्विध्रुव संपर्क के रूप में देखे जाते हैं।
4.40 बंध क्रम के शब्द का क्या अर्थ है? $\mathrm{N_2}, \mathrm{O_2}, \mathrm{O_2}^{+}$ और $\mathrm{O_2}^{-}$ के बंध क्रम की गणना करें।
उत्तर दिखाएं
उत्तर
बंध क्रम को एक अणु में बंधन और विरोधी बंधन कक्षकों में उपस्थित इलेक्ट्रॉनों की संख्या के अंतर के आधा के रूप में परिभाषित किया जाता है।
यदि $N_a$ विरोधी बंधन कक्षक में उपस्थित इलेक्ट्रॉनों की संख्या है, तो $N_b$ बंधन कक्षक में उपस्थित इलेक्ट्रॉनों की संख्या है।
बंध क्रम $=\dfrac{1}{2}(N_b-N_a)$
यदि $N_b>N_a$, तो अणु स्थायी माना जाता है। हालांकि, यदि $N_b \leq N_a$, तो अणु अस्थायी माना जाता है।
बॉन्ड के कोर्ड के $N_2$ की गणना इसके इलेक्ट्रॉनिक विन्यास से की जा सकती है:
$\begin{aligned} & \mathrm{O}_2:(\sigma 1 s)^2\left(\sigma^* 1 s\right)^2(\sigma 2 s)^2(\sigma * 2 s)^2\left(\sigma 2 \mathrm{p}_z\right)^2 \left(\pi 2 p_x^2=\pi 2 p_y^2\right)\end{aligned}$
बंधन इलेक्ट्रॉन की संख्या, $N_b=10$
विरोधी बंधन इलेक्ट्रॉन की संख्या, $N_a=4$
नाइट्रोजन अणु के बॉन्ड कोर्ड $=\dfrac{1}{2}(10-4)$
$ \hspace{5.7cm}=3$
डाइऑक्सीजन अणु में 16 इलेक्ट्रॉन होते हैं, प्रत्येक ऑक्सीजन परमाणु से 8 इलेक्ट्रॉन। ऑक्सीजन अणु के इलेक्ट्रॉनिक विन्यास को इस प्रकार लिखा जा सकता है :
$\begin{aligned} & \mathrm{O}_2:(\sigma 1 s)^2\left(\sigma^* 1 s\right)^2(\sigma 2 s)^2(\sigma * 2 s)^2\left(\sigma 2 \mathrm{p}_z\right)^2 \left(\pi 2 p_x^2=\pi 2 p_y^2\right)\left(\pi^* 2 p_x^1=\pi^* 2 p_y^1\right)\end{aligned}$
$\mathrm{O}_2$ अणु के इलेक्ट्रॉनिक विन्यास से स्पष्ट है कि बंधन अणुओं में 10 इलेक्ट्रॉन तथा विरोधी बंधन अणुओं में 6 इलेक्ट्रॉन होते हैं। इसलिए इसका बॉन्ड कोर्ड है:
बॉन्ड कोर्ड $=\dfrac{1}{2}\left[\mathrm{~N}{\mathrm{b}}-\mathrm{N}{\mathrm{a}}\right]=\dfrac{1}{2}[10-6]=2$
उसी तरह, $O_2^{+}$ के इलेक्ट्रॉनिक विन्यास को इस प्रकार लिखा जा सकता है :
$\begin{aligned} & \mathrm{O}_2^{+}:(\sigma 1 s)^2\left(\sigma^* 1 s\right)^2(\sigma 2 s)^2(\sigma * 2 s)^2\left(\sigma 2 \mathrm{p}_z\right)^2 \left(\pi 2 p_x^2=\pi 2 p_y^2\right)\left(\pi^* 2 p_x^1=\pi^* 2 p_y^1\right)\end{aligned}$
$N_b=10$
$N_a=5$
$O_2^{+}$ के बॉन्ड कोर्ड $=\dfrac{1}{2}(10-5)$
$ \hspace{3.2cm}=2.5$
$O_2^{-}$ आयन के इलेक्ट्रॉनिक विन्यास इस प्रकार होगा :
$\begin{aligned} & \mathrm{O}_2^{-}:(\sigma 1 s)^2\left(\sigma^* 1 s\right)^2(\sigma 2 s)^2(\sigma * 2 s)^2\left(\sigma 2 \mathrm{p}_z\right)^2 \left(\pi 2 p_x^2=\pi 2 p_y^2\right)\left(\pi^* 2 p_x^2=\pi^* 2 p_y^1\right)\end{aligned}$
$N_b=10$
$N_a=7$
$O_2^{-}$ के बॉन्ड कोर्ड $=\dfrac{1}{2}(10-7)$
$ \hspace{3.2cm} =1.5$





