अध्याय 03 तत्वों का वर्गीकरण एवं गुणों में आवर्तिता
“आवर्त सारणी रसायन विज्ञान में सिद्धांत एवं अनुप्रयोग दोनों तरह से अत्यंत महत्वपूर्ण अवधारणा है। यह छात्रों के दैनिक समर्थन के लिए है, विशेषज्ञों के लिए नए शोध के मार्ग सुझाती है और यह रसायन विज्ञान के सभी भाग के संक्षिप्त व्यवस्था प्रदान करती है। यह एक अद्भुत दर्शाने वाली घटना है कि रसायनिक तत्व यादृच्छिक तत्वों के समूह नहीं हैं बल्कि वे प्रवृत्तियों को दिखाते हैं और अपने परिवारों में एक साथ रहते हैं। आवर्त सारणी के बारे में जागरूकता किसी व्यक्ति के लिए आवश्यक है जो दुनिया को अलग करना चाहता है और देखना चाहता है कि यह रसायन विज्ञान के मूल बनाकर बनायी गई है, रसायनिक तत्वों से।”
ग्लेन टी. सीबर्ग
इस इकाई में, हम आज के तत्वों के आवर्त सारणी के ऐतिहासिक विकास और आधुनिक आवर्त नियम के अध्ययन करेंगे। हम यह भी सीखेंगे कि आवर्त वर्गीकरण परमाणुओं की इलेक्ट्रॉनिक विन्यास के एक तार्किक परिणाम के रूप में कैसे आता है। अंत में, हम तत्वों के भौतिक और रासायनिक गुणों में कुछ आवर्त प्रवृत्तियों का अध्ययन करेंगे।
3.1 क्यों तत्वों की वर्गीकरण की आवश्यकता है?
हम अब जानते हैं कि तत्व सभी प्रकार के पदार्थ के मूल इकाई हैं। 1800 में केवल 31 तत्व ज्ञात थे। 1865 तक ज्ञात तत्वों की संख्या दोगुनी हो गई थी जो 63 तक पहुंच गई। वर्तमान में 114 तत्व ज्ञात हैं। इनमें से, हाल के दिनों में खोजे गए तत्व मानव निर्मित हैं। नए तत्वों के संश्लेषण के प्रयास जारी हैं। इतने बड़ी संख्या में तत्वों के साथ, सभी तत्वों और उनके अंतर्निहित असंख्य यौगिकों के रासायनिक अध्ययन करना बहुत कठिन हो गया है। इस समस्या को आसान बनाने के लिए, वैज्ञानिकों ने अपने ज्ञान को व्यवस्थित रूप से व्यवस्थित करने के लिए तत्वों की वर्गीकरण की खोज की। यह न केवल तत्वों के ज्ञात रासायनिक तथ्यों को तार्किक बनाए रखेगा, बल्कि नए तथ्यों की भविष्यवाणी भी करेगा जिससे आगे के अध्ययन के लिए तैयारी की जा सके।
3.2 तत्वों के आवर्ती वर्गीकरण का उत्पत्ति
तत्वों के समूहों में वर्गीकरण और आवर्ती नियम एवं आवर्त सारणी के विकास विभिन्न वैज्ञानिकों द्वारा अपने अवलोकन और प्रयोगों से प्राप्त ज्ञान के व्यवस्थित करने के परिणाम हैं। जर्मन रसायन विज्ञानी जोहान डोबेरिनर 1800 के शुरू में पहले तत्वों के गुणों में प्रवृत्तियों के विचार को ध्यान में रखने वाला था। 1829 में उन्होंने कई तत्वों के तीन सदस्यों के समूहों (त्रियाएं) के भौतिक और रासायनिक गुणों में समानता का ध्यान रखा। प्रत्येक मामले में उन्होंने त्रियाओं में मध्य तत्व के परमाणु भार के बीच दूसरे दो तत्वों के परमाणु भार के बीच लगभग आधा होने का ध्यान रखा (तालिका 3.1)। इसके अतिरिक्त, मध्य तत्व के गुण अन्य दो सदस्यों के गुणों के बीच होते थे।
तालिका 3.1 डोबेरिनर के त्रिक
| तत्व | परमाणु भार |
तत्व | परमाणु भार |
तत्व | परमाणु भार |
|---|---|---|---|---|---|
| $\mathbf{L i}$ | 7 | $\mathbf{C a}$ | 40 | $\mathbf{C l}$ | 35.5 |
| $\mathbf{N a}$ | 23 | $\mathbf{S r}$ | 88 | $\mathbf{B r}$ | 80 |
| $\mathbf{K}$ | 39 | $\mathbf{B a}$ | 137 | $\mathbf{I}$ | 127 |
डोबेरिनर के संबंध, जिसे त्रिक के कानून के रूप में जाना जाता है, केवल कुछ तत्वों के लिए काम करता हुआ लगता था, इसलिए इसे एक यांत्रिक घटना के रूप में नगण्य कर दिया गया। अगली रिपोर्ट की गई कोशिश तत्वों के वर्गीकरण के लिए एक फ्रांसीसी भूविज्ञानी, ए.ई.बी. डे चैंकर्टोइस द्वारा 1862 में की गई थी। उन्होंने तब जाने वाले तत्वों को उनके परमाणु भार के बढ़ते क्रम में व्यवस्थित किया और गुणों के आवर्ती पुनरावृति को दिखाने के लिए एक सिलेंडर तालिका बनाई। यह भी तब तक ध्यान नहीं आकर्षित कर सका। ब्रिटिश रसायनज्ञ, जॉन एलेक्जेंडर न्यूलैंड्स ने 1865 में आठवें अवधि के कानून को प्रस्तुत किया। उन्होंने तत्वों को उनके परमाणु भार के बढ़ते क्रम में व्यवस्थित किया और नोट किया कि प्रत्येक आठवाँ तत्व पहले तत्व के समान गुण रखता है (तालिका 3.2)। यह संबंध संगीत के आठवें अवधि में पहले अवधि के समान ध्वनि के जैसा था। न्यूलैंड्स के आठवें अवधि के कानून केवल कैल्शियम तक के तत्वों के लिए सही लगता था। हालांकि उनके विचार के उस समय बहुत अधिक स्वीकृति नहीं मिली, लेकिन उनके काम के लिए उन्हें 1887 में लंदन के रॉयल सोसाइटी द्वारा डेवी मेडल से सम्मानित किया गया।
The Periodic Law, जैसा कि हम आज जानते हैं, रूसी रसायन विज्ञानी, डिमित्री मेंडेलीएव (1834-1907) और जर्मन रसायन विज्ञानी, लॉथर मेयर (1830-1895) के विकास के द्वारा हुआ है।
स्वतंत्र रूप से काम करते हुए, दोनों रसायन विज्ञानियों ने 1869 में प्रस्तावित किया कि तत्वों को उनके परमाणु भार के बढ़ते क्रम में व्यवस्थित करने पर, भौतिक और रासायनिक गुणों में नियमित अंतराल पर समानता दिखाई देती है। लॉथर मेयर ने परमाणु भार के विरुद्ध भौतिक गुणों जैसे परमाणु आयतन, गलनांक और क्वथनांक के आलेख करके एक आवर्ती दोहराव के पैटर्न को प्राप्त किया। न्यूलैंड्स के विपरीत, लॉथर मेयर ने उस आवर्ती पैटर्न के लंबाई में परिवर्तन का अवलोकन किया। 1868 में, लॉथर मेयर ने एक तत्व तालिका के विकास के लिए एक ऐसा तालिका बनाई जो आधुनिक आवर्त तालिका के बहुत समान है। हालांकि, उनका कार्य तकनीकी आवर्त तालिका के विकास के लिए जिम्मेदार वैज्ञानिक डिमित्री मेंडेलीएव के कार्य के बाद तक प्रकाशित नहीं किया गया था।
तालिका 3.2 न्यूलैंड्स के अष्टक
| तत्व | $\mathbf{L i}$ | $\mathbf{B e}$ | $\mathbf{B}$ | $\mathbf{C}$ | $\mathbf{N}$ | $\mathbf{O}$ | $\mathbf{F}$ |
|---|---|---|---|---|---|---|---|
| परमाणु भार | 7 | 9 | 11 | 12 | 14 | 16 | 19 |
| तत्व | $\mathbf{N a}$ | $\mathbf{M g}$ | $\mathbf{A l}$ | $\mathbf{S i}$ | $\mathbf{P}$ | $\mathbf{S}$ | $\mathbf{C l}$ |
| परमाणु भार | 23 | 24 | 27 | 29 | 31 | 32 | 35.5 |
| तत्व | $\mathbf{K}$ | $\mathbf{C a}$ |
| परमाणु भार | 39 | 40 | | | | | |
डोबेरिनर ने आवर्त गुणों के अध्ययन की शुरुआत की, लेकिन आवर्त नियम के अध्ययन के लिए पहली बार प्रकाशन करने का श्रेय मेंडलीएव को जाता है। यह निम्नलिखित बताता है :
तत्वों के गुण उनके परमाणु भार के आवर्त फलन होते हैं।
मेंडलीएव ने तत्वों को उनके बढ़ते हुए परमाणु भार के क्रम में एक तालिका के क्षैतिज पंक्तियों और ऊर्ध्वाधर स्तम्भों में व्यवस्थित किया, ताकि समान गुणों वाले तत्व एक ही ऊर्ध्वाधर स्तम्भ या समूह में आएं। मेंडलीएव के तत्वों के वर्गीकरण का प्रणाली लॉथर मेयर के प्रणाली से अधिक विस्तृत थी। उन्होंने आवर्तता के महत्व को पूर्ण रूप से समझा और तत्वों के विभिन्न भौतिक और रासायनिक गुणों के विस्तार के आधार पर तत्वों के वर्गीकरण के लिए उपयोग किया। विशेष रूप से, मेंडलीएव ने तत्वों द्वारा बनाए गए यौगिकों के सूत्रों और गुणों में समानता पर निर्भरता रखी। उन्होंने अपने परमाणु भार के क्रम का सख्ती से पालन करते हुए कुछ तत्वों के अपने वर्गीकरण के ढांचे में फिट नहीं आने के बारे में अपनी जानकारी रखी। उन्होंने परमाणु भार के क्रम को छोड़ दिया, जिसके बारे में उनका मानना था कि परमाणु भार के मापन में त्रुटि हो सकती है, और तत्वों के समान गुणों वाले तत्वों को एक साथ रख दिया। उदाहरण के लिए, आयोडीन के परमाणु भार कम होता है जो तैलियम (समूह VI) के परमाणु भार से कम होता है, लेकिन गुणों में समानता के कारण वह समूह VII में फ्लुओरीन, क्लोरीन और ब्रोमीन के साथ रख दिया गया। (चित्र 3.1) इसी तरह, अपने मुख्य उद्देश्य के अनुरूप, तत्वों के समान गुणों वाले तत्वों को एक ही समूह में रखने के लिए, उन्होंने यह प्रस्तावित किया कि कुछ तत्व अभी खोज नहीं किए गए हैं और इसलिए तालिका में कई खाली स्थान छोड़ दिए गए हैं। उदाहन के लिए, गैलियम और जर्मेनियम दोनों तब अज्ञात थे जब मेंडलीएव ने अपनी आवर्त सारणी का प्रकाशन किया। उन्होंने एल्यूमिनियम के नीचे एक खाली स्थान छोड़ा और सिलिकॉन के नीचे एक खाली स्थान छोड़ा, और इन तत्वों को ईका-एल्यूमिनियम और ईका-सिलिकॉन कहा। मेंडलीएव ने न केवल गैलियम और जर्मेनियम के अस्तित्व की भविष्यवाणी की, बल्कि इन तत्वों के कुछ सामान्य भौतिक गुणों का भी वर्णन किया। ये तत्व बाद में खोजे गए। मेंडलीएव द्वारा इन तत्वों के लिए भविष्यवाणी किए गए गुण और वास्तविक प्रयोगों द्वारा खोजे गए गुणों की एक सारणी नीचे दी गई है (सारणी 3.3)।
मेंडेलीव के मात्रात्मक अनुमानों की बहादुरी और उनकी अंततः सफलता ने उन्हें और उनके आवर्त सारणी के लिए जनता के ध्यान का आकर्षण किया। 1905 में प्रकाशित मेंडेलीव के आवर्त सारणी को चित्र 3.1 में दिखाया गया है।
तालिका 3.3 मेंडेलीव के तत्वों के अनुमान (ईका-एल्यूमिनियम (गैलियम) और ईका-सिलिकॉन (जरमेनियम)) के लिए
| गुण | ईका-एल्यूमिनियम (अनुमानित) |
गैलियम (पाया गया) |
ईका-सिलिकॉन (अनुमानित) |
जरमेनियम (पाया गया) |
|---|---|---|---|---|
| परमाणु भार | 68 | 70 | 72 | 72.6 |
| घनत्व/(g/cm $\mathbf{)}$ | 5.9 | 5.94 | 5.5 | 5.36 | | गलनांक/के | $\mathrm{Low}$ | 302.93 | $\mathrm{High}$ | 1231 | | ऑक्साइड का सूत्र | $\mathrm{E}2 \mathrm{O}3$ | $\mathrm{Ga}2 \mathrm{O}3$ | $\mathrm{EO}{2}$ | $\mathrm{GeO}{2}$ | | क्लोराइड का सूत्र | $\mathrm{E} \mathrm{Cl}{3}$ | $\mathrm{GaCl}{3}$ | $\mathrm{ECl}{4}$ | $\mathrm{GeCl}{4}$ |
तत्वों का आवर्त तालिका समूह एवं श्रेणियों में

चित्र 3.1 मेंडेलीव के आवर्त सारणी के पहले प्रकाशित संस्करण
3.3 आधुनिक आवर्त नियम और आवर्त सारणी के वर्तमान रूप
हमें याद रखना चाहिए कि जब मेंडेलीव ने अपनी आवर्त सारणी विकसित की, तब रसायन विज्ञानियों के पास परमाणु के आंतरिक संरचना के बारे में कोई ज्ञान नहीं था। हालांकि, 20 वीं सदी के शुरूआती दौर में परमाणु कणों के बारे में सिद्धांतों में गहरे विकास हुए। 1913 में, ब्रिटिश भौतिक वैज्ञानिक हेन्री मोसले तत्वों के विशिष्ट X-किरण स्पेक्ट्रम में नियमितता देखा। आवृत्ति (V) के वर्गमूल (sqrt(v)) के विरुद्ध परमाणु संख्या (Z) के आलेख एक सीधी रेखा बनाता है और न कि आवृत्ति के वर्गमूल विरुद्ध परमाणु द्रव्यमान के आलेख। इस तरह उन्होंने दिखाया कि परमाणु संख्या एक तत्व के लिए इसके परमाणु द्रव्यमान से अधिक मूलभूत गुण है। इसलिए मेंडेलीव के आवर्त नियम को इस आधार पर संशोधित किया गया। इसे आधुनिक आवर्त नियम कहा जाता है और इसे इस प्रकार बताया जा सकता है :
तत्वों के भौतिक और रासायनिक गुण उनके परमाणु संख्या के आवर्ती फलन हैं।
आवर्त नियम ने 94 प्राकृतिक तत्वों (नेप्ट्यूनियम और प्लूटोनियम ऐसिनियम और प्रोटोऐसिनियम के समान हैं जो यूरेनियम के अयस्क पिट ब्लेंड में पाए जाते हैं) में महत्वपूर्ण समानताएं खोज निकाली। यह अनौपचारिक रसायन विज्ञान में नए रुझान के उत्प्रेरक बन गया और आज तक आर्टिफिशियल रूप से उत्पन्न अल्पाु तत्वों के निर्माण के साथ चल रहा है।
आप याद कर सकते हैं कि परमाणु संख्या नाभिकीय आवेश (अर्थात प्रोटॉन की संख्या) या उदासीन परमाणु में इलेक्ट्रॉन की संख्या के बराबर होती है। इसलिए तत्वों के आवर्तिता में क्वांटम संख्या और इलेक्ट्रॉनिक विन्यास के महत्व को आसानी से देखा जा सकता है। वास्तव में, अब यह स्वीकृत हो गया है कि आवर्त नियम इलेक्ट्रॉनिक विन्यास में आवर्ती परिवर्तन के परिणामस्वरूप है, जो वास्तव में तत्वों और उनके यौगिकों के भौतिक और रासायनिक गुण निर्धारित करता है।
कई प्रकार के आवर्त सारणिक के रूप बनाए गए हैं। कुछ रूप रासायनिक अभिक्रिया और आबन्धन के बारे में बल देते हैं, जबकि कुछ तत्वों की इलेक्ट्रॉनिक विन्यास के बारे में बल देते हैं। एक आधुनिक रूप, जिसे “लंबा रूप” कहा जाता है, तत्वों के आवर्त सारणिक के रूप (चित्र 3.2) सबसे आसान और व्यापक रूप से उपयोग किया जाता है। क्षैतिज पंक्तियों (जिन्हें मेंडलीएव श्रेणी कहते थे) को आवर्त कहा जाता है और ऊर्ध्वाधर स्तंभों को समूह कहा जाता है। तत्वों के परमाणुओं में समान बाहरी इलेक्ट्रॉनिक विन्यास वाले तत्व ऊर्ध्वाधर स्तंभों में व्यवस्थित किए जाते हैं, जिन्हें समूह या परिवार कहा जाता है। अंतर्राष्ट्रीय शुद्ध और अनुप्रयोग रसायन विज्ञान संघ (IUPAC) के सुझाव के अनुसार, समूहों की संख्या 1 से 18 तक हो जाती है, जो पुराने समूहों के नाम IA … VIIA, VIII, IB … VIIB और 0 के स्थान ले लेती है।
कुल मिलाकर सात अवधि हैं। अवधि की संख्या अवधि में तत्वों के उच्चतम मुख्य क्वांटम संख्या $(n)$ के संगत होती है। पहली अवधि में 2 तत्व होते हैं। अगली अवधियाँ क्रमशः $8, 8, 18, 18$ और 32 तत्वों की होती हैं। सातवीं अवधि अधूरी है और छठी अवधि के समान, इसका सिद्धांतिक अधिकतम (क्वांटम संख्याओं के आधार पर) 32 तत्व हो सकते हैं। इस तत्व-सारणी के रूप में, छठी और सातवीं अवधि के 14 तत्व (क्रमशः लैंथेनॉइड और एक्टिनॉइड) नीचे के अलग-अलग पैनल में रखे गए हैं[^0]।
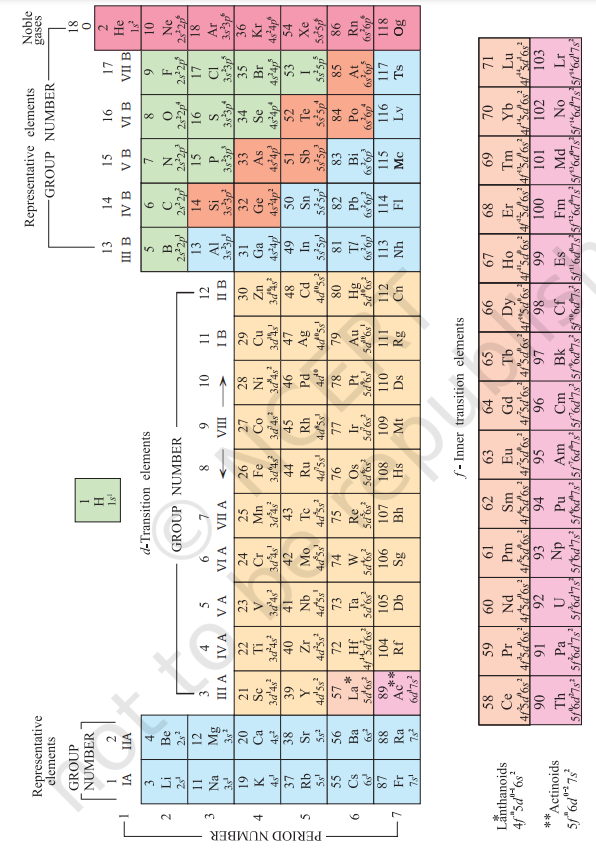
चित्र 3.2 तत्वों के आवर्त सारणी के लंबे रूप के साथ उनकी परमाणु संख्या और आधार अवस्था में बाहरी इलेक्ट्रॉनिक विन्यास। समूह 1-18 के रूप में संख्या दी गई है, जो 1984 में IUPAC के सिफारिश के अनुसार है। इस नोटेशन ने पुराने संख्या व्यवस्था को बदल दिया है, जो IA–VIIA, VIII, IB–VIIB और 0 के रूप में तत्वों के लिए था।
3.4 परमाणु संख्या > 100 के तत्वों के नामकरण
नए तत्वों के नामकरण का अधिकार पहले से ही खोजकर्ता (या खोजकर्ताओं) के होता था और सुझाए गए नाम को IUPAC द्वारा मंजूरी दी जाती थी। अति निकट वर्षों में इसके कारण कुछ विवाद उत्पन्न हो चुके हैं। बहुत उच्च परमाणु संख्या वाले नए तत्व इतने अस्थायी होते हैं कि केवल छोटी मात्रा, कभी-कभी उनके केवल कुछ परमाणु ही प्राप्त किए जा सकते हैं। इनके संश्लेषण और विश्लेषण के लिए, अत्यधिक उन्नत और महंगे उपकरण और लабोरेटरी की आवश्यकता होती है। ऐसा कार्य केवल दुनिया में कुछ लैबोरेटरी में ही प्रतिस्पर्धा के आधार पर किया जाता है। वैज्ञानिक, नए तत्व के विश्वसनीय डेटा के अधिग्रहण से पहले, कभी-कभी उन्हें उसकी खोज के लिए दावा करने के लिए आकर्षित हो जाते हैं। उदाहरण के लिए, अमेरिकी और सोवियत वैज्ञानिक दोनों ने तत्व 104 की खोज के लिए दावा किया। अमेरिकी ने इसे रदरफोर्डियम नाम दिया जबकि सोवियत ने इसे कुर्चातोवियम नाम दिया। इस तरह के समस्याओं से बचने के लिए, IUP ने सुझाव दिया है कि तकनीकी रूप से एक नए तत्व की खोज साबित नहीं होने तक और उसका नाम आधिकारिक रूप से मान्य नहीं होने तक, तत्व के परमाणु संख्या के अंकों के आधार पर संख्यात्मक जड़ों का उपयोग करके एक प्रणालीपूर्ण नामकरण बनाया जाए। ये जड़ें तालिका 3.4 में दिखाए गए हैं। जड़ें परमाणु संख्या के अंकों के क्रम में जोड़ दी जाती हैं और अंत में “ium” जोड़ दिया जाता है। परमाणु संख्या Z जो 100 से अधिक हो, उन तत्वों के IUPAC नाम तालिका 3.5 में दिखाए गए हैं।
तालिका 3.4 IUPAC तत्व नामकरण के लिए अंकन
| अंक | नाम | संक्षिप्त |
|---|---|---|
| 0 | निल | $\mathrm{n}$ |
| 1 | अन | $\mathrm{u}$ |
| 2 | बी | $\mathrm{b}$ |
| 3 | त्रि | $\mathrm{t}$ |
| 4 | क्वाड | $\mathrm{q}$ |
| 5 | पेंट | $\mathrm{p}$ |
| 6 | हेक्स | $\mathrm{h}$ |
| 7 | सेप्ट | $\mathrm{s}$ |
| 8 | ओक्ट | $\mathrm{o}$ |
| 9 | एन | $\mathrm{e}$ |
तालिका 3.5 परमाणु संख्या 100 से अधिक वाले तत्वों के नामकरण
| परमाणु
संख्या | IUPAC नामकरण के अनुसार
नाम | चिह्न | IUPAC
आधिकारिक नाम | IUPAC
चिह्न |
| :—: | :— | :— | :— | :— | | 101 | अनुनिलुनियम | अनु | मेंडेलेवियम | $\mathrm{Md}$ | | 102 | अनुनिलबियम | अनुब | नोबेलियम | No | | 103 | अनुनिलत्रियम | अनुत | लॉरेंसियम | $\mathrm{Lr}$ | | 104 | अनुनिलक्वाडियम | अनुक | रदरफोर्डियम | $\mathrm{Rf}$ | | 105 | अनुनिलपेंटियम | अनुप | डुब्नियम | $\mathrm{Db}$ | | 106 | अनुनिलहेक्सियम | अनुह | सीबोर्गियम | $\mathrm{Sg}$ | | 107 | अनुनिलसेप्टियम | अनुस | बोह्रियम | $\mathrm{Bh}$ | | 108 | अनुनिलऑक्टियम | अनुओ | हैसियम | $\mathrm{Hs}$ | | 109 | अनुनिलेन्नियम | अनुई | मेटनरियम | $\mathrm{Mt}$ |
| 110 | अनुनुनिलियम | Uun | डार्मस्टाड्टियम | $\mathrm{Ds}$ | | 111 | अनुनुनुनियम | Uuu | रॉन्टजेनियम | $\mathrm{Rg}$ | | 112 | अनुनुनबियम | Uub | कोपर्निकियम | $\mathrm{Cn}$ | | 113 | अनुनुनत्रियम | Uut | निहोनियम | $\mathrm{Nh}$ | | 114 | अनुनुनक्वेडियम | Uuq | फ्लेरोवियम | $\mathrm{Fl}$ | | 115 | अनुनुनपेंटियम | Uup | मोस्कोवियम | $\mathrm{Mc}$ | | 116 | अनुनुनहेक्सियम | Uuh | लिवर्मोरियम | $\mathrm{Lv}$ | | 117 | अनुनुनसेप्टियम | Uus | टेनेसीन | $\mathrm{Ts}$ | | 118 | अनुनुनओक्टियम | Uuo | ओगनेसन | $\mathrm{Og}$ |
अतः, नए तत्व के लिए सबसे पहले एक अस्थायी नाम दिया जाता है, जिसका संकेत तीन अक्षरों का होता है। बाद में इसका स्थायी नाम और संकेत IUPAC के प्रतिनिधियों द्वारा वोट देकर निर्धारित किया जाता है। स्थायी नाम उस देश (या देश के राज्य) के नाम पर आधारित हो सकता है जहां तत्व की खोज की गई थी, या किसी प्रसिद्ध वैज्ञानिक के सम्मान में हो सकता है। अब तक 118 तक के परमाणु क्रमांक वाले तत्वों की खोज की गई है। सभी तत्वों के आधिकारिक नामों की घोषणा IUPAC द्वारा की गई है।
समस्या 3.1
परमाणु क्रमांक 120 वाले तत्व का IUPAC नाम और संकेत क्या होगा?
हल
तालिका 3.4 से, 1, 2 और 0 के लिए नाम अनुक्रमशः un, bi और nil हैं। अतः, चिह्न और नाम क्रमशः Ubn और unbinilium हैं।
3.5 तत्वों की इलेक्ट्रॉनिक विन्यास और आवर्त सारणी
पिछले इकाई में हमने सीखा है कि परमाणु में एक इलेक्ट्रॉन को चार क्वांटम संख्याओं के सेट द्वारा विशेषता होती है, और मुख्य क्वांटम संख्या ( $n$ ) मुख्य ऊर्जा स्तर को निर्दिष्ट करती है, जिसे कोश कहते हैं। हमने अलग-अलग उपकोशों में इलेक्ट्रॉनों के भराव के बारे में भी अध्ययन किया है, जिन्हें उपकोश (s, p, $d, f)$ के रूप में भी संदर्भित किया जाता है। परमाणु के उपकोशों में इलेक्ट्रॉनों के वितरण को इलेक्ट्रॉनिक विन्यास कहते हैं। एक तत्व की आवर्त सारणी में स्थिति उसके अंतिम उपकोश के क्वांटम संख्याओं पर निर्भर करती है। इस अनुच्छेद में हम तत्वों के इलेक्ट्रॉनिक विन्यास और आवर्त सारणी के लंबे रूप के बीच एक सीधा संबंध देखेंगे।
(अ) आवर्त में इलेक्ट्रॉनिक विन्यास
आवर्त बाहरी या मूल्यांकन शेल के $n$ के मान को दर्शाता है। अन्य शब्दों में, आवर्तिक सारणी में क्रमागत आवर्त अगले उच्चतम मुख्य ऊर्जा स्तर के भराव के साथ संबंधित होते हैं $(n=1, n=2$, आदि)। यह आसानी से देखा जा सकता है कि प्रत्येक आवर्त में तत्वों की संख्या ऊर्जा स्तर में उपलब्ध अणुओं की संख्या के दोगुनी होती है। पहला आवर्त $(n=1)$ सबसे कम स्तर (1s) के भराव से शुरू होता है और इसलिए दो तत्व होते हैं - हाइड्रोजन $\left(1 s^{1}\right)$ और हीलियम $\left(1 s^{2}\right)$ जब पहला शेल $(K)$ पूर्ण हो जाता है। दूसरा आवर्त $(n=2)$ लिथियम से शुरू होता है और तीसरा इलेक्ट्रॉन $2 s$ ऑर्बिटल में प्रवेश करता है। अगला तत्व, बेरिलियम, चार इलेक्ट्रॉन रखता है और इसका इलेक्ट्रॉनिक विन्यास $1 s^{2} 2 s^{2}$ होता है। अगले तत्व बोरॉन से शुरू होते हैं और जब $L$ शेल नीऑन $\left(2 s^{2} 2 p^{6}\right)$ तक पूर्ण हो जाता है, तो $2 p$ ऑर्बिटल में इलेक्ट्रॉन भरे जाते हैं। इसलिए दूसरे आवर्त में 8 तत्व होते हैं। तीसरा आवर्त $(n=3)$ सोडियम से शुरू होता है, और जोड़े गए इलेक्ट्रॉन $3 s$ ऑर्बिटल में प्रवेश करता है। $3 s$ और $3 p$ ऑर्बिटल के क्रमागत भराव से तीसरे आवर्त में सोडियम से आर्गन तक 8 तत्व होते हैं। चौथा आवर्त $(n=4)$ पोटेशियम से शुरू होता है, और जोड़े गए इलेक्ट्रॉन $4 s$ ऑर्बिटल में प्रवेश करते हैं। अब आप ध्यान दें सकते हैं कि $4 p$ ऑर्बिटल भरे जाने से पहले, $3 d$ ऑर्बिटल के भराव के ऊर्जा रूप से अधिक लाभदायक हो जाता है और हम इस तरह के बोले गए $3 d$ संक्रमण श्रेणी के तत्वों के साथ सामना करते हैं। यह स्कैंडियम $(Z=21)$ से शुरू होता है जिसका इलेक्ट्रॉनिक विन्यास $3 d^{1} 4 s^{2}$ होता है। $3 d$ ऑर्बिटल जिंक $(Z=30)$ में भरे जाते हैं जिसका इलेक्ट्रॉनिक विन्यास $3 d^{10} 4 s^{2}$ होता है। चौथा आवर्त क्रिप्टन तक भरे जाने वाले $4 p$ ऑर्बिटल से समाप्त होता है। इस चौथे आवर्त में कुल 18 तत्व होते हैं। पांचवां आवर्त $(n=5)$ रबीडियम से शुरू होता है जो चौथे आवर्त के समान होता है और $4 d$ संक्रमण श्रेणी के तत्वों के साथ शुरू होता है जो यॉट्रियम $(Z=39)$ से शुरू होता है। यह आवर्त नीऑन तक भरे जाने वाले $5 p$ ऑर्बिटल से समाप्त होता है। छठा आवर्त $(n=6)$ में 32 तत्व होते हैं और क्रमागत इलेक्ट्रॉन $6 s, 4 f, 5 d$ और $6 p$ ऑर्बिटल में प्रवेश करते हैं, आवर्त के क्रम में $4 f$ ऑर्बिटल के भराव के लिए सीरियम $(Z=58)$ से शुरू होता है और लुटेटियम $(Z=71)$ तक समाप्त होता है जिससे $4 f$-आंतरिक संक्रमण श्रेणी बनती है जिसे लैंथेनॉइड श्रेणी कहा जाता है। सातवां आवर्त $(n=7)$ छठे आवर्त के समान होता है जिसमें $7 s, 5 f, 6 d$ और $7 p$ ऑर्बिटल के क्रमागत भराव होता है और इसमें अधिकांश मानव निर्मित रेडियोएक्टिव तत्व शामिल होते हैं। यह आवर्त 118 परमाणु क्रमांक वाले तत्व तक समाप्त होगा जो नोबल गैस वर्ग के तत्व होगा। $5 f$ ऑर्बिटल के भराव के बाद
actinium $(Z=89)$ $5 f$-आंतरिक संक्रमण श्रेणी के रूप में जानी जाती है, जिसे एक्टिनॉइड श्रेणी कहा जाता है। $4 f$ और $5 f$-आंतरिक संक्रमण श्रेणी के तत्वों को आवर्त सारणी में अलग-अलग रखा गया है ताकि इसकी संरचना को बनाए रखा जा सके और वर्गीकरण के सिद्धांत को बनाए रखा जा सके, जिसमें समान गुणों वाले तत्वों को एक ही स्तंभ में रखा जाता है।
समस्या 3.2
आवर्त सारणी के $5^{\text {th }}$ आवर्त में 18 तत्वों की उपस्थिति को कैसे औचित्य दिया जा सकता है?
हल
जब $n=5, l=0,1,2,3$ होता है, तो उपलब्ध कक्षकों $4 d, 5 s$ और $5 p$ की ऊर्जा के बढ़ते क्रम $5 s$ $<4 d<5 p$ होता है। उपलब्ध कक्षकों की कुल संख्या 9 होती है। अधिकतम इलेक्ट्रॉनों की संख्या जो इन कक्षकों में स्थान ले सकते हैं, 18 होती है; अतः $5^{\text {th }}$ आवर्त में 18 तत्व होते हैं।
(ब) समूहवार इलेक्ट्रॉनिक विन्यास
एक ही ऊर्ध्वाधर स्तम्भ या समूह में तत्वों के बाहरी कोश के इलेक्ट्रॉनिक विन्यास, बाहरी कक्षा में इलेक्ट्रॉनों की संख्या और गुण समान होते हैं। उदाहरण के लिए, समूह 1 के तत्व (क्षार धातुएं) सभी के $n s^{1}$ बाहरी कोश इलेक्ट्रॉनिक विन्यास होता है, जैसा कि नीचे दिखाया गया है।
| परमाणु संख्या | चिह्न | इलेक्ट्रॉनिक विन्यास |
|---|---|---|
| 3 | $\mathrm{Li}$ | $1 s^{2} 2 s^{1}$ (या) $[\mathrm{He}] 2 s^{1}$ |
| 11 | $\mathrm{Na}$ | $1 s^{2} 2 s^{2} 2 p^{6} 3 s^{1}$ (या) $[\mathrm{Ne}] 3 s^{1}$ |
| 19 | $\mathrm{~K}$ | $1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{6} 4 s^{1}$ (या) $[\mathrm{Ar}] 4 s^{1}$ | | 37 | $\mathrm{Rb}$ | $1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{6} 3 d^{10} 4 s^{2} 4 p^{6} 5 s^{1}$ (या) $[\mathrm{Kr}] 5 s^{1}$ | | 55 | $\mathrm{Cs}$ | $1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{6} 3 d^{10} 4 s^{2} 4 p^{6} 4 d^{10} 5 s^{2} 5 p^{6} 6 s^{1}$ (या) [Xe]6s $s^{1}$ | | 87 | $\mathrm{Fr}$ | $[\mathrm{Rn}] 7 s^{1}$ |
इस प्रकार देखा जा सकता है कि एक तत्व के गुण इसके परमाणु क्रमांक पर आवर्ती आधार पर निर्भर करते हैं और न कि आपेक्षिक परमाणु द्रव्यमान पर।
3.6 इलेक्ट्रॉनिक विन्यास एवं तत्वों के प्रकार: s-, p-, d-, f- ब्लॉक
अफ़्बाउ (बनावट) सिद्धांत एवं परमाणुओं के इलेक्ट्रॉनिक विन्यास आवर्त सारणी के आवर्त वर्गीकरण के सिद्धांतीय आधार प्रदान करते हैं। आवर्त सारणी के एक ऊर्ध्वाधर स्तम्भ में उपस्थित तत्वों को एक समूह या परिवार कहा जाता है और ये एक समान रासायनिक व्यवहार प्रदर्शित करते हैं। इस समानता के कारण इन तत्वों में बाहरी कक्षकों में इलेक्ट्रॉनों की संख्या एवं वितरण एक समान होता है। हम तत्वों को चार ब्लॉकों में वर्गीकृत कर सकते हैं, अर्थात् s-ब्लॉक, $\boldsymbol{p}$-ब्लॉक, $\boldsymbol{d}$-ब्लॉक एवं $\bold, f$-ब्लॉक, जो इलेक्ट्रॉनों के भरे जाने वाले परमाणु कक्षकों के प्रकार पर आधारित होते हैं। इसका चित्रण चित्र 3.3 में दिखाया गया है। हम इस वर्गीकरण के दो अपवादों को ध्यान में रखते हैं। सख्ती से, हीलियम s-ब्लॉक में आता है, लेकिन अन्य समूह 18 के तत्वों के साथ p-ब्लॉक में स्थिति दी गई है क्योंकि इसका वैलेंस शेल $\left(1 s^{2}\right)$ पूर्ण रूप से भरा होता है और इस कारण यह अन्य नोबल गैसों के गुणों को प्रदर्शित करता है। दूसरा अपवाद हाइड्रोजन है। इसके केवल एक s-इलेक्ट्रॉन होता है और इसलिए इसे समूह 1 (एल्कली मेटल) में रखा जा सकता है। इसके अलावा, इसके एक इलेक्ट्रॉन ग्रहण करके नोबल गैस व्यवस्था प्राप्त कर सकता है और इसलिए इसके गुण अन्य समूह 17 (हैलोजन परिवार) के तत्वों के समान हो सकते हैं। क्योंकि यह एक विशेष स्थिति है, हम आवर्त सारणी के शीर्ष पर इसे अलग से रखेंगे जैसा कि चित्र 3.2 एवं चित्र 3.3 में दिखाया गया है। हम आवर्त सारणी में चौदह प्रकार के तत्वों के महत्वपूर्ण गुणों के बारे में ब्रिफ़ चर्चा करेंगे। इन तत्वों के बारे में अधिक जानकारी बाद में चर्चा की जाएगी। इन गुणों के वर्णन में कुछ शब्दों का उपयोग किया गया है जिन्हें अनुच्छेद 3.7 में वर्गीकृत किया गया है।
3.6.1 s-ब्लॉक तत्व
समूह 1 (क्षार धातुएँ) और समूह 2 (क्षारीय भूमि धातुएँ) के तत्व जिनके बाहरी इलेक्ट्रॉनिक विन्यास $n s^{1}$ और $n s^{2}$ होते हैं, s-ब्लॉक तत्व कहलाते हैं। ये सभी प्रतिक्रियाशील धातुएँ हैं जिनकी आयनन एन्थैल्पी कम होती है। वे बाहरी इलेक्ट्रॉन (एक या दो) त्वरित रूप से खो देते हैं ताकि $1+$ आयन (क्षार धातुओं के मामले में) या $2+$ आयन (क्षारीय भूमि धातुओं के मामले में) बन जाए। समूह में नीचे जाने पर धात्विक गुण और प्रतिक्रियाशीलता बढ़ती जाती है। उच्च प्रतिक्रियाशीलता के कारण ये तत्व प्रकृति में शुद्ध रूप में नहीं पाए जाते। s-ब्लॉक तत्वों के यौगिक, लिथियम और बेरिलियम के अतिरिक्त, आमतौर पर आयनिक होते हैं।
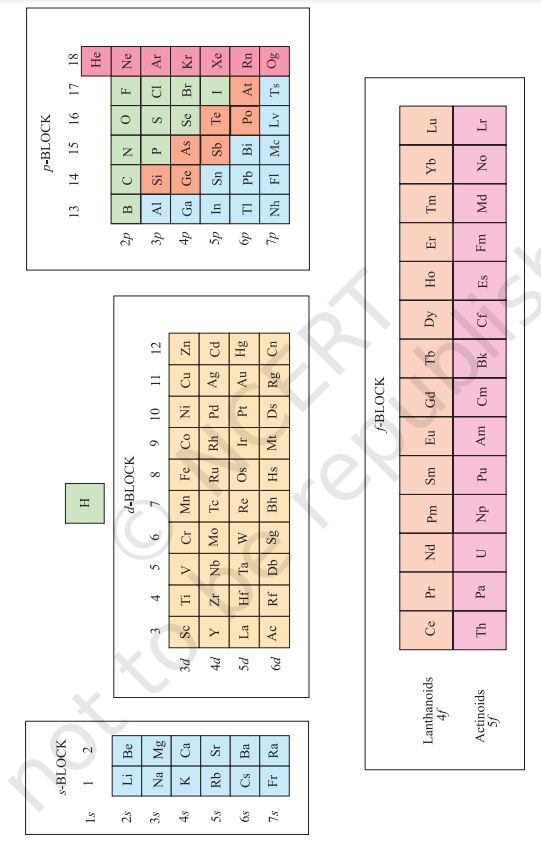
चित्र 3.3 आवर्त सारणी में ऑर्बिटल भरे जाने पर आधारित तत्वों के प्रकार। इसमें तत्वों के बड़े वर्गीकरण के बारे में भी दिखाया गया है, जैसे कि धातुएं, अधातुएं और धातु अधातु (मेटलॉइड)।
3.6.2 p-ब्लॉक तत्व
$\boldsymbol{p}$-ब्लॉक तत्व वे होते हैं जो समूह 13 से 18 तक संबंधित होते हैं। ये तत्व सी-ब्लॉक तत्वों के साथ मिलकर प्रतिनिधि तत्व या मुख्य समूह तत्व कहलाते हैं। प्रत्येक आवर्त में बाहरी इलेक्ट्रॉनिक विन्यास $n s^{2} n p^{1}$ से $n s^{2} n p^{6}$ तक बदलता है। प्रत्येक आवर्त के अंत में एक नोबल गैस तत्व होता है जिसका मूल्यांकन बंद वैलेंस शेल $n s^{2} n p^{6}$ के विन्यास के साथ होता है। नोबल गैस के वैलेंस शेल में सभी ऑर्बिटल इलेक्ट्रॉन द्वारा पूर्ण रूप से भरे जाते हैं और इलेक्ट्रॉन के जोड़ या बर्बाद करने से इस स्थिर व्यवस्था को बदलना बहुत कठिन होता है। इसलिए नोबल गैस बहुत कम रासायनिक प्रतिक्रियाशीलता दिखाते हैं। नोबल गैस परिवार के पहले दो रासायनिक महत्वपूर्ण गैस ग्रुप होते हैं। वे हैं हैलोजिन (समूह 17) और चैलकोजिन (समूह 16)। इन दोनों तत्वों के इलेक्ट्रॉन ग्रहण एंथैल्पी बहुत नकारात्मक होती है और वे क्रमशः एक या दो इलेक्ट्रॉन जोड़कर नोबल गैस के स्थिर विन्यास की प्राप्ति करते हैं। एक आवर्त में बाएं से दाएं जाने पर अधातु गुण बढ़ते जाते हैं और एक समूह में नीचे जाने पर धातु गुण बढ़ते जाते हैं।
3.6.3 d-ब्लॉक तत्व (अंतराल तत्व)
ये आवर्त सारणी के केंद्र में समूह 3 से 12 तक के तत्व हैं। ये तत्व आंतरिक $d$ कक्षकों में इलेक्ट्रॉनों के भराव द्वारा चिह्नित किए जाते हैं और इसलिए “d-ब्लॉक तत्व” के रूप में जाने जाते हैं। ये तत्व सामान्य बाहरी इलेक्ट्रॉनिक विन्यास $(n-1) d^{1-10} n s^{0-2}$ के अतिरिक्त $\mathrm{Pd}$ के लिए इलेक्ट्रॉनिक विन्यास $4 \mathrm{~d}^{10} 5 \mathrm{~s}^{0}$ होता है। ये सभी धातुएँ हैं। ये अधिकांशतः रंगीन आयन बनाते हैं, विशिष्ट वैलेंस (ऑक्सीकरण अवस्था) दर्शाते हैं, पैरामैग्नेटिक होते हैं और अक्सर कैटलिस्ट के रूप में उपयोग किए जाते हैं। हालांकि, Zn, $\mathrm{Cd}$ और $\mathrm{Hg}$ जिनका इलेक्ट्रॉनिक विन्यास $(n-1) d^{10} n s^{2}$ होता है, अधिकांश अंतराल तत्वों के गुणों को दर्शाते हैं। एक तरह से, अंतराल धातुएँ $s$-ब्लॉक तत्वों के रासायनिक सक्रिय धातुओं और समूह 13 और 14 के कम सक्रिय तत्वों के बीच एक पुल के रूप में कार्य करती हैं और इसलिए अपने परिचित नाम “अंतराल तत्व” प्राप्त करती हैं।
3.6.4 f-ब्लॉक तत्व (आंतरिक-अंतर्गत तत्व)
तत्वों के आवर्त सारणी के नीचे दो पंक्तियों के तत्व, जिन्हें लैंथेनॉइड (Lanthanoids), $\mathrm{Ce}(Z=58)-\mathrm{Lu}(Z=71)$ और एक्टिनॉइड (Actinoids), $\operatorname{Th}(Z=90)-\operatorname{Lr}(Z=103)$ कहा जाता है, के बाहरी इलेक्ट्रॉनिक विन्यास $(n-2) f^{1-14}$ $(n-1) d^{0-1} n s^{2}$ द्वारा चिह्नित किया जाता है। प्रत्येक तत्व के अंतिम इलेक्ट्रॉन को $f$-कक्षक में भरा जाता है। इन दो श्रृंखलाओं के तत्वों को आंतरिक-अंतर्गत तत्व (f-ब्लॉक तत्व) कहा जाता है। ये सभी धातुएं हैं। प्रत्येक श्रृंखला में तत्वों के गुण बहुत समान होते हैं। एक्टिनॉइड तत्वों के रासायनिक गुण उनके बहुत संख्या में ऑक्सीकरण अवस्थाओं के कारण लैंथेनॉइड तत्वों के अपेक्षा अधिक जटिल होते हैं। एक्टिनॉइड तत्व रेडियोएक्टिव होते हैं। अधिकांश एक्टिनॉइड तत्वों को नाभिकीय प्रतिक्रियाओं द्वारा केवल नैनोग्राम मात्रा में या उससे कम मात्रा में बनाया गया है और उनका रासायनिक अध्ययन पूर्ण रूप से नहीं किया गया है। यूरेनियम के बाद आने वाले तत्वों को ट्रांसयूरेनियम तत्व कहा जाता है।
समस्या 3.3
तत्व $Z=117$ और 120 अब तक खोज नहीं किए गए हैं। आप इन तत्वों को किस परिवार/समूह में रखेंगे और प्रत्येक स्थिति में इलेक्ट्रॉनिक विन्यास भी देंगे।
हल
हम चित्र 3.2 से देख सकते हैं कि $Z=117$ के तत्व के फ्लूओरीन परिवार (समूह 17) में स्थान लेगा और इलेक्ट्रॉनिक विन्यास $[\mathrm{Rn}]$ $5 f^{14} 6 d^{10} 7 s^{2} 7 p^{5}$ होगा। $Z=120$ के तत्व को समूह 2 (क्षार धातुएँ) में रखा जाएगा और इसका इलेक्ट्रॉनिक विन्यास [Uuo] $8 s^{2}$ होगा।
3.6.5 धातु, अधातु एवं धातु विरोधी तत्व
सामग्री के वर्गीकरण के अतिरिक्त, चित्र 3.3 तत्वों के गुणों के आधार पर एक अन्य व्यापक वर्गीकरण को भी दर्शाता है। तत्वों को धातु एवं अधातु में विभाजित किया जा सकता है। धातुएँ सभी ज्ञात तत्वों के लगभग 78% हैं और आवर्त सारणी के बाएँ ओर स्थित होती हैं। धातुएँ आमतौर पर कमरे के तापमान पर ठोस होती हैं [रту प्रतिवेशी है; गैलियम एवं सीजियम के बहुत कम गलनांक होते हैं (क्रमशः 303 K एवं 302 K)]। धातुएँ आमतौर पर उच्च गलनांक एवं क्वथनांक वाली होती हैं। वे ऊष्मा एवं विद्युत के अच्छे चालक होती हैं। वे मृदुता वाली होती हैं (हथेली से मोड़कर पतली चादर में बदल देती हैं) एवं धातु विरोधी गुण रखती हैं (तार में खींच देती हैं)। विपरीत रूप से, अधातु आवर्त सारणी के ऊपरी दाएँ कोने में स्थित होते हैं। वास्तव में, एक क्षैतिज पंक्ति में, तत्वों के गुण बाएँ ओर धातु गुण से शुरू होकर दाएँ ओर अधातु गुण में परिवर्तित होते हैं। अधातुएँ आमतौर पर कमरे के तापमान पर ठोस या गैस होते हैं एवं उनके गलनांक एवं क्वथनांक निम्न होते हैं (बोरॉन एवं कार्बन अपवाद हैं)। वे ऊष्मा एवं विद्युत के खराब चालक होते हैं। अधातु ठोस आमतौर पर टूटे एवं मृदुता एवं धातु विरोधी गुण नहीं रखते हैं। एक समूह में नीचे की ओर जाने पर तत्व अधिक धातु गुण रखते हैं; आवर्त सारणी में बाएँ से दाएँ जाने पर अधातु गुण बढ़ते जाते हैं। धातु गुण से अधातु गुण में परिवर्तन चित्र 3.3 में बड़ी रेखा द्वारा दिखाए गए तरंग रेखा के अनुसार तीव्र नहीं होता। आवर्त सारणी में इस रेखा के सीधे विपरीत चलने वाले तत्व (जैसे सिलिकॉन, जर्मेनियम, अर्सेनिक, एंटिमनी एवं टेलुरियम) दोनों धातु एवं अधातु गुणों के गुण दिखाते हैं। इन तत्वों को अर्धचालक या धातु विरोधी तत्व कहा जाता है।
समस्या 3.4
परमाणु क्रमांक और आवर्त सारणी में स्थिति के आधार पर, निम्नलिखित तत्वों को धात्विक गुण के बढ़ते क्रम में व्यवस्थित करें :
$\mathrm{Si}, \mathrm{Be}, \mathrm{Mg}$, $\mathrm{Na}, \mathrm{P}$.
हल
धात्विक गुण एक समूह में नीचे की ओर बढ़ता है और एक आवर्त में बाएँ से दाएँ जाने पर घटता है। इसलिए धात्विक गुण के बढ़ते क्रम के अनुसार क्रम इस प्रकार है:
$\mathrm{P}<\mathrm{Si}<\mathrm{Be}<\mathrm{Mg}<\mathrm{Na}$.
3.7 तत्वों के गुणों में आवर्त प्रवृत्तियाँ
एक तत्व के भौतिक और रासायनिक गुणों में एक समूह में नीचे जाने या आवर्त सारणी में एक आवर्त में बढ़ते हुए अनेक प्रेक्षित पैटर्न होते हैं। उदाहरण के लिए, एक आवर्त में, ग्रुप 1 धातुओं में रासायनिक क्रियाशीलता उच्च होती है, तालिका के मध्य भाग के तत्वों में कम होती है, और ग्रुप 17 अधातुओं में अधिकतम होती है। इसी तरह, प्रतिनिधि धातुओं के एक समूह (मान लीजिए अल्कली धातुएं) में क्रियाशीलता समूह में नीचे जाने से बढ़ती जाती है, जबकि अधातुओं के एक समूह (मान लीजिए हैलोजन) में क्रियाशीलता समूह में नीचे जाने से कम होती जाती है। लेकिन क्यों तत्वों के गुण इन प्रवृत्तियों का पालन करते हैं? और हम कैसे आवर्तता की व्याख्या कर सकते हैं? इन प्रश्नों के उत्तर देने के लिए, हमें परमाणु संरचना के सिद्धांत और परमाणु के गुणों के बारे में जानकारी लेनी पड़ेगी। इस अनुभाग में हम निश्चित भौतिक और रासायनिक गुणों में आवर्त प्रवृत्तियों के बारे में चर्चा करेंगे और इनकी व्याख्या इलेक्ट्रॉनों की संख्या और ऊर्जा स्तरों के आधार पर करेंगे।
3.7.1 भौतिक गुणों में घटना
तत्वों के कई भौतिक गुण, जैसे गलनांक और क्वथनांक, गलन एवं वाष्पीकरण की ऊष्मा, परमाणु विखंडन ऊर्जा आदि, आवर्ती रूप से बदलते हैं। हालांकि, हम तत्वों के परमाणु त्रिज्या, आयनिक त्रिज्या, आयनन एन्थैल्पी, इलेक्ट्रॉन ग्रहण एन्थैल्पी और विद्युत ऋणात्मकता के संदर्भ में आवर्ती प्रवृत्तियों के बारे में चर्चा करेंगे।
(a) परमाणु त्रिज्या
आप बहुत अच्छी तरह से समझ सकते हैं कि एक परमाणु के आकार के निर्धारण काफी जटिल होता है जैसे एक गेंद के त्रिज्या के मापन से। आप जानते हैं क्यों? पहले, एक परमाणु के आकार ( $1.2 \mathring{A}$ अर्थात $1.2 \times 10^{-10} \mathrm{~m}$ त्रिज्या) बहुत
छोटा। दूसरे, क्योंकि परमाणु के चारों ओर इलेक्ट्रॉन क्षमक एक स्पष्ट सीमा के बिना होता है, परमाणु के आकार का निर्धारण ठीक नहीं किया जा सकता। अन्य शब्दों में, कोई व्यावहारिक तरीका नहीं है जिसके द्वारा एक व्यक्तिगत परमाणु के आकार को मापा जा सके। हालांकि, जब परमाणु एक संयोजी अणु में एक बंधन द्वारा बंधे होते हैं, तब दो परमाणुओं के बीच की दूरी के ज्ञान से परमाणु के आकार का अनुमान लगाया जा सकता है। एक व्यावहारिक तरीका एक अधातु के परमाणु के आकार का अनुमान लगाने के लिए है जब दो परमाणु एक संयोजी अणु में एक बंधन द्वारा बंधे होते हैं और इस मान से तत्व के “संयोजी त्रिज्या” की गणना की जा सकती है। उदाहरण के लिए, क्लोरीन अणु $\left(\mathrm{Cl}_{2}\right)$ में बंधन दूरी $198 \mathrm{pm}$ है और इस दूरी के आधा $(99 \mathrm{pm})$ क्लोरीन के परमाणु त्रिज्या के रूप में लिया जाता है। धातुओं के लिए हम “धातु त्रिज्या” शब्द को परिभाषित करते हैं जो धातु क्रिस्टल में धातु के केंद्रों के बीच अंतराणु दूरी के आधा मान के रूप में लिया जाता है। उदाहण के लिए, ठोस कॉपर में दो समीपवर्ती कॉपर परमाणुओं के बीच दूरी $256 \mathrm{pm}$ है; अतः कॉपर के धातु त्रिज्या के मान को $128 \mathrm{pm}$ निर्धारित किया जाता है। सरलता के लिए, इस किताब में हम दोनों संयोजी या धातु त्रिज्या के लिए “परमाणु त्रिज्या” शब्द का उपयोग करते हैं, जो तत्व एक अधातु या धातु हो इस पर निर्भर करता है। परमाणु त्रिज्याओं को $X$-किरण या अन्य स्पेक्ट्रोस्कोपिक विधियों द्वारा मापा जा सकता है।
कुछ तत्वों के परमाणु त्रिज्याएँ तालिका 3.6 में सूचीबद्ध हैं। दो प्रवृत्तियाँ स्पष्ट हैं। हम इन प्रवृत्तियों को नाभिकीय आवेश और ऊर्जा स्तर के अनुसार समझ सकते हैं। परमाणु आकार एक आवर्त में बाएँ से दाएँ घटता है, जैसा कि चित्र 3.4(a) में द्वितीय आवर्त के तत्वों के लिए दिखाया गया है। इसका कारण यह है कि आवर्त में बाहरी इलेक्ट्रॉन समान वैलेंस शेल में होते हैं और परमाणु क्रमांक के बढ़ने के साथ-साथ प्रभावी नाभिकीय आवेश बढ़ता है, जिसके कारण इलेक्ट्रॉन नाभिक की ओर अधिक आकर्षित होते हैं। आवर्त सारणी के एक परिवार या ऊर्ध्वाधर स्तम्भ में, परमाणु त्रिज्या परमाणु क्रमांक के साथ नियमित रूप से बढ़ती है, जैसा कि चित्र 3 बी में दिखाया गया है। अल्कली धातुओं और हैलोजनों के लिए, जैसे हम ग्रुप में नीचे जाते हैं, मुख्य क्वांटम संख्या $(n)$ बढ़ती है और वैलेंस इलेक्ट्रॉन नाभिक से दूर होते हैं। यह घटना इसलिए होती है कि आंतरिक ऊर्जा स्तर इलेक्ट्रॉनों से भरे होते हैं, जो बाहरी इलेक्ट्रॉनों को नाभिक के आकर्षण से बचाते हैं। इस प्रकार परमाणु का आकार बढ़ता है, जैसा कि परमाणु त्रिज्याओं में प्रतिबिंबित होता है।
ध्यान दें कि नोबल गैसों के परमाणु त्रिज्याओं को यहाँ ध्यान में नहीं लिया गया है। एकल परमाणु होने के कारण, उनके (असंगत त्रिज्याओं) मान बहुत बड़े होते हैं। वास्तव में नोबल गैसों के त्रिज्याओं की तुलना उनके सहसंयोजक त्रिज्याओं के साथ नहीं की जानी चाहिए, बल्कि अन्य तत्वों के वैन डर वाल्स त्रिज्याओं के साथ की जानी चाहिए।
तालिका 3.6(a) आवर्त में परमाणु त्रिज्याएँ/pm
| परमाणु (आवर्त II) | Li | Be | B | $\mathbf{C}$ | $\mathbf{N}$ | $\mathbf{O}$ | $\mathbf{F}$ |
| परमाणु त्रिज्या | 152 | 111 | 88 | 77 | 74 | 66 | 64 |
| परमाणु (तृतीय आवर्त) | $\mathbf{N a}$ | $\mathbf{M g}$ | $\mathbf{A l}$ | $\mathbf{S i}$ | $\mathbf{P}$ | $\mathbf{S}$ | $\mathbf{C l}$ | | परमाणु त्रिज्या | 186 | 160 | 143 | 117 | 110 | 104 | 99 |
तालिका 3.6(b) एक परिवार में नीचे जाने पर परमाणु त्रिज्या
| परमाणु (समूह I) |
परमाणु त्रिज्या |
परमाणु (समूह 17) |
परमाणु त्रिज्या |
|---|---|---|---|
| $\mathbf{L i}$ | 152 | $\mathbf{F}$ | 64 |
| $\mathbf{N a}$ | 186 | $\mathbf{C l}$ | 99 |
| $\mathbf{K}$ | 231 | $\mathbf{B r}$ | 114 |
| $\mathbf{R b}$ | 244 | $\mathbf{I}$ | 133 | | $\mathbf{C s}$ | 262 | $\mathbf{A t}$ | 140 |
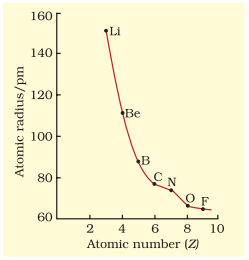
चित्र 3.4 (a) परमाणु क्रमांक के साथ परमाणु त्रिज्या में परिवर्तन
(b) आयनिक त्रिज्या
एक परमाणु से एक इलेक्ट्रॉन के निकल जाने पर एक धनायन के निर्माण होता है, जबकि एक इलेक्ट्रॉन के अधिग्रहण से ऋणायन के निर्माण होता है। आयनिक त्रिज्या को आयनिक क्रिस्टल में धनायन और ऋणायन के बीच की दूरी को मापकर अनुमानित किया जा सकता है। सामान्यतः, तत्वों की आयनिक त्रिज्या परमाणु त्रिज्या के समान प्रवृत्ति दिखाती है। एक धनायन अपने मूल परमाणु की तुलना में छोटा होता है क्योंकि इसमें इलेक्ट्रॉन कम होते हैं जबकि इसका नाभिकीय आवेश समान रहता है। एक ऋणायन का आकार अपने मूल परमाणु की तुलना में बड़ा होता है क्योंकि एक या एक से अधिक इलेक्ट्रॉन के जोड़ने से इलेक्ट्रॉनों में बढ़ती प्रतिकर्षण और कम होता नाभिकीय आवेश के कारण होता है। उदाहरण के लिए, फ्लुओराइड आयन $\left(\mathrm{F}^{-}\right)$ की आयनिक त्रिज्या $136 \mathrm{pm}$ है जबकि फ्लुओरीन की परमाणु त्रिज्या केवल $64 \mathrm{pm}$ है। दूसरी ओर, सोडियम की परमाणु त्रिज्या $186 \mathrm{pm}$ है जबकि $\mathrm{Na}^{+}$ की आयनिक त्रिज्या $95 \mathrm{pm}$ है।
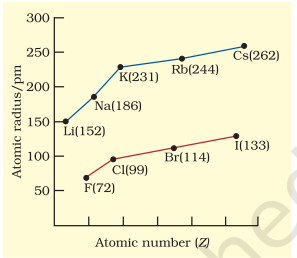
चित्र 3.4 (b) परमाणु क्रमांक के साथ परमाणु त्रिज्या में परिवर्तन अल्कली धातुओं और हैलोजन के लिए
जब हम कुछ परमाणु और आयन खोजते हैं जो समान संख्या में इलेक्ट्रॉन रखते हैं, तो उन्हें आइसोइलेक्ट्रॉनिक वस्तुओं कहा जाता है[^1]। उदाहरण के लिए, $\mathrm{O}^{2-}, \mathrm{F}^{-}, \mathrm{Na}^{+}$ और $\mathrm{Mg}^{2+}$ में समान संख्या में इलेक्ट्रॉन (10) होते हैं। उनकी त्रिज्या अलग-अलग हो सकती है क्योंकि उनके नाभिकीय आवेश अलग-अलग होते हैं। एक धनावेशित आयन जिसका धनावेश अधिक होगा, उसकी त्रिज्या छोटी होगी क्योंकि इलेक्ट्रॉन नाभिक की ओर अधिक आकर्षण करते हैं। एक ऋणावेशित आयन जिसका ऋणावेश अधिक होगा, उसकी त्रिज्या बड़ी होगी। इस मामले में, इलेक्ट्रॉन के शुद्ध प्रतिरोध के कारण नाभिकीय आवेश के विपरीत आयन का आकार बढ़ जाएगा।
समस्या 3.5
निम्नलिखित विशिष्टताओं में से कौन सी विशिष्टता सबसे बड़ी और सबसे छोटी होगी?
$\mathrm{Mg}, \mathrm{Mg}^{2+}, \mathrm{Al}, \mathrm{Al}^{3+}$.
हल
परमाणु त्रिज्या एक आवर्त में घटती है। आयन अपने मूल परमाणु की तुलना में छोटे होते हैं। समान आवेश वाली विशिष्टताओं में, उस विशिष्टता की त्रिज्या छोटी होती है जिसका धनात्मक नाभिकीय आवेश अधिक होता है।
अतः सबसे बड़ी विशिष्टता $\mathrm{Mg}$ है; सबसे छोटी विशिटता $\mathrm{Al}^{3+}$ है।
(c) आयनन एंथैल्पी
एक तत्व के इलेक्ट्रॉन खोने की प्रवृत्ति के एक मात्रक रूप में आयनन एंथैल्पी द्वारा दिया जाता है। यह ऊर्जा को मापता है जो आइसोलेटेड गैसीय परमाणु (X) के आधार अवस्था में एक इलेक्ट्रॉन को हटाने के लिए आवश्यक होती है।
अन्य शब्दों में, एक तत्व $\mathrm{X}$ के लिए प्रथम आयनन py उस अभिक्रिया के लिए एंथैल्पी परिवर्तन $\left(\Delta_{i} H\right)$ होती है जो समीकरण 3.1 में दर्शाई गई है।
$$\mathrm{X}(\mathrm{g}) \rightarrow \mathrm{X}^{+}(\mathrm{g})+\mathrm{e}^{-} \tag{3.1}$$
आयनन एंथैल्पी को $\mathrm{kJ} \mathrm{mol}^{-1}$ के इकाई में व्यक्त किया जाता है। हम द्वितीय आयनन एंथैल्पी को दूसरे सबसे कम बंधे इलेक्ट्रॉन को हटाने के लिए आवश्यक ऊर्जा के रूप में परिभाषित कर सकते हैं; यह उस अभिक्रिया के लिए ऊर्जा होती है जो समीकरण 3.2 में दर्शाई गई है।
$$\mathrm{X}^{+}(\mathrm{g}) \rightarrow \mathrm{X}^{2+}(\mathrm{g})+\mathrm{e}^{-} \tag{3.2}$$
एक परमाणु से इलेक्ट्रॉन हटाने के लिए हमेशा ऊर्जा की आवश्यकता होती है और इसलिए आयनन py हमेशा धनात्मक होती है। दूसरी आयनन py पहली आयनन py से अधिक होगी क्योंकि एक धनावेशित आयन से इलेक्ट्रॉन हटाना एक उदासीन परमाणु से इलेक्ट्रॉन हटाने की तुलना में कठिन होता है। इसी तरह तीसरी आयनन py दूसरी आयनन py से अधिक होगी और इसी तरह आगे भी। “आयनन py” शब्द के अगर अपवाद नहीं दिया गया है, तो इसे पहली आयनन py के रूप में लिया जाता है।
प्रथम आयनन py के तत्वों के तत्वों के परमाणु क्रमांक तक 60 तक आरेख में चित्र 3.5 में खींचे गए हैं। आरेख की आवर्तिता बहुत उल्लेखनीय है। आप नोबल गैसों पर उच्चिष्ठ पाएंगे जो बंद इलेक्ट्रॉन शेल और बहुत स्थायी इलेक्ट्रॉन विन्यास वाले होते हैं। दूसरी ओर, अल्कली धातुओं पर न्यूनतम होते हैं और उनकी कम आयनन एंथैल्पी उनकी उच्च प्रतिक्रियाशीलता के साथ संबंधित हो सकती है।
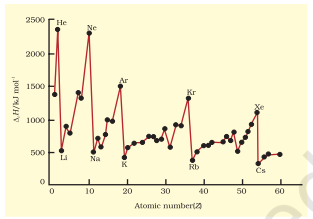
चित्र 3.5 प्रथम आयनन एन्थैल्पी ($∆_i$ H) के परिवर्तन (आयनन ऊर्जा) परमाणु क्रमांक के साथ तत्वों के लिए जो Z = 1 से 60 तक हैं
इसके अतिरिक्त, आप दो तरंगों को भी ध्यान में रखेंगे: प्रथम आयनन एन्थैल्पी एक आवर्त में बाएँ से दाएँ जाने पर बढ़ती जाती है और एक समूह में नीचे जाने पर घटती जाती है। इन तरंगों को चित्र 3.6(a) और 3.6(b) में क्रमशः द्वितीय आवर्त के तत्वों और आवर्त सारणी के प्रथम समूह के तत्वों के लिए दर्शाया गया है। आप ध्यान देंगे कि आयनन एन्थैल्पी और परमाणु त्रिज्या गहरी रूप से संबंधित गुण हैं। इन तरंगों को समझने के लिए हमें दो कारकों को ध्यान में रखना होगा: (i) इलेक्ट्रॉन के नाभिक की ओर आकर्षण, और (ii) इलेक्ट्रॉन के एक दूसरे से बाहर खिंचाव।

चित्र 3.6 (a) द्वितीय आवर्त के तत्वों के प्रथम आयनन एंथैल्पी (∆i H) परमाणु संख्या (Z) के फ़ंक्शन के रूप में और चित्र 3.6(b) अल्कली धातुओं के ∆i H परमाणु संख्या (Z) के फ़ंक्शन के रूप में।
एक परमाणु में मूल्य इलेक्ट्रॉन द्वारा नाभिक के द्वारा अनुभव किया गया प्रभावी नाभिकीय आवेश वास्तविक नाभिक पर आवेश से कम होता है क्योंकि मूल्य इलेक्ट्रॉन द्वारा नाभिक से बचाव या स्क्रीनिंग के कारण होता है। उदाहरण के लिए, लिथियम में $2 s$ इलेक्ट्रॉन नाभिक से बचाव के कारण $1 \mathrm{~s}$ इलेक्ट्रॉन के आंतरिक नाभिक के बाहर रहता है। इसके परिणामस्वरूप, मूल्य इलेक्ट्रॉन द्वारा एक शुद्ध धनावेश अनुभव किया जाता है जो वास्तविक +3 आवेश से कम होता है। सामान्य रूप से, बचाव केवल तब होता है जब आंतरिक कोश में ऑर्बिटल पूरी तरह से भरे होते हैं। यह स्थिति अल्कली धातुओं के मामले में होती है जो एक नोबल गैस इलेक्ट्रॉनिक विन्यास के पीछे एकल बाहरी $n s$-इलेक्ट्रॉन के साथ होती है।
जब हम लिथियम से फ्लुओरीन तक द्वितीय आवर्त में बढ़ते हैं, तो क्रमागत इलेक्ट्रॉन एक ही मुख्य क्वांटम स्तर के ऑर्बिटल में जोड़े जाते हैं और आंतरिक कोर इलेक्ट्रॉन द्वारा नाभिकीय आवेश के छाया करने की मात्रा बहुत अधिक नहीं बढ़ती है जो इलेक्ट्रॉन के नाभिक के प्रति आकर्षण के बढ़े हुए मूल्य को बदल नहीं सकती। इसलिए, एक आवर्त में बढ़ते नाभिकीय आवेश, छाया करने के बराबर हो जाता है। इस प्रकार, बाहरी सबसे बड़े इलेक्ट्रॉन को अधिक तेजी से बांधे रखे जाते हैं और आवर्त में आयनन एंथैल्पी बढ़ती जाती है। जब हम एक समूह में नीचे जाते हैं, तो बाहरी सबसे बड़े इलॉक्ट्रॉन नाभिक से धीरे-धीरे दूर हो जाते हैं, इसलिए आंतरिक स्तर के इलेक्ट्रॉन द्वारा नाभिकीय आवेश के छाया करने की मात्रा बढ़ जाती है। इस मामले में, छाया करने के बढ़ने के बराबर हो जाता है नाभिकीय आवेश के बढ़े हुए मूल्य और बाहरी सबसे बड़े इलेक्ट्रॉन के हटाने के लिए आवश्यक ऊर्जा एक समूह में नीचे जाने पर कम हो जाती है।
From Fig. 3.6(a), आप यह भी नोटिस करेंगे कि बोरॉन $(Z=5)$ के पहले आयनन एंथैल्पी बेरिलियम $(Z=4)$ के पहले आयनन एंथैल्पी से थोड़ी कम है, भले ही पहले के नाभिकीय आवेश अधिक है। जब हम एक ही मुख्य क्वांटम स्तर की बात करते हैं, तो एस-इलेक्ट्रॉन नाभिक के प्रति अधिक आकर्षित होता है जबकि पी-इलेक्ट्रॉन नहीं। बेरिलियम में आयनन के दौरान हटाए गए इलेक्ट्रॉन एस-इलेक्ट्रॉन हैं जबकि बोरॉन में आयनन के दौरान हटाए गए इलेक्ट्रॉन पी-इलेक्ट्रॉन हैं। $2s$-इलेक्ट्रॉन के नाभिक के तक घुसने की क्षमता $2p$-इलेक्ट्रॉन की तुलना में अधिक होती है; इसलिए बोरॉन के $2p$ इलेक्ट्रॉन नाभिक से बाहर बरकरार रहते हैं जबकि बेरिलियम के $2s$ इलेक्ट्रॉन नाभिक से अधिक छिपे होते हैं। इसलिए, बोरॉन से $2p$-इलेक्ट्रॉन हटाना बेरिलियम से $2s$-इलेक्ट्रॉन हटाने की तुलना में आसान है। इसलिए, बोरॉन के पहले आयनन एंथैल्पी बेरिलियम के पहले आयनन एंथैल्पी से कम है। एक अन्य “असामान्यता” ऑक्सीजन के पहले आयनन एंथैल्पी नाइट्रोजन के पहले आयनन एंथैल्पी से कम होना है। इसका कारण यह है कि नाइट्रोजन परमाणु में तीन $2p$-इलेक्ट्रॉन अलग-अलग परमाणु कक्षक में रहते हैं (हंड के नियम) जबकि ऑक्सीजन परमाणु में चार $2p$-इलेक्ट्रॉन में से दो एक ही $2p$-कक्षक में रहते हैं जिसके कारण इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकर्षण बढ़ जाता है। इसलिए, ऑक्सीजन से चौथे $2p$-इलेक्ट्रॉन को हटाना नाइट्रोजन से एक तीसरे $2p$-इलेक्ट्रॉन को हटाने की तुलना में आसान है।
समस्या 3.6
तीसरे आवर्त के तत्वों $\mathrm{Na}, \mathrm{Mg}$ और $\mathrm{Si}$ के पहले आयनन एन्थैल्पी $\left(\Delta_{i} H\right)$ के मान क्रमशः 496, 737 और $786 \mathrm{~kJ}$ $\mathrm{mol}^{-1}$ हैं। बताइए कि $\mathrm{Al}$ के पहले $\Delta_{i} H$ मान $575 \mathrm{~kJ}$ $\mathrm{mol}^{-1}$ या $760 \mathrm{~kJ}$ $\mathrm{mol}^{-1}$ के अधिक करीब होगा? अपने उत्तर की व्याख्या कीजिए।
हल
यह $575 \mathrm{~kJ}$ $\mathrm{mol}^{-1}$ के अधिक करीब होगा। $\mathrm{Al}$ के मान $\mathrm{Mg}$ के मान से कम होगा क्योंकि $3s$-इलेक्ट्रॉन नाभिक से $3p$ इलेक्ट्रॉन को प्रभावी रूप से छाँट देते हैं।
(d) इलेक्ट्रॉन ग्रहण एंथैल्पी
जब कोई इलेक्ट्रॉन एक तटस्थ गैसीय परमाणु $(\mathrm{X})$ में जोड़ा जाता है ताकि इसे ऋणावेशित आयन में परिवर्तित कर दिया जाए, तो इस प्रक्रिया के साथ संगत एंथैल्पी परिवर्तन को इलेक्ट्रॉन ग्रहण एंथैल्पी $\left(\Delta_{\boldsymbol{e}} \boldsymbol{H}\right)$ कहा जाता है। इलेक्ट्रॉन ग्रहण एंथैल्पी एक परमाणु के इलेक्ट्रॉन के जोड़ने की आसानी को मापती है जैसा कि समीकरण 3.3 में दर्शाया गया है।
$\mathrm{X}(\mathrm{g})+\mathrm{e}^{-} \rightarrow \mathrm{X}^{-}(\mathrm{g})$
तत्व के अनुसार, परमाणु में इलेक्ट्रॉन के जोड़ने की प्रक्रिया या तो एंडोथर्मिक हो सकती है या एक्जोथर्मिक। कई तत्वों के लिए जब इलेक्ट्रॉन परमाणु में जोड़ा जाता है तो ऊर्जा विमुक्त होती है और इलेक्ट्रॉन ग्रहण एंथैल्पी ऋणात्मक होती है।
तालिका 3.7 इलेक्ट्रॉन ग्रहण एंथैल्पी / (kJ mol-1) कुछ मुख्य समूह तत्वों के
| समूह 1 | $\Delta_{\boldsymbol{e g}} \boldsymbol{H}$ | समूह 16 | $\Delta_{\boldsymbol{e g}} \boldsymbol{H}$ | समूह 17 | $\Delta_{\boldsymbol{e g}} \boldsymbol{H}$ | समूह 0 | $\Delta_{\boldsymbol{e g}} \boldsymbol{H}$ |
|---|---|---|---|---|---|---|---|
| $\mathbf{H}$ | -73 | $\mathbf{H e}$ | +48 | ||||
| $\mathbf{L i}$ | -60 | $\mathbf{O}$ | -141 | $\mathbf{F}$ | -328 | $\mathbf{N e}$ | +116 |
| $\mathbf{N a}$ | -53 | $\mathbf{S}$ | -200 | $\mathbf{C l}$ | -349 | $\mathbf{A r}$ | +96 | | $\mathbf{K}$ | -48 | $\mathbf{S e}$ | -195 | $\mathbf{B r}$ | -325 | $\mathbf{K r}$ | +96 | | $\mathbf{R b}$ | -47 | $\mathbf{T e}$ | -190 | $\mathbf{I}$ | -295 | $\mathbf{X e}$ | +77 | | $\mathbf{C s}$ | -46 | $\mathbf{P o}$ | -174 | $\mathbf{A t}$ | -270 | $\mathbf{R n}$ | +68 |
उदाहरण के लिए, समूह 17 के तत्व (हैलोजन) बहुत उच्च नकारात्मक इलेक्ट्रॉन ग्रहण py के कारण होते हैं क्योंकि वे एक इलेक्ट्रॉन लेकर स्थायी नोबल गैस इलेक्ट्रॉनिक विन्यास प्राप्त कर सकते हैं। दूसरी ओर, नोबल गैसों के इलेक्ट्रॉन ग्रहण py बहुत धनात्मक होते हैं क्योंकि इलेक्ट्रॉन को अगले उच्च प्रमुख क्वांटम स्तर में प्रवेश करना पड़ता है जो बहुत अस्थायी इलेक्ट्रॉनिक विन्यास के लिए जिम्मेदार होता है। ध्यान दें कि इलेक्ट्रॉन ग्रहण py के मान आवर्त सारणी में नोबल गैसों के पहले ऊपरी दाहिने के क्षेत्र में बहुत नकारात्मक होते हैं।
परमाणु क्रमांक के बढ़ते होने पर एक तत्व के इलेक्ट्रॉन ग्रहण py के अंतर कम नियमित होते हैं जितना कि आयनन py के अंतर में होता है। एक सामान्य नियम के अनुसार, एक आवर्त में परमाणु क्रमांक के बढ़ते होने के साथ-साथ इलेक्ट्रॉन ग्रहण py अधिक नकारात्मक होता जाता है। एक आवर्त में बाएँ से दाएँ जाने पर परमाणु के प्रभावी नाभिकीय आवेश बढ़ता है और इसलिए छोटे परमाणु में एक इलेक्ट्रॉन के जोड़ने के लिए आसानी होती है क्योंकि जोड़े गए इलेक्ट्रॉन औसतन धनात्मक नाभिक के निकट होता है। हम इसकी उम्मीद भी कर सकते हैं कि एक समूह में नीचे जाने पर इलेक्ट्रॉन ग्रहण py कम नकारात्मक होता जाएगा क्योंकि परमाणु के आकार बढ़ जाता है और जोड़े गए इलेक्ट्रॉन नाभिक से दूर होता है। यह आम तौर पर सच होता है (तालिका 3.7)। हालाँकि, $\mathrm{O}$ या $F$ के इलेक्ट्रॉन ग्रहण py कम नकारात्मक होता है जितना कि उनके अगले तत्व के इलेक्ट्रॉन ग्रहण py होता है। इसका कारण यह है कि जब एक इलेक्ट्रॉन $\mathrm{O}$ या $\mathrm{F}$ में जोड़ा जाता है, तो जोड़े गए इलेक्ट्रॉन $n=2$ क्वांटम स्तर में जाता है और इस स्तर में मौजूद अन्य इलेक्ट्रॉनों से बहुत अधिक प्रतिकर्षण अनुभव करता है। $n=3$ क्वांटम स्तर ( $\mathrm{S}$ या $\mathrm{Cl}$ ) में जोड़े गए इलेक्ट्रॉन एक बड़े क्षेत्र में बसते हैं और इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकर्षण बहुत कम होता है।
समस्या 3.7
निम्नलिखित में से कौन सा इलेक्ट्रॉन ग्रहण py के सबसे नकारात्मक होगा और कौन सा सबसे कम नकारात्मक होगा?$\mathrm{P}, \mathrm{S}, \mathrm{Cl}, \mathrm{F}$. अपने उत्तर की व्याख्या करें।
हल
इलेक्ट्रॉन ग्रहण py एक आवर्त में बाएँ से दाएँ जाने पर सामान्यतः अधिक नकारात्मक होता जाता है। एक समूह में, इलेक्ट्रॉन ग्रहण py नीचे जाने पर कम नकारात्मक होता जाता है। हालाँकि, $2 p$-कक्षक में एक इलेक्ट्रॉन जोड़ने के लिए बड़ी विपरीत बल उत्पन्न होता है जबकि $3 p$-कक्षक में एक इलेक्ट्रॉन जोड़ने के लिए इसकी तुलना में कम विपरीत बल होता है। इसलिए, सबसे नकारात्मक इलेक्ट्रॉन ग्रहण py वाला तत्व क्लोरीन है; जबकि सबसे कम नकारात्मक इलेक्ट्रॉन ग्रहण py वाला तत्व फॉस्फोरस है।
(e) विद्युत ऋणात्मकता
एक रासायनिक यौगिक में एक परमाणु के आत्मसारी इलेक्ट्रॉनों को अपने केंद्र की ओर आकर्षित करने की क्षमता के गुणात्मक माप को विद्युत ऋणात्मकता कहते हैं। यह आयनन एंथैल्पी और इलेक्ट्रॉन ग्रहण एंथैल्पी के विपरीत एक माप्य राशि नहीं है। हालांकि, कई संख्यात्मक विद्युत ऋणात्मकता पैमानों के विकास किया गया है, जैसे कि पॉलिंग पैमाना, मुल्लिकेन-जैफे पैमाना, अल्लर्ड-रोचोव पैमाना आदि। जो पैमाना सबसे व्यापक रूप से उपयोग किया जाता है वह पॉलिंग पैमाना है। अमेरिकी वैज्ञानिक लिनस पॉलिंग ने 1922 में फ्लुओरीन को, जिसे इलेक्ट्रॉनों को आकर्षित करने की सबसे बड़ी क्षमता वाला तत्व माना जाता है, को असंगत रूप से 4.0 के मान का निर्धारण किया। कुछ तत्वों के विद्युत ऋणात्मकता के अनुमानित मान तालिका 3.8(a) में दिए गए हैं।
ईलेक्ट्रोनेगेटिविटी किसी भी तत्व के लिए निरंतर नहीं होती; यह उस तत्व पर निर्भर करती है जिससे यह बंधी होती है। हालांकि यह एक माप्य राशि नहीं है, लेकिन यह दो परमाणुओं के बीच बल की प्रकृति का अनुमान लगाने के एक तरीका प्रदान करती है - जिसके बारे में आप बाद में अध्ययन करेंगे।
ईलेक्ट्रोनेगेटिविटी आवर्त सारणी में बाएं से दाएं आवर्त में बढ़ती जाती है (जैसे लिथियम से फ्लुओरीन तक) और एक समूह में नीचे जाने पर घटती जाती है (जैसे फ्लुओरीन से एस्टैटीन तक)। इन प्रवृत्तियों को कैसे समझा जा सकता है? ईलेक्ट्रोनेगेटिविटी को परमाणु त्रिज्या से कैसे संबंधित बताया जा सकता है, जो प्रत्येक आवर्त में बाएं से दाएं जाने पर घटती है, लेकिन प्रत्येक समूह में नीचे जाने पर बढ़ती है? एक आवर्त में परमाणु त्रिज्या कम होने पर बाहरी (या संयोजक) इलेक्ट्रॉन और नाभिक के बीच आकर्षण बढ़ता है। ईलेक्ट्रोनेगेटिविटी भी बढ़ती है।
एक ही अकाउंट पर वर्ग में परमाणु त्रिज्या बढ़ते हुए विद्युत ऋणात्मकता के मान घटते जाते हैं। यह प्रवृत्ति आयनन py के साथ एक जैसी है।
विद्युत ऋणात्मकता और परमाणु त्रिज्या के बीच संबंध को जानने के बाद, आप अब विद्युत ऋणात्मकता और अधातु गुणों के बीच संबंध को कल्पना कर सकते हैं?
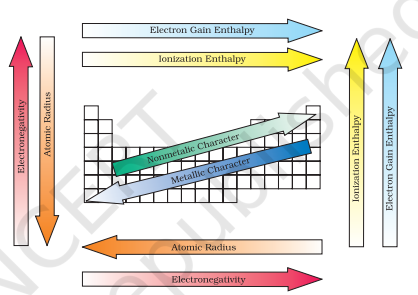
चित्र 3.7 आवर्त सारणी में तत्वों के आवर्त प्रवृत्तियाँ
तालिका 3.8(a) आवर्त में विद्युत ऋणात्मकता के मान (पॉलिंग पैमाने पर)
| तत्व (आवर्त II) | $\mathbf{L i}$ | $\mathbf{B e}$ | $\mathbf{B}$ | $\ | |||
|---|---|---|---|---|---|---|---|
| विद्युत ऋणात्मकता | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| तत्व (आवर्त III) | $\mathbf{N a}$ | $\mathbf{M g}$ | $\mathbf{A l}$ | $\mathbf{S i}$ | $\mathbf{P}$ | $\mathbf{S}$ | $\mathbf{C l}$ |
| विद्युत ऋणात्मकता | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
तालिका 3.8(b) विद्युत ऋणात्मकता मान (पॉलिंग पैमाना पर) एक परिवार में नीचे के लिए
| परमाणु (समूह I) |
विद्युत ऋणात्मकता मान |
परमाणु (समूह 17) |
विद्युत ऋणात्मकता मान |
|---|---|---|---|
| $\mathbf{L i}$ | 1.0 | $\mathbf{F}$ | 4.0 |
| $\mathbf{N a}$ | 0.9 | $\mathbf{C l}$ | 3.0 |
| $\mathbf{K}$ | 0.8 | $\mathbf{B r}$ | 2.8 |
| $\mathbf{R b}$ | 0.8 | $\mathbf{I}$ | 2.5 |
| $\mathbf{C s}$ | 0.7 | $\mathbf{A t}$ | 2.2 |
अधातुक तत्वों के पास इलेक्ट्रॉन प्राप्त करने की मजबूत ललक होती है। इसलिए, विद्युत ऋणात्मकता तत्वों के अधातुक गुणों के सीधे संबंध में होती है। इसको और आगे बढ़ाया जा सकता है कि विद्युत ऋणात्मकता तत्वों के धातुक गुणों के विपरीत संबंध में होती है। इस प्रकार, एक आवर्त में विद्युत ऋणात्मकता के बढ़ने के साथ-साथ तत्वों के अधातुक गुण (या धातुक गुणों के कम होने) में वृद्धि होती है। इसी तरह, एक समूह में विद्युत ऋणात्मकता के घटने के साथ-साथ तत्वों के अधातुक गुण (या धातुक गुणों के बढ़ने) में कमी होती है।
सभी इन आवर्ती प्रवृत्तियों का सार चित्र 3.7 में दिखाया गया है।
3.7.2 रासायनिक गुणों में आवर्ती प्रवृत्तियाँ
तत्वों के रासायनिक गुणों में अधिकांश प्रवृत्तियाँ, जैसे कि विकर्ण संबंध, अप्रतिक्रियाशी युग्म प्रभाव, लैंथेनॉइड संकुचन के प्रभाव आदि, आगामी इकाइयों में प्रत्येक समूह के चर्चा के साथ विस्तार से चर्चा की जाएंगी। इस अनुभाग में हम तत्वों द्वारा प्रदर्शित आवर्ती अपचायक अवस्था या वैलेंस अवस्था और द्वितीय आवर्त तत्वों (लिथियम से फ्लुओरीन तक) के असामान्य गुणों के बारे में अध्ययन करेंगे।
(a) वैलेंस या ऑक्सीकरण अवस्था की आवर्तीता
The valence is the most characteristic property of the elements and can be understood in terms of their electronic configurations. The valence of representative elements is usually (though not necessarily) equal to the number of electrons in the outermost orbitals and/or equal to eight minus the number of outermost electrons as shown below.
Nowadays the term oxidation state is frequently used for valence. Consider the two oxygen containing compounds: $\mathrm{OF}_2$ and $\mathrm{Na}_2 \mathrm{O}$. The order of electronegativity of the three elements involved in these compounds is $\mathrm{F}>\mathrm{O}>\mathrm{Na}$. Each of the atoms of fluorine, with outer electronic configuration $2 s^2 2 p^5$, shares one electron with oxygen in the $\mathrm{OF}_2$ molecule. Being highest electronegative element, fluorine is given oxidation state -1 . Since there are two fluorine atoms in this molecule, oxygen with outer electronic configuration $2 s^2 2 p^4$ shares two electrons with fluorine atoms and thereby exhibits oxidation state +2 . In $\mathrm{Na}_2 \mathrm{O}$, oxygen being more electronegative accepts two electrons, one from each of the two sodium atoms and, thus, shows oxidation state -2 . On the other hand sodium with electronic configuration $3 s^1$ loses one electron to oxygen and is given oxidation state +1 . Thus, the oxidation state of an element in a particular compound can be defined as the charge acquired by its atom on the basis of electronegative consideration from other atoms in the molecule.
समस्या 3.8
परिसंचय तालिका का उपयोग करते हुए, निम्नलिखित तत्वों के युग्म द्वारा बनने वाले यौगिकों के सूत्रों का अनुमान लगाएं; (a) सिलिकॉन और ब्रोमीन (b) एल्यूमिनियम और सल्फर।
हल
(a) सिलिकॉन एक 14 समूह का तत्व है जिसकी संयोजकता 4 है; ब्रोमीन हैलोजन परिवार के तत्व है जिसकी संयोजकता 1 है। अतः बने हुए यौगिक का सूत्र $\mathrm{SiBr}_{4}$ होगा।
(b) एल्यूमिनियम 13 समूह का तत्व है जिसकी संयजकता 3 है; सल्फर 16 समूह के तत्व है जिसकी संयोजकता 2 है। अतः बने हुए यौगिक का सूत्र $\mathrm{Al}_2 \mathrm{~S}_3$ होगा।
कुछ आवर्त घटनाएँ तत्वों के मूल्यांकन (हाइड्राइड और ऑक्साइड) में देखी जाती हैं, जो तालिका 3.9 में दिखाई गई हैं। तत्वों के रासायनिक व्यवहार में अन्य ऐसी आवर्त घटनाएँ भी होती हैं, जिनकी चर्चा इस किताब के अन्य भाग में की गई है। कई तत्व विभिन्न मूल्यांकन दर्शाते हैं। यह विशेष रूप से संक्रमण तत्वों और एक्टिनॉइड्स की विशेषता है, जिनके बारे में हम बाद में अध्ययन करेंगे।
| समूह | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|
| मूलक इलेक्ट्रॉन की संख्या
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| मूलक | 1 | 2 | 3 | 4 | 3,5 | 2,6 | 1,7 | 0,8 |
तालिका 3.9 तत्वों के मूलक के आवर्त प्रवृत्ति उनके यौगिकों के सूत्रों द्वारा दिखाए गए हैं
| समूह | 1 | 2 | 13 | 14 | 15 | 16 | 17 |
|---|---|---|---|---|---|---|---|
| हाइड्राइड का सूत्र |
$\mathrm{LiH}$ $\mathrm{NaH}$ $\mathrm{KH}$ |
$\mathrm{CaH}_2$ | $\mathrm{B}_2 \mathrm{H}_6$ $\mathrm{AlH}_3$ |
$\mathrm{CH}_4$ $\mathrm{SiH}_4$ $\mathrm{GeH}_4$ $\mathrm{SnH}_4$ |
$\mathrm{NH}_3$ $\mathrm{PH}_3$ $\mathrm{AsH}_3$ |
$\mathrm{H}_2 \mathrm{O}$ $\mathrm{H}_2 \mathrm{~S}$ $\mathrm{H}_2 \mathrm{Se}$ $\mathrm{H}_2 \mathrm{Te}$ |
$\mathrm{HF}$ $\mathrm{HCl}$ $\mathrm{HBr}$ $\mathrm{HI}$ |
| ऑक्साइड का सूत्र
$\mathrm{Li}_2 \mathrm{O}$
$\mathrm{Na}_2 \mathrm{O}$
$\mathrm{K}_2 \mathrm{O}$ | $\mathrm{MgO}$
$\mathrm{CaO}$
$\mathrm{SrO}$
$\mathrm{BaO}$ | $\mathrm{B}_2 \mathrm{O}_3$
$\mathrm{Al}_2 \mathrm{O}_3$
$\mathrm{Ca}_2 \mathrm{O}_3$
$\mathrm{In}_2 \mathrm{O}_3$ | $\mathrm{CO}_2$
$\mathrm{SiO}_2$
$\mathrm{GeO}_2$
$\mathrm{SnO}_2$
$\mathrm{PbO}_2$ | $\mathrm{N}_2 \mathrm{O}_3, \mathrm{~N}_2 \mathrm{O}_5$
$\mathrm{P}_4 \mathrm{O}_6, \mathrm{P}_4 \mathrm{O_10}$
$\mathrm{As}_2 \mathrm{O}_3, \mathrm{As}_2 \mathrm{O}_5$
$\mathrm{Sb}_2 \mathrm{O}_3, \mathrm{Sb}_2 \mathrm{O}_5$
$\mathrm{Bi}_2 \mathrm{O}_3-$ | $\mathrm{SO}_3$
$\mathrm{SeO}_3$
$\mathrm{TeO}_3$ | -
$\mathrm{Cl}_2 \mathrm{O}_7$
- |
(ब) द्वितीय आवर्त तत्वों के असामान्य गुण
प्रत्येक समूह 1 (लिथियम) और समूह 2 (बेरिलियम) तथा समूह 13 से 17 (बोरॉन से फ्लूओरीन) के पहले तत्व क्रमशः अपने समूह के अन्य सदस्यों से कई बातों में भिन्न होते हैं। उदाहरण के लिए, लिथियम अन्य अल्कली धातुओं के विपरीत, और बेरिलियम अन्य अल्कली पृथक धातुओं के विपरीत, उनके साथ उच्च आबंध विशिष्टता वाले यौगिक बनाते हैं; इन समूहों के अन्य सदस्य अधिकतर आयनिक यौगिक बनाते हैं। वास्तव में, लिथियम और बेरिलियम के व्यवहार अगले समूह के द्वितीय तत्व अर्थात् मैग्नीशियम और एल्यूमिनियम के साथ अधिक समान होते हैं। इस प्रकार की समानता आवर्त गुणों में आमतौर पर “कोणीय संबंध” के रूप में संदर्भित की जाती है।
एक समूह के तत्वों के पहले सदस्य के अपेक्षक अगले सदस्यों के अलग-अलग रासायनिक व्यवहार के कारण क्या हैं? इस असामान्य व्यवहार को उनके छोटे आकार, बड़ा आवेश/त्रिज्या अनुपात और उच्च विद्युत ऋणात्मकता के कारण समझा जाता है। इसके अतिरिक्त, एक समूह के पहले सदस्य के केवल चार संयोजक कक्षक (2s और 2p) बंधन के लिए उपलब्ध होते हैं, जबकि दूसरे सदस्य के नौ संयोजक कक्षक (3s, 3p, 3d) उपलब्ध होते हैं। इस कारण से, प्रत्येक समूह के पहले सदस्य की अधिकतम सहसंयोजकता 4 होती है (उदाहरण के लिए, बोरॉन केवल [BF₄]⁻ बना सकता है, जबकि अन्य सदस्य अपने संयोजक बाह्य कोश को बढ़ाकर चार से अधिक इलेक्ट्रॉन युग्म ले सकते हैं, उदाहरण के लिए, एलुमिनियम [AlF₆]³⁻ बनाता है)। इसके अतिरिक्त, p-ब्लॉक के पहले सदस्य अपने से अन्य परमाणुओं के साथ pπ-pπ बहुलक बंधन बनाने में अधिक क्षमता रखते हैं (उदाहरण के लिए, C=C, C≡C, N=N, N≡N) और दूसरे कक्षक के तत्वों के साथ भी (उदाहरण के लिए, C=O, C=N, C≡N, N=O) अपेक्षाकृत अगले सदस्यों की तुलना में अधिक क्षमता रखते हैं।
समस्या 3.9
$\left[\mathrm{AlCl}\left(\mathrm{H}_2 \mathrm{O}\right)_5\right]^{2+}$ में $\mathrm{Al}$ के ऑक्सीकरण अवस्था और सहसंयोजकता समान हैं?
हल
नहीं। $\mathrm{Al}$ का ऑक्सीकरण अवस्था +3 है और सहसंयोजकता 6 है।
3.7.3 आवर्त घटत और रासायनिक अभिक्रियाशीलता
हमने कुछ मूल गुणों जैसे परमाणु और आयनिक त्रिज्या, आयनन एन्थैल्पी, इलेक्ट्रॉन ग्रहण एन्थैल्पी और संयोजकता में आवर्त घटत देखे हैं। अब तक हम जानते हैं कि आवर्तता इलेक्ट्रॉनिक विन्यास से संबंधित है। अर्थात, सभी रासायनिक और भौतिक गुण तत्वों के इलेक्ट्रॉनिक विन्यास के प्रकाशन हैं। अब हम इन मूल गुणों के तत्वों के रासायनिक अभिक्रियाशीलता से संबंध खोजने की कोशिश करेंगे।
परमाणु और आयनिक त्रिज्याएँ, जैसा कि हम जानते हैं, एक आवर्त में बाएँ से दाएँ घटती जाती हैं। इसके परिणामस्वरूप, आयनन एंथैल्पी आमतौर पर बढ़ती जाती है (कुछ अपवादों के बारे में अनुच्छेद 3.7.1(a) में बताया गया है) और इलेक्ट्रॉन अधिग्रहण एंथैल्पी एक आवर्त में बाएँ से दाएँ अधिक नकारात्मक हो जाती है। अन्य शब्दों में, एक आवर्त में बाएँ से दाएँ घटती जाती हैं। इसके परिणामस्वरूप, आवर्त के दो अत्यधिक छोरों पर उच्च रासायनिक प्रतिक्रियाशीलता और केंद्र में न्यूनतम रासायनिक प्रतिक्रियाशीलता होती है। इसलिए, आवर्त के बाएँ छोर पर (सोडियम आधारित धातुओं में) उच्चतम रासायनिक प्रतिक्रियाशीलता उस धातु के इलेक्ट्रॉन के नुकसान से एक धनायन के निर्माण के कारण होती है, जबकि आवर्त के दाएँ छोर पर (हैलोजन में) उच्चतम रासायनिक प्रतिक्रियाशीलता उस तत्व के इलेक्ट्रॉन के अधिग्रहण से एक ऋणायन के निर्माण के कारण होती है। इस गुण को आगे चर्चा करते हुए आप तत्वों के अपचायक और ऑक्सीकारक व्यवहार से संबंधित बताया जाएगा। हालांकि, यहाँ इसे तत्वों के धात्विक और अधात्विक गुण से सीधे संबंधित बताया जा सकता है। इसलिए, एक तत्व के धात्विक गुण, जो आवर्त के बाएँ छोर पर सबसे अधिक होते हैं, आवर्त के बाएँ से दाएँ जाने पर कम होते जाते हैं और अधात्विक गुण बढ़ते जाते हैं। एक तत्व की रासायनिक प्रतिक्रियाशीलता ऑक्सीजन और हैलोजन के साथ अपनी अभिक्रियाओं के माध्यम से सबसे अच्छा दिखाई देती है। यहाँ, हम केवल तत्वों के ऑक्सीजन के साथ अभिक्रिया के बारे में चर्चा करेंगे। आवर्त के दो अत्यधिक छोरों पर वर्तमान तत्व ऑक्साइड बनाने के लिए ऑक्सीजन के साथ आसानी से संयोजित हो जाते हैं। आवर्त के बाएँ छोर पर बनने वाला सामान्य ऑक्साइड सबसे क्षारीय होता है (उदाहरण के लिए, $\mathrm{Na}_2 \mathrm{O}$), जबकि आवर्त के दाएँ छोर पर बनने वाला सामान्य ऑक्साइड सबसे अम्लीय होता है (उदाहरण के लिए, $\mathrm{Cl}_2 \mathrm{O}_7$)। आवर्त के केंद्रीय तत्वों के ऑक्साइड अम्लीय (उदाहरण के लिए, $\mathrm{Al}_2 \mathrm{O}_3, \mathrm{As}_2 \mathrm{O}_3$) या उदासीन (उदाहरण के लिए, $\mathrm{CO}, \mathrm{NO}, \mathrm{N}_2 \mathrm{O}$) होते हैं। अम्लीय ऑक्साइड अम्लों के साथ बेसिक व्यवहार दिखाते हैं और बेसों के साथ अम्लीय व्यवहार दिखाते हैं, जबकि उदासीन ऑक्साइड कोई अम्लीय या बेसिक गुण नहीं रखते हैं।
समस्या 3.10
पानी के साथ रासायनिक अभिक्रिया द्वारा दिखाइए कि $\mathrm{Na}_2 \mathrm{O}$ एक क्षारकीय ऑक्साइड है और $\mathrm{Cl}_2 \mathrm{O}_7$ एक अम्लीय ऑक्साइड है।
हल
$\mathrm{Na}_2 \mathrm{O}$ पानी के साथ एक मजबूत क्षार बनाता है जबकि $\mathrm{Cl}_2 \mathrm{O}_7$ एक मजबूत अम्ल बनाता है।
$\mathrm{Na}_2 \mathrm{O}+\mathrm{H}_2 \mathrm{O} \rightarrow 2 \mathrm{NaOH}$
$\mathrm{Cl}_2 \mathrm{O}_7+\mathrm{H}_2 \mathrm{O} \rightarrow 2 \mathrm{HClO}_4$
उनकी क्षारकीय या अम्लीय प्रकृति को लिटमस पेपर के साथ गुणात्मक रूप से परीक्षण किया जा सकता है।
सारांश
इस इकाई में, आपने आवर्त नियम और आवर्त सारणी के विकास के बारे में अध्ययन किया है। मेंडेलीएव की आवर्त सारणी में परमाणु द्रव्यमान पर आधारित थी। आधुनिक आवर्त सारणी में तत्वों को उनके परमाणु संख्या के क्रम में छह सात स्तंभों (आवर्त) और आठ तेरह ऊर्ध्वाधर स्तंभों (समूह या परिवार) में व्यवस्थित किया गया है। एक आवर्त में परमाणु संख्या क्रमवार होती है, जबकि एक समूह में वे एक पैटर्न के अनुसार बढ़ती हैं। एक समूह के तत्वों के बाह्य कोश के इलेक्ट्रॉनिक विन्यास समान होता है और इसलिए उनके रासायनिक गुण भी समान होते हैं। हालांकि, एक आवर्त के तत्वों में बाएं से दाएं जाने पर इलेक्ट्रॉन की संख्या धीरे-धीरे बढ़ती जाती है और इसलिए उनके विभिन्न अभिकर्मकता होती है। आवर्त सारणी में इलेक्ट्रॉनिक विन्यास के आधार पर चार प्रकार के तत्वों की पहचान की जा सकती है। ये हैं s-ब्लॉक, $\boldsymbol{p}$-ब्लॉक, $\boldsymbol{d}$-ब्लॉक और $\boldsymbol{f}$-ब्लॉक तत्व। हाइड्रोजन, जिसमें $1 \boldsymbol{s}$ ऑर्बिटल में एक इलेक्ट्रॉन होता है, आवर्त सारणी में अद्वितीय स्थान ठहराया गया है। धातुएं ज्ञात तत्वों के अधिक तेरह प्रतिशत से अधिक होती हैं। वे तत्व जो आवर्त सारणी के शीर्ष पर स्थित होते हैं, अल्प संख्या में होते हैं। धातु और अधातु के बीच सीमा पर स्थित तत्व (जैसे, Si, Ge, As) को धातु विरोधी या अर्ध-धातु कहा जाता है। एक समूह में धात्विक गुण परमाणु संख्या के बढ़ने के साथ बढ़ते जाते हैं, जबकि एक आवर्त में बाएं से दाएं जाने पर घटते जाते हैं। तत्वों के भौतिक और रासायनिक गुण उनके परमाणु संख्या के आवर्त रूप से बदलते रहते हैं।
परिसंचरण तरंगें परमाणु आकार, आयनन एन्थैल्पी, इलेक्ट्रॉन ग्रहण एन्थैल्पी, विद्युत ऋणात्मकता और मूल्यांकन में देखी जाती हैं। परिसंचरण में बाएँ से दाएँ जाते हुए परमाणु त्रिज्या घटती जाती है और एक समूह में परमाणु क्रमांक बढ़ते हुए बढ़ती जाती है। आयनन एन्थैल्पी आमतौर पर एक परिसंचरण में बढ़ती है और एक समूह में घटती है। विद्युत ऋणात्मकता भी इसी प्रकार की दिशा में दिखाई देती है। इलेक्ट्रॉन ग्रहण एन्थैल्पी, आमतौर पर, एक परिसंचरण में अधिक नकारात्मक होती है और एक समूह में कम नकारात्मक होती है। मूल्यांकन में कुछ आवर्तिकता होती है, उदाहरण के लिए, प्रतिनिधि तत्वों में मूल्यांकन बाहरी कक्षा में इलेक्ट्रॉनों की संख्या के बराबर होता है या इस संख्या के आठ कम होता है। एक परिसंचरण के दो अंतिम बिंदुओं पर रासायनिक अभिक्रियाशीलता सबसे अधिक होती है और केंद्र में यह सबसे कम होती है। एक परिसजरण के बाएँ अंतिम बिंदु पर अभिक्रियाशीलता इलेक्ट्रॉन खोने की आसानी (या निम्न आयनन एन्थैल्पी) के कारण होती है। अत्यधिक अभिक्रियाशील तत्व प्रकृति में मुक्त अवस्था में नहीं पाए जाते; वे आमतौर पर संयोजित रूप में पाए जाते हैं। बाएँ तत्वों के ऑक्साइड बेसिक होते हैं और दाएँ तत्वों के ऑक्साइड अम्लीय प्रकृति के होते हैं। केंद्रीय तत्वों के ऑक्साइड अम्फोटेरिक या उदासीन प्रकृति के होते हैं।
अभ्यास
3.1 आवर्त सारणी में वर्गीकरण के मूल विषय क्या है?
उत्तर दिखाएँ
उत्तर
आवर्त सारणी में वर्गीकरण के मूल विषय तत्वों के परमाणु क्रमांक, गुण, इलेक्ट्रॉनिक विन्यास एवं रासायनिक व्यवहार के आधार पर तत्वों को आवर्त एवं समूह में वर्गीकृत करना है। समान गुण वाले तत्वों को एक ही समूह में रखा जाता है। इस व्यवस्था तत्वों एवं उनके यौगिकों के अध्ययन को प्रणालीय बनाती है एवं उनके मूल गुण एवं रासायनिक व्यवहार को समझने में सहायता करती है।
3.2 मेंडलीएव के आवर्त सारणी में तत्वों के वर्गीकरण के लिए कौन सी महत्वपूर्ण गुण का उपयोग किया गया था एवं वह इस व्यवस्था के बंधन में बने रहे?
उत्तर दिखाएँ
उत्त र
मेंडलीएव ने अपने आवर्त सारणी में तत्वों को उनके परमाणु भार या द्रव्यमान के आधार पर व्यवस्थित किया। वे तत्वों को उनके बढ़ते हुए परमाणु भार के क्रम में आवर्त एवं समूह में व्यवस्थित करते थे। वे समान गुण वाले तत्वों को एक ही समूह में रखते थे।
हालांकि, वे लंबे समय तक इस व्यवस्था के बंधन में नहीं रहे। उन्होंने खोज निकाला कि यदि तत्वों को उनके बढ़ते हुए परमाणु भार के क्रम में व्यवस्थित किया जाए तो कुछ तत्व इस वर्गीकरण के योजना में फिट नहीं होते।
इसलिए, उन्होंने कुछ मामलों में परमाणु भार के क्रम को नगण्य कर दिया। उदाहरण के लिए, आयोडीन का परमाणु भार तेलुरियम के परमाणु भार से कम होता है। फिर भी मेंडलीएव ने तेलुरियम (समूह VI में) को आयोडीन (समूह VII में) के पहले रख दिया केवल इसलिए कि आयोडीन के गुण फ्लूओरीन, क्लोरीन एवं ब्रोमीन के गुणों के बहुत समान हैं।
3.3 मेंडलीएव के आवर्त नियम एवं आधुनिक आवर्त नियम के बीच मूल अंतर क्या है?
उत्तर दिखाएँ
उत्तर
मेंडलीएव के आवर्त नियम के अनुसार तत्वों के भौतिक एवं रासायनिक गुण उनके परमाणु भार के आवर्त फलन होते हैं। दूसरी ओर, आधुनिक आवर्त नियम के अनुसार तत्वों के भौतिक एवं रासायनिक गुण उनके परमाणु क्रमांक के आवर्त फलन होते हैं।
3.4 क्वांटम संख्याओं के आधार पर समझाइए कि आवर्त सारणी के छठे आवर्त में 32 तत्व होने चाहिए।
उत्तर दिखाएं
उत्तर
तत्वों के आवर्त सारणी में, एक आवर्त बाहरी कोश के मुख्य क्वांटम संख्या $(n)$ के मान को दर्शाता है। प्रत्येक आवर्त मुख्य क्वांटम संख्या $(n)$ के भरने से शुरू होता है। छठे आवर्त के लिए $n$ का मान 6 है। $n=6$ के लिए, कुंडली क्वांटम संख्या $(l)$ के मान 0, 1, 2, 3, 4 हो सकते हैं।
अफबाउ के सिद्धांत के अनुसार, इलेक्ट्रॉन उनकी बढ़ती ऊर्जा के क्रम में विभिन्न कक्षकों में जोड़े जाते हैं। $6d$ उपकक्षा की ऊर्जा $7s$ उपकक्षा की ऊर्जा से अधिक होती है।
छठे आवर्त में, इलेक्ट्रॉन केवल $6s$, $4f$, $5d$ और $6p$ उपकक्षाओं में भरे जा सकते हैं। अब, $6s$ में एक कक्षक होता है, $4f$ में सात कक्षक होते हैं, $5d$ में पांच कक्षक होते हैं, और $6p$ में तीन कक्षक होते हैं। इसलिए, उपलब्ध कक्षकों की कुल संख्या 16 $(1+7+5+3=16)$ है। पॉली के अपवाद सिद्धांत के अनुसार, प्रत्येक कक्षक में अधिकतम 2 इलेक्ट्रॉन रह सकते हैं। इसलिए, 16 कक्षक 32 इलेक्ट्रॉन के लिए स्थान देते हैं।
इसलिए, आवर्त सारणी के छठे आवर्त में 32 तत्व होने चाहिए।
3.5 आप तत्व कहां रखेंगे जिसकी परमाणु संख्या $Z=114$ है? आवर्त और समूह के अनुसार बताइए।
उत्तर दिखाएं
उत्तर
परमाणु संख्या $\mathrm{Z}=114$ वाले तत्व की इलेक्ट्रॉनिक विन्यास $[Rn] 5f^{14} 6d^{10} 7s^2 7p^2$ होता है।
इसलिए, तत्व सातवें आवर्त में स्थित है। इलेक्ट्रॉन प उपकक्षा में प्रवेश करते हैं। इसलिए, यह प ब्लॉक में स्थित है। समूह संख्या $10+4=14$ है।
तत्व फ्लरोवियम है।
इसलिए, तत्व सातवें आवर्त और $14^{\text{th}}$ समूह में स्थित है।
3.6 आवर्त सारणी के तीसरे आवर्त और सत्रहवें समूह में उपस्थित तत्व की परमाणु संख्या लिखिए।
उत्तर दिखाएं
उत्तर
$n=3$
$\text{ समूह }=10+(n s+n p) $
$ 17=10+(3 s+3 p) $
$ 3 s+3 p=17-10 $
$ \Rightarrow 3 s+3 p=7 $
$ \Rightarrow 2+3 p=7 $
$ \Rightarrow 3 p=7-2 $
$ \Rightarrow 3 p=5 $
$ z=1 s^2 2 s^2 2 p^6 3 s^2 3 p^5$
$ \text{परमाणु क्रमांक }= 17 \hspace{0.8mm }i.e.\text { क्लोरीन }$
3.7 आपका अनुमान होगा कि कौन सा तत्व निम्नलिखित द्वारा नामित किया गया होगा?
(i) लॉरेंस बेरकली प्रयोगशाला
(ii) सीबर्ग के समूह द्वारा?
उत्तर दिखाएं
उत्तर
(i) लॉरेंसियम (Lr) $Z=103$ और बर्केलियम (Bk) $Z=97$
(ii) सीबर्गियम $(Sg)$ $Z=106$
3.8 एक समूह में तत्वों के भौतिक और रासायनिक गुण समान क्यों होते हैं?
उत्तर दिखाएं
उत्तर
तत्वों के भौतिक और रासायनिक गुण उनके संयोजक इलेक्ट्रॉन की संख्या पर निर्भर करते हैं। एक ही समूह में उपस्थित तत्वों के संयोजक इलेक्ट्रॉन की संख्या समान होती है। इसलिए, एक ही समूह में उपस्थित तत्वों के भौतिक और रासायनिक गुण समान होते हैं।
3.9 परमाणु त्रिज्या और आयन त्रिज्या आपके लिए क्या अर्थ होते हैं?
उत्तर दिखाएं
उत्तर
परमाणु त्रिज्या :
परमाणु त्रिज्या एक ही तत्व के दो सहसंयोजी आबंधित परमाणुओं के नाभिक के बीच की दूरी के आधे के बराबर होती है। मेटल के मामले में, परमाणु त्रिज्या को धातु त्रिज्या कहा जाता है। यह एक क्रिस्टल लेटिस में दो समीपवर्ती परमाणुओं के बीच की दूरी के आधे के बराबर होती है।
आयन त्रिज्या :
आयन त्रिज्या आयन के आकार को बताता है, एक धनायन या ऋणायन। यह आयन के नाभिक से तक उपलब्ध असर की दूरी को बताता है।
धनायन का आकार मूल परमाणु के आकार से हमेशा छोटा होता है जबकि ऋणायन का आकार मूल परमाणु के आकार से हमेशा बड़ा होता है।
3.10 परमाणु त्रिज्या एक आवर्त और एक समूह में कैसे बदलती है? आप इस बदलाव को कैसे समझ सकते हैं?
उत्तर दिखाएं
उत्तर
परमाणु त्रिज्या आवर्त में बाएँ से दाएँ घटती जाती है। इसका कारण यह है कि एक आवर्त में, बाहरी इलेक्ट्रॉन समान वलेंस शेल में होते हैं और आवर्त में बाएँ से दाएँ आवर्त बढ़ते हैं, जिसके कारण प्रभावी नाभिकीय आवेश बढ़ता है। इसके परिणामस्वरूप, इलेक्ट्रॉन के नाभिक की ओर आकर्षण बढ़ता है।
दूसरी ओर, परमाणु त्रिज्या एक समूह में नीचे जाने से आमतौर पर बढ़ती जाती है। इसका कारण यह है कि एक समूह में नीचे जाने से मुख्य क्वांटम संख्या $(n)$ बढ़ती जाती है, जिसके परिणामस्वरूप नाभिक और मूल इलेक्ट्रॉन के बीच की दूरी बढ़ जाती है।
3.11 आपको आइसोइलेक्ट्रॉनिक वस्तुओं के बारे में क्या समझ आ रहा है? निम्नलिखित परमाणु या आयनों के साथ आइसोइलेक्ट्रॉनिक वस्तुओं के नाम बताइए।
(i) $\mathrm{F}^{-}$
(ii) Ar
(iii) $\mathrm{Mg}^{2+}$
(iv) $\mathrm{Rb}^{+}$
उत्तर दिखाएं
उत्तर
इलेक्ट्रॉन की समान संख्या वाले परमाणु और आयन आइसोइलेक्ट्रॉनिक वस्तुएं कहलाते हैं।
(i) $F^{-}$ आयन में $9+1=10 \text{ इलेक्ट्रॉन}$ होते हैं। इसलिए, इसके साथ आइसोइलेक्ट्रॉनिक वस्तुएं भी $10 \text{ इलेक्ट्रॉन}$ रखती होंगी। इसके कुछ आइसोइलेक्ट्रॉनिक वस्तुएं $Na^{+}$ आयन $(11 - 1=10 \text{ इलेक्ट्रॉन})$, $Ne (10 \text{ इलेक्ट्रॉन})$, $O^{2-}$ आयन $(8+2=10 \text{ इलेक्ट्रॉन})$, और $Al^{3+}$ आयन $(13 - 3=10 \text{ इलेक्ट्रॉन})$ हैं।
(ii) Ar में 18 इलेक्ट्रॉन होते हैं। इसलिए, इसके साथ आइसोइलेक्ट्रॉनिक वस्तुएं भी 18 इलेक्ट्रॉन रखती होंगी। इसके कुछ आइसोइलेक्ट्रॉनिक वस्तुएं $S^{2-}$ आयन $(16+2=18 \text{ इलेक्ट्रॉन})$, $Cl^{-}$ आयन $(17+1=18 \text{ इलेक्ट्रॉन})$, $K^{+}$ आयन $(19-1=18 \text{ इलेक्ट्रॉन})$, और $Ca^{2+}$ आयन $(20 - 2 = 18 \text{ इलेक्ट्रॉन})$ हैं।
(iii) $Mg^{2+}$ आयन में $12-2=10 \text{ इलेक्ट्रॉन}$ होते हैं। इसलिए, इसके साथ आइसोइलेक्ट्रॉनिक वस्तुएं भी $10 \text{ इलेक्ट्रॉन}$ रखती होंगी। इसके कुछ आइसोइलेक्ट्रॉनिक वस्तुएं $F^{-}$ आयन $(9+1=10 \text{ इलेक्ट्रॉन})$, $Ne (10 \text{ इलेक्ट्रॉन})$, $O^{2-}$ आयन $(8+2=10 \text{ इलेक्ट्रॉन})$, और $Al^{3+}$ आयन $(13 - 3 = 10 \text{ इलेक्ट्रॉन})$ हैं।
(iv) $Rb^{+}$ आयन में $37-1=36 \text{ इलेक्ट्रॉन}$ होते हैं। इसलिए, इसके साथ आइसोइलेक्ट्रॉनिक वस्तुएं भी $36 \text{ इलेक्ट्रॉन}$ रखती होंगी। इसके कुछ आइसोइलेक्ट्रॉनिक वस्तुएं $Br$ आयन $( 35+1=36 \text{ इलेक्ट्रॉन})$, $Kr (36 \text{ इलेक्ट्रॉन})$, और $Sr^{2+}$ आयन $( 38 - 2=36 \text{ इलेक्ट्रॉन})$ हैं।
3.12 निम्नलिखित वस्तुओं को ध्यान में रखें :
$\mathrm{N}^{3-}, \mathrm{O}^{2-}, \mathrm{F}^{-}, \mathrm{Na}^{+}, \mathrm{Mg}^{2+}$ और $\mathrm{Al}^{3+}$
(a) उनमें क्या सामान्य है?
(b) उन्हें आयनिक त्रिज्या में बढ़ते क्रम में व्यवस्थित करें।
उत्तर दिखाएं
उत्तर
(a) दिए गए विशिष्ट (आयन) प्रत्येक के पास 10 इलेक्ट्रॉन की समान संख्या होती है। इसलिए, दिए गए विशिष्ट आयोनिक त्रिज्या के बराबर होते हैं।
(b) आयोनिक त्रिज्या के आयोनिक विशिष्ट बढ़ते क्रम में नाभिकीय आवेश के मान में कमी के साथ बढ़ती है।
दिए गए विशिष्ट के नाभिकीय आवेश के बढ़ते क्रम में व्यवस्था निम्नलिखित है:
$ N^{3-} < O^{2-} < F < Na^{+} < Mg^{2+} < Al^{3+}$
नाभिकीय आवेश $= 7 < 8 < 9 < 11 < 12 < 13$
इसलिए, दिए गए विशिष्ट के आयोनिक त्रिज्या के बढ़ते क्रम में व्यवस्था निम्नलिखित है:
$Al^{3+} < Mg^{2+} < Na^{+} < F < O^{2-} < N^{3-}$
3.13 क्यों आयन अपने मूल परमाणु की तुलना में छोटे और ऋणायन बड़े होते हैं?
उत्तर दिखाएं
उत्तर
एक आयन अपने मूल परमाणु की तुलना में कम इलेक्ट्रॉन रखता है, जबकि इसका नाभिकीय आवेश समान रहता है। इसके परिणामस्वरूप, आयन में इलेक्ट्रॉन के नाभिक की ओर आकर्षण अपने मूल परमाणु की तुलना में अधिक होता है। इसलिए, आयन अपने मूल परमाणु की तुलना में छोटा होता है।
दूसरी ओर, एक ऋणायन अपने मूल परमाणु की तुलना में एक या अधिक इलेक्ट्रॉन रखता है, जिसके परिणामस्वरूप इलेक्ट्रॉन के बीच प्रतिकर्षण बढ़ जाता है और प्रभावी नाभिकीय आवेश कम हो जाता है। इसलिए, ऋणायन में मूल परमाणु की तुलना में मूल इलेक्ट्रॉन और नाभिक के बीच दूरी अधिक होती है। इसलिए, ऋणायन अपने मूल परमाणु की तुलना में बड़ा होता है।
3.14 आयनन एंथैल्पी और इलेक्ट्रॉन ग्रहण एंथैल्पी को परिभाषित करते समय ‘आइसोलेटेड गैस एटॉम’ और ‘ग्राउंड स्टेट’ शब्दों के महत्व क्या है?
संकेत: तुलना के लिए आवश्यकताएं।
उत्तर दिखाएं
उत्तर
आयनन एंथैल्पी एक आइसोलेटेड गैस एटॉम के ग्राउंड स्टेट में एक इलेक्ट्रॉन को हटाने के लिए आवश्यक ऊर्जा होती है। भले ही गैसीय अवस्था में परमाणु बहुत दूर होते हैं, लेकिन वे एक दूसरे के आकर्षण बलों के कारण थोड़ा सा आकर्षण बल रखते हैं।
परमाणु। आयनन एंथैल्पी का निर्धारण करने के लिए, एक अकेले परमाणु को अलग करना संभव नहीं है। लेकिन, दबाव कम करके आकर्षण बल को और भी कम किया जा सकता है। इस कारण, आयनन एंथैल्पी के परिभाषा में ‘अकेला गैसीय परमाणु’ शब्द का उपयोग किया जाता है।
एक परमाणु के आधार अवस्था का अर्थ है एक परमाणु की सबसे स्थिर अवस्था। यदि एक अकेला गैसीय परमाणु अपनी आधार अवस्था में है, तो उसके इलेक्ट्रॉन को हटाने के लिए कम ऊर्जा की आवश्यकता होती है। इसलिए, तुलना के उद्देश्यों के लिए, आयनन एंथैल्पी और इलेक्ट्रॉन ग्रहण एंथैल्पी के लिए एक ‘अकेला गैसीय परमाणु’ और इसकी ‘आधार अवस्था’ के लिए निर्धारण किया जाना चाहिए।
3.15 हाइड्रोजन परमाणु के आधार अवस्था में इलेक्ट्रॉन की ऊर्जा $-2.18 \times 10^{-18} \mathrm{~J}$ है। परमाणुक हाइड्रोजन की आयनन एंथैल्पी की गणना करें जो $\mathrm{J} \hspace{0.5mm } \mathrm{mol}^{-1}$ में हो।
संकेत: उत्तर के लिए मोल की अवधारणा का उपयोग करें।
उत्तर दिखाएं
उत्तर
दिया गया है कि हाइड्रोजन परमाणु के आधार अवस्था में इलेक्ट्रॉन की ऊर्जा $2.18 \times 10^{-18} \hspace{0.5mm } J$ है।
इसलिए, हाइड्रोजन परमाणु के आधार अवस्था से उस इलेक्ट्रॉन को हटाने के लिए आवश्यक ऊर्जा $2.18 \times 10^{-18} \hspace{0.5mm } J$ है।
$\therefore$ परमाणुक हाइड्रोजन की आयनन एंथैल्पी $=2.18 \times 10^{-18} \hspace{0.5mm } J$
इसलिए, परमाणुक हाइड्रोजन की आयनन एंथैल्पी $J \hspace{0.5mm } mol^{{-1}}$ में $=2.18 \times 10^{-18} \hspace{0.5mm } J \hspace{0.5mm } mol^{-1} \times 6.02 \times 10^{23} \hspace{0.5mm } J \hspace{0.5mm } mol^{-1}$
$\hspace{11.6cm }=1.31 \times 10^{6} \hspace{0.5mm } J$ $mol^{{-1}}$
3.16 द्वितीय आवर्त तत्वों में वास्तविक आयनन एंथैल्पी का क्रम $\mathrm{Li}<\mathrm{B}<\mathrm{Be}<\mathrm{C}<\mathrm{O}<\mathrm{N}<\mathrm{F}<\mathrm{Ne}$ है।
स्पष्ट करें कि
(i) $Be$ के $\Delta_{i} H$ $B$ से अधिक है
(ii) $O$ के $\Delta_{i} H$ $N$ और $F$ से कम है?
उत्तर दिखाएं
उत्तर
(i) आयनन प्रक्रिया के दौरान, बेरिलियम परमाणु से हटाए जाने वाले इलेक्ट्रॉन $2 s$-इलेक्ट्रॉन है, जबकि बोरॉन परमाणु से हटाए जाने वाले इलेक्ट्रॉन $2 p$-इलेक्ट्रॉन है। अब, $2 s$-इलेक्ट्रॉन $2 p$-इलेक्ट्रॉन की तुलना में नाभिक से अधिक जुड़े होते हैं। इसलिए, बेरिलियम के $2 s$-इलेक्ट्रॉन को हटाने के लिए अधिक ऊर्जा की आवश्यकता होती है जो बोरॉन के $2 p$-इलेक्ट्रॉन को हटाने के लिए आवश्यक ऊर्जा से अधिक होती है। इसलिए, बेरिलियम के $\Delta_i H$ बोरॉन से अधिक होता है।
(ii) नाइट्रोजन में, नाइट्रोजन के तीन $2 p$-इलेक्ट्रॉन तीन अलग-अलग परमाणु कक्षक में बसे होते हैं। हालांकि, ऑक्सीजन में, ऑक्सीजन के चार $2 p$-इलेक्ट्रॉन में से दो एक ही $2 p$-कक्षक में बसे होते हैं। इसके परिणामस्वरूप, ऑक्सीजन परमाणु में इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकर्षण बढ़ जाता है। इस कारण, ऑक्सीजन से चौथे $2 p$-इलेक्ट्रॉन को हटाने के लिए आवश्यक ऊर्जा नाइट्रोजन से एक तीन $2 p$-इलेक्ट्रॉन को हटाने के लिए आवश्यक ऊर्जा की तुलना में कम होती है। इसलिए, ऑक्सीजन के $\Delta_i H$ नाइट्रोजन के तुलना में कम होता है।
फ्लूओरीन में, ऑक्सीजन की तुलना में एक इलेक्ट्रॉन और एक प्रोटॉन अधिक होते हैं। जैसे ही इलेक्ट्रॉन एक ही कोश में जोड़ा जाता है, नाभिकीय आकर्षण में वृद्धि (एक प्रोटॉन के जोड़ने के कारण) इलेक्ट्रॉनिक प्रतिकर्षण में वृद्धि (एक इलेक्ट्रॉन के जोड़ने के कारण) से अधिक होती है। इसलिए, फ्लूओरीन परमाणु के बाहरी कक्षक इलेक्ट्रॉन ऑक्सीजन के इलेक्ट्रॉन की तुलना में अधिक प्रभावी नाभिकीय आवेश का अनुभव करते हैं। इस कारण, फ्लूओरीन परमाणु से एक इलेक्ट्रॉन हटाने के लिए आवश्यक ऊर्जा ऑक्सीजन परमाणु से एक इलेक्ट्रॉन हटाने के लिए आवश्यक ऊर्जा की तुलना में अधिक होती है। इसलिए, ऑक्सीजन के $\Delta_i H$ फ्लूओरीन के तुलना में कम होता है।
3.17 आप बताइए कि सोडियम के प्रथम आयनन एन्थैल्पी मैग्नीशियम के तुलना में कम होता है लेकिन इसका द्वितीय आयनन एन्थैल्पी मैग्नीशियम के तुलना में अधिक होता है, इस तथ्य को कैसे समझाएंगे?
उत्तर दिखाएं
उत्तर
सोडियम का प्रथम आयनन एन्थैल्पी मैग्नीशियम के तुलना में कम होता है। इसका मुख्य कारण दो कारणों के कारण होता है:
- सोडियम का परमाणु आकार मैग्नीशियम के तुलना में अधिक होता है
- मैग्नीशियम का प्रभावी नाभिकीय आवेश सोडियम के तुलना में अधिक होता है
इन कारणों से, मैग्नीशियम से एक इलेक्ट्रॉन हटाने के लिए आवश्यक ऊर्जा सोडियम से एक इलेक्ट्रॉन हटाने के लिए आवश्यक ऊर्जा की तुलना में अधिक होती है। इसलिए, सोडियम का प्रथम आयनन एन्थैल्पी मैग्नीशियम के तुलना में कम होता है।
हालांकि, सोडियम का द्वितीय आयनन एन्थैल्पी मैग्नीशियम के तुलना में अधिक होता है। इसका कारण यह है कि एक इलेक्ट्रॉन हटाने के बाद, सोडियम नींबू गैस कॉन्फ़िगरेशन के स्थायी रूप ले लेता है। दूसरी ओर, मैग्नीशियम, एक इलेक्ट्रॉन हटाने के बाद भी 3s-कक्षक में एक इलेक्ट्रॉन बचा रहता है। स्थायी नींबू गैस कॉन्फ़िगरेशन प्राप्त करने के लिए इसे एक और इलेक्ट्रॉन हटाना पड़ता है। इसलिए, सोडियम में द्वितीय इलेक्ट्रॉन हटाने के लिए आवश्यक ऊर्जा मैग्नीशियम में द्वितीय इलेक्ट्रॉन हटाने के लिए आवश्यक ऊर्जा की तुलना में बहुत अधिक होती है। इसलिए, सोडियम का द्वितीय आयनन एन्थैल्पी मैग्नीशियम के तुलना में अधिक होता है।
3.18 मुख्य समूह तत्वों के आयनन py के घटते होने के विभिन्न कारक कौन से हैं?
उत्तर दिखाएं
उत्तर
मुख्य समूह तत्वों के आयनन py के घटते होने के जिम्मेदार कारक नीचे दिए गए हैं:
(i) तत्वों के परमाणु आकार में वृद्धि : एक समूह में नीचे जाने पर शेल की संख्या बढ़ती जाती है। इसके परिणामस्वरूप, एक समूह में नीचे जाने पर परमाणु आकार धीरे-धीरे बढ़ता जाता है। जैसे तत्व के मूल इलेक्ट्रॉन नाभिक से दूर होते जाते हैं, वे नाभिक द्वारा अधिक तीव्रता से बंधे नहीं रहते। इसलिए, एक समूह में नीचे जाने पर आयनन ऊर्जा कम हो जाती है।
(ii) छायांकन प्रभाव में वृद्धि : एक समूह में नीचे जाने पर आंतरिक शेल के इलेक्ट्रॉनों की संख्या बढ़ती जाती है। इसलिए, आंतरिक नाभिक के इलेक्ट्रॉन द्वारा मूल इलेक्ट्रॉनों के छायांकन के प्रभाव एक समूह में नीचे जाने पर बढ़ता जाता है। इसके परिणामस्वरूप, मूल इलेक्ट्रॉन नाभिक द्वारा अधिक तीव्रता से बंधे नहीं रहते। इसलिए, मूल इलेक्ट्रॉन को हटाने के लिए आवश्यक ऊर्जा एक समूह में नीचे जाने पर कम हो जाती है।
3.19 समूह 13 तत्वों के पहले आयनन ऊर्जा मान (kJ mol⁻¹ में) नीचे दिए गए हैं:
$ \begin{array}{ccccc} \mathrm{B} & \mathrm{Al}& \mathrm{Ga} & \mathrm{In} & \mathrm{Tl} \\ \\ 801 & 577 & 579 & 558 & 589 \end{array} $
इस विचलन को आम प्रवृत्ति से कैसे समझाएंगे?
उत्तर दिखाएं
उत्तर
एक समूह में नीचे जाने पर आयनन ऊर्जा आमतौर पर कम हो जाती है, क्योंकि परमाणु आकार में वृद्धि और छायांकन के कारण। इसलिए, समूह 13 में नीचे जाने पर B से Al तक आयनन ऊर्जा कम हो जाती है। लेकिन, Ga के आयनन ऊर्जा Al की अपेक्षा अधिक है। Al, s-ब्लॉक तत्वों के तुरंत बाद आता है, जबकि Ga, d-ब्लॉक तत्वों के बाद आता है। d-इलेक्ट्रॉन द्वारा छायांकन कम प्रभावी होता है। इन इलेक्ट्रॉन वैलेंस इलेक्ट्रॉन को अधिक प्रभावी रूप से छायांकन नहीं करते हैं। इसलिए, Ga के वैलेंस इलेक्ट्रॉन नाभिक द्वारा अधिक प्रभावी नाभिकीय आवेश का अनुभव करते हैं, जो Al के वैलेंस इलेक्ट्रॉन की तुलना में अधिक है। इसके अलावा, Ga से In तक आयनन ऊर्जा कम हो जाती है, क्योंकि परमाणु आकार में वृद्धि और छायांकन के कारण। लेकिन, In से Tl तक आयनन ऊर्जा फिर से बढ़ जाती है। आवर्त सारणी में, Tl, 4f और 5d इलेक्ट्रॉन के बाद आता है। इन ऑर्बिटल में इलेक्ट्रॉन द्वारा छायांकन कम प्रभावी होता है। इसलिए, वैलेंस इलेक्ट्रॉन नाभिक द्वारा बहुत मजबूती से बंधे रहते हैं। इसलिए, Tl की आयनन ऊर्जा उच्च ओर बढ़ जाती है।
3.20 निम्नलिखित तत्वों के युग्म में से कौनसा इलेक्ट्रॉन ग्रहण py के अधिक नकारात्मक होगा?
(i) $\mathrm{O}$ या $\mathrm{F}$
(ii) $\mathrm{F}$ या $\mathrm{Cl}$
उत्तर दिखाएं
Answer
(i) $O$ और $F$ आवर्त सारणी के एक ही आवर्त में उपस्थित हैं। $F$ परमाणु में $O$ के तुलना में एक प्रोटॉन और एक इलेक्ट्रॉन अधिक होता है और इलेक्ट्रॉन को समान कोश में जोड़ा जाता है, इसलिए $F$ का परमाणु आकार $O$ के आकार से छोटा होता है। चूंकि $F$ के परमाणु में $O$ के परमाणु के तुलना में एक प्रोटॉन अधिक होता है, इसलिए $F$ के नाभिक इलेक्ट्रॉन को अधिक तीव्रता से आकर्षित कर सकता है। इसके अतिरिक्त, $F$ को एक इलेक्ट्रॉन के अधिग्रहण से अनुरक्षित नोबल गैस विन्यास प्राप्त हो जाता है। इसलिए, $F$ का इलेक्ट्रॉन ग्रहण py $O$ के इलेक्ट्रॉन ग्रहण py से अधिक नकारात्मक होता है।
(ii) $F$ और $Cl$ आवर्त सारणी के एक ही समूह में उपस्थित हैं। आम तौर पर, एक समूह में नीचे जाने पर इलेक्ट्रॉन ग्रहण py कम नकारात्मक हो जाता है। हालांकि, इस मामले में $Cl$ के इलेक्ट्रॉन ग्रहण py का मान $F$ के इलेक्ट्रॉन गैस ग्रहण py से अधिक नकारात्मक होता है। इसका कारण यह है कि $F$ का परमाणु आकार $Cl$ के परमाणु आकार से छोटा होता है। $F$ में इलेक्ट्रॉन $n=2$ के क्वांटम स्तर में जोड़ा जाता है, जबकि $Cl$ में इलेक्ट्रॉन $n=3$ के क्वांटम स्तर में जोड़ा जाता है। इसलिए, $Cl$ में इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकर्षण कम होता है और एक अतिरिक्त इलेक्ट्रॉन को आसानी से स्थान दिया जा सकता है। इसलिए, $Cl$ का इलेक्ट्रॉन ग्रहण py $F$ के इलेक्ट्रॉन ग्रहण py से अधिक नकारात्मक होता है।
3.21 क्या आप $O$ के द्वितीय इलेक्ट्रॉन ग्रहण py को धनात्मक, अधिक नकारात्मक या कम नकारात्मक अपेक्षित करेंगे? अपने उत्तर की व्याख्या करें।
उत्तर दिखाएं
Answer
जब एक इलेक्ट्रॉन $O$ परमाणु में जोड़ा जाता है ताकि $O^{-}$ आयन बने, तो ऊर्जा विमुक्त होती है। इसलिए, $O$ का प्रथम इलेक्ट्रॉन ग्रहण py नकारात्मक होता है।
$ O {(g)}+e^{-} \longrightarrow O {(g)}^{-} $
दूसरी ओर, जब एक इलेक्ट्रॉन $O^{-}$ आयन में जोड़ा जाता है ताकि $O^{2-}$ आयन बने, तो ऊर्जा के अतिरिक्त देना पड़ता है ताकि तीव्र इलेक्ट्रॉनिक प्रतिकर्षण को दूर किया जा सके। इसलिए, $O$ का द्वितीय इलेक्ट्रॉन ग्रहण py धनात्मक होता है।
$ O {(g)}^{-}+e^{-} \longrightarrow O {(g)}^{2-} $
3.22 इलेक्ट्रॉन ग्रहण py और विद्युत ऋणात्मकता के बीच मूल अंतर क्या है?
उत्तर दिखाएं
Answer
इलेक्ट्रॉन ग्रहण py एक विच्छिन्न गैसीय परमाणु के एक इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति के माप को दर्शाता है, जबकि विद्युत ऋणात्मकता एक रासायनिक यौगिक में एक परमाणु के साझा इलेक्ट्रॉन युग्म को आकर्षित करने की प्रवृत्ति के माप को दर्शाता है।
3.23 यह कथन कि पॉलिंग स्केल पर नाइट्रोजन की विद्युत ऋणात्मकता सभी नाइट्रोजन यौगिकों में 3.0 होती है, के बारे में आप कैसे अपना विचार रखेंगे?
उत्तर दिखाएं
Answer
एक तत्व की विद्युत ऋणात्मकता एक चर गुण है। यह विभिन्न यौगिकों में अलग-अलग होती है। अतः, यह कथन गलत है जो कहता है कि पॉलिंग स्केल पर सभी नाइट्रोजन यौगिकों में नाइट्रोजन की विद्युत ऋणात्मकता 3.0 होती है। नाइट्रोजन की विद्युत ऋणात्मकता $NH_3$ और $NO_2$ में अलग-अलग होती है।
3.24 आप एक परमाणु के व्यास के संबंध में इसके इलेक्ट्रॉन लेने या छोड़ने के संबंध में कौन सा सिद्धांत वर्णन करेंगे?
(a) एक इलेक्ट्रॉन लेने के बाद
(b) एक इलेक्ट्रॉन छोड़ने के बाद
उत्तर दिखाएं
Answer
(a) जब एक परमाणु एक इलेक्ट्रॉन लेता है, तो इसका आकार बढ़ जाता है। जब एक इलेक्ट्रॉन जोड़ा जाता है, तो इलेक्ट्रॉनों की संख्या एक बढ़ जाती है। इसके परिणामस्वरूप इलेक्ट्रॉनों के बीच प्रतिकर्षण बढ़ जाता है। हालांकि, प्रोटॉन की संख्या अपरिवर्तित रहती है। इसके परिणामस्वरूप परमाणु के प्रभावी नाभिकीय आवेश कम हो जाता है और परमाणु की त्रिज्या बढ़ जाती है।
(b) जब एक परमाणु एक इलेक्ट्रॉन छोड़ता है, तो इलेक्ट्रॉनों की संख्या एक कम हो जाती है जबकि नाभिकीय आवेश अपरिवर्तित रहता है। इसलिए, परमाणु में इलेक्ट्रॉनों के बीच प्रतिकर्षण कम हो जाता है। इसके परिणामस्वरूप प्रभावी नाभिकीय आवेश बढ़ जाता है। अतः, परमाणु की त्रिज्या कम हो जाती है।
3.25 एक ही तत्व के दो समस्थानिकों के लिए पहला आयनन एंथैल्पी एक ही होगी या अलग-अलग? अपने उत्तर की व्याख्या करें।
उत्तर दिखाएं
Answer
एक परमाणु की आयनन एंथैल्पी उस परमाणु के इलेक्ट्रॉन और प्रोटॉन (नाभिकीय आवेश) की संख्या पर निर्भर करती है। अब, एक तत्व के समस्थानिक उस तत्व के एक ही संख्या के प्रोटॉन और इलेक्ट्रॉन रखते हैं। अतः, एक ही तत्व के दो समस्थानिकों के लिए पहला आयनन एंथैल्पी एक ही होगी।
3.26 धातु और अधातुओं में मुख्य अंतर क्या हैं?
उत्तर दिखाएं
उत्तर
| धातु | अधातु | ||
|---|---|---|---|
| 1. | धातु आसानी से इलेक्ट्रॉन खो सकते हैं। | 1. | अधातु आसानी से इलेक्ट्रॉन खो नहीं सकते हैं। |
| 2. | धातु आसानी से इलेक्ॉन लेने में असमर्थ होते हैं। | 2. | अधातु आसानी से इलेक्ट्रॉन ले सकते हैं। |
| 3. | धातु आमतौर पर आयनिक यौगिक बनाते हैं। | 3. | अधातु आमतौर पर सहसंयोजक यौगिक बनाते हैं। |
| 4. | धातु ऑक्साइड मूलतः क्षारकीय प्रकृति के होते हैं। | 4. | अधातु ऑक्साइड मूलतः अम्लीय प्रकृति के होते हैं। |
| 5. | धातु कम आयनन एन्थैल्पी के होते हैं। | 5. | अधातु उच्च आयनन एन्थैल्पी के होते हैं। |
| 6. | धातु कम नकारात्मक इलेक्ट्रॉन ग्रहण एन्थैल्पी के होते हैं। | 6. | अधातु उच्च नकारात्मक इलेक्ट्रॉन ग्रहण एन्थैल्पी के होते हैं। |
| 7. | धातु कम विद्युत ऋणात्मकता के होते हैं। वे बजाय विद्युत धनात्मक तत्व होते हैं। | 7. | अधातु विद्युत ऋणात्मक होते हैं। |
| 8. | धातु उच्च अपचायक शक्ति के होते हैं। | 8. | अधातु निम्न अपचायक शक्ति के होते हैं। |
3.27 आवर्त सारणी का उपयोग करके निम्नलिखित प्रश्नों के उत्तर दें।
(a) बाहरी सबशेल में पांच इलेक्ट्रॉन वाला तत्व कौन सा है?
(b) दो इलेक्ट्रॉन खो देने की प्रवृत्ति रखने वाला तत्व कौन सा है?
(c) दो इलेक्ट्रॉन लेने की प्रवृत्ति रखने वाला तत्व कौन सा है?
(d) कौन सा समूह तापमान के अनुसार धातु, अधातु, तरल और गैस दोनों के रूप में उपलब्ध होता है?
उत्तर दिखाएं
उत्तर
(a) एक तत्व के बाहरी सबशेल में 5 इलेक्ट्रॉन होने पर इसकी इलेक्ट्रॉनिक विन्यास $n s^{2} n p^{5}$ होता है। यह हैलोजन समूह के इलेक्ट्रॉनिक विन्यास है। इसलिए, तत्व $F, Cl, Br, I$ हो सकते हैं।
(b) एक तत्व जो दो इलेक्ट्रॉन खो देने की प्रवृत्ति रखता है, नाबू गैस विन्यास प्राप्त करने के लिए आसानी से दो इलेक्ट्रॉन खो सकता है। ऐसे तत्व के सामान्य इलेक्ट्रॉनिक विन्यास $n s^{2}$ होता है। यह समूह 2 के तत्वों के इलेक्ट्रॉनिक विन्यास है। समूह 2 में उपस्थित तत्व $Be, Mg, Ca, Sr$ हैं।
(c) एक तत्व जो दो इलेक्ट्रॉन लेने की प्रवृत्ति रखता है, नाबू गैस विन्यास प्राप्त करने के लिए दो इलेक्ट्रॉन ले सकता है। इसलिए, ऐसे तत्व के सामान्य इलेक्ट्रॉनिक विन्यास $n s^{2} n p^{4}$ होता है। यह ऑक्सीजन परिवार के इलेक्ट्रॉनिक विन्यास है।
(d) समूह 17 में कमरे के तापमान पर धातु, अधातु, तरल तथा गैस भी होते हैं।
3.28 समूह 1 तत्वों में प्रतिक्रियाशीलता के बढ़ते क्रम के बारे में $\mathrm{Li}<\mathrm{Na}<\mathrm{K}<\mathrm{Rb}<\mathrm{Cs}$ है, जबकि समूह 17 तत्वों में प्रतिक्रियाशीलता के घटते क्रम के बारे में $\mathrm{F}>\mathrm{Cl}>\mathrm{Br}>\mathrm{I}$ है। समझाइए।
उत्तर दिखाएं
Answer
समूह 1 में उपस्थित तत्वों में केवल 1 संयोजक इलेक्ट्रॉन होता है, जिसे वे खो देने की प्रवृत्ति रखते हैं। दूसरी ओर, समूह 17 के तत्वों के लिए नोबल गैस विन्यास प्राप्त करने के लिए केवल एक इलेक्ट्रॉन की आवश्यकता होती है। समूह 1 में नीचे जाने पर आयनन एन्थैल्पी कम होती जाती है। इसका अर्थ यह है कि वैलेंस इलेक्ट्रॉन को खोने के लिए आवश्यक ऊर्जा कम होती जाती है। इसलिए, एक समूह में नीचे जाने पर प्रतिक्रियाशीलता बढ़ती जाती है। इसलिए, समूह 1 तत्वों में प्रतिक्रियाशीलता के बढ़ते क्रम निम्नलिखित है:
$Li<Na<K<Rb<Cs$
समूह 17 में, जब हम $Cl$ से $I$ तक नीचे जाते हैं, तो इलेक्ट्रॉन ग्रहण एन्थैल्पी कम ऋणात्मक हो जाती है, अर्थात इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति समूह 17 में नीचे जाने पर कम होती जाती है। इसलिए, प्रतिक्रियाशीलता एक समूह में नीचे जाने पर कम होती जाती है। $F$ की इलेक्ट्रॉन ग्रहण एन्थैल्पी $Cl$ की तुलना में कम ऋणात्मक होती है। फिर भी, यह सबसे अधिक प्रतिक्रियाशील हैलोजन है। इसका कारण इसकी कम बंधन वियोजन ऊर्जा होना है। इसलिए, समूह 17 तत्वों में प्रतिक्रियाशीलता के घटते क्रम निम्नलिखित है:
$F>Cl>Br>I$
3.29 $s{-}, p{-}, d$ - तथा $f$ - ब्लॉक तत्वों की सामान्य बाहरी इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर दिखाएं
Answer
| तत्व | सामान्य बाहरी इलेक्ट्रॉनिक विन्यास |
|---|---|
| s-ब्लॉक | $ n s^{1-2} $, जहाँ $ n=2-7 $ |
| p-ब्लॉक | $ n s^{2} n p^{1-6} $, जहाँ $ n=2-6 $ |
| d-ब्लॉक | $ (n-1) d^{1-10} n s^{0-2} $, जहाँ $ n=4-7 $ |
| f-ब्लॉक | $ (n-2) f^{1-14}(n-1) d^{0-10} n s^{2} $, जहाँ $ n=6-7 $ |
3.30 बाहरी इलेक्ट्रॉनिक विन्यास के अनुसार तत्व की स्थिति निर्धारित कीजिए।
(i) $n s^{2} n p^{4}$ जहाँ $n=3$
(ii) $(n-1) d^{2} n s^{2}$ जहाँ $n=4$, और
(iii) $(n-2) f^{7}(n-1) d^{1} n s^{2}$ जब $n=6$ हो, तत्व perioic table में।
उत्तर दिखाएं
Answer
(i) जब $\mathrm{n}=3$ हो, तत्व के अंतर्भुक्त आवर्त है तीसरा। इलेक्ट्रॉनिक विन्यास $3 \mathrm{s}^2 3 \mathrm{p}^4$ है और तत्व p ब्लॉक में है।
तत्व की समूह संख्या = $10+$ बाह्य कोश में इलेक्ट्रॉन की संख्या।
$ \hspace{6.1cm}=10+6=1 $
इसलिए, तत्व तीसरे आवर्त और सोलहवें समूह में है।
(ii) जब $\mathrm{n}=4$ हो, तत्व के अंतर्भुक्त आवर्त है चौथा। इलेक्ट्रॉनिक विन्यास $3 \mathrm{d}^2 4 \mathrm{s}^2$ है और तत्व d ब्लॉक में है।
तत्व की समूह संख्या $=$ $(\mathrm{n}-1) \mathrm{d}$ उप-कोश में इलेक्ट्रॉन की संख्या + ns उप-कोश में इलेक्ट्रॉन की संख्या $=2+2=4$
इसलिए, तत्व चौथे आवर्त और चौथे समूह में है।
(iii) जब $\mathrm{n}=6$ हो, तत्व के अंतर्भुक्त आवर्त है छठा। इलेक्ट्रॉनिक विन्यास $4 \mathrm{f}^7 5 \mathrm{d}^1 6 \mathrm{s}^2$ है और तत्व f ब्लॉक में है। सभी f ब्लॉक तत्व तीसरे समूह में हैं।
इसलिए, तत्व छठे आवर्त और तीसरे समूह में है।
3.31 कुछ तत्वों के प्रथम $\left(\Delta_{i} H_{1}\right)$ और द्वितीय $\left(\Delta_{i} H_{2}\right)$ आयनन pies (in $\left.\mathrm{kJ} \hspace{0.5mm } \mathrm{mol}^{-1}\right)$ और $\left(\Delta_{e g} H\right.$ ) इलेक्ट्रॉन ग्रहण py (in $\mathrm{kJ} \hspace{0.5mm } \mathrm{mol}^{-1}$ ) नीचे दिए गए हैं :
| तत्व | $\Delta H_{1}$ | $\Delta H_{2}$ | $\Delta_{e g} H$ |
|---|---|---|---|
| $I$ | 520 | 7300 | -60 |
| $II$ | 419 | 3051 | -48 |
| $III$ | 1681 | 3374 | -328 |
| $IV$ | 1008 | 1846 | -295 |
| $V$ | 2372 | 5251 | +48 |
| $VI$ | 738 | 1451 | -40 |
उपरोक्त में से कौन सा तत्व संभवतः है :
(a) सबसे कम अभिक्रियाशील तत्व।
(b) सबसे अभिक्रियाशील धातु।
(c) सबसे अभिक्रियाशील अधातु।
(d) सबसे कम अभिक्रियाशील अधातु।
(e) धातु जो फॉर्मूला $\mathrm{MX}_{2}$ के स्थायी द्विसंयोजी हैलाइड बना सकता है ( $\mathrm{X}=$ हैलोजन)।
(f) धातु जो फॉर्मूला MX (X=हैलोजन) के अधिकांश रूप से स्थायी सहसंयोजक हैलाइड बना सकती है?
उत्तर दिखाएं
उत्तर
(a) तत्व $V$ सबसे कम प्रतिक्रियाशील तत्व हो सकता है। इसका कारण यह है कि इसका पहला आयनन एन्थैल्पी $(\Delta_i H_1)$ सबसे अधिक है और इसका इलेक्ट्रॉन अधिग्रहण एन्थैल्पी $(\Delta _{e g} H)$ धनात्मक है।
(b) तत्व $II$ सबसे प्रतिक्रियाशील धातु हो सकता है क्योंकि इसका पहला आयनन एन्थैल्पी $(\Delta_i H_1)$ सबसे कम है और इसका इलेक्ट्रॉन अधिग्रहण एन्थैल्पी $(\Delta _{e g} H)$ नकारात्मक है।
(c) तत्व $III$ सबसे प्रतिक्रियाशील अधातु हो सकता है क्योंकि इसका पहला आयनन एन्थैल्पी $(\Delta_i H_1)$ अधिक है और इसका इलेक्ट्रॉन अधिग्रहण एन्थैल्पी $(\Delta _{e g} H)$ सबसे अधिक नकारात्मक है।
(d) तत्व $V$ सबसे कम प्रतिक्रियाशील अधातु हो सकता है क्योंकि इसका पहला आयनन एन्थैल्पी $(\Delta_i H_1)$ बहुत अधिक है और इसका इलेक्ट्रॉन अधिग्रहण एन्थैल्पी $(\Delta _{e g} H)$ धनात्मक है।
(e) तत्व $VI$ का इलेक्ट्रॉन अधिग्रहण एन्थैल्पी $(\Delta _{e g} H)$ नकारात्मक है लेकिन अपेक्षाकृत कम है। इसलिए, यह एक धातु है। इसके अतिरिक्त, इसका दूसरा आयनन एन्थैल्पी $(\Delta_i H_2)$ सबसे कम है। इसलिए, यह $MX_2(X=$ हैलोजन) के रूप में स्थायी द्विपरमाणुक हैलाइड बना सकता है।
( $f$ ) तत्व $I$ के पहला आयनन ऊर्जा अधिक है और दूसरा आयनन ऊर्जा भी अधिक है। इसलिए, यह $MX$ ( $X=$ हैलोजन) के रूप में अधिकांश रूप से स्थायी सहसंयोजक हैलाइड बना सकता है।
3.32 निम्नलिखित तत्वों के संयोजन द्वारा बने स्थायी द्विपरमाणुक यौगिकों के सूत्रों का अनुमान लगाएं।
(a) लिथियम और ऑक्सीजन
(b) मैग्नीशियम और नाइट्रोजन
(c) एल्यूमिनियम और आयोडीन
(d) सिलिकॉन और ऑक्सीजन
(e) फॉस्फोरस और फ्लूओरीन
(f) तत्व 71 और फ्लूओरीन
उत्तर दिखाएं
उत्तर
(a) $Li_2 O$
(b) $Mg_3 N_2$
(c) $AlI_3$
(d) $SiO_2$
(e) $PF_3$ या $PF_5$
(f) तत्व 71 के बाहरी कोश में 3 इलेक्ट्रॉन होते हैं $\left(4 f^{14} 5 {d}^1 6 {s}^2\right)$ जो ग्रुप 17 के तत्व फ्लूओरीन (एक हैलोजन जिसका बाहरी कोश में 1 इलेक्ट्रॉन होता है) के साथ संयोजन करता है और $EF_3$ के रूप में हैलाइड बनाता है, जहां E तत्व का प्रतीक है। परमाणु क्रमांक 71 के तत्व का नाम लुटेटियम (Lu) है। इसकी वैलेंस 3 है। इसलिए, यौगिक का सूत्र $LuF_3$ है।
3.33 आधुनिक आवर्त सारणी में, आवर्त के मान को निर्देशित करता है :
(a) परमाणु संख्या
(b) परमाणु द्रव्यमान
(c) मुख्य क्वांटम संख्या
(d) अक्षायी क्वांटम संख्या।
उत्तर दिखाएं
उत्तर : (c) मुख्य क्वांटम संख्या
स्पष्टीकरण
आवर्त आधुनिक आवर्त सारणी में बाहरी शेल या मूलक शेल के मुख्य क्वांटम संख्या ( $n$ ) के मान को निर्देशित करता है।
3.34 आधुनिक आवर्त सारणी से संबंधित निम्नलिखित कथनों में से कौन-सा गलत है?
(a) $p$-ब्लॉक में 6 स्तंभ होते हैं, क्योंकि $p$-शेल में सभी ऑर्बिटल में अधिकतम 6 इलेक्ट्रॉन बस सकते हैं।
(b) $d$-ब्लॉक में 8 स्तंभ होते हैं, क्योंकि $d$-उप-शेल में सभी ऑर्बिटल में अधिकतम 8 इलेक्ट्रॉन बस सकते हैं।
(c) प्रत्येक ब्लॉक में उप-शेल में बस सकने वाले इलेक्ट्रॉन की संख्या के बराबर स्तंभ होते हैं।
(d) ब्लॉक अंतिम उप-शेल में इलेक्ट्रॉन बसे जाने के लिए अक्षायी क्वांटम संख्या ( $l$ ) के मान को निर्देशित करता है।
उत्तर दिखाएं
उत्तर : (b) $d$-ब्लॉक में 8 स्तंभ होते हैं, क्योंकि $d$-उप-शेल में सभी ऑर्बिटल में अधिकतम 8 इलेक्ट्रॉन बस सकते हैं।
स्पष्टीकरण
$d$-ब्लॉक में 10 स्तंभ होते हैं क्योंकि $d$ उप-शेल में सभी ऑर्बिटल में अधिकतम 10 इलेक्ट्रॉन बस सकते हैं।
3.35 कोई भी वस्तु जो मूलक इलेक्ट्रॉन को प्रभावित करती है, तत्व के रासायनिक गुणों को प्रभावित करती है। निम्नलिखित में से कौन-सा कारक मूलक शेल को प्रभावित नहीं करता है?
(a) मूलक मुख्य क्वांटम संख्या $( n )$
(b) नाभिकीय आवेश $(Z)$
(c) नाभिकीय द्रव्यमान
(d) कोर इलेक्ट्रॉन की संख्या।
उत्तर दिखाएं
उत्तर : (c) नाभिकीय द्रव्यमान
स्पष्टीकरण
नाभिकीय द्रव्यमान मूलक शेल को प्रभावित नहीं करता है क्योंकि नाभिक में प्रोटॉन और न्यूट्रॉन होते हैं। प्रोटॉन अर्थात नाभिकीय आवेश मूलक शेल को प्रभावित करता है लेकिन न्यूट्रॉन नहीं।
3.36 समपरमाणु वस्तुओं - $\mathrm{F}^{-}$, $\mathrm{Ne}$ और $\mathrm{Na}^{+}$ के आकार को प्रभावित करता है
(a) परमाणु आवेश $(Z)$
(b) मूल द्रव्यवेत्ता क्वांटम संख्या ( $n$ )
(c) बाहरी कक्षकों में इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिक्रिया
(d) कोई भी कारक नहीं क्योंकि उनका आकार समान है।
उत्तर दिखाएँ
उत्तर : (a) परमाणु आवेश $(Z)$
स्पष्टीकरण
एक समान आवेश वाले अणुओं के आकार में परमाणु आवेश $(Z)$ के कम होने के साथ-साथ वृद्धि होती है। उदाहरण के लिए, $F, Ne$ और $Na^{+}$ के बढ़ते हुए परमाणु आवेश के क्रम निम्नलिखित है:
$ \begin{array}{c|c|c|c} & F & Ne & Na^{+} \ \hline Z & 9 & 10 & 11 \ \end{array} $
$ F < Ne < Na^{+} $
इसलिए, $F, Ne$ और $Na^{+}$ के बढ़ते हुए आकार के क्रम निम्नलिखित है:
$ Na^{+} < Ne < F $
3.37 निम्नलिखित में से कौन सा कथन आयनन एंथैल्पी के संबंध में गलत है?
(a) आयनन एंथैल्पी प्रत्येक अगले इलेक्ट्रॉन के लिए बढ़ती जाती है।
(b) कोर नॉबल गैस विन्यास से इलेक्ट्रॉन के निकलने पर आयनन एंथैल्पी में सबसे बड़ी वृद्धि होती है।
(c) मूल इलेक्ट्रॉन के समापन को आयनन एंथैल्पी में एक बड़ी छलांग द्वारा चिह्नित किया जाता है।
(d) निम्न $n$ मान वाले कक्षकों से इलेक्ट्रॉन के निकलना उच्च $n$ मान वाले कक्षकों से इलेक्ट्रॉन के निकलने से आसान होता है।
उत्तर दिखाएँ
उत्तर : (d) निम्न $n$ मान वाले कक्षकों से इलेक्ट्रॉन के निकलना उच्च $n$ मान वाले कक्षकों से इलेक्ट्रॉन के निकलने से आसान होता है।
स्पष्टीकरण
कम $n$ मान वाले कक्षकों में इलेक्ट्रॉन नाभिक के प्रति अधिक आकर्षित होते हैं जबकि उच्च $n$ मान वाले कक्षकों में इलेक्ट्रॉन नाभिक के प्रति कम आकर्षित होते हैं। इसलिए, उच्च $n$ मान वाले कक्षकों से इलेक्ट्रॉन के निकलना निम्न $n$ मान वाले कक्षकों से इलेक्ट्रॉन के निकलने से आसान होता है।
3.38 तत्व $\mathrm{B}, \mathrm{Al}, \mathrm{Mg}$ और $\mathrm{K}$ के लिए उनके धात्विक गुण का सही क्रम है :
(a) $\mathrm{B}>\mathrm{Al}>\mathrm{Mg}>\mathrm{K}$
(b) $\mathrm{Al}>\mathrm{Mg}>\mathrm{B}>\mathrm{K}$
(c) $\mathrm{Mg}>\mathrm{Al}>\mathrm{K}>\mathrm{B}$
(d) $\mathrm{K}>\mathrm{Mg}>\mathrm{Al}>\mathrm{B}$
उत्तर दिखाएँ
उत्तर : (d) $\mathrm{K}>\mathrm{Mg}>\mathrm{Al}>\mathrm{B}$
स्पष्टीकरण
एक आवर्त में बाएँ से दाएँ जाने पर धात्विक गुण बढ़ता है क्योंकि मूलक इलेक्ट्रॉन और नाभिक के बीच आकर्षण कम हो जाता है, जिसके कारण इलेक्ट्रॉन के नुकसान करना आसान हो जाता है।
धात्विक गुण एक समूह में नीचे की ओर जाने पर बढ़ता है क्योंकि परमाणु आकार बढ़ता है।
इसलिए, धात्विक गुण का सही क्रम $K>Mg>Al>B$ है।
3.39 B, C, N, F और Si तत्वों के लिए उनके अधात्विक गुण का सही क्रम है :
(a) $\mathrm{B}>\mathrm{C}>\mathrm{Si}>\mathrm{N}>\mathrm{F}$
(b) $\mathrm{Si}>\mathrm{C}>\mathrm{B}>\mathrm{N}>\mathrm{F}$
(c) $\mathrm{F}>\mathrm{N}>\mathrm{C}>\mathrm{B}>\mathrm{Si}$
(d) $\mathrm{F}>\mathrm{N}>\mathrm{C}>\mathrm{Si}>\mathrm{B}$
उत्तर दिखाएँ
उत्तर : (c) $\mathrm{F}>\mathrm{N}>\mathrm{C}>\mathrm{B}>\mathrm{Si}$
स्पष्टीकरण
एक आवर्त में बाएँ से दाएँ जाने पर अधात्विक गुण बढ़ता है क्योंकि परमाणु आकार कम हो जाता है, जिसके कारण इलेक्ट्रॉन के ग्रहण करने की प्रवृत्ति बाएँ से दाएँ बढ़ती है।
एक समूह में भी अधात्विक गुण कम होता है क्योंकि परमाणु आकार बढ़ता है, जिसके कारण इलेक्ट्रॉन के ग्रहण करने की प्रवृत्ति शीर्ष से नीचे की ओर कम होती है।
इसलिए, उनके अधात्विक गुण का सही क्रम $F > N > C > B > Si $ है।
3.40 F, Cl, O और N तत्वों के लिए उनकी रासायनिक प्रतिक्रियाशीलता के अपचायक गुण के अनुसार सही क्रम है :
(a) $\mathrm{F}>\mathrm{Cl}>\mathrm{O}>\mathrm{N}$
(b) $\mathrm{F}>\mathrm{O}>\mathrm{Cl}>\mathrm{N}$
(c) $\mathrm{Cl}>\mathrm{F}>\mathrm{O}>\mathrm{N}$
(d) $\mathrm{O}>\mathrm{F}>\mathrm{N}>\mathrm{Cl}$
उत्तर दिखाएँ
उत्तर : (b) $\mathrm{F}>\mathrm{O}>\mathrm{Cl}>\mathrm{N}$
स्पष्टीकरण
एक आवर्त में बाएँ से दाएँ जाने पर परमाणु क्रमांक बढ़ने के साथ-साथ अपचायक गुण बढ़ता है क्योंकि उनके बाह्य कोश में रिक्त d ऑर्बिटल उपस्थित होते हैं।
अतः, ऑक्सीकारक गुण के घटते क्रम में $\mathrm{F}>\mathrm{O}>\mathrm{N}$ है।
समूह में नीचे जाने पर ऑक्सीकारक गुण कम होता जाता है। अतः, $\mathrm{F}>\mathrm{Cl}$। लेकिन O का ऑक्सीकारक गुण Cl से अधिक होता है, अतः $\mathrm{O}>\mathrm{Cl}$।
अतः, $\mathrm{F}, \mathrm{Cl}, \mathrm{O}$ और N के ऑक्सीकारक गुण के अनुसार रासायनिक सक्रियता के सही क्रम $\mathrm{F}>\mathrm{O}>\mathrm{Cl}>\mathrm{N}$ है।





