अध्याय 13 हाइड्रोकार्बन
“हाइड्रोकार्बन ऊर्जा के महत्वपूर्ण स्रोत हैं।”
“हाइड्रोकार्बन” शब्द स्वयं स्पष्ट है जिसका अर्थ कार्बन और हाइड्रोजन के मिश्रण होते हैं। हाइड्रोकार्बन हमारे दैनिक जीवन में महत्वपूर्ण भूमिका निभाते हैं। आपको ‘एलपीजी’ और ‘सीएनजी’ जैसे ईंधन के रूप में उपयोग किए जाने वाले शब्द जाने होंगे। एलपीजी लिक्विफाइड पेट्रोलियम गैस के संक्षिप्त रूप है जबकि सीएनजी कम्प्रेस्ड नैचुरल गैस के लिए उपयोग किया जाता है। एक अन्य शब्द ‘एलएनजी’ (लिक्विफाइड नैचुरल गैस) भी अब खबरों में है। यह भी एक ईंधन है और इसे प्राकृतिक गैस के ठंडा करके प्राप्त किया जाता है। पेट्रोल, डीजल और केरोसिन तेल पृथ्वी के भू-परत में पाए जाने वाले पेट्रोलियम के भिन्न भिन्न भाप अलग करके प्राप्त किए जाते हैं। कोयला गैस को कोयला के विनाशकारी भाप अलग करके प्राप्त किया जाता है। पेट्रोलियम के कुओं के खुदाई के दौरान ऊपरी परत में प्राकृतिक गैस पाई जाती है। गैस के संपीड़न के बाद इसे कम्प्रेस्ड नैचुरल गैस कहा जाता है। एलपीजी को घरेलू ईंधन के रूप में उपयोग किया जाता है जो सबसे कम प्रदूषण करता है। केरोसिन तेल भी घरेलू ईं धन के रूप में उपयोग किया जाता है लेकिन इसके कुछ प्रदूषण होता है। वाहनों के लिए पेट्रोल, डीजल और सीएनजी जैसे ईंधन की आवश्यकता होती है। पेट्रोल और सीएनजी वाले वाहन कम प्रदूषण करते हैं। इन सभी ईंधनों में हाइड्रोकार्बन के मिश्रण होते हैं, जो ऊर्जा के स्रोत होते हैं। हाइड्रोकार्बन का उपयोग विभिन्न पॉलीमर जैसे पॉलीथीन, पॉलीप्रोपीन, पॉलीस्टाइरीन आदि के उत्पादन में भी होता है। उच्च हाइड्रोकार्बन पेंट के घोलक के रूप में उपयोग किए जाते हैं। वे विभिन्न रंगों और दवाओं के उत्पादन के लिए भी शुरुआती सामग्री के रूप में उपयोग किए जाते हैं। इस प्रकार आप अपने दैनिक जीवन में हाइड्रोकार्बन के महत्व को अच्छी तरह समझ सकते हैं। इस इकाई में आप हाइड्रोकार्बन के बारे में अधिक जानेंगे।
13.1 वर्गीकरण
हाइड्रोकार्बन विभिन्न प्रकार के होते हैं। कार्बन-कार्बन बंधों के प्रकार के आधार पर, उन्हें तीन मुख्य श्रेणियों में वर्गीकृत किया जा सकता है - (i) संतृप्त, (ii) असंतृप्त और (iii) औषधीय हाइड्रोकार्बन। संतृप्त हाइड्रोकार्बन में कार्बन-कार्बन और कार्बन-हाइड्रोजन एकल बंध होते हैं। यदि विभिन्न कार्बन परमाणु एकल बंधों के माध्यम से एक खुले शृंखला के रूप में जुड़े हों, तो उन्हें एल्केन कहा जाता है, जैसा कि आपने इकाई 8 में पहले से ही अध्ययन किया है। दूसरी ओर, यदि कार्बन परमाणु एक बंद शृंखला या एक वलय के रूप में बनाते हैं, तो उन्हें साइक्लोएल्केन कहा जाता है। असंतृप्त हाइड्रोकार्बन में कार्बन-कार्बन बहुल बंध (एक द्विबंध, त्रिबंध या दोनों) होते हैं। औषधीय हाइड्रोकार्बन एक विशेष प्रकार के चक्रीय यौगिक होते हैं। आप इन अणुओं के दोनों प्रकारों (खुले शृंखला और बंद शृंखला) के बहुत सारे मॉडल बना सकते हैं, ध्यान रखते हुए कि कार्बन चतुर्विभाजी और हाइड्रोजन एकल विभाजी होते हैं। एल्केन के मॉडल बनाने के लिए, आप बंध के लिए दांत के छोटे छड़ियों का उपयोग कर सकते हैं और परमाणु के लिए प्लास्टिकीन गेंदों का उपयोग कर सकते हैं। एल्कीन, एल्काइन और औषधीय हाइड्रोकार्बन के मॉडल के लिए, स्प्रिंग मॉडल बनाए जा सकते हैं।
13.2 एल्केन
जैसा कि पहले बताया गया है, एल्केन संतृप्त खुले शृंखला वाले हाइड्रोकार्बन हैं जिनमें कार्बन-कार्बन एकल बंध होते हैं। मेथेन $\left(\mathrm{CH_4}\right)$ इस परिवार का पहला सदस्य है। मेथेन कोल खानों और खारी जगहों में पाया जाता है। अगर आप मेथेन के एक हाइड्रोजन परमाणु को कार्बन से बदल दें और दूसरे कार्बन परमाणु के चतुर्विमल बनाने के लिए आवश्यक संख्या में हाइड्रोजन को जुड़ दें, तो आपको क्या मिलता है? आपको $\mathrm{C_2} \mathrm{H_6}$ मिलता है। इस हाइड्रोकार्बन के अणुसूत्र $\mathrm{C_2} \mathrm{H_6}$ है जिसे एथेन कहा जाता है। इस प्रकार आप $\mathrm{C_2} \mathrm{H_6}$ को $\mathrm{CH_4}$ से बनाया जा सकता है जिसमें एक हाइड्रोजन परमाणु को $-\mathrm{CH_3}$ समूह द्वारा बदल दिया जाता है। इस सैद्धांतिक अभ्यास को करते रहें और एल्केन बनाते रहें, अर्थात हाइड्रोजन परमाणु को $-\mathrm{CH_3}$ समूह द्वारा बदल दें। अगले अणु $\mathrm{C_3} \mathrm{H_8}, \mathrm{C_4}$ $\mathrm{H_{10}} \ldots$ होंगे।

इन हाइड्रोकार्बन के अनुप्रस्थ अवस्था में अक्रिय होते हैं क्योंकि वे अम्ल, क्षार और अन्य अभिकर्मकों के साथ अभिक्रिया नहीं करते हैं। इसलिए, वे पहले पैराफिन के रूप में जाने जाते थे (लैटिन: पैरम, थोड़ा; अफिनिस, आकर्षण)। आप एल्केन परिवार या समान श्रेणी के सामान्य सूत्र के बारे में सोच सकते हैं? यदि हम विभिन्न एल्केन के सूत्र की जांच करते हैं, तो हम देखते हैं कि एल्केन के सामान्य सूत्र $\mathrm{C_\mathrm{n}} \mathrm{H_{2 \mathrm{n}+2}}$ होता है। जब $n$ को उचित मान दिया जाता है, तो यह किसी भी विशिष्ट समान श्रेणी को प्रतिनिधित्व करता है। आप बर्नेट के संरचना को याद कर सकते हैं? वीएसईपीआर सिद्धांत (यूनिट 4) के अनुसार, मेथेन की संरचना चतुष्कोणीय होती है (चित्र 13.1), जिसमें कार्बन परमाणु केंद्र में होता है और चार हाइड्रोजन परमाणु एक सम चतुष्कोणीय के चार कोनों पर होते हैं। सभी $\mathrm{H}-\mathrm{C}-\mathrm{H}$ बंध कोण 109.5 होते हैं।

चित्र 13.1 मेथेन की संरचना
अल्केन में, टेट्राहेड्रल के बीच जुड़े होते हैं जिनमें $\mathrm{C}-\mathrm{C}$ और $\mathrm{C}-\mathrm{H}$ बंध की लंबाई क्रमशः $154 \mathrm{pm}$ और $112 \mathrm{pm}$ होती है (इकाई 8)। आप पहले ही पढ़ चुके हैं कि $\mathrm{C}-\mathrm{C}$ और $\mathrm{C}-\mathrm{H} \sigma$ बंध कार्बन के $s p^{3}$ हाइब्रिड ऑर्बिटल और हाइड्रोजन परमाणु के $1 s$ ऑर्बिटल के सिर-सिर अधिच्छेदन से बनते हैं।
13.2.1 नामांकन एवं समावयवीता
आपने इकाई 8 में विभिन्न श्रेणियों के कार्बनिक यौगिकों के नामांकन के बारे में पहले ही पढ़ लिया होगा। एल्केन के नामांकन एवं समावयवीता को और बेहतर समझने के लिए कुछ अतिरिक्त उदाहरण देखें। सामान्य नाम के अंदर दिया गया है। पहले तीन एल्केन - मेथेन, एथेन और प्रोपेन केवल एक संरचना के साथ होते हैं, लेकिन उच्च एल्केन एक से अधिक संरचना के साथ हो सकते हैं। चलो $\mathrm{C_4} \mathrm{H_{10}}$ के लिए संरचना लिखें। $\mathrm{C_4} \mathrm{H_{10}}$ के चार कार्बन परमाणु निम्नलिखित दो तरीकों से एक लगातार श्रृंखला में या शाखित श्रृंखला में जुड़ सकते हैं:


$\mathrm{C_5} \mathrm{H_{12}}$ के पांच कार्बन परमाणु और बारह हाइड्रोजन परमाणु को कितने तरीकों से जोड़ सकते हैं? वे तीन तरीकों से व्यवस्थित किए जा सकते हैं, जैसा कि तीसरे से पांचवें संरचनाओं में दिखाया गया है।

संरचना I और II के एक ही अणुसूत्र है लेकिन उनके क्वथनांक और अन्य गुण में अंतर है। इसी तरह संरचना III, IV और $\mathrm{V}$ के एक ही अणुसूत्र है लेकिन उनके गुण में अंतर है। संरचना I और II ब्यूटेन के समावयवी हैं, जबकि संरचना III, IV और V पेंटेन के समावयवी हैं। क्योंकि गुणों में अंतर संरचना में अंतर के कारण होता है, इन्हें संरचनात्मक समावयवी कहा जाता है। यह भी स्पष्ट है कि संरचना I और III में कार्बन परमाणु का लगातार श्रृंखला है जबकि संरचना II, IV और V में शाखित श्रृंखला है। ऐसे संरचनात्मक समावयवी जो कार्बन श्रृंखला में अंतर रखते हैं, श्रृंखला समावयवी कहलाते हैं। इस प्रकार आप देख सकते हैं कि $\mathrm{C_4} \mathrm{H_{10}}$ और $\mathrm{C_5} \mathrm{H_{12}}$ क्रमशः दो और तीन श्रृंखला समावयवी हैं।
समस्या 13.1
$\mathrm{C_6} \mathrm{H_{14}}$ अणुसूत्र के अनुरूप एल्केन के विभिन्न श्रृंखला समावयवियों के संरचना सूत्र लिखिए। इनके IUPAC नाम भी लिखिए।
हल

एक कार्बन परमाणु के आधार पर, जिसके एक कार्बन परमाणु के साथ जुड़े अन्य कार्बन परमाणुओं की संख्या के आधार पर, कार्बन परमाणु को प्राथमिक (1), द्वितीयक (2), तृतीयक (3) या चतुर्थक (4) कहा जाता है। जिस कार्बन परमाणु के कोई अन्य कार्बन परमाणु नहीं जुड़े हो जैसे मेथेन में या केवल एक कार्बन परमाणु के साथ जुड़े हो जैसे एथेन में, वह प्राथमिक कार्बन परमाणु कहलाता है। सिंगल कार्बन परमाणु अंतिम कार्बन परमाणु होते हैं जो हमेशा प्राथमिक होते हैं। जिस कार्बन परम णु के दो कार्बन परमाणु जुड़े हो वह द्वितीयक कार्बन परमाणु कहलाता है। तीन कार्बन परमाणु जुड़े होने पर वह तृतीयक कार्बन परमाणु कहलाता है और चार कार्बन परमाणु जुड़े होने पर वह चतुर्थक कार्बन परमाणु कहलाता है। आप $1,2,3$ और 4 कार्बन परमाणु की पहचान कर सकते हैं कि आप इसके लिए कैसे करेंगे?
संरचनाएँ I से V ? यदि आप उच्चतर एल्केन के लिए संरचनाएँ बना रहे हैं, तो आपको अभी भी बड़ी संख्या में समावयवी प्राप्त होंगे। $\mathrm{C_6} \mathrm{H_{14}}$ में पांच समावयवी होते हैं और $\mathrm{C_7} \mathrm{H_{16}}$ में नौ समावयवी होते हैं। $\mathrm{C_{10}} \mathrm{H_{22}}$ के लिए 75 समावयवी संभव हैं।
संरचनाओं II, IV और V में आप देखेंगे कि $-\mathrm{CH_3}$ समूह कार्बन परमाणु जो कि संख्या 2 के कार्बन परमाणु से जुड़ा है। आप एल्केन या अन्य वर्ग के यौगिकों के कार्बन परमाणुओं पर $-\mathrm{CH_3},-\mathrm{C_2} \mathrm{H_5},-\mathrm{C_3} \mathrm{H_7}$ आदि जैसे समूहों के साथ भी मिलेंगे। इन समूहों या प्रतिस्थापकों को एल्किल समूह कहा जाता है क्योंकि ये एल्केन से एक हाइड्रोजन परमाणु के अपसार के द्वारा प्राप्त किए जाते हैं। एल्किल समूह के सामान्य सूत्र $\mathrm{C_\mathrm{n}} \mathrm{H_{2 \mathrm{n}+1}}$ (एकांक 8) है।
Let us recall the general rules for nomenclature already discussed in Unit 8. Nomenclature of substituted alkanes can further be understood by considering the following problem:
Problem 13.2
Write structures of different isomeric alkyl groups corresponding to the molecular formula $\mathrm{C_5} \mathrm{H_11}$. Write IUPAC names of alcohols obtained by attachment of $-\mathrm{OH}$ groups at different carbons of the chain.
#missing
Solution

तालिका 13.1 कुछ कार्बनिक यौगिकों के नामकरण

समस्या 13.3
निम्नलिखित यौगिकों के IUPAC नाम लिखिए :
(i) $\left(\mathrm{CH_3}\right)_3 \mathrm{C} \mathrm{CH_2} \mathrm{C}\left(\mathrm{CH_3}\right)_3$
(ii) $\left(\mathrm{CH_3}\right)_2 \mathrm{C}\left(\mathrm{C_2} \mathrm{H_5}\right)_2$
(iii) टेट्रा - टेर्ट-ब्यूटिलमेथेन
हल
(i) 2, 2, 4, 4-टेट्रामेथिलपेंटेन
(ii) 3, 3-डाइमेथिलपेंटेन
(iii) 3,3-डी-टर्ट-ब्यूटिल -2, 2, 4, 4 टेट्रामेथिलपेंटेन
एक दिए गए संरचना के लिए सही IUPAC नाम लिखना महत्वपूर्ण है, इसी तरह दिए गए IUPAC नाम से सही संरचना लिखना भी महत्वपूर्ण है। इसके लिए सबसे पहले मूल एल्केन के संगत सबसे लंबे कार्बन श्रृंखला को लिखा जाता है। फिर इसे संख्यांकन करके, स्थानांतरण के अनुसार सही कार्बन पर विस्थापक जुड़े और अंत में प्रत्येक कार्बन पर सही संख्या में हाइड्रोजन अधिकारियों को जोड़कर प्रत्येक कार्बन के मोलार अधिकार को संतुलित किया जाता है। इसको स्पष्ट करने के लिए 3-एथिल-2, 2-डाइमेथिलपेंटेन की संरचना को निम्नलिखित चरणों में लिखा जा सकता है :
i) पांच कार्बन परमाणुओं की श्रृंखला बनाइए:
$\mathrm{C}-\mathrm{C}-\mathrm{C}-\mathrm{C}-\mathrm{C}$
ii) कार्बन परमाणुओं की संख्या दीजिए:
$\mathrm{C}^{1}-\mathrm{C}^{2}-\mathrm{C}^{3}-\mathrm{C}^{4}-\mathrm{C}^{5}$
iii) कार्बन 3 पर एथिल समूह और कार्बन 2 पर दो मेथिल समूह जोड़ें

iv) प्रत्येक कार्बन परमाणु की संयोजकता को संतुष्ट करने के लिए आवश्यक संख्या में हाइड्रोजन परमाणु लगाइए :

इस प्रकार हम ठीक संरचना पर पहुँच गए हैं। यदि आप दिए गए नाम से संरचना लिखने को समझ गए हैं, तो निम्नलिखित समस्याओं को हल करें।
समस्या 13.4
निम्नलिखित यौगिकों के संरचना सूत्र लिखिए :
(i) 3, 4, 4, 5-टेट्रामेथिलहेप्टेन
(ii) 2,5-डाइमेथिलहेक्सेन
हल

समस्या 13.5
निम्नलिखित यौगिकों के लिए संरचना लिखिए। दिए गए नाम क्यों गलत हैं? सही IUPAC नाम लिखिए।
(i) 2-एथिलपेंटेन
(ii) 5-एथिल - 3-मेथिलहेप्टेन
हल

सबसे लंबी श्रृंखला छह कार्बन अणुओं की है और नहीं कि पांच कार्बन अणुओं की। अतः सही नाम 3-मेथिलहेक्सेन है।

संख्या को अंत से शुरू करना होता है जो एथिल समूह को कम संख्या देता है। इसलिए, सही नाम 3-एथिल-5-मेथिलहेप्टेन है।
13.2.2 तैयारी
पेट्रोलियम और प्राकृतिक गैस एल्केन के मुख्य स्रोत हैं। हालांकि, एल्केन को निम्नलिखित विधियों द्वारा तैयार किया जा सकता है :
1. असंतृप्त हाइड्रोकार्बन से
डाइहाइड्रोजन गैस एल्कीन और एल्काइन के साथ उपस्थिति में प्लेटिनम, पैलेडियम या निकेल जैसे छोटे कणों वाले कैटलिस्ट के साथ मिलकर एल्केन बनाती है। यह प्रक्रिया हाइड्रोजनेशन कहलाती है। इन धातुओं डाइहाइड्रोजन गैस को अपनी सतह पर अवशोषित करती हैं और हाइड्रोजन-हाइड्रोजन बंध को सक्रिय करती हैं। प्लेटिनम और पैलेडियम कैटलिस्ट तापमान के अति निम्न स्तर पर अभिक्रिया को कैटलिस्ट करते हैं लेकिन निकेल कैटलिस्ट के साथ अपेक्षाकृत उच्च तापमान और दबाव की आवश्यकता होती है।
$$\underset{\text{एथीन}}{\mathrm{CH_2}=\mathrm{CH_2}}+\mathrm{H_2} \xrightarrow{\mathrm{Pt} / \mathrm{Pd} / \mathrm{Ni}} \underset{\text{प्रोपेन}}{\mathrm{CH_3}-\mathrm{CH_3}}\tag{13.1}$$
$$\underset{\text{प्रोपीन}}{\mathrm{CH_2}-\mathrm{CH}=\mathrm{CH_2}}+\mathrm{H_2} \xrightarrow{\mathrm{Pt} / \mathrm{Pd} / \mathrm{Ni}} \underset{\text{प्रोपेन}}{\mathrm{CH_3}-\mathrm{CH_2} \mathrm{CH_3}}\tag{13.2}$$
$$\underset{\text{प्रोपाइन}}{\mathrm{CH_3}-\mathrm{C} \equiv \mathrm{C}-\mathrm{H}}+2 \mathrm{H} \xrightarrow{\mathrm{Pt} / \mathrm{Pd} / \mathrm{Ni}} \underset{\text{प्रोपेन}}{\mathrm{CH_3}-\mathrm{CH_2} \mathrm{CH_3}}\tag{13.3}$$
2. एल्किल हैलाइड से
i) एल्किल हैलाइड (फ्लूओराइड के अलावा) जिंक और तनु हाइड्रोक्लोरिक अम्ल के साथ अपचयन से एल्केन बनाते हैं।
$$\underset{\text{क्लोरोमेथेन}}{\mathrm{CH}-\mathrm{Cl}} +\mathrm{H_2} \xrightarrow{\mathrm{Zn}, \mathrm{H}^{+}} \underset{\text{मेथेन}}{\mathrm{CH_4}}+\mathrm{HCl} \tag{13.4}$$
$$ \begin {equation*} \underset{\text{क्लोरोएथेन}}{\mathrm{C_2} \mathrm{H_5}-\mathrm{Cl}}+\mathrm{H_2} \xrightarrow{\mathrm{Zn}, \mathrm{H}^{+}} \underset{\text{एथेन}}{\mathrm{C_2} \mathrm{H_6}}+\mathrm{HCl} \tag{13.5}
$$ $$
$$\underset{\text{1-क्लोरोप्रोपेन}}{\mathrm{CH_3} \mathrm{CH_2} \mathrm{CH_2} \mathrm{Cl}}+\mathrm{H_2} \xrightarrow{\mathrm{Zn}, \mathrm{H}^{+}} \underset{\text{प्रोपेन}}{\mathrm{CH_3} \mathrm{CH_2} \mathrm{CH_3}}+\mathrm{HCl} \tag{13.5}$$
ii) एल्किल हैलाइड शुष्क एथेरियल (माइग्रेशन रहित) घोल में सोडियम धातु के साथ उपचार देने पर अधिक ऐल्केन बनाते हैं। इस अभिक्रिया को वर्ट्ज अभिक्रिया कहा जाता है और इसका उपयोग सम संख्या वाले कार्बन परमाणुओं वाले अधिक ऐल्केन के निर्माण के लिए किया जाता है।
$$\underset{\text{ब्रोमोमेथेन}}{\mathrm{CH_3} \mathrm{Br}}+2 \mathrm{Na}+\mathrm{BrCH_3} \xrightarrow{\text { सूखा ईथर }} \underset{\text{ईथेन}}{\mathrm{CH_3}}+2 \mathrm{Na}\tag{13.7}$$
$$\underset{\text{ब्रोमोएथेन}}{\mathrm{C_2} \mathrm{H_5} \mathrm{Br}}+2 \mathrm{Na}+\mathrm{BrC_2} \mathrm{H_5} \xrightarrow{\text { सूखा ईथर }} \underset{\text{n-ब्यूटेन}}{\mathrm{C_2} \mathrm{H_5}-\mathrm{C_2} \mathrm{H}}\tag{13.8}$$
अगर दो अलग-अलग एल्किल हैलाइड लिए जाएं तो क्या होगा?
3. कार्बॉक्सिलिक अम्ल से
i) कार्बॉक्सिलिक अम्ल के सोडियम लवण को सोडा लाइम (सोडियम हाइड्रॉक्साइड और कैल्शियम ऑक्साइड के मिश्रण) के साथ गरम करने पर कार्बॉक्सिलिक अम्ल की तुलना में एक कार्बन परमाणु कम वाले एल्केन प्राप्त होते हैं। कार्बॉक्सिलिक अम्ल से कार्बोनिक ऑक्साइड के अपसारण की प्रक्रिया को डेकार्बॉक्सिलेशन कहते हैं।
$\underset{\text{सोडियम एथेनोएट}}{\mathrm{CH_3} \mathrm{COO}^{-} \mathrm{Na}^{+}}+\mathrm{MaOH} \xrightarrow[\Delta]{\mathrm{CaO}} \mathrm{CH_4}+\mathrm{Na_2 CO_3}$
समस्या 13.6
प्रोपेन के निर्माण के लिए किस अम्ल के सोडियम लवण की आवश्यकता होगी? अभिक्रिया के रासायनिक समीकरण लिखिए।
हल
ब्यूटाइक अम्ल,
$$ \begin{aligned} \mathrm{CH_3} \mathrm{CH_2} \mathrm{CH_2} \mathrm{COO^-Na^+} + & \mathrm{NaOH} \xrightarrow{\mathrm{CaO}} \mathrm{CH_3CH_2CH_3} + \mathrm{Na_2CO_3} \end{aligned} $$
ii) कोल्बे के विद्युत अपघटन विधि: कार्बोक्सिलिक अम्ल के सोडियम या पोटैशियम लवण के जलीय विलयन के विद्युत अपघटन द्वारा ऐनोड पर समान संख्या में कार्बन परमाणु वाले एल्केन प्राप्त होते हैं।
$$ \underset{\text{सोडियम एसीटेट}}{2 \mathrm{CH_3} \mathrm{COO}^{-} \mathrm{Na}^{+}}+2 \mathrm{H_2} \mathrm{O}$$
$$ \begin{gather*} \downarrow \text { विद्युत अपघट्य } \\ \mathrm{CH_3}-\mathrm{CH_3}+2 \mathrm{CO_2}+\mathrm{H_2}+2 \mathrm{NaOH} \tag{13.9} \end{gather*} $$
अभिक्रिया निम्नलिखित पथ का अनुसरण करने की उम्मीद है :
i) $2 \mathrm{CH_3} \mathrm{COO}^{-} \mathrm{Na}^{+} \rightleftharpoons 2 \mathrm{CH_3}-\stackrel{\substack{\mathrm{O} \\ ||} }{\mathrm{C}}-\mathrm{O}^{-}+2 \mathrm{Na}^{+}$
ii) ऐनोड पर:

iii) $\mathrm{H_3} \mathrm{C}+\mathrm{CH_3} \longrightarrow \mathrm{H_3} \mathrm{C}-\mathrm{CH_3} \uparrow$
iv) एनोड पर :
$$ \begin{aligned} \mathrm{H} _{2} \mathrm{O}+\mathrm{e}^{-} & \rightarrow{ }^{-} \mathrm{OH}+\overset{\cdot}{H} \\ 2 \overset{\cdot}{H} & \rightarrow \mathrm{H} _{2} \uparrow \end{aligned} $$
इस विधि से मेथेन के निर्माण की असमर्थता क्यों है?
13.2.3 गुण
भौतिक गुण
एल्केन लगभग अध्रुवीय अणु होते हैं क्योंकि $\mathrm{C}-\mathrm{C}$ और $\mathrm{C}-\mathrm{H}$ बंध के सहसंयोजक प्रकृति के कारण तथा कार्बन और हाइड्रोजन परमाणुओं के बीच बहुत कम विद्युत ऋणात्मकता के अंतर के कारण। ये दुर्बल वैन डर वाल्स बल प्रकट करते हैं। दुर्बल बल के कारण, पहले चार सदस्य, $\mathrm{C_1}$ से $\mathrm{C_4}$ गैस होते हैं, $\mathrm{C_5}$ से $\mathrm{C_{17}}$ तरल होते हैं और 18 कार्बन परमाणु या अधिक वाले अणु 298 $\mathrm{~K}$ पर ठोस होते हैं। ये रंगहीन और गंधहीन होते हैं। आप एल्केन के अध्रुवीय प्रकृति के आधार पर एल्केन के पानी में विलेयता के बारे में क्या सोचते हैं? पेट्रोल एक हाइड्रोकार्बन के मिश्रण होता है और यह वाहनों के ईंधन के रूप में उपयोग किया जाता है। पेट्रोल और पेट्रोलियम के निम्न भाग भी कपड़ों के शुष्क साफ़ करने के लिए उपयोग किए जाते हैं ताकि ग्रीस धब्बे हट जाएं। इस अवलोकन के आधार पर, आप ग्रीस वाले पदार्थ की प्रकृति के बारे में क्या सोचते हैं? आप ठीक हैं यदि आप ग्रीस (उच्च एल्केन के मिश्रण) के अध्रुवीय प्रकृति के कारण इसे अध्रुवीय कहते हैं।
पोलर होते हैं, इसलिए जल-अपसरणीय प्रकृति के होते हैं। आम तौर पर यह देखा जाता है कि पदार्थों के विलयन विलायकों में विलयनशीलता के संदर्भ में, पोलर पदार्थ पोलर विलायकों में विलयनशील होते हैं, जबकि अपोलर पदार्थ अपोलर विलायकों में विलयनशील होते हैं, अर्थात जैसे विलयन होते हैं, वैसे ही विलयन होते हैं।
अल्केनों के क्वथनांक (b.p.) तालिका 13.2 में दिए गए हैं, जिससे स्पष्ट होता है कि अणुभार में वृद्धि के साथ क्वथनांक में एक स्थिर वृद्धि होती है। इसका कारण यह है कि अणुओं के बीच वैन डर वाल्स बल अणु के आकार या अणु के सतह क्षेत्रफल में वृद्धि के साथ बढ़ते जाते हैं।
आप तीन समावेशी पेंटेन के क्वथनांकों को देखकर एक दिलचस्प अवलोकन कर सकते हैं, जैसे कि (पेंटेन, 2-मेथिलब्यूटेन और 2,2-डाइमेथिलप्रोपेन)। यह देखा गया है (तालिका 13.2) कि पेंटेन, जिसमें पांच कार्बन परमाणुओं की लगातार श्रृंखला होती है, के क्वथनांक सबसे अधिक होते हैं (309.1 K) जबकि 2,2-डाइमेथिलप्रोपेन के क्वथनांक $282.5 \mathrm{~K}$ होते हैं। शाखा श्रृंखला की संख्या बढ़ने के साथ-साथ अणु के आकार गोला के आकार में बदल जाता है। इसके परिणामस्वरूप गोल अणुओं के बीच संपर्क क्षेत्र कम हो जाता है और इसलिए कम तापमान पर अपेक्षाकृत कम अंतराणुक बल द्वारा परागमन हो जाता है।
रासायनिक गुण
जैसा कि पहले उल्लेख किया गया है, एल्केन अम्ल, क्षारक, ऑक्सीकारक और अपचायक एजेंट के प्रति सामान्यतः अक्रिय होते हैं। हालांकि, वे निश्चित शर्तों के तहत निम्नलिखित अभिक्रियाएं अनुभव करते हैं।
1. बदलाव अभिक्रियाएं
एल्केन के एक या एक से अधिक हाइड्रोजन परमाणु ब्रोमीन, क्लोरीन, नाइट्रो समूह और सल्फोनिक अम्ल समूह द्वारा प्रतिस्थापित किए जा सकते हैं। ब्रोमीन या क्लोरीन अभिक्रिया उच्च तापमान (573-773 K) पर या फैले हुए सूर्य के प्रकाश या अवतल विकिरण की उपस्थिति में होती है। निम्न एल्केन नाइट्रेशन और सल्फोनेशन अभिक्रियाओं के अनुसरण नहीं करते हैं। एल्केन के हाइड्रोजन परमाणुओं के स्थान पर बदलाव वाली अभिक्रियाओं को बदलाव अभिक्रियाएं कहा जाता है। उदाहरण के लिए, मेथेन के क्लोरीनीकरण को नीचे दिया गया है:
हैलोजनणः
$$\mathrm{CH_2}+\mathrm{Cl} \xrightarrow{h \nu} \underset{\text{क्लोरोमेथेन}}{\mathrm{CH_3} \mathrm{Cl}}+\mathrm{HCl}\tag{13.10}$$
$$\underset{\text { क्लोरोमेथेन }}{\mathrm{CH_3} \mathrm{Cl}}+\xrightarrow{h v} \underset{\text{डाइक्लोरोमेथेन}}{\mathrm{CH_2} \mathrm{Cl_2}}+\mathrm{HCl}\tag{13.11}$$
$$\mathrm{CH_2} \mathrm{Cl_2} \xrightarrow{h \nu} \underset{\text{ट्राइक्लोरोमेथेन}}{\mathrm{CHCl_3}}+\mathrm{HCl}\tag{13.12}$$
$$\mathrm{CHCl_3}+\mathrm{Cl_2} \xrightarrow{h v} \underset{\text{टेट्राक्लोरोमेथेन}}{\mathrm{CCl_4}}+\mathrm{H3Cl}\tag{13.13}$$
तालिका 13.2 एल्केन में गलनांक और क्वथनांक के भिन्नता
| अणुसूत्र | नाम | अणुभार/ u | क्वथनांक/(K) | गलनांक/(K) |
|---|---|---|---|---|
| $\mathrm{CH_4}$ | मेथेन | 16 | 111.0 | 90.5 |
| $\mathrm{C_2} \mathrm{H_6}$ | एथेन | 30 | 184.4 | 101.0 |
| $\mathrm{C_3} \mathrm{H_8}$ | प्रोपेन | 44 | 230.9 | 85.3 |
| $\mathrm{C_4} \mathrm{H_{10}}$ | ब्यूटेन | 58 | 272.4 | 134.6 |
| $\mathrm{C_4} \mathrm{H_{10}}$ | 2-मेथिलप्रोपेन | 58 | 261.0 | 114.7 |
| $\mathrm{C_5} \mathrm{H_{12}}$ | पेंटेन | 72 | 309.1 | 143.3 |
| $\mathrm{C_5} \mathrm{H_{12}}$ | 2-मेथिलब्यूटेन | 72 | 300.9 | 113.1 | | $\mathrm{C_5} \mathrm{H_{12}}$ | 2,2-डाइमेथिलप्रोपेन | 72 | 282.5 | 256.4 | | $\mathrm{C_6} \mathrm{H_{14}}$ | हेक्सेन | 86 | 341.9 | 178.5 | | $\mathrm{C_7} \mathrm{H_{16}}$ | हेप्टेन | 100 | 371.4 | 182.4 | | $\mathrm{C_8} \mathrm{H_{18}}$ | ओक्टेन | 114 | 398.7 | 216.2 | | $\mathrm{C_9} \mathrm{H_{20}}$ | नॉनेन | 128 | 423.8 | 222.0 | | $\mathrm{C_{10}} \mathrm{H_{22}}$ | डेकेन | 142 | 447.1 | 243.3 | | $\mathrm{C_{20}} \mathrm{H_{42}}$ | एकोसेन | 282 | 615.0 | 236.2 |
$$ \mathrm{CH_3}-\mathrm{CH_3}+\mathrm{Cl_2} \xrightarrow{h v} \underset{\text{Chloroethane}}{\mathrm{CH_3}-\mathrm{CH_2} \mathrm{Cl}}+\mathrm{HCl} \tag{13.14} $$
पाया गया है कि एल्केन के हैलोजन के साथ अभिक्रिया की दर $\mathrm{F_2}>\mathrm{Cl_2}>\mathrm{Br_2}>\mathrm{I_2}$ होती है। एल्केन के हाइड्रोजन के बदले लगाने की दर : $3>2>1$ होती है। फ्लूओरीनेशन इतना तीव्र होता है कि इसे नियंत्रित करना मुश्किल होता है। आयोडीनेशन बहुत धीमा होता है और एक उत्क्रमणीय अभिक्रिया होती है। इसे $\mathrm{HIO_3}$ या $\mathrm{HNO_3}$ जैसे ऑक्सीकारक एजेंट की उपस्थिति में कराया जा सकता है।
$$\mathrm{CH_4}+\mathrm{I_2} \rightleftharpoons \mathrm{CH_3} \mathrm{I}+\mathrm{HI}\tag{13.15}$$
$$\mathrm{HIO_3}+5 \mathrm{HI} \rightarrow 31_{2}+3 \mathrm{H_2} \mathrm{O}\tag{13.16}$$
हैलोजनीकरण के लिए एक मुक्त अपवाही श्रृंखला योजना के माध्यम से चलने का अनुमान लगाया जाता है, जिसमें तीन चरण शामिल होते हैं, अर्थात् प्रारंभन, प्रसार और समापन जैसे नीचे दिए गए हैं:
मैकेनिज्म
(i) प्रारंभन : अभिक्रिया प्रकाश या गर्मी की उपस्थिति में क्लोरीन अणु के होमोलिसिस द्वारा शुरू होती है। $\mathrm{Cl}-\mathrm{Cl}$ बंध $\mathrm{C}-\mathrm{C}$ और $\mathrm{C}-\mathrm{H}$ बंध की तुलना में कमजोर होती है और इसलिए, इसे आसानी से तोड़ा जा सकता है।
$$\mathrm{Cl} - \mathrm{Cl} \xrightarrow[{\text{homolysis}}]{hv} \underset{\text{Chlorine free radical}}{\dot{\mathrm{C}}\mathrm{H_3}} + \mathrm{Cl}$$
(ii) प्रसार : क्लोरीन आवेग अभिकर्मक एथेन अणु पर हमला करता है और $\mathrm{C}-\mathrm{H}$ बंध को तोड़कर मेथिल आवेग के निर्माण के साथ $\mathrm{H}-\mathrm{Cl}$ के निर्माण के साथ अभिक्रिया को आगे बढ़ाता है।
(a) $\mathrm{CH_4}+\overset{+}{\mathrm{C}} \mathrm{l} \xrightarrow{h v} \stackrel{+}{\mathrm{C}} \mathrm{H_3}+\mathrm{H}-\mathrm{C} 1$
मेथिल रेडिकल इस प्रकार प्राप्त होता है जो क्लोरीन के दूसरे अणु के साथ अभिक्रिया करता है और $\mathrm{CH_3}-\mathrm{Cl}$ के निर्माण के साथ क्लोरीन अणु के होमोलिज़ करने से एक अन्य क्लोरीन रेडिकल के मुक्त होने के साथ अभिक्रिया करता है।
(b) $\mathrm{CH_3}+\mathrm{Cl}-\mathrm{Cl} \xrightarrow{h \nu} \mathrm{CH_3}-\mathrm{Cl}+\mathrm{Cl}$
ऊपर उत्पन्न क्लोरीन और मेथिल रेडिकल क्रमशः चरण (a) और (b) को दोहराते हैं और इस प्रकार अभिक्रिया के एक श्रृंखला की स्थापना करते हैं। चरण (a) और (b) वे चरण हैं जो मुख्य उत्पादों के उत्पादन के लिए सीधे उत्पादन करते हैं, लेकिन कई अन्य चरण भी संभव हैं और हो सकते हैं। नीचे दिए गए दो ऐसे चरण बताते हैं कि कैसे अधिक उच्च विशिष्ट उत्पाद बनते हैं।
$\mathrm{CH_3} \mathrm{C} 1+\dot{\mathrm{C}} 1 \rightarrow \dot{\mathrm{C}} \mathrm{H_2} \mathrm{C} 1+\mathrm{HCl} $
$\dot{\mathrm{C}} \mathrm{H_2} \mathrm{C} 1+\mathrm{C} 1-\mathrm{Cl} \rightarrow \mathrm{CH_2} \mathrm{Cl_2}+\dot{\mathrm{C}} 1$
(iii) अंत: अभिक्रिया कुछ समय के बाद अभिकर्मकों के उपयोग और / या निम्नलिखित अप्रत्यक्ष अभिक्रियाओं के कारण रोक देती है:
संभावित श्रृंखला अंत के कदम हैं:
(a) $\dot{\mathrm{C}} 1+\dot{\mathrm{C}} 1 \rightarrow \mathrm{C} 1-\mathrm{C} 1$
(b) $\mathrm{H_3} \dot{\mathrm{C}}+\dot{\mathrm{C}} \mathrm{H_3} \rightarrow \mathrm{H_3} \mathrm{C}-\mathrm{CH_3}$
(c) $\mathrm{H_3} \dot{\mathrm{C}} 1+\dot{\mathrm{C}} 1 \rightarrow \mathrm{H_3} \mathrm{C}-\mathrm{Cl}$
हालांकि, (c) में $\mathrm{CH_3}-\mathrm{Cl}$, उत्पाद में से एक बनता है लेकिन मुक्त रadicals खाली हो जाते हैं और शृंखला अंत हो जाती है। उपरोक्त योजना हमें मेथेन के क्लोरीनन के दौरान एथेन के उत्पाद के रूप में बनने के कारण को समझने में मदद करती है।
2. ज्वलन
अल्केन वायु या डाइऑक्सीजन की उपस्थिति में गरम करने पर कार्बन डाइऑक्साइड और पानी में पूरी तरह से ऑक्सीकृत हो जाते हैं और बहुत अधिक मात्रा में ऊष्मा के उत्सर्जन के साथ।
$$ \begin{array}{r} \mathrm{CH_4}(\mathrm{~g})+2 \mathrm{O_2}(\mathrm{~g}) \rightarrow \mathrm{CO_2}(\mathrm{~g})+2 \mathrm{H_2} \mathrm{O}(1) ; \\ \ddot{\mathrm{A}_\mathrm{c}} \mathrm{H}^{\grave{\mathrm{e}}}-890 \mathrm{~kJ} \mathrm{~mol}{ }^{-1} \\ (13.17) \\ \end{array} $$
$$ \begin{array}{r} \mathrm{C_4} \mathrm{H_{10}}(\mathrm{~g})+13 / 2 \mathrm{O_2}(\mathrm{~g}) \rightarrow 4 \mathrm{CO_2}(\mathrm{~g})+5 \mathrm{H_2} \mathrm{O}(1) \tag{13.18}\\
$$ \ddot{\mathrm{A}_\mathrm{c}} \mathrm{H}^{\grave{\mathrm{e}}}=-2875.84 \mathrm{~kJ} \mathrm{~mol}^{-1} $$ $$ \end{array} $$
किसी भी एल्केन के लिए सामान्य दहन समीकरण निम्नलिखित है :
$$\mathrm{C_\mathrm{n}} \mathrm{H_{2n+2}}+ \left(\frac{3 \mathrm{n}+1}{2} \right) \mathrm{O_2} \rightarrow \mathrm{nCO_2}+(\mathrm{n}+1) \mathrm{H_2} \mathrm{O} \tag{13.19}$$
दहन के दौरान बहुत अधिक ऊष्मा के उत्पादन के कारण, एल्केन ईंधन के रूप में उपयोग किए जाते हैं।
एल्केन के अपूर्ण दहन के दौरान हवा या डाइऑक्सीजन की मात्रा कम होने के कारण कार्बन ब्लैक बनता है जो इंक, प्रिंटर इंक, काले रंगक और फिल्टर के निर्माण में उपयोग किया जाता है।
$$\mathrm{CH_4}(\mathrm{~g})+\mathrm{O_2}(\mathrm{~g}) \xrightarrow[\text { combustion }]{\text { incomplete }} \mathrm{C}(\mathrm{s})+2 \mathrm{H_2} \mathrm{O}(1)\tag{13.20}$$
3. नियंत्रित ऑक्सीकरण
अल्केन उच्च दबाव एवं उपयुक्त कैटलिस्ट की उपस्थिति में डाइऑक्सीजन या हवा के नियंत्रित आपूर्ति के साथ गरम करने पर विभिन्न प्रकार के ऑक्सीकरण उत्पाद देते हैं।
$$ \text{(i)} \quad 2 \mathrm{CH_4}+\mathrm{O_2} \xrightarrow{\mathrm{Cu} / 523 \mathrm{~K} / 100 \mathrm{~atm}} \underset{\text{मेथनॉल}}{2 \mathrm{CH}_{3} \mathrm{OH}}\tag{13.21}$$
$$\text{(ii)} \quad\mathrm{CH_4}+\mathrm{O_2} \xrightarrow[\Delta]{\mathrm{Mo_2} \mathrm{O_3}} \underset{\text{मेथेनल}}{\mathrm{HCHO}}+\mathrm{H_2} \mathrm{O}\tag{13.22}$$
$$\text{(iii)}\quad 2 \mathrm{CH_3} \mathrm{CH_3}+3 \mathrm{O_2} \xrightarrow[\Delta]{\left(\mathrm{CH_3} \mathrm{COO}\right) \mathrm{Mn}} \underset{\text{एथेनोइक अम्ल}}{2 \mathrm{CH_3} \mathrm{COOH}}+2 \mathrm{H_2} \mathrm{O}\tag{13.23}$$
(iv) सामान्यतः एल्केन ऑक्सीकरण के प्रति प्रतिरोधी होते हैं लेकिन तृतीयक $\mathrm{H}$ परमाणु वाले एल्केन को पोटैशियम परमैंगनेट द्वारा संगत एल्कोहल में ऑक्सीकृत किया जा सकता है।
$$\underset{\text{2-मेथिलप्रोपेन}}{\left(\mathrm{iCH_3}\right)_3 \mathrm{CH}} \xrightarrow[\text { ऑक्सीकरण }]{\mathrm{KMnO_4}} \underset{\text{2-मेथिलप्रोपेन-2-ऑल}}{\left(\mathrm{CH_3}\right)_3 \mathrm{COH}} \tag{13.24}$$
4. समावयवीकरण
$ n $-एल्केन अनुग्रह बिना जल के एल्यूमिनियम क्लोराइड और हाइड्रोजन क्लोराइड गैस के उपस्थिति में गरम करने पर समावयवी एल्केन में बदल जाते हैं। मुख्य उत्पाद नीचे दिए गए हैं। कुछ छोटे उत्पाद भी संभव हैं जिनके बारे में आप विचार कर सकते हैं। छोटे उत्पाद आमतौर पर अनुगमन अभिक्रियाओं में रिपोर्ट नहीं किए जाते हैं।

5. आरोमैटिकता
$ n $-एल्केन्स जिनमें छह या उससे अधिक कार्बन परमाणु होते हैं, 10-20 वायुमंडलीय दबाव पर $ 773 \mathrm{~K} $ तक गरम करने पर वैनेडियम, मोलिब्डेनम या क्रोमियम के ऑक्साइड आधारित एल्यूमिना पर विलेय होकर डिहाइड्रोजनेट और साइक्लाइज़ कर बेंजीन और इसके समानुपाती बन जाते हैं। इस प्रक्रिया को आरोमैटिकता या रीफॉर्मिंग कहते हैं।

टولूईन $\left(\mathrm{C_7} \mathrm{H_8}\right)$ बेंजीन का मेथिल अवतरण है। टॉलूईन के निर्माण के लिए आप किस अल्केन को सुझाएंगे?
6. भाप के साथ अभिक्रिया
मेथेन 1273 K तापमान पर निकेल कैटलिस्ट की उपस्थिति में भाप के साथ अभिक्रिया करता है और कार्बन मोनोऑक्साइड तथा डाइहाइड्रोजन बनाता है। यह विधि डाइहाइड्रोजन गैस के औद्योगिक निर्माण के लिए प्रयोग की जाती है
$$\mathrm{CH_4}+\mathrm{H_{2IO}} \xrightarrow[\Delta]{\mathrm{Ni}} \mathrm{CO}+3 \mathrm{H_2} \tag{13.27}$$
7. पाइरोलिज़िस
उच्च अल्केन उच्च तापमान पर गरम करने पर निम्न अल्केन, अल्कीन आदि में विघटित हो जाते हैं। अत: ऊष्मा के अनुप्रयोग द्वारा इनकी विघटन अभिक्रिया द्वारा छोटे टुकड़ों में विघटन को पाइरोलिज़िस या क्रैकिंग कहते हैं।

अल्केन के पिरोलिज़ करना एक मुक्त रadical अभिक्रिया के रूप में माना जाता है। केरोसिन तेल या पेट्रोल से तेल गैस या पेट्रोल गैस के तैयार करने में पिरोलिज़ के सिद्धांत का उपयोग किया जाता है। उदाहरण के लिए, केरोसिन तेल के एक संघटक डोडेकेन, प्लैटिनम, पैलेडियम या निकेल की उपस्थिति में $973 \mathrm{~K}$ तक गरम करने पर हेप्टेन और पेंटीन के मिश्रण को देता है।
$$\underset{\text{डोडेकेन}}{\mathrm{C_{12}} \mathrm{H_{26}}} \xrightarrow[973 \mathrm{~K}]{\mathrm{Pt} / \mathrm{Pd} / \mathrm{Ni}} \underset{\text{हेप्टेन}}{\mathrm{C_7} \mathrm{H_{16}}} +\underset{\text{पेंटीन}}{\mathrm{C_5} \mathrm{H_{10}}} + {\text {अन्य उत्पाद}}\tag{13.29}$$
13.2.4 आकृतियाँ (Conformations)
अल्केन में कार्बन-कार्बन सिग्मा ( $\sigma$ ) बंध होते हैं। सिग्मा अणुओं के आवेश वितरण केंद्रीय अक्ष के चारों ओर सममित होता है जो इसके अक्ष के चारों ओर घूर्णन के कारण अप्रभावित रहता है। इसके कारण $\mathrm{C}-\mathrm{C}$ एकल बंध के चारों ओर स्वतंत्र घूर्णन होता है। यह घूर्णन अंतरिक्ष में परमाणुओं के विभिन्न स्थानीय व्यवस्था के रूप में व्यक्त होता है जो एक दूसरे में परिवर्तित हो सकते हैं। ऐसी स्थानीय व्यवस्था जो $\mathrm{C}-\mathrm{C}$ एकल बंध के चारों ओर घूर्णन के माध्यम से एक दूसरे में परिवर्तित हो सकती हैं, आकृतियाँ (conformations) या आकृति परिवर्तक (conformers) या घूर्णन परिवर्तक (rotamers) कहलाती हैं। अतः अल्केन $\mathrm{C}-\mathrm{C}$ एकल बंध के चारों ओर घूर्णन के माध्यम से अपरिमित आकृतियों के रूप में व्यक्त हो सकते हैं। हालांकि, यह याद रखना आवश्यक है कि $\mathrm{C}-\mathrm{C}$ एकल बंध के चारों ओर घूर्णन पूर्णतः स्वतंत्र नहीं होता। इसके चारों ओर घूर्णन को 1-20 किलोजूल प्रति मोल ${ }^{-1}$ के छोटे ऊर्जा बाधा के कारण अवरोधित होता है जो आसन्न बंधों के बीच कमजोर प्रतिकर्षण के कारण होता है। ऐसे प्रतिकर्षण को घूर्णन तनाव (torsional strain) कहा जाता है।
ईथेन के रूपांतरण : ईथेन अणु $\left(\mathrm{C_2} \mathrm{H_6}\right)$ में एक कार्बन-कार्बन एकल बंध होता है जिसमें प्रत्येक कार्बन परमाणु तीन हाइड्रोजन परमाणुओं से जुड़े होते हैं। ईथेन के गेंद और छड़ मॉडल को ध्यान में रखते हुए, एक कार्बन परमाणु को स्थिर रखें और दूसरे कार्बन परमाणु को $\mathrm{C}-\mathrm{C}$ अक्ष के चारों ओर घुमाएं। इस घुमाव के परिणामस्वरूप एक कार्बन परमाणु पर जुड़े हाइड्रोजन परमाणुओं के दूसरे कार्बन पर जुड़े हाइड्रोजन परमाणुओं के संबंध में असीमित स्थानिक व्यवस्थाएं बनती हैं। इन्हें रूपांतरण आइसोमर (रूपांतरण अणु) कहते हैं। इस प्रकार ईथेन के असीमित रूपांतरण होते हैं। हालांकि, दो अत्यधिक मामले होते हैं। एक रूपांतरण जिसमें दोनों कार्बन पर जुड़े हाइड्रोजन परमाणु एक दूसरे के बहुत करीब होते हैं, इसे छायांतरण रूपांतरण कहते हैं और दूसरा जिसमें हाइड्रोजन परमाणु एक दूसरे से बहुत दूर होते हैं, इसे स्थायी रूपांतरण कहते हैं। कोई भी अन्य मध्यवर्ती रूपांतरण झुके रूपांतरण कहलाते हैं। यह याद रखें कि सभी रूपांतरणों में बंध कोण और बंध लंबाई समान रहती है। छायांतरण और स्थायी रू रूपांतरण को सव एंड न्यूमैन प्रोजेक्शन द्वारा प्रस्तुत किया जा सकता है।
1. सॉवहॉर्स प्रोजेक्शन
इस प्रोजेक्शन में, अणु को अणु अक्ष के अनुदिश देखा जाता है। फिर इसे कागज पर प्रक्षेपित करने के लिए, केंद्रीय $\mathrm{C}-\mathrm{C}$ बंध को एक थोड़ा लंबी सीधी रेखा के रूप में खींचा जाता है। रेखा के ऊपरी सिरे को दाहिने या बाएं ओर कुछ हद तक झुकाया जाता है। रेखा के निचले सिरे पर सामने कार्बन दिखाया जाता है, जबकि रेखा के ऊपरी सिरे पर पीछे कार्बन दिखाया जाता है। प्रत्येक कार्बन के तीन रेखाएँ जुड़ी होती हैं जो तीन हाइड्रोजन परमाणुओं को दर्शाती हैं। रेखाएँ एक दूसरे से 120 डिग्री के कोण पर झुकी होती हैं। एथेन के डिस्क्लोज़ और स्टैग्गर्ड कон्फ़िगरेशन के सॉवहॉर्स प्रोजेक्शन को आकृति 13.2 में दर्शाया गया है।

चित्र 13.2 एथेन के सॉ ए हर्स प्रोजेक्शन
2. न्यूमैन प्रोजेक्शन
इस प्रोजेक्शन में, अणु को $\mathrm{C}-\mathrm{C}$ बंध के सामने से देखा जाता है। आंख के करीब वाले कार्बन परमाणु को एक बिंदु द्वारा प्रस्तुत किया जाता है। आगे के कार्बन परमाणु के तीन हाइड्रोजन परमाणु एक दूसरे से 120 डिग्री के कोण पर खींचे गए तीन रेखाओं द्वारा दिखाए जाते हैं। पीछे के कार्बन परमाणु (आंख से दूर वाला कार्बन परमाणु) को एक वृत्त द्वारा प्रस्तुत किया जाता है और तीन हाइड्रोजन परमाणु इसे एक दूसरे से 120 डिग्री के कोण पर खींचे गए छोटी रेखाओं द्वारा दिखाए जाते हैं। न्यूमैन के प्रोजेक्शन चित्र 13.3 में दिखाए गए हैं।

चित्र 13.3 एथेन के न्यूमैन प्रोजेक्शन
संकरण के सापेक्ष स्थिरता: जैसा कि पहले उल्लेख किया गया है, एथेन के स्थागित रूप में कार्बन-हाइड्रोजन बंध के इलेक्ट्रॉन बादल एक दूसरे से जितना संभव हो अधिक दूर रहते हैं। इसलिए, न्यूनतम प्रतिकर्षण बल, न्यूनतम ऊर्जा और अधिकतम अणु की स्थिरता होती है। दूसरी ओर, जब स्थागित रूप से झुकित रूप में परिवर्तित होता है, तो कार्बन-हाइड्रोजन बंध के इलेक्ट्रॉन बादल एक दूसरे के पास आ जाते हैं, जिसके परिणामस्वरूप इलेक्ट्रॉन बादल के प्रतिकर्षण बल बढ़ जाते हैं। इन बढ़े हुए प्रतिकर्षण बल के कारण अणु को अधिक ऊर्जा की आवश्यकता होती है और इसलिए अणु कम स्थिर होता है। जैसा कि पहले उल्लेख किया गया है, इलेक्ट्रॉन बादल के बीच प्रतिकर्षण, जो एक संकरण की स्थिरता को प्रभावित करता है, टॉर्शनल स्ट्रेन कहलाता है। टॉर्शनल स्ट्रेन के मापदंड एक बंध के घूर्णन कोण पर निर्भर करता है। इस कोण को भी डाइहेड्रल कोण या टॉर्शनल कोण कहा जाता है। एथेन के सभी संकरणों में, स्थागित रूप टॉर्शनल स्ट्रेन के लिए सबसे कम होता है और झुकित रूप टॉर्शनल स्ट्रेन के लिए सबसे अधिक होता है। इसलिए, स्थागित संकरण झुकित संकरण की तुलना में अधिक स्थिर होता है। इसलिए, अणु बहुत अधिक स्थागित संकरण में रहता है या हम कह सकते हैं कि यह पसंदीदा संकरण है। इसलिए, एथेन में एक बंध के घूर्णन के लिए निर्विवाद रूप से अनुमति नहीं है। दो अत्यधिक रूपों के बीच ऊर्जा अंतर लगभग 12.5 $\mathrm{kJ} \mathrm{mol}^{-1}$ के क्रम में होता है, जो बहुत कम है। सामान्य तापमान पर, एथेन अणु अंतराणुक संघटन के माध्यम से इस ऊर्जा बाधा के लिए पर्याप्त ऊष्मीय या गतिज ऊर्जा प्राप्त कर लेता है। इसलिए, एथेन में कार्बन-कार्बन एकल बंध के घूर्णन के लिए सभी व्यावहारिक उद्देश्यों के लिए लगभग अनुमति होती है। एथेन के विभिन्न संकरणीय आइसोमर को अलग और पहचान नहीं किया जा सकता है।
13.3 एल्कीन
एल्कीन असंतृप्त हाइड्रोकार्बन हैं जिनमें कम से कम एक द्विबंध होता है। एल्कीन के सामान्य सूत्र क्या होना चाहिए? एल्कीन में दो कार्बन परमाणुओं के बीच एक द्विबंध होता है, इसलिए एल्कीन के प्रत्येक अणु में एल्केन के अणु की तुलना में दो हाइड्रोजन परमाणु कम होते हैं। इसलिए, एल्कीन के सामान्य सूत्र $\mathrm{C_n} \mathrm{H_2 n}$ होता है। एल्कीन को ओलीफिन (ई बनाने वाला) भी कहा जाता है क्योंकि पहला सदस्य, एथिलीन या एथीन $\left(\mathrm{C_2} \mathrm{H_4}\right)$ क्लोरीन के साथ अभिक्रिया करने पर एक तेली तरल बनाता है।
13.3.1 डबल बॉंड की संरचना
एल्कीन में कार्बन-कार्बन डबल बॉंड एक मजबूत सिग्मा ( $\sigma$ ) बॉंड (बंधन एंथैल्पी लगभग $397 \mathrm{~kJ} \mathrm{~mol}^{-1}$ ) से बना होता है, जो $s p^{2}$ हाइब्रिडाइज्ड ऑर्बिटल के सीधे ओवरलैप के कारण होता है और एक दुर्बल पाई ( $\pi$ ) बॉंड (बंधन एंथैल्पी लगभग $284 \mathrm{~kJ} \mathrm{~mol}^{-1}$ ) जो दो कार्बन परमाणुओं के दो $2 p$ ऑर्बिटल के लेटरल या ओर ओवरलैप के कारण प्राप्त होता है। डबल बॉंड की बंधन लंबाई (134 pm) एक एकल $\mathrm{C}-\mathrm{C}$ बंध (154 pm) की तुलना में छोटी होती है। आप पहले जान चुके हैं कि पाई $(\pi)$ बॉंड दुर्बल बंध होता है क्योंकि दो $2 p$ ऑर्बिटल के बीच खराब लेटरल ओवरलैप के कारण होता है। इसलिए, पाई $(\pi)$ बॉंड की उपस्थिति एल्कीन को आवेग वाले आवेग वाले इलेक्ट्रॉनों के स्रोत के रूप में व्यवहार कराती है। इसलिए, एल्कीन इलेक्ट्रॉनों की खोज में रहे रासायनिक अभिकर्मकों या यौगिकों द्वारा आसानी से हमला किया जा सकता है। ऐसे अभिकर्मकों को इलेक्ट्रॉन अभिकर्मक कहा जाता है। दुर्बल $\pi$-बंध की उपस्थिति के कारण एल्कीन एल्केन की तुलना में अनाजान अणु होते हैं और इसलिए, एल्कीन इलेक्ट्रॉन अभिकर्मकों के साथ संयोजन करके एकल बंध युक्त यौगिकों में परिवर्तित किए जा सकते हैं। डबल बंध की शक्ति (बंधन एंथैल्पी, $681 \mathrm{~kJ} \mathrm{~mol}^{-1}$ ) एथेन में कार्बन-कार्बन एकल बंध की तुलना में अधिक होती है (बंधन एंथैल्पी, $348 \mathrm{~kJ} \mathrm{~mol}^{-1}$ )। एथीन अणु के ऑर्बिटल आरेख चित्र 13.4 और 13.5 में दिखाए गए हैं।

चित्र 13.4 एथीन का ऑर्बिटल चित्र जो केवल σ बंधों को दर्शाता है
13.3.2 नामकरण
IUPAC प्रणाली में एल्कीन के नामकरण के लिए, द्विबंध वाले अणु के सबसे लंबे कार्बन श्रृंखला को चुना जाता है। श्रृंखला की संख्या द्विबंध के करीब वाले सिरे से की जाती है। एल्केन के ‘एन’ से बदलकर ‘ईन’ का प्रतिस्थापन किया जाता है।

चित्र 13.5 एथीन के ऑर्बिटल चित्र जो (a) π-बंड, (b) π-क्लाउड और (c) बंड कोण और बंड लंबाई को दिखाता है
यह याद रखा जा सकता है कि एल्कीन श्रृंखला का पहला सदस्य है: $\mathrm{CH_2}$ ( $\mathrm{C_n} \mathrm{H_2 n}$ में $n$ को 1 से बदलकर प्राप्त किया जाता है) जिसे मेथीन कहा जाता है लेकिन इसकी बहुत छोटी आयु होती है। जैसा कि पहले उल्लेख किया गया है, एल्कीन श्रृंखला का पहला स्थायी सदस्य $\mathrm{C_2} \mathrm{H_4}$ है जिसे एथिलीन (सामान्य) या एथीन (IUP ए) कहा जाता है। एल्कीन के कुछ सदस्यों के IUPAC नाम नीचे दिए गए हैं :

समस्या 13.7
निम्नलिखित यौगिकों के IUPAC नाम लिखिए:

हल
(i) 2,8-डाइमेथिल-3, 6-डेकाडाईईन;
(ii) $1,3,5,7$ ओक्टाटेट्रेन;
(iii) 2-n-प्रोपिलपेंट-1-ईन;
(iv) 4-एथिल-2,6-डाइमेथिल-डेस-4-ईन;
समस्या 13.8
उपरोक्त संरचनाओं (i-iv) में सिग्मा ( $\sigma$ ) और पाई $(\pi)$ बंड की संख्या गणना करें।
हल
$\sigma$ बंड : $33, \pi$ बंड : 2
$\sigma$ बंड : $17, \pi$ बंड : 4
$\sigma$ बंड : $23, \pi$ बंड $: 1$
$\sigma$ बंड : $41, \pi$ बंड : 1
13.3.3 समावेशन
एल्कीन दोनों संरचनात्मक समावेशन और ज्यामितीय समावेशन दिखाते हैं।
संरचनात्मक समावेशन : ऐथीन $\left(\mathrm{C_2} \mathrm{H_4}\right)$ और प्रोपीन $\left(\mathrm{C_3} \mathrm{H_6}\right)$ केवल एक संरचना के रूप में हो सकते हैं, लेकिन प्रोपीन से बड़े एल्कीन अलग-अलग संरचनाएं हो सकते हैं। $\mathrm{C_4} \mathrm{H_8}$ के अणुसूत्र वाले एल्कीन को निम्नलिखित तीन तरीकों से लिखा जा सकता है:



संरचना I और III, तथा II और III श्रृंखला समावयवता के उदाहरण हैं जबकि संरचना I और II स्थान समावयवता के उदाहरण हैं।
समस्या 13.9
$\mathrm{C_5} \mathrm{H_{10}}$ के अल्कीन के विभिन्न संरचनात्मक समावयवों के संरचना एवं IUPAC नाम लिखिए।
हल

ज्यामितीय समावयवता: द्विबंधित कार्बन परमाणु अपने शेष दो बंधों को संतुष्ट करने के लिए दो परमाणुओं या समूहों के साथ जुड़े होते हैं। यदि प्रत्येक कार्बन परमाणु के दो परमाणु या समूह अलग-अलग हों, तो उन्हें YX C = C XY जैसी संरचना द्वारा प्रस्तुत किया जा सकता है। $\mathrm{YX} \mathrm{C}=\mathrm{C} X Y$ को अंतरिक अंतर के द्वारा निम्नलिखित दो तरीकों से प्रस्तुत किया जा सकता है :

(ए) में, दो समान परमाणु अर्थात दोनों $\mathrm{X}$ या दोनों $\mathrm{Y}$ डबल बॉंड के एक ही ओर हैं लेकिन (बी) में दो $\mathrm{X}$ या दो $\mathrm{Y}$ डबल बॉंड के विपरीत ओर हैं या डबल बॉंड के दोनों ओर हैं। इसके परिणामस्वरूप (ए) और (बी) के अलग-अलग ज्यामिति होती है अर्थात दो व्यवस्थाओं में परमाणुओं या समूहों के अंतर के अंतर अंतर अंतर होता है। इसलिए, वे स्टीरियोइसोमर होते हैं। यदि $\mathrm{C}=\mathrm{C}$ बॉंड के चारों ओर परमाणु या समूह घूम सकते हैं तो इनकी एक ही ज्यामिति होती लेकिन $\mathrm{C}=\mathrm{C}$ बॉंड के चारों ओर घूमना स्वतंत्र नहीं है। यह सीमित है। इस अवधारणा को समझने के लिए दो मजबूत कार्डबोर्ड के टुकड़े ले लो और दो नाइल की सहायता से उन्हें जोड़ दो। एक कार्डबोर्ड को अपने एक हाथ में रखो और दूसरे कार्डबोर्ड को घुमाने की कोशिश करो। क्या आप वास्तव में दूसरे कार्डबोर्ड को घुमा सकते हैं? उत्तर हां नहीं है। घूमना सीमित है। यह दर्शाता है कि डबल बॉंड के कार्बन परमाणुओं के चारों ओर परमाणुओं या समूहों के सीमित घूमने से ऐसे यौगिकों के अलग-अलग ज्यामिति उत्पन्न होती है। इस प्रकार के स्टीरियोइसोमर को ज्यामितीय इसोमर कहा जाता है। (ए) प्रकार के इसोमर, जिसमें डबल बॉंड के एक ही ओर दो समान परमाणु या समूह होते हैं, को सिस इसोमर कहा जाता है और (बी) प्रकार के इसोमर, जिसमें डबल बॉंड के विपरीत ओर दो समान परमाणु या समूह होते हैं, को ट्रांज़ इसोमर कहा जाता है। इसलिए, सिस और ट्रांज़ इसोमर की संरचना समान होती है लेकिन उनकी विन्यास (अंतर के अंतर) अलग होता है। अंतर के अंतर के कारण इन इसोमर के गुण अलग होते हैं जैसे गलनांक, क्वथनांक, विद्युत बहुलक, घुलनशीलता आदि। ब्यूट-2-ईन के ज्यामितीय या सिस-ट्रांज़ इसोमर नीचे दिखाए गए हैं :

अल्कीन के सिस रूप ट्रांस रूप की तुलना में अधिक ध्रुवीय पाए जाते हैं। उदाहरण के लिए, सिस-ब्यूट-2-ईन के द्विध्रुव आघूर्ण 0.33 डेबी होता है, जबकि ट्रांस रूप के द्विध्रुव आघूर्ण लगभग शून्य होता है या इसके अंतर्गत ट्रांस-ब्यूट-2-ईन को अधिक ध्रुवीय नहीं माना जा सकता। इसकी व्याख्या दोनों रूपों के ज्यामितीय आकृतियों के बारे में चित्र बनाकर की जा सकती है जैसा कि नीचे दिया गया है। इससे स्पष्ट होता है कि ट्रांस-ब्यूट-2-ईन में दो मेथिल समूह विपरीत दिशाओं में होते हैं, अतः $\mathrm{C}-\mathrm{CH_3}$ बंधों के द्विध्रुव आघूर्ण एक दूसरे को विपरीत दिशा में बरकरार रखते हैं, जिसके कारण ट्रांस रूप अधिक ध्रुवीय नहीं होता।

ठोसों के मामले में देखा गया है कि ट्रांस इसोमर के गलनांक एसिस रूप के मुकाबले अधिक होता है।
ज्यामेट्रिकल या सिस-ट्रांस इसोमरिज्म $\mathrm{XYC}=\mathrm{CXZ}$ और $\mathrm{XYC}=\mathrm{CZW}$ आइसोमर के प्रकार के एल्कीन द्वारा भी प्रदर्शित किया जाता है।
समस्या 13.10
निम्नलिखित यौगिकों के सिस और ट्रांस इसोमर बनाइए। इनके IUPAC नाम भी लिखिए :
(i) $\mathrm{CHCl}=\mathrm{CHCl}$
(ii) $\mathrm{C_2} \mathrm{H_5} \mathrm{CCH_3}=\mathrm{CCH_3} \mathrm{C_2} \mathrm{H_5}$
हल

समस्या 13.11
निम्नलिखित में से कौन-सा यौगिक समावयवता दर्शाएगा?
$ \begin{aligned} & \text { (i) }\left(\mathrm{CH_3}\right)_{2} \mathrm{C}=\mathrm{CH}-\mathrm{C_2} \mathrm{H_5} \\ `
& \text { (ii) } \mathrm{CH_2}=\mathrm{CBr_2} \\ & \text { (iii) } \mathrm{C_6} \mathrm{H_5} \mathrm{CH}=\mathrm{CH}-\mathrm{CH_3} \\ & \text { (iv) } \mathrm{CH_3} \mathrm{CH}=\mathrm{CCl} \mathrm{CH} \\ \end{aligned} $
हल
(iii) और (iv)।
संरचना (i) और (ii) में, एक द्विबंधित कार्बन पर दो समान समूह जुड़े हुए हैं।
13.3.4 तैयारी
1. ऐल्काइन से: ऐल्काइन को बर्फ के उपस्थिति में गणना किए गए मात्रा में डाइहाइड्रोजन के साथ आंशिक अपचयन द्वारा ऐल्कीन प्राप्त किए जा सकते हैं। ऐल्काइन के आंशिक अपचयन द्वारा ऐल्कीन बनाए जाते हैं। ऐल्कीन जो इस तरह प्राप्त किए जाते हैं, वे सिस ज्योमेट्री के होते हैं। हालांकि, तरल अमोनिया में सोडियम की उपस्थिति में ऐल्काइन के अपचयन द्वारा ट्रांस ऐल्कीन प्राप्त किए जा सकते हैं।

क्या इस प्रकार प्राप्त प्रोपीन एक जैकर्बिक समावयवता दिखाएगा? अपने उत्तर के समर्थन में कारण बताएं।
2. एल्किल हैलाइड से: एल्किल हैलाइड (R-X) एल्कोहॉलिक पोटाश (एल्कोहल में घोला गया पोटेशियम हाइड्रॉक्साइड, जैसे एथेनॉल में) के साथ गरम करने पर एक अणु हैलोजन अम्ल के अपसारण द्वारा एल्कीन बनाते हैं। यह अभिक्रिया डिहाइड्रोहैलोजनेशन के रूप में जानी जाती है, अर्थात हैलोजन अम्ल के अपसारण। यह एक $\beta$-अपसारण अभिक्रिया का उदाहरण है, क्योंकि हाइड्रोजन परमाणु के अपसारण के लिए $\beta$ कार्बन परमाणु (हैलोजन जुड़े कार्बन के अगले कार्बन परमाणु) से होता है।

हैलोजन परमाणु की प्रकृति और ऐल्किल समूह अभिक्रिया की दर को निर्धारित करते हैं। यह प्रेक्षित किया गया है कि हैलोजन के लिए दर इस प्रकार होती है: आयोडीन > ब्रोमीन > क्लोरीन, जबकि ऐल्किल समूह के लिए यह इस प्रकार होती है: तृतीयक $>$ द्वितीयक $>$ प्राथमिक।
3. समीपस्थ डाइहैलाइड से: वे डाइहैलाइड जिनमें दो हैलोजन परमाणु दो समीपस्थ कार्बन परमाणुओं के साथ जुड़े होते हैं, समीपस्थ डाइहैलाइड कहलाते हैं। समीपस्थ डाइहैलाइड जिंक धातु के साथ अभिक्रिया करते हुए $\mathrm{ZnX_2}$ के एक अणु के नुकसान के साथ एक ऐल्कीन बनाते हैं। इस अभिक्रिया को डेहैलोजनन कहते हैं।
$$\mathrm{CH_2Br-CH_2Br}+ \mathrm{Zn} \longrightarrow \mathrm{CH_2=CH_2} + \mathrm{ZnBr_2} \tag{13.35}$$
$$\mathrm{CH_2CHBr-CH_2Br}+ \mathrm{Zn} \longrightarrow \mathrm{CH_3CH=CH_2} + \mathrm{ZnBr_2} \tag{13.36}$$
4. एल्कोहल से अम्लीय विस्थापन द्वारा: आपने इकाई 12 में विभिन्न समान श्रेणी के नामकरण के दौरान पढ़ा होगा कि एल्कोहल एल्केन के हाइड्रॉक्सी अवतरण होते हैं। वे $\mathrm{R}-\mathrm{OH}$ द्वारा प्रतिनिधित्व किए जाते हैं जहाँ, $\mathrm{R}$ एल्केन के रूप में $\mathrm{C_\mathrm{n}} \mathrm{H_{2 \mathrm{n}+1}}$ होता है। एल्कोहल को अम्लीय विस्थापन द्वारा गर्म करके एल्कीन बनते हैं जिसमें एक जल अणु के विस्थापन होता है। चूंकि अम्ल की उपस्थिति में एल्कोहल अणु से एक जल अणु के विस्थापन होता है, इस अभिक्रिया को एल्कोहल के अम्लीय विस्थापन के रूप में जाना जाता है। यह अभिक्रिया $\beta$-विस्थापन अभिक्रिया का एक उदाहरण भी है क्योंकि $-\mathrm{OH}$ समूह एक हाइड्रोजन परमाणु को $\beta$-कार्बन परमाणु से निकालता है।

13.3.5 गुण
भौतिक गुण
एल्कीन के भौतिक गुण एल्केन के समान होते हैं, बिलकुल अपवाद के रूप में अपवाद आइसोमरिज्म के प्रकार और ध्रुवीय प्रकृति में अंतर होता है। पहले तीन सदस्य गैस होते हैं, अगले चौदह सदस्य तरल होते हैं और उच्च तापमान वाले सदस्य ठोस होते हैं। एथीन एक रंगहीन गैस है जिसका एक नुस्खा रूप से मीठा गंध होती है। सभी अन्य एल्कीन रंगहीन और गंधहीन होते हैं, पानी में घुलनशील नहीं होते लेकिन बेन्जीन, पेट्रोलियम ईथर जैसे अध्रुवीय विलायकों में अच्छी तरह से घुलते हैं। वे आकार में वृद्धि के साथ उबलने के बिंदु में नियमित वृद्धि दिखाते हैं, अर्थात, प्रत्येक - $\mathrm{CH_2}$ समूह के जोड़ने से उबलने के बिंदु में 20-3 डिग्री की वृद्धि होती है। एल्केन की तरह, सीधे शृंखला वाले एल्कीन के उबलने के बिंदु आइसोमेरिक शाखित शृंखला यौगिकों के बराबर होते हैं।
रासायनिक गुण
एल्कीन्स अपने कार्बन-कार्बन द्विबंध पर आसानी से बंधे पाई $(\pi)$ इलेक्ट्रॉनों के स्रोत होते हैं, जिस कारण वे योग अभिक्रियाओं में भाग लेते हैं। इन अभिक्रियाओं में इलेक्ट्रॉन धनात्मक अभिकर्मक द्वारा द्विबंध पर जुड़ते हैं और योग उत्पाद बनते हैं। कुछ अभिकर्मक आवेग अभिक्रिया योग के माध्यम से भी जुड़ते हैं। विशेष शर्तों के अधीन एल्कीन्स आवेग प्रतिस्थापन अभिक्रियाओं में भी भाग ले सकते हैं। ऑक्सीकरण और ओजोनोलाइज़ अभिक्रियाएं एल्कीन्स में भी बहुत प्रमुख होती हैं। एल्कीन्स के विभिन्न अभिक्रियाओं का एक संक्षिप्त वर्णन नीचे दिया गया है:
1. द्विहाइड्रोजन के योग: एल्कीन छोटे कणों वाले निकल, पैलेडियम या प्लैटिनम की उपस्थिति में एक अणु द्विहाइड्रोजन गैस के साथ योग करते हैं ताकि एल्केन बने (अनुच्छेद 9.2.2)
2. हैलोजन के योग : ब्रोमीन या क्लोरीन जैसे हैलोजन एल्कीन के साथ योग करके विसंगत डाइहैलाइड बनाते हैं। हालांकि, आम शर्तों में आयोडीन के योग अभिक्रिया नहीं होती। कार्बन टेट्राक्लोराइड में ब्रोमीन के लाल-पीले रंग की विलयन का रंग जब ब्रोमीन एक असंतृप्त साइट पर योग करता है तो खत्म हो जाता है। यह अभिक्रिया असंतृप्तता के परीक्षण के रूप में उपयोग की जाती है। एल्कीन में हैलोजन के योग एक विसंगत योग अभिक्रिया के उदाहरण है जिसमें चक्रीय हैलोनियम आयन के निर्माण शामिल होता है जिसे आप उच्च वर्ग में अध्ययन करेंगे।

3. हाइड्रोजन हैलाइड के योग: हाइड्रोजन हैलाइड $(\mathrm{HCl}, \mathrm{HBr}, \mathrm{HI})$ एल्कीन के साथ जुड़कर एल्किल हैलाइड बनाते हैं। हाइड्रोजन हैलाइड की प्रतिक्रिया क्षमता का क्रम $\mathrm{HI}>\mathrm{HBr}>\mathrm{HCl}$ होता है। एल्कीन पर हैलोजन के योग के समान, हाइड्रोजन हैलाइड के योग भी एक उदाहरण है इलेक्ट्रोफिलिक योग प्रतिक्रिया का। हम इसका उदाहरण लेते हुए देखेंगे कि $\mathrm{HBr}$ किस प्रकार सममित एवं असममित एल्कीन पर जुड़ता है।
सममित एल्कीन पर $\mathrm{HBr}$ के योग अभिक्रिया
सममित एल्कीन पर $\mathrm{HBr}$ के योग अभिक्रिया (एल्कीन पर दोनों तरफ समान समूह जुड़े हों) विद्युत धनात्मक योग योग अभिक्रिया के माध्यम से होती है।

असममित एल्कीन पर $\mathrm{HBr}$ के योग अभिक्रिया (मार्कोनिकोव नियम)
प्रोपीन पर $\mathrm{H}-\mathrm{Br}$ कैसे जुड़ेगा? दो संभावित उत्पाद I और II हैं।

1869 में एक रूसी रसायन विज्ञानी मार्कोवनिकोव ने ऐसी अभिक्रियाओं के विस्तारपूर्वक अध्ययन के बाद एक सामान्यीकरण किया। इन सामान्यीकरणों ने मार्कोवनिकोव को एक नियम के निर्माण में सहायता की, जिसे मार्कोवनिकोव नियम कहते हैं। नियम कहता है कि अभिकर्मक के नकारात्मक भाग को वह कार्बन परमाणु जो कम संख्या में हाइड्रोजन परमाणु रखता है, उस पर जुड़ेगा। इस नियम के अनुसार, उत्पाद I अर्थात 2-ब्रोमोप्रोपेन की उम्मीद होती है। वास्तविक अभिक्रिया में, यह अभिक्रिया का मुख्य उत्पाद होता है। मार्कोवनिकोव नियम के इस सामान्यीकरण को अभिक्रिया के योग संचालन के अनुसार बेहतर ढंग से समझा जा सकता है।
मेकैनिज़्म
हाइड्रोजन ब्रोमाइड एक इलेक्ट्रॉन अतिक्रमणक (electrophile), $\mathrm{H}^{+}$, प्रदान करता है, जो द्विबंध के बराबर आक्रमण करता है और कार्बोकेटियन के निर्माण के लिए जैसा नीचे दिखाया गया है :

(i) द्वितीयक कार्बोकेटियन (b) प्राथमिक कार्बोकेटियन (a) की तुलना में अधिक स्थायी होता है, इसलिए यह पहले से बनने के कारण अधिक विद्यमान होता है।
(ii) कार्बोकेटियन (b) के द्वारा $\mathrm{Br}^{-}$ आयन के आक्रमण से उत्पाद बनता है जैसा कि नीचे दिखाया गया है :

अंतर मार्कोवनिकोव योग या परॉक्साइड प्रभाव या खरश प्रभाव
परॉक्साइड की उपस्थिति में, $\mathrm{HBr}$ के असममित एल्कीन जैसे प्रोपीन पर योग अभिक्रिया मार्कोवनिकोव नियम के विपरीत होती है। यह केवल $\mathrm{HBr}$ के साथ ही होती है, न कि $\mathrm{HCl}$ और $\mathrm{HI}$ के साथ। इस अभिक्रिया को 1933 में चिकागो विश्वविद्यालय में M.S. खरश और F.R. मेयो द्वारा देखा गया था। इस अभिक्रिया को परॉक्साइड या खरश प्रभाव या मार्कोवनिकोव नियम के विपरीत अंतर योग अभिक्रिया के रूप में जाना जाता है।

मेकैनिज्म : परॉक्साइड प्रभाव निम्नलिखित तरीके से मुक्त रेडिकल श्रृंखला मेकैनिज्म के माध्यम से चलता है:


ऊपर दिए गए योग के योगांतर में (चरण iii) प्राप्त द्वितीयक मुक्त रadical प्राथमिक से अधिक स्थायी होता है। इसके कारण 1-ब्रोमोप्रोपेन प्रमुख उत्पाद के रूप में बनता है। ध्यान देने योग्य है कि $\mathrm{HCl}$ और $\mathrm{HI}$ के योग में परॉक्साइड प्रभाव नहीं दिखाई देता। इसके कारण यह हो सकता है कि $\mathrm{H}-\mathrm{Cl}$ बंध (430.5 $\mathrm{kJ} \mathrm{mol}^{-1}$ ) $\mathrm{H}-\mathrm{Br}$ बंध $\left(363.7 \mathrm{~kJ} \mathrm{~mol}^{-1}\right.$ ) से अधिक मजबूत होती है और मुक्त रadical द्वारा टूट नहीं सकती, जबकि $\mathrm{H}-\mathrm{I}$ बंध (296.8 $\left.\mathrm{kJ} \mathrm{mol}^{-1}\right)$ अपेक्षाकृत कमजोर होती है और आयोडीन मुक्त रadical आयोडीन अणु बनाने के बजाए द्विबंध के साथ योग करते हैं।
समस्या 13.12
हेक्स-1-ईन पर $\mathrm{HBr}$ के योग अभिक्रिया द्वारा प्राप्त उत्पादों के IUPAC नाम लिखिए
(i) परॉक्साइड की अनुपस्थिति में और
(ii) परॉक्साइड की उपस्थिति में।
हल

4. सल्फ्यूरिक अम्ल के योग : ठंडा सांद्र सल्फ्यूरिक अम्ल एल्कीन पर मार्कोवनिकोव नियम के अनुसार एल्किल हाइड्रोजन सल्फेट बनाने के लिए एलेक्ट्रोफिलिक योग अभिक्रिया द्वारा अभिक्रिया करता है।

5. जल का योग : केंद्रित सल्फ्यूरिक अम्ल के कुछ बूँदों की उपस्थिति में एल्कीन जल के साथ अभिक्रिया करके एल्कोहल बनाते हैं, मार्कोवनिकोव के नियम के अनुसार।

6. ऑक्सीकरण: एल्कीन को ठंडे, तनु, जलीय पोटैशियम परमैंगनेट (बेयरर के अजल) के साथ अभिक्रिया में विकिन ग्लाइकॉल बनते हैं। $\mathrm{KMnO_4}$ के घोल के अपचायकरण का परीक्षण असंतृप्तता के लिए किया जाता है।

b) अम्लीय पोटैशियम परमैंगनेट या अम्लीय पोटैशियम डाइक्रोमेट एल्कीन को एल्कीन की प्रकृति और प्रयोगशाला स्थितियों के आधार पर केटोन और/या अम्ल में ऑक्सीकृत करते हैं।
$$\underset{\text{2-मेथिल प्रोपीन}}{\left(\mathrm{CH_3}\right)_2 \mathrm{C}=\mathrm{CH_2}} \xrightarrow{\mathrm{KMnO_4} / \mathrm{H}^{+}} \underset{\text{प्रोपेन-2-ओन}}{\left(\mathrm{CH_3}\right)_2 \mathrm{C}=\mathrm{O}+\mathrm{CO_2}}+\mathrm{H_2} \mathrm{O}\tag{13.49}$$
$$\underset{\text{ब्यूट-2-ईन}}{\mathrm{CH_3}-\mathrm{CH}=\mathrm{CH}-\mathrm{CH_3}} \xrightarrow{\mathrm{KMnO_4} / \mathrm{H}^{+}} \underset{\text{एथेनोइक अम्ल}}{2 \mathrm{CH_3} \mathrm{COOH}}\tag{13.50}$$
7. ओजोनोलाइसिस : एल्कीन के ओजोनोलाइसिस में ओजोन अणु के एल्कीन पर जोड़ कर ओजोनाइड का निर्माण होता है, और फिर ओजोनाइड के विघटन के लिए $\mathrm{Zn}-\mathrm{H_2} \mathrm{O}$ का उपयोग किया जाता है जिससे छोटे अणु बनते हैं। इस अभिक्रिया का उपयोग एल्कीन या अन्य असंतृप्त यौगिकों में द्विबंध के स्थान के पता लगाने में बहुत उपयोगी होती है।

8. पॉलीमरीकरण: आप पॉलीथीन बैग और पॉलीथीन शीट के बारे में अच्छी तरह जानते हैं। पॉलीथीन उच्च तापमान, उच्च दबाव और एक कैटलॉस्ट की उपस्थिति में बहुत सारे एथीन अणुओं के संयोजन से प्राप्त किया जाता है। इस प्रकार प्राप्त बड़े अणु एक बार बने अणुओं के रूप में जाने जाते हैं जिन्हें पॉलीमर कहा जाता है। इस अभिक्रिया को पॉलीमरीकरण कहा जाता है। जिन सरल यौगिकों से पॉलीमर बनाए जाते हैं उन्हें मोनोमर कहा जाता है।
अन्य एल्कीन भी पॉलीमरीकरण के अंतर्गत आते हैं।

पॉलीमर प्लास्टिक बैग, स्प्रेट बोतल, रेफ्रिजरेटर डिश, खिलौने, पाइप, रेडियो और टी.वी. कैबिनेट आदि के निर्माण में प्रयोग किए जाते हैं। पॉलीप्रोपीन का उपयोग दूध के क्रेट, प्लास्टिक बर्तन और अन्य मॉल्ड किए गए वस्तुओं के निर्माण में किया जाता है। यद्यपि इन सामग्रियों का उपयोग अब सामान्य बन गया है, लेकिन पॉलीथीन और पॉलीप्रोपीन के अत्यधिक उपयोग सभी के लिए एक बड़ी चिंता का विषय है।
13.4 ऐल्किन
ऐल्कीन के जैसे, ऐल्किन असंतृप्त हाइड्रोकार्बन भी होते हैं। ये दो कार्बन परमाणुओं के बीच कम से कम एक त्रिगुणी बंध के साथ होते हैं। ऐल्किन में हाइड्रोजन परमाणुओं की संख्या ऐल्कीन या ऐल्केन की तुलना में अधिक कम होती है। इनका सामान्य सूत्र $\mathrm{C_\mathrm{n}} \mathrm{H_{2 \mathrm{n}-2}}$ होता है।
ऐल्किन श्रृंखला के पहले स्थायी सदस्य ऐथाइन है, जिसे आमतर पर एसिटिलीन के रूप में जाना जाता है। एसिटिलीन का उपयोग ऑक्सीएसिटिलीन लौ बनाकर विद्युत लौ बर्निंग के लिए किया जाता है, जो एसिटिलीन और ऑक्सीजन गैस के मिश्रण से प्राप्त किया जाता है। ऐल्किन बहुत से अनुप्रयोगों के लिए बड़ी संख्या में आगे के अनुप्रयोगों के लिए आधार बनते हैं। इसलिए, इस वर्ग के अनुप्रयोगों के अध्ययन के लिए रुचि रखना दिलचस्प होता है।
13.4.1 नामकरण एवं समावयवता
सामान्य प्रणाली में, ऐल्काइन के नाम एसिटिलीन के अवतरण के रूप में दिए जाते हैं। IUPAC प्रणाली में, वे संगत ऐल्केन के अवतरण के रूप में नामित किए जाते हैं, जहाँ ‘ane’ के स्थान पर ‘yne’ के प्रतीक का उपयोग किया जाता है। त्रिगुणित बंध की स्थिति को पहले त्रिगुणित बंध वाले कार्बन के द्वारा इंगित किया जाता है। ऐल्काइन श्रेणी के कुछ सदस्यों के सामान्य एवं IUPAC नाम तालिका 13.2 में दिए गए हैं।
आप पहले सीख चुके हैं कि ऐथाइन एवं प्रोपाइन केवल एक संरचना के रूप में होते हैं, लेकिन ब्यूटाइन के लिए दो संभावित संरचनाएँ हो सकती हैं (i) ब्यूट-1-इन एवं (ii) ब्यूट-2-इन। इन दो यौगिकों में त्रिगुणित बंध की स्थिति के कारण संरचना में अंतर होता है, इसलिए उन्हें स्थान समावयवी कहा जाता है। आगे वाले होमोलॉग के संरचना कितने तरीकों से बनाई जा सकती है, अर्थात अगले ऐल्काइन के अणुसूत्र $\mathrm{C_5} \mathrm{H_8}$ के लिए? चलो पाँच कार्बन परमाणुओं के साथ एक लंबी श्रृंखला एवं एक ओर बाहरी शाखा के साथ संभावित संरचनाओं को व्यवस्थित करने की कोशिश करें। नीचे दी गई संभावित संरचनाएँ हैं :

संरचना I और II स्थान समावयवी हैं और संरचना I और III या II और III श्रृंखला समावयवी हैं।
समस्या 13.13
अल्काइन श्रृंखला के $5^{\text {th }}$ सदस्य के लिए विभिन्न समावयवियों की संरचना लिखिए। सभी समावयवियों के IUPAC नाम भी लिखिए। विभिन्न समावयवियों के समावयवी विकृति किस प्रकार की है?
हल
एल्काइन के $5^{\text {th }}$ सदस्य के अणुसूत्र $\mathrm{C_6} \mathrm{H_{10}}$ है। संभावित समावयवी हैं:

अलग-अलग युग्मों द्वारा दर्शाए गए स्थान और श्रृंखला समावयवी।
तालिका 13.2 एल्काइन के सामान्य और IUPAC नाम $\left(\mathrm{C_\mathrm{n}} \mathrm{H_2 \mathrm{n}-2}\right)$
| $\mathbf{n}$ का मान | सूत्र | संरचना | सामान्य नाम | IUP नाम |
| :—: | :—: | :— | :— | :— | | 2 | $\mathrm{C_2} \mathrm{H_2}$ | $\mathrm{H}-\mathrm{C} \equiv \mathrm{CH}$ | एसिटिलीन | एथाइन | | 3 | $\mathrm{C_3} \mathrm{H_4}$ | $\mathrm{CH_3}-\mathrm{C} \equiv \mathrm{CH}$ | मेथिलएसिटिलीन | प्रोपाइन | | 4 | $\mathrm{C_4} \mathrm{H_6}$ | $\mathrm{CH_3} \mathrm{CH} \mathrm{H_2}-\mathrm{C} \equiv \mathrm{CH}$ | एथिलएसिटिलीन | ब्यूट-1-इन | | 4 | $\mathrm{C_4} \mathrm{H_6}$ | $\mathrm{CH_3}-\mathrm{C} \equiv \mathrm{C}-\mathrm{CH_3}$ | डाइमेथिलएसिटिलीन | ब्यूट-2-इन |
13.4.2 त्रि-बंड की संरचना
ईथाइन ऐल्काइन श्रेणी के सरलतम अणु है। ईथाइन की संरचना चित्र 13.6 में दिखाई गई है।
ईथाइन के प्रत्येक कार्बन परमाणु के दो $s p$ हाइब्रिडाइज्ड ऑर्बिटल होते हैं। कार्बन-कार्बन सिग्मा ( $\sigma$ ) बंड दोनों कार्बन परमाणुओं के दो $s p$ हाइब्रिडाइज्ड ऑर्बिटल के सिर-सिर अधिरोपण से बनता है। प्रत्येक कार्बन परमाणु के शेष $s p$ हाइब्रिडाइज्ड ऑर्बिटल अंतर-केंद्रीय अक्ष के अनुदिश दोनों हाइड्रोजन परमाणुओं के $1 \mathrm{~s}$ ऑर्बिटल के साथ अधिरोपित होते हैं जिससे दो $\mathrm{C}-\mathrm{H}$ सिग्मा बंड बनते हैं। $\mathrm{H}-\mathrm{C}-\mathrm{C}$ बंड कोण 180 है। प्रत्येक कार्बन के दो अहाइब्रिडाइज्ड $p$ ऑर्बिटल होते हैं जो एक दूसरे और $\mathrm{C}-\mathrm{C}$ सिग्मा बंड के तल के लंबवत होते हैं। एक कार्बन परमाणु के $2 p$ ऑर्बिटल दूसरे कार्बन परमाणु के $2 p$ ऑर्बिटल के समानांतर होते हैं।

चित्र 13.6 एथाइन के ऑर्बिटल चित्र जो (a) सिग्मा अधिरोपण और (b) पाई अधिरोपण दिखाता है।
दूसरे कार्बन परमाणु के ऑर्बिटल, जो लेटरल या ओर बाजू की ओर अधिरोपण करते हैं, दो पाई $(\pi)$ बंधन बनाते हैं। इस प्रकार एथाइन अणु में एक $\mathrm{C}-\mathrm{C} \sigma$ बंधन, दो $\mathrm{C}-\mathrm{H} \sigma$ बंधन और दो $\mathrm{C}-\mathrm{C}$ $\pi$ बंधन होते हैं। $\mathrm{C} \equiv \mathrm{C}$ बंधन की शक्ति (बंधन एंथैल्पी $823 \mathrm{~kJ} \mathrm{~mol}^{-1}$ ) $\mathrm{C}=\mathrm{C}$ बंधन (बंधन एंथैल्पी $681 \mathrm{~kJ} \mathrm{~mol}^{-1}$ ) और $\mathrm{C}-\mathrm{C}$ बंधन (बंधन एंथैल्पी $348 \mathrm{~kJ} \mathrm{~mol}^{-1}$ ) की तुलना में अधिक होती है। $\mathrm{C} \equiv \mathrm{C}$ बंधन की लंबाई ( $120 \mathrm{pm}$ ) $\mathrm{C}=\mathrm{C}$ (133 pm) और $\mathrm{C}-\mathrm{C}$ (154 pm) की तुलना में छोटी होती है। दो कार्बन परमाणु के बीच इलेक्ट्रॉन क्षेत्र अंतरनाभिक अक्ष के बारे में सिलिंड्रिकल सममित होता है। इसलिए, एथाइन एक रेखीय अणु होता है।
13.4.3 तैयारी
1. कैल्शियम कार्बाइड से: औद्योगिक तैयारी में, एथिन एक बार जल के साथ कैल्शियम कार्बाइड के साथ उपचार करके बनाया जाता है। कैल्शियम कार्बाइड को तेज लीम के साथ कोक के साथ गरम करके बनाया जाता है। तेज लीम को चूना पत्थर के गरम करके प्राप्त किया जा सकता है, जैसा कि नीचे दिए गए अभिक्रियाओं में दिखाया गया है:
$\mathrm{CaCO} _{3} \xrightarrow{\Delta} \mathrm{CaO}+\mathrm{CO} _{2}$
$\mathrm{CaO}+3 \mathrm{C} \xrightarrow{\Delta} \underset{\text { कैल्शियम कार्बाइड }}{\mathrm{CaC} _{2}+\mathrm{CO}}$
$\mathrm{CaC} _{2}+2 \mathrm{H} _{2} \mathrm{O} \longrightarrow \mathrm{Ca}(\mathrm{OH}) _{2}+\mathrm{C} _{2} \mathrm{H} _{2}$
2. विकिन डाइहैलाइड से: विकिन डाइहैलाइड को एल्कोहलिक पोटैशियम हाइड्रॉक्साइड के साथ उपचार देने पर डिहाइड्रोहैलोजनन क्रिया होती है। एक अणु हाइड्रोजन हैलाइड के अपसारण से एल्केनिल हैलाइड बनता है जिसे सोडामाइड के साथ उपचार देने पर एल्किन बनता है।

13.4.4 गुण
भौतिक गुण
एल्किन के भौतिक गुण एल्कीन और एल्केन के भौतिक गुण के समान प्रवृत्ति अनुसरण करते हैं। पहले तीन सदस्य गैस होते हैं, अगले आठ द्रव होते हैं और उच्च अणुक द्रव्यमान वाले ठोस होते हैं। सभी एल्किन रंगहीन होते हैं। एथीन के विशिष्ट गंध होती है। अन्य सदस्य गंधहीन होते हैं। एल्किन प्रकृति में कमजोर ध्रुवी होते हैं। वे पानी से हल्के होते हैं और पानी में अघुलनशील होते हैं लेकिन एथर, कार्बन टेट्राक्लोराइड और बेंजीन जैसे कार्बनिक विलायक में घुलनशील होते हैं। उनका गलनांक, क्वथनांक और घनत्व अणुक द्रव्यमान में वृद्धि के साथ बढ़ता है।
रासायनिक गुण
एल्काइन अम्लीय प्रकृति, योग अभिक्रियाएँ और पॉलीमरीकरण अभिक्रियाएँ निम्नलिखित तरीके से प्रदर्शित करते हैं :
A. एल्काइन की अम्लीय प्रकृति: सोडियम धातु और सोडामाइड $\left(\mathrm{NaNH_2}\right)$ मजबूत क्षारक होते हैं। वे एथिन के साथ अभिक्रिया करके सोडियम एसिटिलाइड बनाते हैं और डाइहाइड्रोजन गैस के उत्सर्जन के साथ। इन अभिक्रियाओं को एथीन और एथेन के मामले में नहीं देखा गया है, जिससे यह संकेत मिलता है कि एथिन की अम्लीय प्रकृति एथीन और एथेन की तुलना में अधिक है। क्यों ऐसा होता है? इसके पीछे उनकी संरचना और हाइब्रिडाइजेशन के कारण कुछ हो सकता है? आप जान चुके हैं कि एथिन में हाइड्रोजन परमाणु $s p$ हाइब्रिडाइज्ड कार्बन परमाणुओं के बंधन में होते हैं, जबकि एथीन में वे $s p^{2}$ हाइब्रिडाइज्ड कार्बन परमाणुओं के बंधन में होते हैं और एथेन में $s p^{3}$ हाइब्रिडाइज्ड कार्बन परमाणुओं के बंधन में होते हैं। $s$ चरित्र के अधिकतम प्रतिशत (50%) के कारण, एथिन अणुओं में कार्बन परमाणुओं के $s p$ हाइब्रिडाइज्ड ऑर्बिटल अधिकतम विद्युत ऋणात्मकता रखते हैं; इसलिए, ये एथिन के $\mathrm{C}-\mathrm{H}$ बंध के साझा इलेक्ट्रॉन युग्म को एथीन में कार्बन के $s p^{2}$ हाइब्रिडाइज्ड ऑर्बिटल और एथेन में कार्बन के $s p^{3}$ हाइब्रिडाइज्ड ऑर्बिटल की तुलना में अधिक आकर्षित करते हैं। इसलिए, एथिन में हाइड्रोजन परमाणुओं को एथीन और एथेन की तुलना में आसानी से प्रोटॉन के रूप में मुक्त किया जा सकता है। इसलिए, एथिन के त्रिगुणित बंध के कार्बन परमाणु पर लगे हाइड्रोजन परमाणु अम्लीय प्रकृति के होते हैं। आप ध्यान दें कि त्रिगुणित बंध के कार्बन परमाणु पर लगे हाइड्रोजन परमाणु अम्लीय प्रकृति के होते हैं, लेकिन सभी एल्काइन के हाइड्रोजन परमाणु नहीं होते।
$$ \begin{align*} & \mathrm{HCl} \equiv \mathrm{CH}+\mathrm{Na} \rightarrow \underset{\substack{\text{Monosodium}\\ \text{ethynide}}}{\mathrm{HCl} \equiv \mathrm{C}^{-} \mathrm{Na}^{+}}+1 / 2 \mathrm{H_2} \tag{13.59} \end{align*} $$
$$ \mathrm{HCl} \equiv \mathrm{C}^{-} \mathrm{Na}+\mathrm{Na} \rightarrow \underset{\text{Disodium ethynide}}{\mathrm{Na}^{+} \mathrm{C}^{-} \mathrm{Na}^{+} \equiv \mathrm{C}^{-} \mathrm{Na}^{+}}+1 / 2 \mathrm{H_2} \tag{13.60} $$
$$ \begin{array}{c} \mathrm{CH_3}-\mathrm{C} \equiv \mathrm{C}-\mathrm{H}+\mathrm{Na}^{+} \mathrm{NH_2}^{-} \\
$$ \downarrow \\ \underset{\text{सोडियम प्रोपिनाइड}}{\mathrm{CH_3}-\mathrm{C} \equiv \mathrm{C}^{-} \mathrm{Na}^{+}}+\mathrm{NH_3} \tag{13.61} \end{array} $$
इन अभिक्रियाओं को एल्कीन और एल्केन द्वारा नहीं दिखाया जाता है, इसलिए इनका उपयोग एल्किन, एल्कीन और एल्केन के बीच अंतर करने में किया जाता है। लेकिन उपरोक्त अभिक्रियाओं के साथ ब्यूट-1-ईन और ब्यूट-2-ईन के बारे में क्या होता है? एल्केन, एल्कीन और एल्किन के अम्लीय व्यवहार में निम्नलिखित प्रवृत्ति होती है :
i) $\mathrm{CH} \equiv \mathrm{CH}>\mathrm{H_2} \mathrm{C}-\mathrm{CH_2}>\mathrm{CH_3}-\mathrm{CH_3}$
ii) $\mathrm{HCl} \equiv \mathrm{CH}>\mathrm{CH_3}-\mathrm{C} \equiv \mathrm{CH} > > \mathrm{CH_3}-\mathrm{C} \equiv \mathrm{C}-\mathrm{CH_3}$
बी. योग अभिक्रियाएं: ऐल्काइन में त्रिगुणी बंध होता है, इसलिए वे द्विकार्बनिक अणु, हैलोजन, हाइड्रोजन हैलाइड आदि के दो अणुओं के साथ योग करते हैं। योग उत्पाद के निर्माण के लिए निम्नलिखित कदम अपनाए जाते हैं।

एक्सेप्टर उत्पाद के निर्माण पर विनाइलिक केटियन की स्थायित्व निर्भर करता है। असममित ऐल्किन में एक्सेप्शन एक मार्कोवनिकोव नियम के अनुसार होता है। ऐल्किन के अधिकांश अभिक्रियाएं एक इलेक्ट्रॉन अभिकरक एक्सेप्शन अभिक्रियाओं के उदाहरण हैं। कुछ एक्सेप्शन अभिक्रियाएं नीचे दी गई हैं:
(i) डाइहाइड्रोजन का एक्सेप्शन

(ii) हैलोजन का एक्सेप्शन

ब्रोमीन के कार्बोन टेट्राक्लोराइड में विलयन के लाल बूंदी रंग अपचायक रंग खो देता है। यह अनसतुरेशन के लिए परीक्षण के रूप में उपयोग किया जाता है।
(iii) हाइड्रोजन हैलाइड के योग
दो अणु हाइड्रोजन हैलाइड $(\mathrm{HCl}, \mathrm{HBr}$, $\mathrm{HI}$ ) ऐल्काइन के साथ जुड़कर जेम डाइहैलाइड बनाते हैं (जिनमें दो हैलोजन एक ही कार्बन पर जुड़े होते हैं)


(iv) जल के योग
एल्केन और एल्कीन के जैसे, एल्काइन भी अघुलनशील होते हैं और जल के साथ अभिक्रिया नहीं करते हैं। हालांकि, एल्काइन के एक अणु को $333 \mathrm{~K}$ पर मर्करी सल्फेट और तनु सल्फ्यूरिक अम्ल के साथ गर्म करने पर कार्बोनिल यौगिक बनाते हैं।

(व) पॉलीमरीकरण
(अ) रेखीय पॉलीमरीकरण: उपयुक्त शर्तों के तहत एथाइन के रेखीय पॉलीमरीकरण के माध्यम से पॉलीएक्टीलीन या पॉलीएथाइन बनता है, जो एक उच्च अणुभार वाला पॉलीईन होता है जिसमें $(\mathrm{CH}=\mathrm{CH}-\mathrm{CH}=\mathrm{CH})$ के दोहराए गए इकाइयाँ होती हैं और इसे $+\mathrm{CH}=\mathrm{CH}-\mathrm{CH}=\mathrm{CH})_{n}-$ के रूप में प्रस्तुत किया जा सकता है। विशेष शर्तों के तहत, यह पॉलीमर विद्युत का सुचालक हो सकता है।
पॉलीएसिटिलीन के पतले फिल्म को बैटरी में इलेक्ट्रोड के रूप में उपयोग किया जा सकता है। ये फिल्म अच्छे चालक होते हैं, धातु चालकों की तुलना में हल्के और सस्ते होते हैं।
(b) चक्रीय पॉलीमरीकरण: एथाइन को लाल गरम लोहे के ट्यूब में $873 \mathrm{~K}$ पर पार कराने पर चक्रीय पॉलीमरीकरण होता है। तीन अणु पॉलीमरीकरण के बाद बेंजीन बनता है, जो बेंजीन के अवतरणों, रंगों, दवाओं और बहुत से अन्य कार्बनिक यौगिकों के निर्माण के लिए प्रारंभिक अणु होता है। यह एलिफैटिक से आरोमैटिक यौगिकों में प्रवेश के लिए सबसे अच्छा रास्ता है, जैसा कि नीचे चर्चा किया गया है:

समस्या 13.14
आप एथेनोइक अम्ल को बेंज़ीन में कैसे परिवर्तित करेंगे?
हल
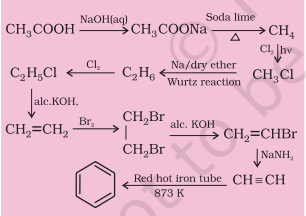
13.5 आवृत्ति युक्त हाइड्रोकार्बन
इन हाइड्रोकार्बन को आवृत्ति युक्त या ‘एरिन्स’ के रूप में भी जाना जाता है। इनमें से अधिकांश के खुशबू रहती है (ग्रीक शब्द ‘आरोमा’ खुशबू के अर्थ में है), इसलिए इन यौगिकों के वर्ग को ‘आवृत्ति युक्त यौगिक’ कहा गया। इन यौगिकों में से अधिकांश में बेंजीन वलय उपस्थित होता है। बेंजीन वलय बहुत असंतृप्त होता है, लेकिन आवृत्ति युक्त हाइड्रोकार्बन के अधिकांश अभिक्रियाओं में बेंजीन वलय की असंतृप्तता बरकरार रहती है। हालांकि, आवृत्ति युक्त हाइड्रोकार्बन के कुछ उदाहरण जो बेंजीन वलय नहीं बल्कि अन्य बहुत असंतृप्त वलय के साथ होते हैं, उनके बारे में भी बताया गया है। बेंजीन वलय वाले आवृत्ति युक्त यौगिकों को बेंज़ेनॉइड और बेंजीन वलय नहीं वाले आवृत्ति युक्त यौगिकों को गैर-बेंज़ेनॉइड कहा जाता है। कुछ एरिन्स के उदाहरण नीचे दिए गए हैं:

13.5.1 नामकरण एवं समावयवता
साइक्लोहेक्सेन के नामकरण एवं समावयवता के बारे में इकाई 8 में चर्चा कर चुके हैं। बेंजीन में सभी छह हाइड्रोजन परमाणु समान होते हैं; इसलिए इसका केवल एक प्रकार का मोनोसब्स्टिट्यूएंट उत्पाद बनता है। जब बेंजीन के दो हाइड्रोजन परमाणु दो समान या अलग-अलग मोनोवैलेंट परमाणुओं या समूहों द्वारा प्रतिस्थापित हो जाते हैं, तो तीन अलग-अलग स्थिति समावयवी संभव होते हैं। 1, 2 या 1, 6 को ओर्थो (o-) कहा जाता है, 1,3 या 1,5 को मेटा (m-) और 1, 4 को पेरा (p-) द्वि-प्रतिस्थापित यौगिक कहा जाता है। बेंजीन के कुछ अवतरणों के उदाहरण नीचे दिए गए हैं:


फ्रिडरिच ऑगस्ट केकुले (7 नवम्बर 1829–13 जुलाई 1896)

Friedrich August Kekulé, एक जर्मन रसायन विज्ञानी, 1829 में जर्मनी के डार्मस्टाट में पैदा हुए। 1856 में वह प्रोफेसर बन गए और 1875 में रॉयल सोसाइटी के फेलो बन गए। उन्होंने संरचनात्मक अंगों के रसायन विज्ञान में महत्वपूर्ण योगदान दिया, जब उन्होंने 1858 में यह प्रस्तावित किया कि कार्बन परमाणु एक दूसरे के साथ जुड़ सकते हैं और श्रृंखला बना सकते हैं। बाद में 1865 में, उन्होंने बेंजीन संरचना के चुनौतीपूर्ण समस्या के उत्तर के रूप में प्रस्तावित किया कि ये श्रृंखलाएं बंद होकर वलय बन सकती हैं। उन्होंने बेंजीन के गतिशील संरचना सूत्र का प्रस्तावित किया जो इसकी आधुनिक इलेक्ट्रॉन संरचना के आधार का निर्माण करता है। उन्होंने बेंजीन संरचना की खोज के बारे में अपनी खोज के बारे में बाद में इस प्रकार बताया:
“मैं अपने पाठ्यपुस्तक पर बैठकर लिख रहा था, लेकिन काम आगे बढ़ रहा नहीं था; मेरे मन के विचार अन्यत्र थे। मैं अपनी चेयर को अग्नि के पास ले आया और नींद आ गई। फिर भी अणुओं के बीच खेल चल रहा था। इस बार छोटे समूह अपने आप को छोड़कर पीछे रह गए थे। मेरी मानसिक आंख, जो इस दृश्य के बारंबार देखने से अधिक तीखी हो गई थी, अब विभिन्न रूपों वाले बड़े संरचनाओं को अलग एक सौ वर्ष बाद, केकुले के सैकुलर उत्सव के अवसर पर एक समूह यौगिकों के नाम केकुलीन के रूप में घोषित किए गए जो पॉलीबेंजीनॉइड संरचना के अनुरूप हैं।
13.5.2 बेंजीन की संरचना
बेंजीन को माइकल फैराडे ने 1825 में अलग किया गया था। बेंजीन के अणुसूत्र, $\mathrm{C_6} \mathrm{H_6}$, एक उच्च असंतृप्तता को दर्शाता है। इस अणुसूत्र ने इसके संगत अलकेन, अलकीन और अलकाइन के साथ संबंध को बताने में असमर्थ रहा, जिसके बारे में आप इकाई के पहले अनुभागों में अध्ययन कर चुके होंगे। आपका क्या अनुमान है इसकी संभावित संरचना के बारे में? इसके अद्वितीय गुणों और असामान्य स्थायित्व के कारण इसकी संरचना के निर्धारण में कई वर्ष लगे। बेंजीन को एक स्थायी अणु के रूप में पाया गया और एक ट्राइओजोनाइड बनाने के लिए पाया गया जो तीन द्विबंधों की उपस्थिति को दर्शाता है। बेंजीन के आगे एक और केवल एक मोनोसब्स्टिट्यूएटेड अपवाहक बनाने के लिए पाया गया जो बेंजीन के सभी छह कार्बन और छह हाइड्रोजन परमाणुओं के समान होने को दर्शाता है। इस अवलोकन के आधार पर आगस्ट केकुले ने 1865 में बेंजीन के निम्नलिखित संरचना का प्रस्ताव रखा जिसमें छह कार्बन परमाणुओं की चक्रीय व्यवस्था होती है जिसमें एक द्विबंध और एक एकल बंध के बारे में विकल्पतः व्यवस्था होती है और प्रत्येक कार्बन परमाणु पर एक हाइड्रोजन परमाणु जुड़ा होता है।

केकुले संरचना द्वारा 1, 2-डाइब्रोमोबेंज़ीन के दो समावेशी के संभावना को दर्शाया गया है। एक समावेशी में, ब्रोमीन परमाणु द्विबंधित कार्बन परमाणुओं के संलग्न होते हैं जबकि दूसरे में वे एकल बंधित कार्बन परमाणुओं के संलग्न होते हैं।

हालांकि, बेंजीन केवल एक ओर्थो डिसबस्टिट्यूएड उत्पाद बनाने वाला पाया गया। इस समस्या को केकुले द्वारा द्विबंध डबल बंडल के झूलते हुए प्रकृति के अवधारणा को सुझाकर दूर किया गया, जैसा कि नीचे दिया गया है।

इस संशोधन के बावजूद, बेंजीन के केकुले संरचना असामान्य स्थायित्व और योगात्मक अभिक्रियाओं की तुलना में प्रतिस्थापन अभिक्रियाओं की प्राथमिकता को समझने में विफल रहती है, जिसे बाद में अनुनाद द्वारा समझाया गया।
बेंजीन के विचार एवं स्थिरता
मूल्यांकन बंधन सिद्धांत के अनुसार, बेंजीन में झूलते हुए दोहरे बंध के अवधारणा को अब अनुनाद द्वारा समझाया जाता है। बेंजीन विभिन्न अनुनादी संरचनाओं के मिश्रण है। केकुले द्वारा दिए गए दो संरचनाएँ, A और B, मुख्य योगदानकर्ता संरचनाएँ हैं। मिश्रित संरचना को छह कार्बन परमाणुओं के बीच विस्थापित होने वाले छह इलेक्ट्रॉनों को प्रदर्शित करने के लिए छह कोने के आकार में एक वृत्त या बिंदु वाला वृत्त डालकर दिखाया जाता है, जैसा कि (C) में दिखाया गया है।

ऑर्बिटल अधिकार बेंज़ीन के संरचना के बारे में हमें बेहतर दृष्टि देता है। बेंज़ीन में सभी छह कार्बन परमाणु $s p^{2}$ हाइब्रिडाइज़्ड होते हैं। प्रत्येक कार्बन परमाणु के दो $s p^{2}$ हाइब्रिड ऑर्बिटल आसन्न कार्बन परमाणुओं के $s p^{2}$ हाइब्रिड ऑर्बिटल के साथ अधिकार बनाते हैं जो छह $\mathrm{C}-\mathrm{C}$ सिग्मा बंध बनाते हैं जो षष्टक तल में होते हैं। प्रत्येक कार्बन परमाणु के बचे हुए $s p^{2}$ हाइब्रिड ऑर्बिटल एक हाइड्रोजन परमाणु के $s$ ऑर्बिटल के साथ अधिकार बनाते हैं जो छह $\mathrm{C}-\mathrm{H}$ सिग्मा बंध बनाते हैं। अब प्रत्येक कार्बन परमाणु के एक अनुहाइब्रिडिज़्ड $p$ ऑर्बिटल वलय के तल के लंबवत होता है जैसा कि नीचे दिखाया गया है:

कार्बन परमाणु के अनुनादित $p$ ऑर्बिटल एक दूसरे के पास हैं जिसके कारण लंबवत अधिरंजन द्वारा $\pi$ आबन्ध के निर्माण के लिए पर्याप्त हैं। $\mathrm{C_1}-\mathrm{C_2}, \mathrm{C_3}-\mathrm{C_4}, \mathrm{C_5}-\mathrm{C_6}$ या $\mathrm{C_2}-\mathrm{C_3}, \mathrm{C_4}-\mathrm{C_5}, \mathrm{C_6}-\mathrm{C_1}$ के $p$ ऑर्बिटल के अधिरंजन द्वारा तीन $\pi$ आबन्ध बनाने के दो समान संभावनाएं हैं, जैसा कि निम्नलिखित चित्रों में दिखाया गया है।

चित्र 13.7 (a)

चित्र 13.7 (b)
चित्र 13.7 (a) और (b) में दिखाए गए संरचनाएँ दो खेकुले संरचनाओं के रूप में हैं, जिनमें स्थानीयकृत $\pi$ बंध होते हैं। वृत्त में सभी कार्बन परमाणुओं के बीच अंतराणु दूरी के बारे में एक्स-रे विवर्धन द्वारा निर्धारित किया गया है, जो समान है; प्रत्येक कार्बन परमाणु के $p$ ऑर्बिटल के लिए आसन्न कार्बन परमाणुओं के $p$ ऑर्बिटल के साथ संकरण के बराबर संभावना है [चित्र 13.7 (c)]। इसे एक वृत्त के रूप में दो डूंट (एलेक्ट्रॉन बादल) के रूप में प्रस्तुत किया जा सकता है [चित्र 13.7 (d)], जिसमें एक षट्कोणीय वृत्त के तल के ऊपर और एक नीचे होता है जैसा कि नीचे दिखाया गया है:

चित्र 13.7 (c) $\quad \quad $ चित्र 13.7 (d)
इस प्रकार छह $\pi$ इलेक्ट्रॉन अपस्थिति रहित हो जाते हैं और वे छह कार्बन नाभिकों के चारों ओर मुक्त रूप से घूम सकते हैं, जैसा कि चित्र 13.6 (a) या (b) में दिखाया गया है। अपस्थिति रहित $\pi$ इलेक्ट्रॉन बादल द्वारा कार्बन परमाणुओं के नाभिकों के अधिक बलपूर्वक आकर्षित होते हैं, जबकि दो कार्बन परमाणुओं के बीच स्थित इलेक्ट्रॉन बादल कम आकर्षित होते हैं। अतः बेंजीन में अपस्थिति रहित $\pi$ इलेक्ट्रॉन की उपस्थिति इसे अपेक्षाकृत अधिक स्थायी बनाती है।
X-Ray विवर्धन डेटा बताता है कि बेंजीन एक समतल अणु है। यदि उपरोक्त बेंजीन के कोई एक संरचना (A या B) सही रही होती, तो $\mathrm{C}-\mathrm{C}$ बंध के दो प्रकार की लंबाई अपेक्षित रहती। हालांकि, X-Ray डेटा बताता है कि सभी छह $\mathrm{C}-\mathrm{C}$ बंधों की लंबाई एक ही कोटि (139 pm) है जो $\mathrm{C}-\mathrm{C}$ एकल बंध (154 pm) और $\mathrm{C}-\mathrm{C}$ द्विबंध (133 pm) के बीच मध्य स्थित है। इसलिए, बेंजीन में शुद्ध द्विबंध की अनुपस्थिति बेंजीन के सामान्य शर्तों में योगात्मक अभिक्रियाओं के प्रति अस्वीकृति के कारण है, जो बेंजीन के असामान्य व्यवहार को समझाता है।
13.5.3 औषधीयता
बेंजीन को मूल ‘औषधीय’ यौगिक माना जाता था। अब, नाम सभी वलय प्रणालियों के लिए लगाया जाता है, चाहे वे बेंजीन वलय के साथ हों या नहीं, जो निम्नलिखित विशेषताओं के साथ हों।
(i) समतलता
(ii) वलय में $\pi$ इलेक्ट्रॉन की पूर्ण विस्थापन
(iii) वलय में $(4 n+2) \pi$ इलेक्ट्रॉन की उपस्थिति जहां $n$ एक पूर्णांक है $(n=0,1,2, \ldots)$।
- इसे अक्सर हुकल नियम के रूप में संदर्भित किया जाता है।
निम्नलिखित कुछ औषधीय यौगिकों के उदाहरण दिए गए हैं:

13.5.4 बेंजीन के तैयारी
बेंजीन व्यापारिक रूप से कोयला तेल से अलग किया जाता है। हालांकि, इसे प्रयोगशाला में निम्नलिखित विधियों द्वारा तैयार किया जा सकता है।
(i) एथिन की चक्रीय पॉलीमरीकरण: (अनुच्छेद 13.4.4)
(ii) औषधीय अम्लों के डेकार्बॉक्सिलेशन: बेंजोइक अम्ल के सोडियम लवण को सोडालाइम के साथ गर्म करने पर बेंजीन प्राप्त होता है।

(iii) फीनॉल के अपचयन: फीनॉल को बेंजीन में अपचयित किया जाता है जब इसके वाष्पों को गरम जिंक धूल पर गुजारा जाता है

13.5.5 गुण
भौतिक गुण
एरोमैटिक हाइड्रोकार्बन अप्राप्त अणु होते हैं और आमतौर पर रंगहीन तरल या ठोस होते हैं जिनका विशिष्ट गंध होती है। आप नाप्थलीन गेंदों के बारे में भी अच्छी तरह जानते हैं जो टॉयलेट में और कपड़ों के संरक्षण के लिए उपयोग किए जाते हैं क्योंकि इनकी विशिष्ट गंध और मक्खी दूर करने की गुण इन्हें विशिष्ट बनाती है। एरोमैटिक हाइड्रोकार्बन पानी के साथ अमिश्रणीय होते हैं लेकिन वे आगंतुक विलायकों के साथ आसानी से मिश्रण कर सकते हैं। ये धुंआ वाले ज्वलनशील आग लगाते हैं।
रासायनिक गुण
एरीन्स इलेक्ट्रॉन अभिकर्मक प्रतिस्थापन अभिक्रियाओं द्वारा चिह्नित किए जाते हैं। हालांकि, विशेष स्थितियों में वे अतिसंयोजन और ऑक्सीकरण अभिक्रियाओं के भी अनुभव कर सकते हैं।
इलेक्ट्रॉन अभिकर्मक प्रतिस्थापन अभिक्रियाएं
एरीन्स की सामान्य इलेक्ट्रॉन अभिकर्मक प्रतिस्थापन अभिक्रियाएं नाइट्रेशन, हैलोजनीकरण, सल्फोनेशन, फ्रेडेल क्राफ्ट्स ऐल्किलेशन और ऐसिलेशन अभिक्रियाएं होती हैं, जहां हमलावर अभिकर्मक एक इलेक्ट्रॉन अभिकर्मक $\left(\mathrm{E}^{+}\right)$ होता है।
(i) नाइट्रेशन: बेंज़ीन को अम्लीय नाइट्रिक अम्ल और अम्लीय सल्फरिक अम्ल के मिश्रण के साथ गरम करने पर बेंज़ीन वलय में एक नाइट्रो समूह को प्रवेश कराया जाता है (नाइट्रेशन मिश्रण)।

(ii) हैलोजनीकरण: ऐरीन एक लेविस अम्ल जैसे अनुत्प्रस्थ $\mathrm{FeCl_3}, \mathrm{FeBr_3}$ या $\mathrm{AlCl_3}$ की उपस्थिति में हैलोऐरीन बनाते हैं।

(iii) सल्फोनेशन: एक वलय में हाइड्रोजन परमाणु के सल्फोनिक अम्ल समूह द्वारा प्रतिस्थापन को सल्फोनेशन कहते हैं। इसके लिए बेंजीन को लेपित सल्फरिक अम्ल (ओलियम) के साथ गरम किया जाता है।

(iv) फ्रेडेल-क्राफ्ट्स ऐल्किलेशन अभिक्रिया: जब बेंजीन को एनहाइड्रोस ऐलुमिनियम क्लोराइड की उपस्थिति में एक ऐल्किल हैलाइड के साथ अभिक्रिया कराई जाती है, तो ऐल्किलबेंजीन बनता है।

क्यों 1-क्लोरोप्रोपेन के साथ बेंजीन के उपचार से हम आइसोप्रॉपिल बेंजीन प्राप्त करते हैं, बजाए $n$-प्रॉपिल बेंजीन के?
(v) फ्रेडेल-क्राफ्ट्स एसिलेशन अभिक्रिया: बेंजीन के एसिल हैलाइड या एसिड एनहाइड्राइड के साथ अभिक्रिया लेविस अम्ल $\left(\mathrm{AlCl_3}\right)$ की उपस्थिति में एसिल बेंजीन देती है।

अगर एक अतिरिक्त विद्युत धनात्मक अभिकरक का उपयोग किया जाए, तो अतिरिक्त प्रतिस्थापन अभिक्रिया हो सकती है जिसमें बेंजीन के वें अन्य हाइड्रोजन परमाणु भी विद्युत धनात्मक अभिकरक द्वारा क्रमागत रूप से प्रतिस्थापित हो सकते हैं। उदाहरण के लिए, बेंजीन को अनुग्रहित $\mathrm{AlCl_3}$ की उपस्थिति में अतिरिक्त क्लोरीन के साथ उपचार देने पर यह छह क्लोरीन वाला बेंजीन ( $\mathrm{C_6} \mathrm{Cl_6}$ ) बन सकता है।

इलेक्ट्रॉफिलिक प्रतिस्थापन अभिक्रियाओं के यांत्रिक तंत्र:
प्रयोगात्मक प्रमाण के अनुसार, $\mathrm{S_\mathrm{E}}(\mathrm{S}=$ प्रतिस्थापन; $\mathrm{E}=$ इलेक्ट्रॉफिलिक) अभिक्रियाएं निम्नलिखित तीन चरणों के माध्यम से होती हैं:
(a) इलेक्ट्रॉफिल के उत्पादन
(b) कार्बोकेटियन अंतराल के निर्माण
(c) कार्बोकेटियन अंतराल से हाइड्रोजन आयन के अपसारण
(a) इलेक्ट्रॉफिल के उत्पादन $\boldsymbol{E}^{\oplus}$ : बेंज़ीन के क्लोरीनन, ऐल्किलीकरण और ऐसीलीकरण के दौरान, अनुपचय अम्ल $\mathrm{AlCl_3}$, जो लेविस अम्ल होता है, आक्रमणकर्ता अभिकरक के साथ मिलकर इलेक्ट्रॉफिल $\mathrm{Cl}^{\oplus}, \mathrm{R}^{\oplus}$, $\mathrm{RC}^{\opl3} \mathrm{O}$ (ऐसीलियम आयन) के उत्पादन में सहायता करता है।

नाइट्रेशन के मामले में, इलेक्ट्रोफ़िल, नाइट्रोनियम आयन, $\stackrel{+}{\mathrm{N}} \mathrm{O_2}$, नाइट्रिक अम्ल में प्रोटॉन (सल्फ्यूरिक अम्ल से) के स्थानांतरण के द्वारा निम्नलिखित तरीके से उत्पन्न होता है:

यह दिलचस्प है कि नाइट्रोनियम आयन के निर्माण की प्रक्रिया में, सल्फ्यूरिक अम्ल एक अम्ल के रूप में और नाइट्रिक अम्ल एक क्षार के रूप में कार्य करता है। इसलिए, यह एक सरल अम्ल-क्षार साम्य है।
(b) कार्बोकेटियन (अरीनियम आयन) के निर्माण: इलेक्ट्रॉन अभिकर्षी के हमले के परिणामस्वरूप $\sigma$-कम्प्लेक्स या अरीनियम आयन के निर्माण में एक कार्बन $s p^{3}$ हाइब्रिडाइज्ड होता है।

अरीनियम आयन अपने अनुवाद के माध्यम से स्थायित्त हो जाता है:
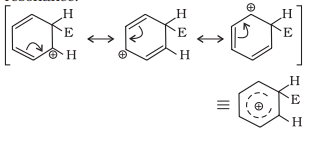
सिग्मा सम复合体 या अरीनियम आयन अपने औषधीय गुण को खो देता है क्योंकि इलेक्ट्रॉन के विस्थापन $s p^{3}$ हाइब्रिडाइज्ड कार्बन पर रूक जाता है।
(c) प्रोटॉन के अपसारण: औषधीय गुण को बहाल करने के लिए, $ \sigma $-सम复合体 $ [\mathrm{AlCl_4}]^{-} $ (हैलोजनीकरण, ऐल्किलीकरण और ऐसिलेशन के मामले में) और $ [\mathrm{HSO_4}]^{-} $ (नाइट्रेशन के मामले में) के हमले पर $ s p^{3} $ हाइब्रिडाइज्ड कार्बन से प्रोटॉन छोड़ देता है।

समावेशी अभिक्रियाएं
उच्च तापमान और/ या दबाव की उपस्थिति में निकेल कैटलिस्ट की उपस्थिति में बेंजीन के हाइड्रोजनीकरण से साइक्लोहेक्सेन प्राप्त होता है।

अति-नील लाइट में, तीन क्लोरीन अणु बेंजीन के साथ मिलकर बेंजीन हेक्साक्लोराइड, $\mathrm{C_6} \mathrm{H_6} \mathrm{Cl_6}$ बनाते हैं, जिसे गैम्मैक्सेन भी कहते हैं।

ज्वलन: वायु में गर्म करने पर बेंजीन धुंआ छाए लाल ज्वाला में जलता है और $\mathrm{CO_2}$ तथा $\mathrm{H_2} \mathrm{O}$ उत्पन्न करता है
$$ \begin{equation*}
\mathrm{C_6} \mathrm{H_6}+\frac{15}{2} \mathrm{O_2} \rightarrow 6 \mathrm{CO_2}+3 \mathrm{H_2} \mathrm{O} \tag{13.82} \end{equation*} $$
किसी भी हाइड्रोकार्बन के सामान्य दहन अभिक्रिया को निम्नलिखित रासायनिक समीकरण द्वारा दर्शाया जा सकता है:
$$\mathrm{C_x} \mathrm{H_y}+\left(x+\frac{y}{4}\right) \mathrm{O_2} \rightarrow x \mathrm{CO_2}+\frac{y}{2} \mathrm{H_2} \mathrm{O} \quad \mathrm{n} \tag{13.83}$$
13.5.6 एकल स्थानांतरित बेंजीन में कार्यगत समूह का निर्देशक प्रभाव
जब एकल स्थानांतरित बेंजीन को अतिरिक्त स्थानांतरण के अधीन किया जाता है, तो तीन संभावित द्विस्थानांतरित उत्पादों के बराबर मात्रा में नहीं बनते। दो प्रकार के व्यवहार देखे जाते हैं। या तो अंतर्गत और परागत उत्पाद या मेटा उत्पाद अधिकतम रूप से बनते हैं। यह भी देखा गया है कि इस व्यवहार के पीछे बेंजीन वलय में पहले से मौजूद स्थानांतरक की प्रकृति ही जिम्मेदार है और नए प्रवेश करने वाले समूह की प्रकृति पर निर्भर नहीं है। इसे स्थानांतरक के निर्देशक प्रभाव के रूप में जाना जाता है। अंतर्गत/परागत या मेटा निर्देशक प्रकृति के समूहों के कारणों के बारे में नीचे चर्चा की जाएगी:
ओर्थो एवं पेरा दिशानिर्देशक समूह: वे समूह जो आगंतुक समूह को ओर्थो एवं पेरा स्थितियों पर निर्देशित करते हैं, ओर्थो एवं पेरा दिशानिर्देशक समूह कहलाते हैं। उदाहरण के लिए, हम फेनॉलिक $(-\mathrm{OH})$ समूह के दिशानिर्देशक प्रभाव के बारे में चर्चा करेंगे। फेनॉल निम्नलिखित संरचनाओं के रेजोनेंस मिश्रण होता है:

उपरोक्त रेजोनेंस संरचनाओं से स्पष्ट है कि $o-$ एवं $p-$ स्थितियों पर इलेक्ट्रॉन घनत्व अधिक होता है। अतः, प्रतिस्थापन मुख्य रूप से इन स्थितियों पर होता है। हालांकि, ध्यान देने योग्य है कि $-\mathrm{I}$ प्रभाव के कारण $-\mathrm{OH}$ समूह के इलेक्ट्रॉन घनत्व ओर्थो एवं पेरा स्थितियों पर थोड़ा कम हो जाता है। लेकिन रेजोनेंस के कारण बेंजीन वलय के इन स्थितियों पर इलेक्ट्रॉन घनत्व कुल रूप से बढ़ जाता है। अतः, $-\mathrm{OH}$ समूह बेंजीन वलय के आक्रमण के लिए सक्रिय करता है।
एक विद्युताकर्षक। अन्य उदाहरण एक्टिवेटिंग समूह हैं $-\mathrm{NH_2},-\mathrm{NHR},-\mathrm{NHCOCH_3},-\mathrm{OCH_3}$, $-\mathrm{CH_3},-\mathrm{C_2} \mathrm{H_5}$, आदि।
अरिल हैलाइड के मामले में, हैलोजन मध्यम रूप से अक्रियकरण करते हैं। उनके मजबूत -I प्रभाव के कारण, बेंजीन वलय पर समग्र इलेक्ट्रॉन घनत्व कम हो जाता है। यह आगे के विस्थापन को कठिन बना देता है। हालांकि, संकरण के कारण $o-$ और $p$- स्थितियों पर इलेक्ट्रॉन घनत्व $m$- स्थिति के मुकाबले अधिक होता है। इसलिए, वे भी $o-$ और $p-$ दिशा देने वाले समूह होते हैं। क्लोरोबेंजीन के संकरण संरचनाएं नीचे दी गई हैं:

मेटा दिशा देने वाला समूह: वे समूह जो आगंतुक समूह को मेटा स्थिति पर दिशा देते हैं, मेटा दिशा देने वाले समूह कहलाते हैं। मेटा दिशा देने वाले कुछ उदाहरण हैं $-\mathrm{NO_2},-\mathrm{CN},-\mathrm{CHO}$, $-\mathrm{COR},-\mathrm{COOH},-\mathrm{COOR},-\mathrm{SO_3} \mathrm{H}$, आदि।
हम नाइट्रो समूह के उदाहरण लें। नाइट्रो समूह बेंजीन वलय में इलेक्ट्रॉन घनत्व को कम करता है क्योंकि इसका शक्तिशाली -I प्रभाव होता है। नाइट्रोबेंज़ीन निम्नलिखित संरचनाओं के उत्कृष्ट अवलोकन के मिश्रण होता है।

इस मामले में, बेंजीन अंग के समग्र इलेक्ट्रॉन घनत्व कम हो जाता है, जिसके कारण आगे के स्थलांतरण कठिन हो जाता है, इसलिए ये समूह भी ‘अक्रियकरण समूह’ कहलाते हैं। $o-$ और $p$ स्थिति पर इलेक्ट्रॉन घनत्व मेटा स्थिति के मुकाबले कम होता है। इसलिए, इलेक्ट्रॉन समृद्ध मेटा स्थिति पर इलेक्ट्रॉन धनात्मक अभिकर्मी आक्रमण करता है जिसके कारण मेटा स्थलांतरण होता है।
13.6 कैंसरजनकता और विषैलापन
बेंजीन और तीन या अधिक बेंजीन अणुओं के एक साथ मिले हुए बहुकेंद्रीय हाइड्रोकार्बन विषैले होते हैं और कैंसर उत्पन्न करने वाले (कैंसरजनक) गुण रखते हैं। ऐसे बहुकेंद्रीय हाइड्रोकार्बन जैविक पदार्थों जैसे तम्बाकू, कोयला और पेट्रोलियम के अपूर्ण ज्वलन से बनते हैं। वे मानव शरीर में प्रवेश करते हैं और विभिन्न बायोकेमिकल अभिक्रियाओं के बाद अंत में DNA को नुकसान पहुंचाते हैं और कैंसर का कारण बनते हैं। कुछ कैंसरजनक हाइड्रोकार्बन नीचे दिए गए हैं

सारांश
हाइड्रोकार्बन कार्बन और हाइड्रोजन के मिश्रण होते हैं। हाइड्रोकार्बन मुख्य रूप से कोयला और पेट्रोलियम से प्राप्त किए जाते हैं, जो ऊर्जा के मुख्य स्रोत हैं। पेट्रोकेमिकल्स उत्पादन के लिए एक बड़ी संख्या में व्यावसायिक रूप से महत्वपूर्ण उत्पादों के निर्माण के लिए प्रमुख प्रारंभिक सामग्री होते हैं। एलपीजी (लिक्विडेटेड पेट्रोलियम गैस) और सीएनजी (कम्प्रेस्ड नैचुरल गैस), घरेलू ईंधन और ऑटोमोबाइल उद्योग के लिए ऊर्जा के मुख्य स्रोत, पेट्रोलियम से प्राप्त किए जाते हैं। हाइड्रोकार्बन के अपने संरचना के आधार पर खुले शृंखला वाले संतृप्त (एल्केन्स) और असंतृप्त (एल्कीन्स और एल्काइन्स), चक्रीय (एलिसीक्लिक) और औषधीय (एरोमैटिक) वर्गों में वर्गीकृत किए जाते हैं।
अल्केन के महत्वपूर्ण अभिक्रियाएं मुक्त रadical प्रतिस्थापन, दहन, ऑक्सीकरण और एरोमैटिकरण हैं। अल्कीन और अल्काइन मुख्य रूप से इलेक्ट्रोफिलिक अधिकार अभिक्रियाएं अनुगमन करते हैं। एरोमैटिक हाइड्रोकार्बन, बावजूद असंतृप्तता के उपस्थिति, मुख्य रूप से इलेक्ट्रोफिलिक प्रतिस्थापन अभिक्रियाएं अनुगमन करते हैं। ये अनुगमन अभिक्रियाएं केवल विशेष शर्तों के तहत ही होती हैं।
अल्केन के कारण $\mathrm{C}-\mathrm{C}$ सिग्मा बंधों के मुक्त घूर्णन के कारण अनुकूलन आइसोमरिज्म दिखाई देता है। ईथेन के स्थित और अवरोधित अनुकूलन में से स्थित अनुकूलन अधिक स्थायी होता है क्योंकि हाइड्रोजन परमाणु दूर दिखाई देते हैं। अल्कीन कार्बन-कार्बन डबल बंध के घूर्णन के बंधन के कारण ज्यामितीय (सिस-ट्रांस) आइसोमरिज्म दिखाई देते हैं।
बेंजीन एवं बेंजीनॉइड यौगिक और अपचायक गुण दिखाते हैं। अपचायकता, अपचायक गुण के योगिक विशिष्ट इलेक्ट्रॉनिक संरचना के गुण होते हैं जिसे हुकेल $(4 n+2) \pi$ इलेक्ट्रॉन नियम द्वारा वर्णित किया जाता है। बेंजीन वलय पर जुड़े समूह या प्रतिस्थापक के प्रकार बेंजीन वलय के आगे अधिक अपचायक प्रतिस्थापन के लिए सक्रियण या असक्रियण के लिए उत्तरदायी होते हैं तथा आगंतुक समूह के विन्यास के लिए भी उत्तरदायी होते हैं। कुछ बहुकेंद्रीय हाइड्रोकार्बन जो गलत बेंजीन वलय प्रणाली के साथ होते हैं, कार्सिनोजेनिक गुण रखते हैं।
अभ्यास
13.1 मेथेन के क्लोरीनन के दौरान एथेन के निर्माण को कैसे समझाएंगे?
उत्तर दिखाएं
उत्तर
मेथेन के क्लोरीनन के दौरान एथेन के निर्माण को समझने के लिए, हम इस प्रक्रिया को कई मुख्य चरणों में विभाजित कर सकते हैं: प्रारंभना, प्रसार और समाप्ति। यहां एक चरण-दर-चरण समझाना है:
चरण 1: प्रारंभना
क्लोरीनन प्रक्रिया आरंभना चरण से शुरू होती है, जहां क्लोरीन गैस $\left(\mathrm{Cl}_2\right)$ ऊर्जा (आमतौर पर गर्मी या प्रकाश, जिसे Hv के रूप में प्रस्तुत किया जाता है) के अधीन होती है। इस ऊर्जा के कारण $ \mathrm{Cl}-\mathrm{Cl}$ बंध एक प्रक्रिया के माध्यम से टूट जाती है जिसे समान विखंडन कहा जाता है, जिसके परिणामस्वरूप दो क्लोरीन मुक्त मुक्त रेडिकल $(\mathrm{Cl} \bullet)$ के निर्माण होता है।
चरण 2: प्रसार
प्रसार चरण में, एक क्लोरीन मुक्त रेडिकल $(\mathrm{Cl} \cdot)$ मेथेन $\left(\mathrm{CH}_4\right)$ के साथ अभिक्रिया करता है। क्लोरीन रेडिकल मेथेन से एक हाइड्रोजन परमाणु छीन लेता है, जिसके परिणामस्वरूप मेथिल रेडिकल $\left(\mathrm{CH}_3 \bullet\right)$ और हाइड्रोक्लोरिक अम्ल (HCl) के निर्माण होता है।
अभिक्रिया:
$ \mathrm{Cl} \bullet+\mathrm{CH}_4 \rightarrow \mathrm{CH}_3 \bullet+\mathrm{HCl} $
नए रूप में बने मेथिल रेडिकल $\left(\mathrm{CH}_3 \bullet\right)$ अब एक अन्य क्लोरीन अणु के साथ अभिक्रिया कर सकते हैं। मेथिल रेडिकल एक अन्य $ \mathrm{Cl}_2$ अणु के साथ अभिक्रिया करता है, जिसके परिणामस्वरूप क्लोरोमेथेन $\left(\mathrm{CH}_3 \mathrm{Cl}\right)$ के निर्माण और एक अन्य क्लोरीन रेडिकल के पुनर्निर्माण होता है।
अभिक्रिया:
$ \mathrm{CH}_3 \bullet+\mathrm{Cl}_2 \rightarrow \mathrm{CH}_3 \mathrm{Cl}+\mathrm{Cl} \bullet $
चरण 3: एथेन के निर्माण
एथेन $\left(\mathrm{C}_2 \mathrm{H}_6\right)$ के निर्माण को समझने के लिए समाप्ति चरण में ध्यान देना महत्वपूर्ण है। यदि दो मेथिल रेडिकल $\left(\mathrm{CH}_3 \bullet\right)$ टकराएं, तो वे एथेन के निर्माण के लिए संयोजित हो सकते हैं।
अभिक्रिया:
$ \mathrm{CH}_3 \bullet+\mathrm{CH}_3 \bullet \rightarrow \mathrm{C}_2 \mathrm{H}_6
$
चरण 4: समापन
समापन के चरण में, मुक्त रadicals स्थायी उत्पादों में संयोजित होते हैं। विभिन्न संयोजन हो सकते हैं, जिनमें से कुछ निम्नलिखित हैं: दो मेथिल रadicals एथेन $\left(\mathrm{C}_2 \mathrm{H}_6\right)$ बनाते हैं। एक क्लोरीन रadical एक मेथिल रadical के साथ संयोजित होकर क्लोरोमेथेन $\left(\mathrm{CH}_3 \mathrm{Cl}\right)$ बनाता है। दो क्लोरीन रadicals पुनः संयोजित होकर क्लोरीन गैस $\left(\mathrm{Cl}_2\right)$ बनाते हैं।
13.2 निम्नलिखित यौगिकों के IUPAC नाम लिखिए :

उत्तर दिखाएं
उत्तर
(a) $CH3CH=C(CH3)2$
यौगिक का IUPAC नाम : 2-मेथिलब्यूट-2-ईन
(b) ${C} H_2={C} H-{C} \equiv {C}-{C} H_3$
यौगिक का IUPAC नाम : पेन-1-ईन-3-इन
(c)

यौगिक का IUPAC नाम : 1,3-ब्यूटाडाइईन या ब्यूटा-1,3-डाइईन
(d)

यौगिक का IUPAC नाम :1-(ब्यूट-3-एनिल)बेंजीन
(e)

यौगिक का IUPAC नाम : 2-मेथिल फेनॉल
(f)

यौगिक का IUPAC नाम :5-(2-मेथिलप्रोपिल)-डेकेन
(g)
$CH_3-CH=CH-CH_2-CH=CH-\underset{\large{C_2H_5}}{\underset{|\quad}{CH}}-CH_2-CH=CH_2$
यौगिक का IUPAC नाम : 4-एथिलडेका-1,5,8-ट्राइईन
13.3 निम्नलिखित यौगिकों के लिए संरचनात्मक सूत्र लिखिए और उनके सभी संभावित समावयवी के IUPAC नाम लिखिए जो दिए गए डबल या ट्रिपल बंध की संख्या के अनुसार हों :
(a) $ \mathrm{C_4} \mathrm{H_8}$ (एक एकल बंध)
(b) $ \mathrm{C_5} \mathrm{H_8}$ (एक ट्रिपल बंध)
उत्तर दिखाएं
उत्तर
(a) $C_4 H_8$ के एक एकल बंध के साथ संभावित संरचनात्मक समावयवी निम्नलिखित हैं :
(I) $ H_2 {C}= {C} H -{C} H_2-{C} H_3 $
(II) ${C} H_3-{C} H={C} H-{C} H_3$
(III) ${C} H_2=\underset{CH_3}{\underset{\text{|}}C}-{C} H_3$
ऊपर दिए गए यौगिकों के IUPAC नाम निम्नलिखित हैं :
यौगिक (I) का नाम ब्यूट-1-ईन है,
यौगिक (II) का नाम ब्यूट-2-ईन है, और
यौगिक (III) का नाम 2-मेथिलप्रोप-1-ईन है।
(b) $C_5 C_8$ के एक ट्रिपल बंध के साथ संभावित संरचनात्मक समावयवी निम्नलिखित हैं :
(I) $ H {C} \equiv {C} H_2-{C} H_2-{C} H $
(II) $ H_3 {C}-{C} \equiv {C}-{C} H_2-{C} H_3 $
(III) $ H_3 {C-} \underset{CH_3}{\underset{\text{|}}{{C}}}H-{C} \equiv {C}H $
ऊपर दिए गए यौगिकों के IUPAC नाम निम्नलिखित हैं :
यौगिक (I) का नाम पेंट-1-आइन है,
यौगिक (II) का नाम पेंट-2-आइन है, और
यौगिक (III) का नाम 3-मेथिलब्यूट-1-आइन है।
13.4 निम्नलिखित यौगिकों के ओजोनोलिज़ के द्वारा प्राप्त उत्पादों के IUPAC नाम लिखिए :
(i) पेंट-2-ईन
(ii) 3,4-डाइमेथिलहेप्ट-3-ईन
(iii) 2-ईथिलब्यूट-1-ईन
(iv) 1-फेनिलब्यूट-1-ईन
उत्तर दिखाएं
उत्तर
(i) पेंट-2-ईन ओजोनोलिज़ के द्वारा निम्नलिखित रूप में अपघटित होता है :

उत्पाद (I) का IUPAC नाम एथेनल और उत्पाद (II) का प्रोपेनल है।
(ii) 3,4-डाइमेथिलहेप्ट-3-ईन ओजोनोलिज़ के द्वारा निम्नलिखित रूप में अपघटित होता है :

उत्पाद (I) का IUPAC नाम ब्यूटन-2-ओन और उत्पाद (II) का पेंटन-2-ओन है।
(iii) 2-ईथिलब्यूट-1-ईन ओजोनोलिज़ के द्वारा निम्नलिखित रूप में अपघटित होता है :

उत्पाद (I) का IUPAC नाम पेंटन-3-ओन और उत्पाद (II) का मेथेनल है।
(iv) 1-फेनिलब्यूट-1-ईन ओजोनोलाइसिस के अंतर्गत निम्नलिखित रूप में अपचयित होता है :

उत्पाद (I) का IUPAC नाम बेंजल्डिहाइड है और उत्पाद (II) का नाम प्रोपेनल है।
13.5 एक एल्कीन ‘A’ ओजोनोलाइसिस के अंतर्गत एथेनल और पेंटेन-3-ओन के मिश्रण का उत्पादन करता है। ‘A’ की संरचना एवं IUPAC नाम लिखिए।
उत्तर दिखाएं
उत्तर

ओजोनोलाइसिस के दौरान, एक चक्रीय संरचना वाला ओजोनाइड एक मध्यवर्ती उत्पाद के रूप में बनता है जो अंतिम उत्पादों के रूप में विघटित हो जाता है। एथेनल और पेंटेन-3-ओन इस मध्यवर्ती ओजोनाइड से प्राप्त होते हैं। इसलिए, ओजोनाइड की अपेक्षित संरचना निम्नलिखित होगी :

इस ओजोनाइड का निर्माण ‘A’ के ओजोन के साथ अधिस्थापन के रूप में होता है। इच्छित संरचना के लिए ‘A’ की संरचना ओजोनाइड से ओजोन के अपसार के द्वारा प्राप्त की जा सकती है। इसलिए, ‘A’ की संरचना सूत्र है:

‘A’ का IUPAC नाम 3-ईथिलपेंट-2-ईन है।
13.6 एक एल्कीन ‘A’ में तीन $ \mathrm{C}-\mathrm{C} $, आठ $ \mathrm{C}-\mathrm{H}\ \sigma $ बंध और एक $ \mathrm{C}-\mathrm{C}\ \pi $ बंध होते हैं। ‘A’ ओजोनोलाइसिस के अंतर्गत दो मोल एल्डिहाइड के उत्पादन करता है जिसका मोलर द्रव्यमान 44 u है। ‘A’ का IUPAC नाम लिखिए।
उत्तर दिखाएं
उत्तर
दिए गए जानकारी के अनुसार, ‘A’ ओजोनोलाइसिस के अंतर्गत दो मोल एल्डिहाइड के उत्पादन करता है जिसका मोलर द्रव्यमान $44 \hspace{0.5mm} u$ है। दो मोल एल्डिहाइड के उत्पादन का अर्थ है कि द्विबंध के दोनों तरफ एक समान संरचनात्मक इकाई उपस्थित है। इसलिए, ‘A’ की संरचना निम्नलिखित रूप में प्रस्तुत की जा सकती है :
$XC=CX$
आठ C-H $\sigma$ बन्ध हैं। अतः, ‘A’ में 8 हाइड्रोजन परमाणु हैं। इसके अतिरिक्त, तीन C-C बन्ध हैं। अतः, ‘A’ के संरचना में चार कार्बन परमाणु उपस्थित हैं।
अनुमानों को संयोजित करने पर, ‘A’ की संरचना को निम्नलिखित रूप में प्रस्तुत किया जा सकता है :

‘A’ में 3 C-C बन्ध, 8 C-H $\sigma$ बन्ध, और एक C-C $\pi$ बन्ध हैं।
अतः, ‘A’ का IUPAC नाम ब्यूट-2-ईन है।
‘A’ के ओजोनोलिज़ अभिक्रिया के अग्रिम चरण निम्नलिखित है :

अंतिम उत्पाद एथेनल है जिसका अणुभार $=[(2 \times 12)+(4 \times 1)+(1 \times 16)]$
$ \hspace{8.3cm} =44 \hspace{0.5mm} u$
13.7 प्रोपेनल और पेंटेन-3-ओन एक एल्कीन के ओजोनोलिज़ उत्पाद हैं? एल्कीन की संरचना सूत्र क्या है?
उत्तर दिखाएं
उत्तर
दिए गए जानकारी के अनुसार, प्रोपेनल और पेंटेन-3-ओन एक एल्कीन के ओजोनोलिज़ उत्पाद हैं। मान लीजिए कि दिए गए एल्कीन को ‘A’ कहें। ओजोनोलिज़ अभिक्रिया के विपरीत अभिक्रिया को लिखने पर हमें प्राप्त होता है :

ओजोनाइड ‘X’ के विघटन से उत्पाद प्राप्त होते हैं। अतः, ‘X’ में दोनों उत्पाद चक्रीय रूप में उपस्थित हैं। ओजोनाइड की संभावित संरचना को निम्नलिखित रूप में प्रस्तुत किया जा सकता है :

अब, ’ $X$ ’ एल्कीन ’ $A$ ’ के ऑजोन एवं एल्कीन के अधिकार उत्पाद है। अतः, एल्कीन ’ $A$ ’ की संभावित संरचना निम्नलिखित है :

13.8 निम्नलिखित हाइड्रोकार्बन के दहन अभिक्रिया के रासायनिक समीकरण लिखिए :
(i) ब्यूटेन
(ii) पेंटीन
(iii) हेक्साइन
(iv) टॉलूईन
उत्तर दिखाएं
उत्तर
दहन एक यौगिक के ऑक्सीजन के साथ अभिक्रिया को परिभाषित कर सकते हैं।
(i) ब्यूटेन
$ \underset{ब्यूटेन} {2 C_4 H _{10}}(g) +13 O _{2}(g) \longrightarrow 8 CO _{2}(g)+10 H_2 O _{}(g)+\text{ Heat } $
(ii) पेंटीन
$ \underset{पेंटीन} {2 C_5 H _{10}}(g) +15 O _{2}(g) \longrightarrow 10 CO _{2}(g)+10 H_2 O _{}(g)+\text{ Heat } $
(iii) हेक्साइन
$ \underset{हेक्साइन}{2 C_6 H _{10}}(g)+17 O _{2}(g) \longrightarrow 12 CO _{2}(g)+10 H_2 O _{}(g)+\text{ Heat } $
(iv) टॉलूईन
$ \underset{टॉलूईन} {C _ 7 H _ 8}(g)+9 O _{2}(g) \longrightarrow 7 CO _{2}(g)+4 H_2 O _{}(g)+$ Heat
13.9 हेक्स-2-ईन के सिस एवं ट्रांस संरचना बनाइए। कौन सा ऐसमर उच्च वाष्प दाब रखेगा और क्यों?
उत्तर दिखाएं
उत्तर
हेक्स-2-ईन को निम्नलिखित द्वारा प्रदर्शित किया जा सकता है :
$ CH_3-CH=CH-CH_2-CH_2-CH_3 $
हेक्स-2-ईन के ज्यामितीय ऐसमर हैं :

सिस-अभिकरण के द्विध्रुवी आघूर्ण के योग के रूप में द्विध्रुवी आघूर्ण के दोनों C- $CH_3$ और C- $CH_2 CH_2 CH_3$ बंध एक ही दिशा में कार्य करते हैं।
ट्रांस-अभिकरण के द्विध्रुवी आघूर्ण के दोनों C- $CH_3$ और $C- CH_2 CH_2 CH_3$ बंध विपरीत दिशा में कार्य करते हैं।
अतः, सिस-ऐसमर ट्रांस-ऐसमर से अधिक ध्रुवी होता है। ध्रुवता जितनी अधिक होती है, अणुओं के बीच द्विध्रुवी-द्विध्रुवी अंतरक्रिया उतनी अधिक होती है और वाष्प दाब उतना अधिक होता है। अतः, सिस-ऐसमर ट्रांस-ऐसमर से अधिक वाष्प दाब रखेगा।
13.10 क्यों बेंज़ीन तीन डबल बॉन्ड रखते हुए अत्यधिक स्थायी है?
उत्तर दिखाएं
उत्तर
बेंज़ीन के रेज़ोनेंस वर्ग के मिश्रण के रूप में दिया गया है :

बेंज़ीन में सभी छह कार्बन परमाणु $s p^{2}$ हाइब्रिड हैं। प्रत्येक कार्बन परमाणु के दो $s p^{2}$ हाइब्रिड ऑर्बिटल आसन्न कार्बन परमाणुओं के $s p^{2}$ हाइब्रिड ऑर्बिटल के साथ अधिकरण करते हैं ताकि छह सिग्मा बॉन्ड छह कोणीय समतल में बने।
प्रत्येक कार्बन परमाणु के शेष $s p^{2}$ हाइब्रिड ऑर्बिटल अपने हाइड्रोजन के s-ऑर्बिटल के साथ अधिकरण करते हैं ताकि छह सिग्मा $ C- H $ बॉन्ड बने। कार्बन परमाणुओं के शेष अहाइब्रिडित p-ऑर्बिटल द्वारा $C_1-C_2, C_3-C_4, C_5-C_6$ या $C_2-C_3, C_4-C_5, C_6-C_1$ के लेटरल अधिकरण के माध्यम से तीन $\pi$ बॉन्ड बनाने की संभावना है।

छह $ \pi $ इलेक्ट्रॉन सभी छह कार्बन नाभिकों के चारों ओर मुक्त रूप से घूम सकते हैं। तीन डबल बॉन्डों के उपस्थिति के बावजूद, इन विस्थापित $\pi$-इलेक्ट्रॉन बेंज़ीन को स्थायी बनाते हैं।
13.11 कोई व्यवस्था औषधीय होने के लिए कौन से आवश्यक शर्त होती हैं?
उत्तर दिखाएं
उत्तर
एक यौगिक औषधीय कहलाता है यदि यह निम्नलिखित तीन शर्तों को संतुष्ट करता है :
(i) यह एक समतल संरचना रखता हो।
(ii) यौगिक के $ \pi $-इलेक्ट्रॉन पूरी तरह से वलय में विस्थापित होते हैं।
(iii) वलय में मौजूद कुल $ \pi $-इलेक्ट्रॉन की संख्या $(4 n+2)$ के बराबर होनी चाहिए, जहां $n=0,1,2 \ldots$ आदि है। इसे हुकल के नियम के रूप में जाना जाता है।
13.12 बताइए कि निम्नलिखित व्यवस्थाएँ क्यों औषधीय नहीं हैं?

उत्तर दिखाएं
उत्तर
(i)

दिए गए यौगिक के लिए, π-इलेक्ट्रॉन की संख्या छह है। लेकिन केवल चार π-इलेक्ट्रॉन वलय में उपस्थित हैं। वलय में भी π-इलेक्ट्रॉन के संयोजन नहीं होता है और यौगिक के आकार में तल नहीं होता है। अतः दिया गया यौगिक प्रकृति में औषधीय नहीं है।
(ii)

दिए गए यौगिक के लिए, π-इलेक्ट्रॉन की संख्या चार है।
हुकेल के नियम द्वारा,
$4 n+2=4$
$4 n=2$
$n=\dfrac{1}{2}$
एक यौगिक औषधीय होने के लिए, $n$ का मान एक पूर्णांक होना चाहिए $(n=0,1,2 \ldots)$, जो दिए गए यौगिक के लिए सत्य नहीं है। अतः यह प्रकृति में औषधीय नहीं है।
(iii)

दिए गए यौगिक के लिए, m-इलेक्ट्रॉन की संख्या आठ है।
हुकेल के नियम द्वारा,
$4 n+2=8$
$4 n=6$
$n=\dfrac{3}{2}$
एक यौगिक औषधीय होने के लिए, $n$ का मान एक पूर्णांक होना चाहिए $(n=0,1,2 \ldots)$. चूंकि $n$ का मान एक पूर्णांक नहीं है, अतः दिया गया यौगिक प्रकृति में औषधीय नहीं है।
13.13 बेंजीन को कैसे परिवर्तित करेंगे
(i) $p$-नाइट्रोब्रोमोबेंजीन
(ii) $m$ - नाइट्रोक्लोरोबेंजीन
(iii) $p$ - नाइट्रोटोलूईन
(iv) एसीटोफेनोन?
उत्तर दिखाएं
उत्तर
(i) बेंजीन को $p$-नाइट्रोब्रोमोबेंजीन में परिवर्तित कर सकते हैं :

(ii) बेंजीन को $m$-नाइट्रोक्लोरोबेंजीन में परिवर्तित कर सकते हैं :

(iii) बेंजीन को $p$-नाइट्रोटूलीन में परिवर्तित करने के लिए निम्नलिखित है :

(iv) बेंजीन को एसीटोफेनोन में परिवर्तित करने के लिए निम्नलिखित है :

13.14 एल्केन $ \mathrm{H_3} \mathrm{C}-\mathrm{CH_2}-\mathrm{C}\left(\mathrm{CH_3}\right)_2-\mathrm{CH_2}-\mathrm{CH}\left(\mathrm{CH_3}\right)_2$ में, 1, 2, 3 कार्बन परमाणुओं की पहचान करें और इनमें से प्रत्येक के साथ बंधे $ \mathrm{H}$ परमाणुओं की संख्या बताएं।
उत्तर दिखाएं
उत्तर

$1^{\circ}$ कार्बन परमाणु वे होते हैं जो केवल एक कार्बन परमाणु के साथ बंधे होते हैं, अर्थात उनके केवल एक कार्बन परमाणु उनके पड़ोसी होता है। दिए गए संरचना में पांच $1^{\circ}$ कार्बन परमाणु हैं और इनके साथ पंद्रह हाइड्रोजन परमाणु बंधे होते हैं।
$2^{\circ}$ कार्बन परमाणु वे होते हैं जो दो कार्बन परमाणुओं के साथ बंधे होते हैं, अर्थात उनके दो कार्बन परमाणु उनके पड़ोसी होते हैं। दिए गए संरचना में दो $2^{\circ}$ कार्बन परमाणु हैं और इनके साथ चार हाइड्रोजन परमाणु बंधे होते हैं।
$3^{\circ}$ कार्बन परमाणु वे होते हैं जो तीन कार्बन परमाणुओं के साथ बंधे होते हैं, अर्थात उनके तीन कार्बन परमाणु उनके पड़ोसी होते हैं। दिए गए संरचना में एक $3^{\circ}$ कार्बन परमाणु है और इसके साथ केवल एक हाइड्रोजन परमाणु बंधा होता है।
13.15 एल्केन श्रृंखला के शाखन का उसके क्वथनांक पर क्या प्रभाव पड़ता है?
उत्तर दिखाएं
उत्तर
एल्केन अंतर-आणविक वान डर वाल्स बलों का अनुभव करते हैं। बल जितना प्रबल होगा, एल्केन का क्वथनांक उतना ही अधिक होगा।
जैसे-जैसे शाखन बढ़ता है, अणु का सतही क्षेत्रफल घटता जाता है जिसके परिणामस्वरूप संपर्क का क्षेत्र छोटा हो जाता है। परिणामस्वरूप, वान डर वाल्स बल भी कम हो जाता है जिसे अपेक्षाकृत कम तापमान पर दूर किया जा सकता है। अतः, शाखन बढ़ने के साथ एल्केन श्रृंखला का क्वथनांक घटता जाता है।
13.16 प्रोपीन में $ \mathrm{HBr}$ के योग से 2-ब्रोमोप्रोपेन प्राप्त होता है, जबकि बेंज़ोयल परऑक्साइड की उपस्थिति में, वही अभिक्रिया 1-ब्रोमोप्रोपेन देती है। व्याख्या करें और क्रियाविधि दें।
उत्तर दिखाएं
उत्तर
प्रोपीन में $HBr$ का योग एक इलेक्ट्रोफिलिक प्रतिस्थापन अभिक्रिया का उदाहरण है। हाइड्रोजन ब्रोमाइड एक इलेक्ट्रोफाइल, $H^{+}$ प्रदान करता है। यह इलेक्ट्रोफाइल द्विबंध पर आक्रमण करके $1^{\circ}$ और $2^{\circ}$ कार्बोकैटायन बनाता है जैसा कि दिखाया गया है:

द्वितीयक कार्बोकैटायन प्राथमिक कार्बोकैटायन की तुलना में अधिक स्थिर होते हैं। अतः, पूर्ववर्ती प्रबल होता है क्योंकि यह तेजी से बनेगा। इस प्रकार, अगले चरण में, $Br$ कार्बोकैटायन पर आक्रमण करके मुख्य उत्पाद के रूप में 2-ब्रोमोप्रोपेन बनाता है।

यह अभिक्रिया मार्कोवनिकोव के नियम का पालन करती है जहाँ योजक का ऋणात्मक भाग उस कार्बन परमाणु से जुड़ा होता है जिसमें हाइड्रोजन परमाणुओं की संख्या कम होती है।
बेंज़ोयल परऑक्साइड की उपस्थिति में, मार्कोवनिकोव के नियम के विपरीत एक योग अभिक्रिया होती है। यह अभिक्रिया एक मुक्त मूलक श्रृंखला क्रियाविधि का पालन करती है जैसा कि:

द्वितीयक मुक्त मूलक प्राथमिक मूलकों की तुलना में अधिक स्थिर होते हैं। अतः, पूर्ववर्ती प्रबल होता है क्योंकि यह तेजी से बनता है। इस प्रकार, मुख्य उत्पाद के रूप में 1-ब्रोमोप्रोपेन प्राप्त होता है।

परऑक्साइड की उपस्थिति में, $Br$ मुक्त मूलक एक इलेक्ट्रोफाइल के रूप में कार्य करता है। अतः, परऑक्साइड की अनुपस्थिति और उपस्थिति में प्रोपीन में $HBr$ के योग पर दो अलग-अलग उत्पाद प्राप्त होते हैं।
13.17 1,2-डाइमेथिलबेंज़ीन (ओ-क्सीलीन) के ओजोनोलाइसिस के उत्पाद लिखिए। ओ-क्सीलीन के परिणाम कैसे केकुले बेंज़ीन के संरचना को समर्थन देते हैं?
उत्तर दिखाएं
उत्तर
ओ-क्सीलीन को निम्नलिखित दो केकुले संरचनाओं के रेजोनेंस मिश्रण के रूप में देखा जा सकता है। इनमें से प्रत्येक के ओजोनोलाइसिस के दो उत्पाद नीचे दिखाए गए हैं:

इस प्रकार, कुल तीन उत्पाद बनते हैं। क्योंकि तीनों उत्पादों को केकुले संरचनाओं में से किसी एक से प्राप्त नहीं किया जा सकता है, इसलिए यह दिखाता है कि ओ-क्सीलीन दो केकुले संरचनाओं (I और II) के रेजोनेंस मिश्रण है।
13.18 बेंज़ीन, $n$-हेक्सेन और एथिन के अम्लीय व्यवहार के घटते क्रम में व्यवस्थित कीजिए। इस व्यवहार के कारण भी बताइए।
उत्तर दिखाएं
उत्तर
इन तीन यौगिकों में कार्बन के हाइब्रिडन अवस्था है:

क्योंकि, s-इलेक्ट्रॉन नाभिक के करीब होते हैं, इसलिए, जैसे C-H बंध बनाने वाले ऑर्बिटल के s-अंश बढ़ता है, तो C-H बंध के इलेक्ट्रॉन बर्बाद नाभिक के करीब आ जाते हैं।
अन्य शब्दों में, H-परमाणु पर आंशिक + विद्युत आवेश बढ़ता जाता है और इसलिए, जैसे ऑर्बिटल के s-अंश बढ़ता है, वैसे ही अम्लीय व्यवहार बढ़ता जाता है।
इसलिए, अम्लीय व्यवहार के क्रम में: एथिन > बेंज़ीन > हेक्सेन
13.19 बेंज़ीन क्यों आयनिक प्रतिस्थापन अभिक्रियाओं के लिए आसानी से अभिक्रिया करती है और न्यूक्लिओफिलिक प्रतिस्थापन अभिक्रियाओं के लिए कठिनता से?
उत्तर दिखाएं
उत्तर
बेंज़ीन $( C_6 H_6 )$ एक समतल, चक्रीय अणु है जिसमें एक वलय संरचना होती है। बेंज़ीन के प्रत्येक कार्बन परमाणु $ \mathrm{sp}^2 $ हाइब्रिडन होते हैं, जिसके कारण समतल व्यवस्था होती है।
बेंज़ीन वलय में विस्थापित $\pi$ इलेक्ट्रॉन होते हैं, जो पूरे वलय संरचना पर फैले होते हैं। इस विस्थापन के कारण वलय के तल के ऊपर और नीचे एक उच्च इलेक्ट्रॉन घनत्व क्षेत्र बनता है।
इलेक्ट्रॉन अभाव वाले प्रतिस्थापन अभिक्रियाएं:
इलेक्ट्रॉन अभाव वाले अणु जो इलेक्ट्रॉनों की तलाश में होते हैं। क्योंकि बेंजीन के विस्थापित इलेक्ट्रॉन कारण इसके इलेक्ट्रॉन समृद्ध होते हैं, इसलिए इलेक्ट्रॉन अभाव वाले अणुओं को आकर्षित करते हैं।
इलेक्ट्रॉन समृद्ध $\pi$ इलेक्ट्रॉन की उपस्थिति बेंजीन को इलेक्ट्रॉन अभाव वाले अणुओं के प्रति बहुत प्रतिक्रियाशील बनाती है, जो इलेक्ट्रॉन अभाव वाले प्रतिस्थापन अभिक्रियाओं को सुगम बनाती है। इस कारण बेंजीन इलेक्ट्रॉन अभाव वाले प्रतिस्थापन अभिक्रियाओं के लिए आसानी से भाग लेती है।
न्यूक्लिओफिलिक प्रतिस्थापन अभिक्रियाएं:
न्यूक्लिओफिलिक अणु वे होते हैं जो इलेक्ट्रॉन समृद्ध होते हैं और इलेक्ट्रॉन दान करने की प्रवृत्ति रखते हैं। क्योंकि बेंजीन खुद इलेक्ट्रॉन समृद्ज होती है, इसलिए इसके द्वारा अन्य इलेक्ट्रॉन समृद्ध अणुओं (न्यूक्लिओफिलिक) को दूर रखा जाता है।
इस विरोधाभास के कारण न्यूक्लिओफिलिक अणु बेंजीन के वलय पर आक्रमण करने में कठिनाई भोगते हैं, जिसके कारण न्यूक्लिओफिलिक प्रतिस्थापन अभिक्रियाएं कम अनुकूल या कठिन हो जाती हैं।
इसलिए, बेंजीन के इलेक्ट्रॉन समृद्ध प्रकृति के कारण इलेक्ट्रॉन अभाव वाले इलेक्ट्रॉन अभाव वाले अणुओं को आकर्षित करती है, इसलिए इलेक्ट्रॉन अभाव वाले प्रतिस्थापन अभिक्रियाएं आसानी से होती हैं। विपरीत, न्यूक्लिओफिलिक प्रतिस्थापन अभिक्रियाएं कठिन होती हैं क्योंकि इलेक्ट्रॉन समृद्ध न्यूक्लिओफिलिक अणु इलेक्ट्रॉन समृद्ध बेंजीन के द्वारा विरोध करते हैं।
13.20 आप निम्नलिखित यौगिकों को बेंजीन में कैसे परिवर्तित करेंगे?
(i) ऐथाइन
(ii) ऐथीन
(iii) हेक्सेन
उत्तर दिखाएं
उत्तर
(i) ऐथाइन से बेंजीन :

(ii) ऐथीन से बेंजीन :

(iii) हेक्सेन से बेंजीन

13.21 ऐल्कीन के सभी संरचना लिखिए जो हाइड्रोजनीकरण पर 2-मेथिलब्यूटेन देते हैं।
उत्तर दिखाएँ
उत्तर
2-मेथिलब्यूटेन के मूल संरचना को नीचे दिखाया गया है :

$\underset{\text{2-मेथिलब्यूटेन}}{CH_3 - \stackrel{\large{CH_3}}{\stackrel{|\quad }{CH}}-CH_2-CH_3}$
इस संरचना के आधार पर, हाइड्रोजनीकरण पर 2-मेथिलब्यूटेन देने वाले विभिन्न ऐल्कीन हैं :

13.22 निम्नलिखित यौगिकों को उनके विद्युत धनात्मक अभिकरक $ \mathrm{E}^{+} $ के साथ अपेक्षाकृत अभिक्रियाशीलता के घटते क्रम में व्यवस्थित कीजिए।
(a) क्लोरोबेंज़ीन, 2,4-डाइनाइट्रोक्लोरोबेंज़ीन, $p$-नाइट्रोक्लोरोबेंज़ीन
(b) टॉलूईन, $p-\mathrm{H_3} \mathrm{C}-\mathrm{C_6} \mathrm{H_4}-\mathrm{NO_2}, p-\mathrm{O_2} \mathrm{~N}-\mathrm{C_6} \mathrm{H_4}-\mathrm{NO_2}$.
उत्तर दिखाएँ
उत्तर
(a)
क्लोरोबेंज़ीन $ (C_6H_5Cl) $
2,4-डाइनाइट्रोक्लोरोबेंज़ीन $ (C_6H_3Cl(NO_2)_2) $
$ p $-नाइट्रोक्लोरोबेंज़ीन $ (C_6H_4Cl(NO_2)) $
प्रतिस्थापक के प्रकृति के बारे में:
क्लोरीन $ (Cl) $ अपनी विद्युत ऋणात्मकता के कारण एक इलेक्ट्रॉन अपसवाग वर्ग $ (EWG) $ है।
नाइट्रो समूह $ (NO_2) $ शक्तिशाली इलेक्ट्रॉन अपसवाग वर्ग हैं।
बेंजीन वलय पर इलेक्ट्रॉन घनत्व के विश्लेषण:
क्लोरोबेंज़ीन में एक $ EWG $ $ (Cl) $ है, जो इलेक्ट्रॉन घनत्व को कम करता है लेकिन बहुत कम।
$ p $-नाइट्रोक्लोरोबेंज़ीन में दो $ EWGs $ $ (Cl ~and ~ NO_2) $ हैं, जो इलेक्ट्रॉन घनत्व को और कम करेंगे।
2,4-डाइनाइट्रोक्लोरोबेंज़ीन में तीन $ EWGs $ $ (Cl ~and ~ दो ~ NO_2) $ हैं, जो इलेक्ट्रॉन घनत्व को सबसे कम करेंगे।
अभिक्रियाशीलता के क्रम:
बेंजीन वलय पर अधिक इलेक्ट्रॉन घनत्व इलेक्ट्रॉन धनात्मक अभिकरक के साथ अधिक अभिक्रियाशीलता का कारण बनता है।
इसलिए, अभिक्रियाशीलता के घटते क्रम में क्रम है:
$ क्लोरोबेंज़ीन > p-नाइट्रोक्लोरोबेंज़ीन > 2,4-डाइनाइट्रोक्लोरोबेंज़ीन $
(b)
अपचयक: टॉलूईन, $ p-H_3C-C_6H_4-NO_2 ~, ~ p-O_2N-C_6H_4-NO_2 $
टॉलूईन $ (C_6H_5CH_3) $
$ p-H_3C-C_6H_4-NO_2 $ (p-नाइट्रोटॉलूईन)
$ p-O_2N-C_6H_4-NO_2 $ (p-डाइनाइट्रोबेंज़ीन)
प्रतिस्थापक के प्रकृति:
टॉलूईन में मेथिल $ (CH_3) $ एक इलेक्ट्रॉन-दाता समूह $ (EDG) $ है।
नाइट्रो समूह $ (NO_2) $ शक्तिशाली इलेक्ट्रॉन-उपहरारी समूह हैं।
बेंज़ीन वलय पर इलेक्ट्रॉन घनत्व के विश्लेषण:
टॉलूईन में $ EDG $ $ (CH_3) $ है, जो इलेक्ट्रॉन घनत्व को बढ़ाता है और इसे बहुत अभिक्रियाशील बनाता है।
p-नाइट्रोटॉलूईन में एक $ EDG $ $ (CH_3) $ और एक $ EWG $ $ (NO_2) $ है, जो मध्यम इलेक्ट्रॉन घनत्व के निर्माण के लिए ज़िम्मेदार है।
p-डाइनाइट्रोबेंज़ीन में दो $ EWGs $ $ (NO_2) $ हैं, जो इलेक्ट्रॉन घनत्व को बहुत कम कर देते हैं।
अभिक्रियाशीलता का क्रम:
इलेक्ट्रॉन अभिकरकों के साथ अभिक्रियाशीलता के घटते क्रम में क्रम है:
$ टॉलूईन > p-नाइट्रोटॉलूईन > p-डाइनाइट्रोबेंज़ीन $
13.23 बेंज़ीन, m-डाइनाइट्रोबेंज़ीन और टॉलूईन में से कौन सा नाइट्रेशन के लिए सबसे आसानी से अभिक्रिया करेगा और क्यों?
उत्तर दिखाएं
उत्तर
बेंज़ीन, m-डाइनाइट्रोबेंज़ीन और टॉलूईन में से कौन सा नाइट्रेशन के लिए सबसे आसानी से अभिक्रिया करेगा, इसका निर्धारण करने के लिए हमें बेंज़ीन वलय पर प्रतिस्थापक के इलेक्ट्रॉनिक प्रभाव के विश्लेषण करना होगा। नाइट्रेशन एक इलेक्ट्रॉन अभिकरक प्रतिस्थापन अभिक्रिया है जहां एक इलेक्ट्रॉन अभिकरक (नाइट्रोनियम आयन, $ NO_2^+ $) बेंज़ीन वलय पर आक्रमण करता है।
नाइट्रेशन एक इलेक्ट्रॉन अभिकरक प्रतिस्थापन अभिक्रिया है जहां नाइट्रोनियम आयन $ (NO_2^+) $ इलेक्ट्रॉन अभिकरक के रूप में कार्य करता है। अभिक्रिया के लिए एक इलेक्ट्रॉन समृद्ध बेंज़ीन वलय की आवश्यकता होती है ताकि इलेक्ट्रॉन अभिकरक द्वारा आक्रमण सुगम हो सके।
बेंज़ीन:
बेंज़ीन $ (C_6H_6) $ में कोई भी प्रतिस्थापक नहीं है। यह एक उदासीन यौगिक है और इलेक्ट्रॉन घनत्व में मध्यम है। इसलिए, यह नाइट्रेशन कर सकता है, लेकिन इलेक्ट्रॉन-दाता समूह वाले यौगिकों की तुलना में नहीं आसानी से।
टॉलूईन:
टॉलूईन $ (C_6H_5CH_3) $ में एक मेथिल समूह $ (-CH_3) $ होता है। मेथिल समूह इलेक्ट्रॉन-दाता समूह होता है जो $ +I $ (इंडक्टिव) प्रभाव के माध्यम से इलेक्ट्रॉन घनत्व को बढ़ाता है। इस तरह, टॉलूईन नाइट्रोनियम आयन जैसे इलेक्ट्रॉन अभिकरकों के लिए अधिक अभिक्रियाशील होता है। इसलिए, टॉलूईन बेंज़ीन की तुलना में नाइट्रेशन के लिए आसानी से अभिक्रिया करेगा।
m-डाइनाइट्रोबेंज़ीन:
m-डाइनाइट्रोबेंज़ीन $ (C_6H_3(NO_2)_2) $ में दो नाइट्रो समूह $ (-NO_2) $ मेटा स्थिति में होते हैं। नाइट्रो समूह अपने $ -M $ (मेसोमेरिक) और $ -I $ (इंडक्टिव) प्रभाव के कारण तीव्र इलेक्ट्रॉन अपचालक समूह होते हैं। ये बेंज़ीन वलय पर इलेक्ट्रॉन घनत्व को कम करते हैं, जिसके कारण इसके प्रति इलेक्ट्रॉन अभिकर्मक प्रतिस्थापन कम अभिक्रियाशील होता है। इसलिए, m-डाइनाइट्रोबेंज़ीन तीन यौगिकों में से सबसे कम आसानी से नाइट्रेशन करेगा।
अभिक्रियाशीलता की तुलना:
टॉलूईन (सबसे अभिक्रियाशील कारण इलेक्ट्रॉन-दाता मेथिल समूह)
बेंज़ीन (मध्यम अभिक्रियाशील)
m-डाइनाइट्रोबेंज़ीन (सबसे कम अभिक्रियाशील कारण इलेक्ट्रॉन-अपचालक नाइट्रो समूह)
इसलिए, टॉलूईन सबसे आसानी से नाइट्रेशन करेगा, फिर बेंज़ीन और अंत में m-डाइनाइट्रोबेंज़ीन।
13.24 बेंज़ीन के ईथिलेशन के दौरान एनहाइड्रो एलुमिनियम क्लोराइड के अलावा एक लेविस अम्ल का नाम बताइए जिसका उपयोग किया जा सकता है।
उत्तर दिखाएं
उत्तर
बेंज़ीन के ईथिलेशन अभिक्रिया में बेंज़ीन वलय पर एथिल समूह के जोड़ की प्रक्रिया होती है। ऐसी अभिक्रिया को फ्रेडेल-क्राफ्ट ऐल्किलेशन अभिक्रिया कहा जाता है। यह अभिक्रिया एक लेविस अम्ल की उपस्थिति में होती है।
कोई भी लेविस अम्ल जैसे एनहाइड्रो $FeCl_3, SnCl_4, BF_3 $ आदि बेंज़ीन के ईथिलेशन के दौरान उपयोग किया जा सकता है।
13.25 वर्ट्ज अभिक्रिया के द्वारा विषम संख्या के कार्बन परमाणु वाले एल्केन के निर्माण के लिए क्यों अपेक्षित नहीं होती है? एक उदाहरण द्वारा अपने उत्तर को स्पष्ट करें।
उत्तर दिखाएं
उत्तर
वर्ट्ज अभिक्रिया सममित एल्केन (एल्केन जिनमें सम संख्या के कार्बन परमाणु होते हैं) के निर्माण के लिए सीमित होती है। इस अभिक्रिया में दो समान ऐल्किल हैलाइड अभिकर्मक के रूप में लिए जाते हैं और एल्केन बनता है जिसमें कार्बन परमाणु की संख्या दोगुनी होती है। उदाहरण:
$ \underset {ब्रोमोमेथेन}{CH_3-Br} +2 Na+Br-CH_3 \xrightarrow{\text{ सूखा ईथर }} \underset {ईथेन}{CH_3-CH_3} +2 NaBr $
वर्ट्ज अभिक्रिया असममित एल्केन के निर्माण के लिए उपयोग नहीं की जा सकती क्योंकि यदि दो असमान ऐल्किल हैलाइड अभिकर्मक के रूप में लिए जाते हैं, तो एल्केन के मिश्रण के रूप में उत्पाद प्राप्त होते हैं। चूंकि अभिक्रिया मुक्त रadical विशिष्टता के साथ होती है, एक अतिरिक्त अभिक्रिया भी होती है जो एल्कीन के उत्पादन के लिए ज़िम्मेदार होती है। उदाहरण के रूप में, ब्रोमोमेथेन और आयोडोएथेन की अभिक्रिया एल्केन के मिश्रण के रूप में उत्पाद देती है।

अल्केन के क्वथनांक (मिश्रण में प्राप्त) बहुत करीब होते हैं। इसलिए, उन्हें अलग करना कठिन हो जाता है





