विलयन भाग 1
संबंधित वीडियो
अध्ययन नोट्स: विलयन और वाष्प दाब
विषय सूची
- विलयन का परिचय
- विलयन की सांद्रता
- द्रव विलयनों का वाष्प दाब
- धनात्मक और ऋणात्मक विचलन
- विचलन का आरेखीय निरूपण
- मुख्य अवधारणाओं का सारांश
1. विलयन का परिचय
एक विलयन दो या अधिक पदार्थों का एक समांगी मिश्रण होता है जो एक ही प्रावस्था में होता है। विलेय वह पदार्थ है जिसे घोला जाता है, और विलायक वह पदार्थ है जो घोलता है।
2. विलयन की सांद्रता
2.1 सांद्रता के प्रकार
- द्रव्यमान प्रतिशत (w/w):
$$ \text{Mass percent} = \frac{\text{Mass of solute}}{\text{Mass of solution}} \times 100 $$ - आयतन प्रतिशत (v/v):
$$ \text{Volume percent} = \frac{\text{Volume of solute}}{\text{Volume of solution}} \times 100 $$ - मोलरता (M):
$$ \text{Molarity} = \frac{\text{Moles of solute}}{\text{Liters of solution}} $$ - मोललता (m):
$$ \text{Molality} = \frac{\text{Moles of solute}}{\text{Kilograms of solvent}} $$
2.2 विलयन का तनुकरण
जब किसी विलयन को तनुकृत किया जाता है, तो विलेय के मोलों की संख्या अपरिवर्तित रहती है, लेकिन विलयन का आयतन बढ़ जाता है।
$$
M_1V_1 = M_2V_2
$$
3. द्रव विलयनों का वाष्प दाब
3.1 राउल्ट का नियम
राउल्ट का नियम विलयन के वाष्प दाब को उसके घटकों के मोल अंश से संबंधित करता है:
$$ P_{\text{total}} = P_A^0 \cdot X_A + P_B^0 \cdot X_B $$
जहाँ:
- $P_{\text{total}}$ विलयन का कुल वाष्प दाब है
- $P_A^0$ और $P_B^0$ शुद्ध घटकों A और B के वाष्प दाब हैं
- $X_A$ और $X_B$ विलयन में A और B के मोल अंश हैं
3.2 आदर्श और अनादर्श विलयन
- आदर्श विलयन राउल्ट के नियम का ठीक से पालन करते हैं।
- अनादर्श विलयन राउल्ट के नियम से विचलन दर्शाते हैं, जो धनात्मक या ऋणात्मक हो सकता है।
4. धनात्मक और ऋणात्मक विचलन
4.1 धनात्मक विचलन
- कुल वाष्प दाब अपेक्षा से अधिक होता है।
- उदाहरण:
- एथेनॉल + एसीटोन
- बेंजीन + मेथेनॉल
- कारण: विलेय अणुओं के बीच अंतराआण्विक बल, विलेय और विलायक के बीच की तुलना में अधिक मजबूत होते हैं।
4.2 ऋणात्मक विचलन
- कुल वाष्प दाब अपेक्षा से कम होता है।
- उदाहरण:
- क्लोरोफॉर्म + एसीटोन
- नाइट्रिक अम्ल + जल
- कारण: विलेय और विलायक अणुओं के बीच अंतराआण्विक बल, विलेय अणुओं के बीच की तुलना में अधिक मजबूत होते हैं।
5. विचलन का आरेखीय निरूपण
5.1 धनात्मक विचलन (A)

यह आरेख धनात्मक विचलन वाले विलयन के वाष्प दाब को दर्शाता है। कुल वाष्प दाब राउल्ट के नियम द्वारा अनुमानित मान से अधिक होता है।
5.2 ऋणात्मक विचलन (B)
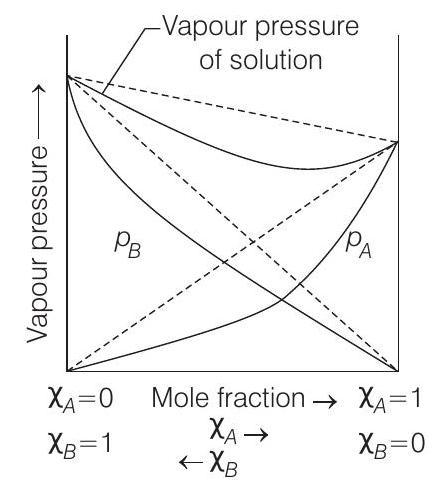
यह आरेख ऋणात्मक विचलन वाले विलयन के वाष्प दाब को दर्शाता है। कुल वाष्प दाब राउल्ट के नियम द्वारा अनुमानित मान से कम होता है।
6. मुख्य अवधारणाओं का सारांश
| अवधारणा | व्याख्या |
|---|---|
| विलयन | दो या अधिक पदार्थों का एक समांगी मिश्रण जो एक ही प्रावस्था में होता है। |
| विलेय | विलयन में घुला हुआ पदार्थ। |
| विलायक | वह पदार्थ जो घोलता है। |
| राउल्ट का नियम | विलयन के वाष्प दाब को घटकों के मोल अंश से संबंधित करता है। |
| आदर्श विलयन | राउल्ट के नियम का ठीक से पालन करता है। |
| धनात्मक विचलन | वाष्प दाब अपेक्षा से अधिक होता है। |
| ऋणात्मक विचलन | वाष्प दाब अपेक्षा से कम होता है। |
7. महत्वपूर्ण सूत्र
7.1 राउल्ट का नियम
$$ P_{\text{total}} = P_A^0 \cdot X_A + P_B^0 \cdot X_B $$
7.2 मोलरता
$$ M = \frac{\text{Moles of solute}}{\text{Liters of solution}} $$
7.3 मोललता
$$ m = \frac{\text{Moles of solute}}{\text{Kilograms of solvent}} $$
7.4 तनुकरण समीकरण
$$ M_1V_1 = M_2V_2 $$
8. उदाहरण और अनुप्रयोग
- एथेनॉल + एसीटोन: कमज़ोर अंतराआण्विक बलों के कारण धनात्मक विचलन प्रदर्शित करता है।
- क्लोरोफॉर्म + एसीटोन: मजबूत हाइड्रोजन बंध के कारण ऋणात्मक विचलन प्रदर्शित करता है।
- बेंजीन + मेथेनॉल: विलेय अणुओं के बीच हाइड्रोजन बंध बनने के कारण धनात्मक विचलन प्रदर्शित करता है।
9. निष्कर्ष
द्रव विलयनों के वाष्प दाब और राउल्ट के नियम से उनके विचलन को समझना, मिश्रणों के व्यवहार की भविष्यवाणी करने में महत्वपूर्ण है। सांद्रता और विलयन का प्रकार (आदर्श या अनादर्श) कुल वाष्प दाब और प्रदर्शित विचलन को निर्धारित करने में महत्वपूर्ण भूमिका निभाते हैं।
अभ्यास प्रश्न
हमारे मॉक टेस्ट देखें
अपनी कुशलताओं को बढ़ाने और अपनी परीक्षाओं की तैयारी के लिए विभिन्न टेस्ट में से चुनें
जेईई मेन मॉक टेस्ट
वास्तविक परीक्षा का अनुभव करने के लिए पूर्ण-लंबाई मॉक टेस्ट के साथ जेईई मेन की तैयारी करें।
जेईई एडवांस्ड मॉक टेस्ट
सभी विषयों और प्रश्न पैटर्न को कवर करने वाले चुनौतीपूर्ण मॉक टेस्ट के साथ जेईई एडवांस्ड की तैयारी करें।
विषय-वार टेस्ट
अपने कमजोर क्षेत्रों को मजबूत करने के लिए भौतिकी, रसायन विज्ञान या गणित जैसे विशिष्ट विषयों पर ध्यान दें।
पिछले वर्ष के प्रश्न मॉक टेस्ट
परीक्षा के रुझानों को समझने के लिए भौतिकी, रसायन विज्ञान और गणित के पिछले वर्षों के प्रश्नों का प्रयास करें।
राज्य-वार साप्ताहिक टेस्ट
क्षेत्रीय परीक्षा पैटर्न के अनुरूप राज्य-विशिष्ट साप्ताहिक मॉक टेस्ट के साथ अपने ज्ञान का परीक्षण करें।





